陇东旱塬区不同粮草轮作模式下土壤细菌群落组成特征
梁志婷,邓建强,王自奎,沈禹颖,王先之
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,草业科学国家级实验教学示范中心,甘肃 兰州 730020)
陇东旱塬区不同粮草轮作模式下土壤细菌群落组成特征
梁志婷,邓建强,王自奎,沈禹颖,王先之*
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,草业科学国家级实验教学示范中心,甘肃 兰州 730020)
以陇东旱塬区冬麦-休闲-大豆(W-F-S)、冬麦-油菜-箭筈豌豆(W-R-V)和冬麦/休闲-苜蓿-苜蓿(W/F-L-L)粮草轮作系统为对象,基于16S rRNA基因序列扩增子测序,研究了3种轮作模式下耕层土壤(0~10 cm及10~20 cm)细菌群落组成特征。结果表明,3种轮作模式下,土壤细菌群落中占优势的菌门为变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria);土壤细菌群落属组成中以红游动菌属(Rhodoplanes)、出芽菌属(Gemmata)、硝化螺旋菌属(Nitrospira)、慢生根瘤菌属(Bradyrhizobium)、Adhaeribacter菌属和Balneimonas菌属等与固氮相关的菌属为主。W-F-S轮作模式下土壤特异优势菌属为紫色杆菌属(Janthinobacterium)和溶杆菌属(Lysobacter),该类菌属与胞囊线虫的防治有关,间接揭示了该轮作模式可能抑制土传病害发生;W-R-V轮作模式下欧文氏菌属(Erwinia)丰度较高,主要与前茬油菜根系残留相关;W/F-L-L轮作模式下鞘脂单胞菌属(Sphingomonas)丰度较高,与苜蓿生长的少免耕措施有关。0~10 cm土层细菌多样性表现为W-F-S>W/F-L-L>W-R-V,10~20 cm土层表现则呈与之相反趋势。本研究从细菌群落组成和功能角度,阐释了包含豆科牧草的粮草轮作系统促进生物固氮、阻隔病害传播的微生物学机理,可为陇东旱塬区建立合理草田轮作制度和维持良好土壤生态环境提供理论依据。
黄土高原;微生物;大豆;箭筈豌豆;苜蓿
陇东黄土高原是我国典型雨养农业区之一,也是甘肃省冬小麦主产区。该地区以冬小麦为主的谷物连作方式及化肥的不合理施用致使土壤有机质含量降低[1-2],造成作物产量低而不稳,影响区域内农业生态系统的可持续发展[3]。豆科作物与禾谷类作物合理轮作是传统农业的精华,是提高农田土壤质量的栽培耕作方式之一[4]。国内外生产实践证明豆科作物可以通过充分利用其生物固氮特性来提高土壤肥力,减少化肥投入,保持农业生态系统健康稳定[5-7]。研究表明,通过合理轮作可增加作物种类,丰富地上、地下生物多样性,从而改善土壤微生态环境[8-9]。土壤微生物作为土壤生态系统重要组成部分,其群落结构和多样性主要受植物物种组成和土壤养分状况的影响[10]。不同作物释放的根系分泌物不同,其土壤微生物群落生长代谢和群落结构存在差异[11]。细菌是土壤微生物中分布最广,数量最多的部分[12],占土壤微生物总数的70%~90%,是土壤养分变化的敏感指标之一[13]。近年来,研究微生物群落组成及多样性一直是揭示植物-微生物互作机制的热点问题[14]。不同轮作模式对土壤微生物的影响不尽相同,因此确定合理轮作模式对促进当地农业发展具有重要意义。
在陇东黄土高原,冬小麦收获后复种豆科牧草箭筈豌豆(Viciasativa)、饲用油菜(Brassicacampestris)及苜蓿(Medicagosativa)构成的粮草轮作系统可提高作物系统生产力和水热资源利用效率[15]。为明确不同粮草轮作体系的构建对土壤微生物群落组成的影响,本研究以陇东旱塬区冬麦-休闲-大豆(wheat-fallow-soybean,W-F-S)、冬麦-油菜-箭筈豌豆(wheat-rapeseed-common vetch,W-R-V)、冬麦/休闲-苜蓿-苜蓿(wheat/fallow-lucerne-lucerne,W/F-L-L)轮作模式为对象,采用Illumina Hiseq平台研究了3种轮作模式下表层0~20 cm土壤细菌类群组成特征,以期解释不同作物与土壤细菌类群间的互作关系,为建立合理的草田轮作模式提供理论支持。
1 材料与方法
1.1 试验地概况
试验在甘肃省庆阳市西峰区什社乡兰州大学庆阳黄土高原试验站(N 35°39′,E 107°51′,海拔1297 m)内进行。该区域是典型黄土高原雨养农业区,属大陆性季风气候,春冬寒冷干燥,夏季炎热多雨。多年平均降雨量573 mm(1961-2015年),主要集中在7、8、9三个月。年均气温在8~10 ℃之间,极端最高气温39.6 ℃,极端最低气温-22.4 ℃,无霜期150~190 d,生长季255 d。供试土壤为黑垆土,质地为粉壤土。本研究开展前,试验地长期种植冬小麦。0~20 cm土层基础养分为:有机质含量为3.63 g/kg,全氮含量为0.61 g/kg。pH值8.1,土壤容重为1.24 g/cm3。
1.2 试验设计
如图1所示,试验始于2013年,设置冬麦-休闲-大豆(W-F-S)、冬麦-油菜-箭筈豌豆(W-R-V)、冬麦/休闲-苜蓿-苜蓿(W/F-L-L)3种轮作模式,小区面积为4 m×5 m=20 m2,每个处理3次重复,共9个小区,随机区组排列。供试作物分别为大豆(Glycinemax)、箭筈豌豆和紫花苜蓿。大豆播种时间为2015年4月23日,大豆行间距和株间距均为20 cm,箭筈豌豆播种时间为2015年7月11日,播量为75 kg/hm2;苜蓿的播种时间为2014年9月7日,播量为22.5 kg/hm2。各处理施氮肥为尿素、磷肥为磷酸二铵,施氮量为69 kg N/hm2,施磷量为27 kg P2O5/hm2,皆于作物播前将肥料撒施地表后耕翻入土,常规田间管理。

图1 3种轮作模式作物种植顺序Fig.1 Crop sequence of three crop rotation models
1.3 土壤样品采集与处理
2015年9月28日分别在大豆(soybean,S)、箭筈豌豆(common vetch,V)和苜蓿(lucerne,L)生育期结束后,用内径40 mm的土钻进行耕层土壤取样,每个小区采用5点“S”型取样法,分0~10 cm和10~20 cm两个层次,共18个样。为避免污染,每次取样后土钻都用75%的酒精消毒。去除植物残体和石砾等杂物后同层混合均匀样品,放入灭菌袋用冰盒带回实验室。样品于-80 ℃冰箱保存,用于土壤微生物DNA提取及后续测定。
1.4 土壤微生物DNA提取和16S rRNA基因高通量测序
每个样品称取相当于0.5 g干土重量的新鲜土壤。采用FastDNA®SPIN Kit for Soil (MP Biomedicals)试剂盒提取土壤微生物总DNA,1%的琼脂糖电泳检测DNA样品是否有降解以及杂质;NanoPhotometer分光光度计检测样品纯度;Qubit 2.0 Flurometer检测DNA样品浓度。利用TE缓冲液将土壤总DNA进行10倍梯度稀释后,进行PCR扩增。提取DNA流程操作步骤参考试剂盒说明书。
土壤DNA样品纯化后用无菌水稀释至1 ng/μL,利用细菌16S rRNA基因的通用引物为341F(5′-CCTACGGGNGGCWGCAG-3′)-805R(5′-GACTACHVGGGTATCTAATCC-3′)扩增土壤微生物16S rRNA的V3+V4区基因片段。修饰后的通用引物含有不同的Tag标签用以区分不同的土壤样品。PCR反应体系如下:Phusion Master Mix (1X)15 μL,DNA模板(1 ng/μL)10 μL,正、反向引物(0.2 μmol/L)各3 μL,蒸馏水补至30 μL。PCR扩增条件为:95 ℃,3 min;(95 ℃,30 s;55 ℃,30 s;72 ℃,30 s),25个循环;16 ℃,10 min。每个样品3个重复。获得扩增产物后,进一步通过2.0%琼脂糖凝胶电泳检测PCR产物纯化效果,测定纯化后PCR产物的浓度。将土壤样品16S rRNA基因的PCR纯化产物等摩尔数混合,利用Thermo Scientific公司的GeneJET胶回收试剂盒,割胶回收目标条带。
使用New England Biolabs公司的NEB Next Ultra DNA Library Prep Kit for Illumina (NEB,USA)试剂盒进行文库构建,构建好的文库经过Qubit@2.0荧光计(Life Technologies,CA,USA)和安捷伦科技公司生物分析仪2100系统定量和文库检测合格后,使用Illumina HiSeq平台进行上机测序。文库构建和测序均在北京安诺优达基因科技有限公司进行。
1.5 数据分析
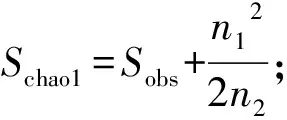
采用Excel2007软件整理数据,然后用Genstat17.0进行单因素方差分析,对同一土层不同轮作模式土壤细菌组成和结构进行方差分析,采用配对T检验法检验同一轮作模式不同土层土壤细菌群落组成差异。通过主成分(PCA)分析3个轮作模式下土壤细菌在属水平的相对丰度特征。
2 结果与分析
2.1 土壤样品测序结果
测序得到的土壤细菌群落序列读数和OTUS数(表1),在相似度大于97%的水平上3个轮作模式共获得高质量目标序列65355条。Cleanreadsrate值均高于80%,说明测序质量可以反映土壤细菌群落组成情况。同一土层不同轮作模式统计分析表明,0~10cm土层各模式下土壤细菌的OTUS的种类数无显著差异(P>0.05),10~20cm土层只有W-F-S出现显著差异(P<0.05);同一轮作模式不同土层统计分析表明,W-R-V的10~20cmOTUS的种类数差异显著,其他各轮作模式差异不显著(P>0.05)。比较OTUS的种类数发现:在0~10cm土层内,W-F-S的OTUS种类数最多,W/F-L-L次之;在10~20cm土层内,W-R-V的OTUS种类数最多,其次是W/F-L-L。在整个0~20cm耕层土壤中除W-F-S外,其他处理OTUS的种类数均随着土层的加深呈增加趋势。
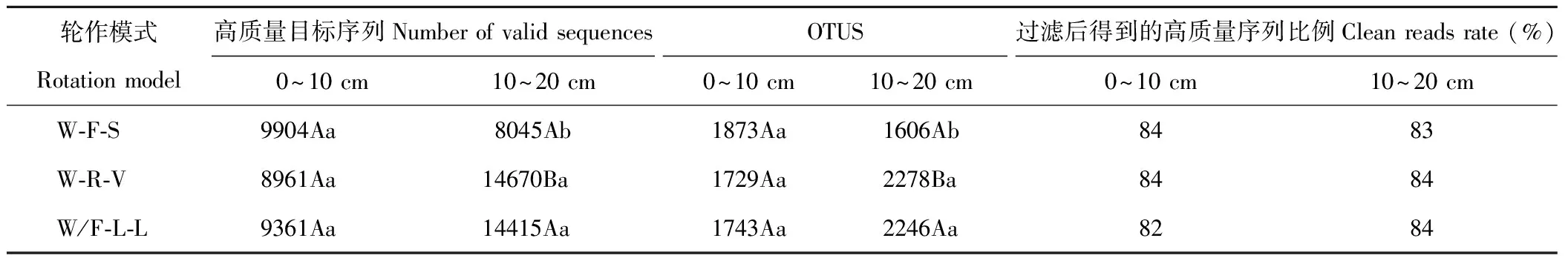
表1 不同轮作模式下不同土层土壤细菌序列读数及OTUS数
注:大写字母表示同行之间比较,小写字母表示同列之间比较,不同字母在0.05水平下差异显著。下同。
Note: The differences among different soil layer are shown by capital letters in the same rotation model, differences among different rotation models are shown by small letters in the same soil layer, the significant differences atP<0.05 are shown by different letters in the Table. The same below.
2.2 土壤细菌群落Alpha多样性
在0~10 cm土层内,土壤细菌群落Alpha多样性指数在3个轮作模式之间差异均不显著(P>0.05)。在10~20 cm土层土壤细菌多样性指数Shannon和Simpson在W-F-S和W-R-V模式之间差异显著(P<0.05)。W-R-V模式在两个土层的Observed species和Shannon指数出现显著差异(P<0.05)。由表2可以看出,在0~10 cm土层内,土壤的细菌丰富度指数Chao1变化趋势为W-F-S>W-R-V>W/F-L-L,Observed species变化趋势为:W-F-S>W/F-L-L>W-R-V。土壤细菌的多样性指数(Shannon和Simpson)变化趋势均为:W-F-S>W/F-L-L>W-R-V。在10~20 cm土层内,土壤的细菌丰富度指数(Chao1和Observed species)、多样性指数(Shannon和Simpson)变化趋势均为:W-R-V>W/F-L-L>W-F-S。上述结果表明,0~10 cm土层,W-F-S的菌群Alpha多样性最高,W/F-L-L次之。在10~20 cm土层,各处理土壤细菌群落组成Alpha多样性指数呈现出与0~10 cm相反的趋势。
2.3 不同分类水平下土壤细菌组成
在门水平上,除极少部分细菌(0.02%~0.05%)未被分类外,3种轮作模式下两个土层土壤细菌均主要分布在25个细菌门类。图2和图3分别为0~10 cm和10~20 cm土层丰度前10(占总量的98%)的菌门分布。其中优势菌门均为酸杆菌门(33.47%~39.76%)和变形菌门(32.55%~37.60%)。在0~10 cm土层中疣微菌门(Verrucomicrobia)的丰度在W-R-V模式中显著高于W/F-L-L模式(P<0.05),硝化螺旋菌门丰度在W-F-S模式中显著高于W-R-V和W/F-L-L(P<0.05)。在10~20 cm土层,W-F-S模式中酸杆菌门丰度显著高于W-R-V模式而绿弯菌门(Chloroflexi)丰度显著低于W-R-V模式(P<0.05);W-R-V的放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)和疣微菌门丰度显著高于其他两个轮作模式。其余各菌在各样品中均有分布,相对丰度因处理不同而存在差异,但差异不显著(P>0.05)。

表2 各轮作模式下0~20 cm土壤细菌群落Alpha多样性比较

图2 不同轮作模式0~10 cm土层土壤在门水平上的细菌类群比较Fig.2 Comparison of bacteria groups at phylum level in soil of 0-10 cm layer under different rotation models 不同小写字母代表不同轮作模式间的差异显著(P<0.05)。Different lowercase letters represent significant differences among different rotation models (P<0.05). Proteobacteria: 变形菌门;Acidobacteria: 酸杆菌门;Bacteroidetes: 拟杆菌门;Actinobacteria: 放线菌门;Planctomycetes: 浮霉菌门;Gemmatimonadetes: 芽单胞菌门;Verrucomicrobia: 疣微菌门;Chloroflexi: 绿弯菌门;Nitrospirae: 硝化螺旋菌门;Armatimonadetes: 装甲菌门. 下同The same below.
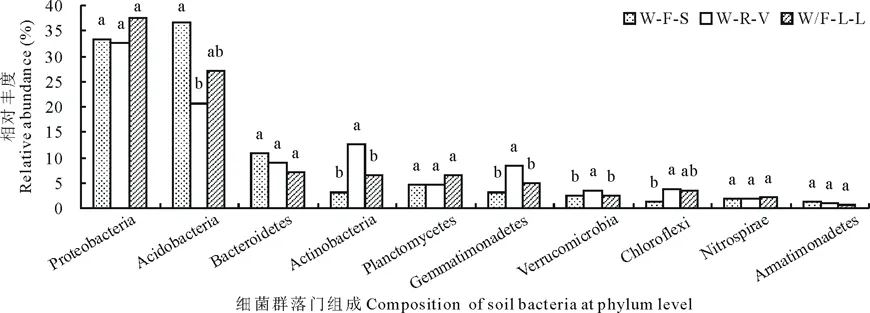
图3 不同轮作模式10~20 cm土层土壤在门水平上的细菌类群比较Fig.3 Comparison of bacteria groups at phylum level in soil of 10-20 cm layer under different rotation models

图4 不同轮作模式0~10 cm土层土壤在属水平上的细菌类群比较Fig.4 Comparison of bacteria groups at genus level in soil of 0-10 cm layer under different rotation models Arthrobacter: 节细菌属;Rhodoplanes: 红游动菌属;Nitrospira: 硝化螺旋菌属;Sphingomonas: 鞘脂单胞菌属;Lysobacter: 溶杆菌属;Janthinobacterium:紫色杆菌属;Gemmata:出芽菌属;Devosia:德沃斯氏菌属;Pseudomonas:假单胞菌属; Phenylobacterium:苯基杆菌属;Bradyrhizobium:慢生根瘤菌属;Erwinia:欧文氏菌属;Bacillus:芽孢杆菌属;Variovorax:贪噬菌属;Balneimonas:拜纳蒙纳斯属。下同The same below.

图5 不同轮作模式10~20 cm土层土壤在属水平上的细菌类群比较Fig.5 Comparison of bacteria groups at genus level in soil of 10-20 cm layer under different rotation models
在属的分类水平,除未被分类的细菌属外(84.96%~90.38%),0~10 cm土层各轮作模式土壤细菌相对丰度前25的细菌菌属分布见图4。3个模式下土壤各细菌属所占相对丰度大小存在差异,其中硝化螺旋菌属和紫色杆菌属丰度在W-F-S模式显著高于W/F-L-L模式,而CandidatusSolibacter菌属丰度显著低于W/F-L-L模式(P<0.05);Flavisolibacter菌属和苯基杆菌属(Phenylobacterium)在W/F-L-L模式丰度显著低于其他轮作模式(P<0.05);红游动菌属在W-F-S模式丰度高于W/F-L-L和W-R-V,且差异显著(P<0.05);Adhaeribacter菌属在W-R-V模式丰度较高且差异显著(P<0.05)。各处理前5种优势细菌属除了共有菌属Kaistobacter属(2.73%~3.67%)和Flavisolibacter属(1.15%~1.90%)外,W-F-S下优势菌属还包括节细菌属(Arthrobacter,0.90%)、红游动菌属(0.85%)和紫色杆菌属(0.77%),W-R-V下包括节细菌属(1.37%)、欧文氏菌属(0.78%)和Adhaeribacter菌属(0.66%);W/F-L-L包括鞘脂单胞菌属(0.83%)、红游动菌属(0.60%)和Fimbriimonas菌属(0.47%)。
在10~20 cm土层土壤内3个轮作模式土壤细菌属的相对丰度大小均存在差异,其中W/F-L-L模式中的红游动菌属相对丰度显著高于W-R-V模式(P<0.05);紫色杆菌属和Ramlibacter菌属在W-F-S模式中相对丰度显著高于其他模式(P<0.05);W-R-V模式中的CandidatusSolibacter菌属丰度显著低于W-F-S和W/F-L-L模式,而Adhaeribacter菌属和Iamia菌属丰度较其他模式高且差异显著(P<0.05);W/F-L-L模式中出芽菌属丰度显著高于W-F-S和W-R-V模式(P<0.05)。Kaistobacter仍然是3种模式下的共有属(1.63%~4.53%),此外硝化螺旋菌属(0.76%~1.34%)、节细菌属(0.85%~1.81%)和红游动菌属(0.75%~1.90%)也是共有菌属。W-F-S下优势菌属还包括溶杆菌属(0.73%);W-R-V还包括Iamia菌属(0.51%);W/F-L-L还包括出芽菌属(0.99%)(图5)。
2.4 土壤细菌属相对丰度的主成分分析

图6 不同轮作模式不同土层土壤在属水平细菌相对丰度主成分分析 Fig.6 Principal component analysis of bacteria relative abundance in different soil layers under different rotation modelsS10、V10、L10分别表示W-F-S、W-R-V和W/F-L-L模式0~10 cm土层样品;S20、V20、L20分别表示W-F-S、W-R-V和W/F-L-L模式10~20 cm土层样品。S10, V10 and L10 respectively represent the samples of 0-10 cm soil layer in W-F-S, W-R-V and W/F-L-L models; S20, V20 and L20 respectively represent the samples of 10-20 cm soil layer in W-F-S, W-R-V and W/F-L-L.
3种轮作模式下土壤细菌物种相对丰度共提取6个主成分,累积贡献率达85.82%,其中第1主成分(PC1)和第2主成分(PC2)贡献率分别为33.85%和18.60%。从图6中可以看出,3种轮作模式的0~10 cm均分布在PC1轴负方向,W/F-L-L模式的10~20 cm分布在正方向。W-R-V模式的0~10 cm分布在PC2轴正方向,W/F-L-L模式的0~10 cm、W-F-S和W-R-V模式的10~20 cm分布在负方向。
载荷因子反映主成分与细菌属水平丰度的相关系数,载荷因子越高,表示该细菌属对主成分的影响越大[16]。与第一主成分(PC1)具有较高相关性的细菌属主要有红游动菌属、Pirellula菌属、慢生根瘤菌属、出芽菌属和硝化螺旋菌属,与第二主成分(PC2)具有较高相关性的细菌属则主要有Balneimonas菌属、DA101菌属、苯基杆菌属、德沃斯氏菌属(Devosia)和Adhaeribacter菌属(表3)。

表3 25个细菌属水平丰度的主成分载荷因子
注:带*的为两个主成分中相关性前5的细菌属。
Note: * are the top 5 related genus of the two main components.
3 讨论
3.1 不同轮作模式下土壤细菌多样性特征
微生物多样性反映微生物与土壤环境间的相互关系,不同轮作模式中各作物对微生物多样性的影响不同[17]。本研究以不同豆科作物构成的轮作模式为对象,发现在冬麦-休闲-大豆模式下土壤0~10 cm细菌多样性最高,这与李晓慧等[18]曾报道种植大豆更有利于土壤微生物的生长和繁殖,提高土壤细菌丰度一致。而且研究表明轮作中对土壤短期休闲处理,使土壤保持肥力,对土壤表层的微生物种群和群落组成有积极作用[19]。冬麦-油菜-箭筈豌豆模式下0~10 cm细菌多样性最低,可能是由于此轮作模式下作物种类多,耕作频繁而扰动土壤生境,导致土壤微生物群落环境不稳定,致使一些适应特定环境的微生物失去活性[20]。而冬麦-油菜-箭筈豌豆和冬麦/休闲-苜蓿-苜蓿模式下10~20 cm多样性相对较高的原因是箭筈豌豆前茬油菜的直根系可以分泌有机酸,促进了土壤难溶性的磷转化为有效磷,改善土壤养分和生物体的代谢,提高土壤微生物群落活性,有增加微生物数量及其多样性的作用[21];而苜蓿是多年生作物,随着生长年限增加,土壤根系累积增多,导致其土壤微生物多样性较高。在0~20 cm耕层土壤中冬麦-休闲-大豆微生物多样性表现最低,这可能是由于大豆种植前,土壤处于冬闲期,导致微生物失去繁殖所需载体[22],这与植被覆盖下细菌种类丰度较裸地要高的结果一致[23]。
3.2 不同轮作模式下土壤细菌类群组成
土壤细菌群落结构受种植作物的影响[24],作物种类不同其土壤微生物所处环境不同,细菌组成和丰度大小有差异,不同的农田土壤中存在共有和特异的细菌种群[25]。本研究发现变形菌、酸杆菌和拟杆菌在各轮作模式丰度较高,这一结果与Sapp等[26]、Liu等[27]和王伏伟等[28]对小麦和大豆土壤细菌的研究结果一致。在属的水平,Kaistobacter属在0~20 cm耕层丰度较高,该属为不产氧光合细菌,其功能与光合作用和固氮作用紧密相关[29],这与3个模式取样阶段均为豆科作物相符。红游动菌属具有脱氮作用,是具有降解有机物及一些难以生物降解的含氮化合物功能菌,在豆科作物土壤中较常见,且在光照厌氧和黑暗好氧条件下降解效果更好[30]。本研究中冬麦/休闲-苜蓿-苜蓿模式下10~20 cm红游动菌属丰度最大,由于苜蓿为多年生作物,免耕下10~20 cm土层氧气含量低于0~10 cm土层。节细菌属是土壤常见细菌之一,为化能异养菌,具有脱硫、解磷和固氮作用[31],在冬麦-油菜-箭筈豌豆模式下丰度最高,这可能与油菜根系分泌有机酸有关。0~10 cm土层土壤细菌中Flavisolibacter属丰度表现较高,这可能由于其为纤维素降解菌属,其产生纤维素酶水解0~10 cm土层植物凋落物的细胞壁,促进根瘤菌侵染根系[32]。轮作系统可以通过增加作物多样性改变土壤环境,抑制植物的一些土传病害发生[33]。研究表明,某些植物能够与微生物产生互作作用,对植物病害控制产生一定效果,同时也可能会引起某种作物感染病害[34]。本研究发现,冬麦-休闲-大豆模式土壤中紫色杆菌属丰度较高,该菌属能够通过产生几丁质酶或紫色杆菌素的方式对大豆胞囊线虫发育产生抑制作用,有生防效果[35]。冬麦-油菜-箭筈豌豆土壤中欧文氏菌属丰度较高,与种植油菜密切相关,欧文氏菌属是十字花科等植物的病原菌,易引起植物器官和组织的软腐,能够以腐生的形式存活于土壤耕层或在植物残体中存活并越冬[36-37]。研究结果揭示了在陇东旱塬区冬麦后复种大豆、箭筈豌豆改善土壤肥力的同时,提示在有大豆加入的轮作土壤中对胞囊线虫防治效果较好、油菜参与的轮作系统中需关注软腐病的发生。冬麦/休闲-苜蓿-苜蓿土壤中鞘脂单胞菌属和Fimbriimonas菌属丰度较高,此二菌均具有固氮和脱氮特征,在维持氮平衡方面起重要作用[38]。刘丹丹等[39]在连作根围土壤发现鞘脂单胞菌属类群数量增加。Fimbriimonas菌属为需氧、嗜温且非运动性细菌,适宜低营养浓度环境生存[40],而苜蓿是二年生,较箭筈豌豆和大豆地上、地下生物量大,对土壤扰动频率低,所以Fimbriimonas菌属在冬麦/休闲-苜蓿-苜蓿0~10 cm土层中丰度较高。在10~20 cm土层土壤,硝化螺旋菌属丰度表现相对较高,这可能与其参与土壤氮循环,适宜在低碳和氮土壤中生存相关联[41]。冬麦-休闲-大豆模式下溶杆菌属丰度较高,该菌与大豆胞囊线虫的卵和胞囊发育有关,其中抗生素溶杆菌有效防治大豆锈病[42],因此有大豆参加的轮作可以很好地抑制有关病虫害。冬麦/休闲-苜蓿-苜蓿模式丰度表现较高的出芽菌属为厌氧氨氧化菌,适宜养分含量较低环境,促进氮循环[43],在非根际土壤丰度较高[44]。
3.3 不同轮作模式对土壤细菌属水平物种丰度的影响
因子载荷用来反映微生物群落的生理特征,是其群落组成和功能多样性的具体表现[45],同时结合主成分分析可以解释不同处理土壤微生物群落组成不同。本研究中红游动菌属、出芽菌属和硝化螺旋菌属与第一主成分相关性较高,这与相对丰度结果相一致。研究发现慢生根瘤菌属具备溶无机磷酸盐的能力,接种该菌株可提高大豆光合作用色素含量[46],在非根际土壤丰度较高。Pirellula菌属为专性好氧菌参与土壤氮循环,在0~10 cm土壤中较丰富。因此,在第一主成分它们相关性较高。本研究中,Balneimonas菌属、DA101菌属、苯基杆菌属和德沃斯氏菌属与第二主成分相关性较高。Balneimonas菌属是与豆科植物相关的根瘤菌属;DA101菌属好氧,一般在表土层丰度较高,可利用植物生物代谢有机碳过程中的化学能[47]。苯基杆菌属和德沃斯氏菌属均为固氮菌,属于好氧细菌常见于土壤表层[48]。但目前为止,德沃斯氏菌属在土壤中的具体功能还鲜有报道。总体来看,与第一、第二主成分相关性较高的菌属均与生物固氮性能有关,这与本研究采用的轮作模式中均包含豆科作物相吻合。
4 结论
在陇东旱塬冬小麦后采用不同的豆科作物复种轮作方式下,土壤0~10 cm细菌多样性以W-F-S模式下最高,W-R-V最低;10~20 cm土层表现出相反趋势。3种轮作模式下细菌群落组成接近,土壤细菌大部分为与固氮有关的菌如红游动菌属、出芽菌属和硝化螺旋菌属等;W-F-S模式中与防治胞囊线虫有关的紫色杆菌属和溶杆菌属丰度较高;W-R-V模式土壤中发现病原菌欧文氏菌属的出现可能受前茬油菜的根系残留影响;W/F-L-L模式土壤中菌属以固氮作用为主。研究结果发现,通过冬麦后复种大豆、箭筈豌豆,或采用小麦-苜蓿轮作模式可改善陇东旱塬区土壤肥力,并揭示了防治某些土传植物病害的微生物机理。
References:
[1] Deng Z Y, Zhang Q, Wang Q,etal. Influence of water storage capacity on yield of winter wheat in dry farming area in the Loess Plateau. Acta Ecologica Sinica, 2011, 31(18): 5281-5290. 邓振镛, 张强, 王强, 等. 黄土高原旱塬区土壤贮水量对冬小麦产量的影响. 生态学报, 2011, 31(18): 5281-5290.
[2] Wang T, Li L L, Zhou H Y,etal. Effects of long-term fertilization on soil nitrogen under rain-fed farming in Loess Plateau of East Gansu. Acta Pedologica Sinica, 2016, 53(1): 177-188. 王婷, 李利利, 周海燕, 等. 长期不同施肥措施对雨养条件下陇东旱塬土壤氮素的影响. 土壤学报, 2016, 53(1): 177-188.
[3] Yang N, Wang Z, Gao Y,etal. Effects of planting soybean in summer fallow on wheat grain yield, total N and Zn in grain and available N and Zn in soil on the Loess Plateau of China. European Journal of Agronomy, 2014, 58: 63-72.
[4] Zhou L, Yang Y, Wang Z H,etal. Influence of maize-soybean rotation and N fertilizer on bacterial community composition. Acta Agronomica Sinica, 2013, 39(11): 2016-2022. 周岚, 杨永, 王占海, 等. 玉米-大豆轮作及氮肥施用对土壤细菌群落结构的影响. 作物学报, 2013, 39(11): 2016-2022.
[5] Christiansen S, Ryan J, Singh M,etal. Potential legume alternatives to fallow and wheat monoculture for mediterranean environments. Crop & Pasture Science, 2014, 66(2): 175-182.
[6] Northup B K, Rao S C. Summer legume ‘green’ nitrogen crops affect winter wheat forage in continuous rotation. Crops and Soils, 2016, 49(1): 39-41.
[7] Qin S H, Cao L, Zhang J L,etal. Effect of rotation of leguminous plants on soil available nutrients and physical and chemical properties in continuous cropping potato field. Acta Agronomica Sinica, 2014, 40(8): 1452-1458. 秦舒浩, 曹莉, 张俊莲, 等. 轮作豆科植物对马铃薯连作田土壤速效养分及理化性质的影响. 作物学报, 2014, 40(8): 1452-1458.
[8] Tiemann L K, Gry A S, Atkinson E E,etal. Crop rotational diversity enhances belowground communities and functions in an agroecosystem. Ecology Letters, 2015, 18(8): 761.
[9] Song L P, Luo Z Z, Li L L,etal. Effects of lucerne-crop rotation patterns on soil aggregate stability and soil organic carbon. Chinese Journal of Eco-Agriculture, 2016, 24(1): 27-35. 宋丽萍, 罗珠珠, 李玲玲, 等. 苜蓿-作物轮作模式对土壤团聚体稳定性及有机碳的影响. 中国生态农业学报, 2016, 24(1): 27-35.
[10] Chen D, Cheng J, Chu P,etal. Regional-scale patterns of soil microbes and nematodes across grasslands on the Mongolian plateau: relationships with climate, soil, and plants. Ecography, 2015, 38(6): 622-631.
[11] Li G B, Li G Y, Sun C S,etal. Rhizosphere microbe quantity and biomass accumulation ofAstragalusmongholicusunder drought stress. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(9): 1868-1874. 李国斌, 李光跃, 孙窗舒, 等. 干旱胁迫对蒙古黄芪生物量及其根际微生物种群数量的影响. 西北植物学报, 2015, 35(9): 1868-1874.
[12] Fierer N, Caporaso J G, Fierer N,etal. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes. Proceedings of the National Academy of Sciences, 2012, 109(52): 21390-21395.
[13] Liu W Q, Mao Z C, Yang Y H,etal. Analysis of soil bacterial diversity by using the 16S rRNA gene library. Acta Microbiologica Sinica, 2008, 48(10): 1344-1350. 刘玮琦, 茆振川, 杨宇红, 等. 应用16S rRNA基因文库技术分析土壤细菌群落的多样性. 微生物学报, 2008, 48(10): 1344-1350.
[14] Herrera Paredes S, Lebeis S L. Giving back to the community: microbial mechanisms of plant——soil interactions. Functional Ecology, 2016, 30(7): 1043-1052.
[15] Deng J Q, Liang Z T, Liu Y B,etal. Dry matter production and water use of winter wheat-forage catch crop rotation systems on the Longdong Loess Plateau. Acta Prataculturae Sinica, 2017, 26(2): 161-170. 邓建强, 梁志婷, 刘渊博, 等. 陇东旱塬冬小麦复种饲草轮作系统产量和水分利用特征. 草业学报, 2017, 26(2): 161-170.
[16] Shi P, Gao Q, Wang S P,etal. Effects of continuous cropping of corn and fertilization on soil microbial community functional diversity. Acta Ecologica Sinica, 2010, 30(22): 6173-6182. 时鹏, 高强, 王淑平, 等. 玉米连作及其施肥对土壤微生物群落功能多样性的影响. 生态学报, 2010, 30(22): 6173-6182.
[17] Nannipieri P, Ascher J, Ceccherini M T,etal. Microbial diversity and soil functions. European Journal of Soil Science, 2003, 54(4): 655-670.
[18] Li X H, Han X Z, Wang S Q,etal. Soil Microorganism amount and population as affected by different crop roots. Soil and Crop, 2010, 26(2): 156-159. 李晓慧, 韩晓增, 王树起, 等. 土壤微生物对不同作物根系活动的响应. 土壤与作物, 2010, 26(2): 156-159.
[19] Acostamartínez V, Mikha M M, Vigil M F. Microbial communities and enzyme activities in soils under alternative crop rotations compared to wheat-fallow for the Central Great Plains. Applied Soil Ecology, 2007, 37(1/2): 41-52.
[20] Li T, Wang Z T, Liu L,etal. Effect of conservation tillage practices on soil microbial spatial distribution and soil physico-chemical properties of the Northwest Dryland. Scientia Agricultura Sinica, 2017, 50(5): 859-870. 李彤, 王梓廷, 刘露, 等. 保护性耕作对西北旱区土壤微生物空间分布及土壤理化性质的影响. 中国农业科学, 2017, 50(5): 859-870.
[21] Yang R J, Ma H L, Yang Q F,etal. Effects of planting density and nitrogen application rate on soil microbial activity under wheat/forage rape multiple cropping. Chinese Journal of Applied Ecology, 2007, 18(1): 113-117. 杨瑞吉, 马海灵, 杨祁峰, 等. 种植密度与施氮量对麦茬复种饲料油菜土壤微生物活性的影响. 应用生态学报, 2007, 18(1): 113-117.
[22] Li Z H, Han Z Q, Gao F H,etal. Effects of different preceding crops on rhizosphere microorganisms of flue-cured tobacco plant. Chinese Agricultural Science Bulletin, 2011, 27(22): 114-118. 李忠环, 韩智强, 高福宏, 等. 不同前茬对烤烟根际土壤微生物的影响. 中国农学通报, 2011, 27(22): 114-118.
[23] Roesch L F W, Fulthorpe R R, Riva A,etal. Pyrosequencing enumerates and contrasts soil microbial diversity. Isme Journal, 2007, 1(4): 283-290.
[24] Wen X, Dubinsky E, Yao W U,etal. Wheat, maize and sunflower cropping systems selectively influence bacteria community structure and diversity in their and succeeding crop’s rhizosphere. Journal of Integrative Agriculture, 2016, 15(8): 1892-1902.
[25] Wu F Z, Wang X Z. Effect of soybean-cucumber and wheat-cucumber rotation on soil microbial community species diversity. Acta Horticulturae Sinica, 2007, 34(6): 1543-1546. 吴凤芝, 王学征. 黄瓜与小麦和大豆轮作对土壤微生物群落物种多样性的影响. 园艺学报, 2007, 34(6): 1543-1546.
[26] Sapp M, Harrison M, Hany U,etal. Comparing the effect of digestate and chemical fertiliser on soil bacteria. Applied Soil Ecology, 2014, 86: 1-9.
[27] Liu J, Sui Y, Yu Z,etal. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China. Soil Biology & Biochemistry, 2014, 70(2): 113-122.
[28] Wang F W, Wang X B, Li J C,etal. Effects of fertilization and straw incorporation on bacterial communities in lime concretion black soil. Chinese Journal of Eco-Agriculture, 2015, 23(10): 1302-1311. 王伏伟, 王晓波, 李金才, 等. 施肥及秸秆还田对砂姜黑土细菌群落的影响. 中国生态农业学报, 2015, 23(10): 1302-1311.
[29] Yang S P, Lin Z H, Cui X H,etal. Current taxonomy of anoxygenic phototrophic bacteria—A review. Acta Microbiologica Sinica, 2008, 48(11): 1562-1566. 杨素萍, 林志华, 崔小华, 等. 不产氧光合细菌的分类学进展. 微生物学报, 2008, 48(11): 1562-1566.
[30] Chen C J, Zhang H Q, Wang Y Q,etal. Characteristics of microbial community in each compartment of ABR ANAMMOX reactor based on high-throughput sequencing. Environmental Science, 2016, 37(7): 2652-2658. 陈重军, 张海芹, 汪瑶琪, 等. 基于高通量测序的ABR厌氧氨氧化反应器各隔室细菌群落特征分析. 环境科学, 2016, 37(7): 2652-2658.
[31] Tian G J, Wang H, Chen L H. Isolation and determination of nitrogen-fixing bacteria in rhizosphere of main tree species in Chifeng, Inner Mongolia. Inner Mongolia Forestry Science and Technology, 2016, 42(1): 21-26. 田国杰, 王晗, 陈立红. 内蒙古赤峰地区主要树种根际固氮菌的分离和鉴定. 内蒙古林业科技, 2016, 42(1): 21-26.
[32] Deng Z S, Du Y, He X L,etal. Combined rhizobium of robinia pseudoacacia with cellulose-decomposing bacteria for promoting growth of Shanghai Green (Brassicachinensis) andSorghumvulgare. Journal of Microbiology, 2016, 36(1): 36-41. 邓振山, 杜洋, 贺晓龙, 等. 刺槐根瘤菌与纤维素分解菌对上海青和高粱的促生效应. 微生物学杂志, 2016, 36(1): 36-41.
[33] Niu J, Chao J, Xiao Y,etal. Insight into the effects of different cropping systems on soil bacterial community and tobacco bacterial wilt rate. Journal of Basic Microbiology, 2017, 57(1): 3-11.
[34] Gong X F, Song Z F, Miao M J,etal. Regulation molecular mechanisms of Ca2+signaling on plant-environmental microorganism interactions. Acta Botanica Boreali-Occidentalia Sinica, 2016, 36(10): 2128-2136. 巩雪峰, 宋占锋, 苗明军, 等. Ca2+信号在植物与环境微生物互相作用中的分子调控机制. 西北植物学报, 2016, 36(10): 2128-2136.
[35] Wu Y P, Shi F Y, Hamid M I,etal. Endophytic bacterial diversity of wild soybean (Glycinesoja) varieties with different resistance to soybean cyst nematode (Heteroderaglycines). Acta Microbiologica Sinica, 2014, 54(8): 926-935. 武云鹏, 史凤玉, Hamid M I, 等. 野生大豆抗感大豆孢囊线虫材料内生细菌多样性分析. 微生物学报, 2014, 54(8): 926-935.
[36] Togashi J, Ueda K, Namai T. Overwintering ofErwiniacarotovorasubsp.carotovorain diseased tissues in soil and its role as inoculum for soft rot of Chinese cabbage (BrassicacampestrisL., Pekinensis Group). Journal of General Plant Pathology, 2001, 67(1): 45-50.
[37] Zhao L, Chai Z X, Li J H,etal. Isolation and identification of four newErwiniacarotovorasubsp.carotovorastrains. Acta Prataculturae Sinica, 2011, 20(4): 244-251. 赵玲, 柴兆祥, 李金花, 等. 四株胡萝卜软腐欧文氏杆菌胡萝卜亚种新菌株的分离鉴定. 草业学报, 2011, 20(4): 244-251.
[38] Hu J, He X H, Li D P,etal. Progress in research ofSphingomonas. Chinese Journal of Applied & Environmental Biology, 2007, 13(3): 431-437. 胡杰, 何晓红, 李大平, 等. 鞘氨醇单胞菌研究进展. 应用与环境生物学报, 2007, 13(3): 431-437.
[39] Liu D D, Li M, Liu R J. Recent advances in the study of plant growth-promoting rhizobacteria in China. Chinese Journal of Ecology, 2016, 35(3): 815-824. 刘丹丹, 李敏, 刘润进. 我国植物根围促生细菌研究进展. 生态学杂志, 2016, 35(3): 815-824.
[40] Im W T, Hu Z Y, Kim K H,etal. Description ofFimbriimonasginsengisoligen. nov., sp. nov. within theFimbriimonadiaclassnov., of the phylum Armatimonadetes. Antonie van Leeuwenhoek, 2012, 102(2): 307-317.
[41] Luo X, Han S, Lai S,etal. Long-term straw returning affectsNitrospira-like nitrite oxidizing bacterial community in a rapeseed-rice rotation soil. Journal of Basic Microbiology, 2017, 57(4): 309-315.
[42] Ji G H. Advances in the study onLysobacterspp. bacteria and their effects on biological control of plant diseases. Journal of Yunnan Agricultural University: Natural Science Edition, 2011, 26(1): 124-130. 姬广海. 溶杆菌属及其在植物病害防治中的研究进展. 云南农业大学学报: 自然科学版, 2011, 26(1): 124-130.
[43] Wagner M, Horn M. ThePlanctomycetes,Verrucomicrobia,Chlamydiaeand sister phyla comprise a superphylum with biotechnological and medical relevance. Current Opinion in Biotechnology, 2006, 17(3): 241-249.
[44] Wang Q T, Zhu W R, Liu M L,etal. Comparison on bacterial community of rhizosphere and bulk soil of poplar plantation based on pyrosequencing. Chinese Journal of Applied Environmental Biology, 2015, 21(5): 967-973. 汪其同, 朱婉芮, 刘梦玲, 等. 基于高通量测序的杨树人工林根际和非根际细菌群落结构比较. 应用与环境生物学报, 2015, 21(5): 967-973.
[45] Long J, Huang C Y, Teng Y,etal. Research on soil microbial characteristics of soil-Elsholtziaharchowensissystem in copper mine tailings. Acta Pedologica Sinica, 2004, 41(1): 120-125. 龙健, 黄昌勇, 滕应, 等. 铜矿尾矿库土壤-海洲香薷(Elsholtziaharchowensis)植物体系的微生物特征研究. 土壤学报, 2004, 41(1): 120-125.
[46] Guo J, Chi J. Effect of Cd-tolerant plant growth-promoting rhizobium on plant growth and Cd uptake byLoliummultiflorumLam. andGlycinemax(L.) Merr. in Cd-contaminated soil. Plant and Soil, 2014, 375(1): 205-214.
[47] Sangwan P, Chen X, Hugenholtz P,etal. Chthoniobacter flavus gen. nov., sp. nov., the first pure-culture representative of subdivision two, spartobacteria classis nov., of the phylum verrucomicrobia. Applied & Environmental Microbiology, 2004, 70(10): 5875-5881.
[48] Oh Y S, Roh D H. Phenylobacterium muchangponense sp. nov., isolated from beach soil, and emended description of the genus Phenylobacterium. International Journal of Systematic & Evolutionary Microbiology, 2012, 62: 977-983.
Differences in soil bacterial community composition among three forage-crop rotations on the Longdong Loess Plateau
LIANG Zhi-Ting, DENG Jian-Qiang, WANG Zi-Kui, SHEN Yu-Ying, WANG Xian-Zhi*
StateKeyLaboratoryofGrasslandAgro-Ecosystems,CollegeofPastoralAgriculturalScienceandTechnology,NationalDemonstrationCenterforExperimentalGrasslandScienceEducation,LanzhouUniversity,Lanzhou730020,China
We analyzed the composition of the soil bacterial community in two topsoil layers (0-10 cm and 10-20 cm) under three crop-forage rotation models; winter wheat-fallow-soybean (W-F-S), winter wheat-forage rapeseed-common vetch (W-R-V), and winter wheat/fallow-lucerne (W/F-L-L). The soil bacterial community was analyzed by sequencing 16S rRNA gene amplicons. The results indicated that the dominant phyla in the topsoil were Proteobacteria and Acidobacteria under all three rotation models. The dominant genera in the topsoil under the three rotation models wereRhodoplanes,Gemmata,Nitrospira,Bradyrhizobium,Adhaeribacter, andBalneimonas. The bacterial communities in the topsoil under the W-F-S rotation sequence were dominated byJanthinobacteriumandLysobacter, which were related to the prevention and control of soybean cyst nematode, and were closely associated with soil-borne pathogen resistance under the W-F-S rotation. The dominant genus in topsoil in the W-R-V rotation wasErwinia, which was related to rapeseed, and that in the W/F-L-L rotation sequence wasSphingomonas, which was indicative of no- or low-tillage during alfalfa planting. The rotations could be ranked, from highest bacterial alpha-diversity to lowest, as follows W-F-S>W/F-L-L>W-R-V in the 0-10 cm topsoil layer; and W-R-V>W/F-L-L>W-F-S in the 10-20 cm topsoil layer. This study reveals the mechanisms by which nitrogen fixation is promoted and soil-borne pathogens are inhibited in various crop-forage rotation systems, from the perspective of the bacterial community composition and function. The results of this study have important theoretical value for maintaining a healthy soil ecological environment and for establishing successful forage-crop rotation systems on the Longdong Loess Plateau.
Loess Plateau; microorganism; soybeans; common vetch; lucerne
10.11686/cyxb2017048
http://cyxb.lzu.edu.cn
2017-02-16;改回日期:2017-04-19
甘肃省草原技术推广总站项目,国家科技支撑计划(2014BAD14B006)和教育部重大科技项目(313028)资助。
梁志婷(1990-),女,甘肃兰州人,在读硕士。E-mail:liangzht15@lzu.edu.cn*通信作者Corresponding author. E-mail:wangxianzhi@lzu.edu.cn
梁志婷, 邓建强, 王自奎, 沈禹颖, 王先之. 陇东旱塬区不同粮草轮作模式下土壤细菌群落组成特征. 草业学报, 2017, 26(8): 180-191.
LIANG Zhi-Ting, DENG Jian-Qiang, WANG Zi-Kui, SHEN Yu-Ying, WANG Xian-Zhi. Differences in soil bacterial community composition among three forage-crop rotations on the Longdong Loess Plateau. Acta Prataculturae Sinica, 2017, 26(8): 180-191.

