渤海不同区域沉积物古菌的多样性分析
王炳臣, 郑世玲, 张洪霞, 魏文超, 王欧美, 刘芳华
渤海不同区域沉积物古菌的多样性分析
王炳臣1, 2, 郑世玲1, 张洪霞1, 2, 魏文超1, 2, 王欧美3, 刘芳华1
(1. 中国科学院烟台海岸带研究所, 海岸带生物学与生物资源利用所重点实验室, 山东烟台 264003; 2. 中国科学院大学, 北京 100049; 3. 滨州医学院, 山东烟台 264003)
产甲烷古菌在滨海沉积物碳循环过程中起着重要作用。本研究以渤海不同区域沉积物为研究对象, 通过T-RFLP以及室内富集培养方法, 解析了渤海不同区域沉积物产甲烷菌群落结构差异, 并评估其产甲烷潜力。结果表明, 渤海不同区域沉积物细菌和产甲烷古菌群落结构组成存在差异, 其主要优势产甲烷菌为和, 主要优势细菌为和。渤海不同区域沉积物在实验室培养条件下产甲烷量存在明显差异, 表现为近岸区域沉积物产甲烷量较高。且渤海沉积物具有较高的产甲烷潜力 (乙酸转换率达到46.46 %), 潜在甲烷排放量估计值可达1.74亿t/年。
甲烷; 渤海; 产甲烷菌; 多样性; 产甲烷潜力
温室效应是全球气候变化的重要表现形式之一。甲烷(CH4)是全球第二大温室气体, 其增温潜势是CO2的21倍[1], 对大气增温贡献率为17%, 研究CH4排放对衡量区域内温室气体的排放具有重要意义。全球甲烷排放量大约为每年500t, 其中74%由产甲烷菌产生[2-3]。产甲烷菌广泛分布于海底及淡水沉积物、水稻田、动物胃肠道、地热及地矿等自然环境中[4], 在全球碳循环中起到重要的作用; 其产甲烷途径主要包括: 氢营养型[5], 乙酸营养型以及利用甲基类化合物的甲基途径[6]。目前, 对甲烷排放的相关研究多集中在草原、水稻田、湿地、湖泊、河口等区域[5-10], 对于海洋沉积物的甲烷排放研究也相对较少。
海洋是大气中CH4的自然排放源, 所释放的CH4量为全球总释放量的2%~4%[11], 其中占全球海洋面积16%的河口和近岸地区的释放量约为全球海洋CH4总释放量的75%[12]。通常, 由于河流中含有的高度过饱和CH4[13]被输入近海区域, 且河流向近岸海域输送大量陆源生物质, 为近海CH4产生提供有利环境条件。因此, 海洋不同区域CH4排放量存在差异, 在估算全球海洋释放CH4量时有很大的不确定性。
渤海属于我国内海, 具有半封闭、海床浅等特性, 是重要的自然渔场与资源矿场, 及重要的水上航线, 因此受到很多人为活动的影响[14-19]。此外, 环渤海区域河流较多, 近海区域受河流陆源性物质输入更为突出, 因此, 分析比较渤海近岸区域、离岸区域以及黄渤海交汇区域沉积物产甲烷菌群落结构与产甲烷潜力具有重要的生态意义。
以往研究主要集中于渤海沉积物微生物多样性, 微生物对渤海溢油降解等方面[20-23], 而对于渤海沉积物甲烷排放的相关研究则很少[24]。本研究通过对渤海不同区域产甲烷菌群落结构的分析及不同区域沉积物CH4排放潜力的评估, 有助于认识渤海区域甲烷代谢的微生物学机制, 同时为估算全球海洋CH4释放量提供理论依据。
1 材料与方法
1.1 沉积物样品来源
沉积物样品于2015年8月取自渤海内不同区域, 共12个位点: 黄河口近岸区域(BHB区域); 从渤海湾至辽东湾贯穿渤海区域(M区域), 样点位于渤海内部; 渤海口与黄海交互作用区域(E区域, 图1)。采用抓斗式取样器采集海洋沉积物后, 取0~5 cm表层沉积物样品, 混合均匀后, 一部分保存于4℃, 用于海水富集培养; 另一部分–80℃冷冻保存, 用于沉积物理化性质测定及微生物多样性分析。
1.2 沉积物理化性质的测定
沉积物硝态氮、铵态氮采用2 mol/L KCl(土水比1︰5) 浸提, 用自动分析仪分析 (AutoAnalyzer III, Seal, Germany)分析测定; 硫酸盐 (SO42–) 用去离子水 (土水比1︰10,/) 提取, 用自动分析仪 (Dionex ICS3000, DIONEX, America)测定; pH值采用去离子水 (土水比1︰2.5,/) 浸提15 min后用pH计 (PH-3C, 上海雷磁, 中国)测定。
可提取态Fe(II)浓度的采用紫外菲啰嗪(Ferrozin)显色法测定[25]: 称取0.5 g沉积物加入到4.5 mL的0.5 mol/L盐酸中, 室温条件下黑暗静置24 h。8 000 r/min离心5 min, 取上清0.1 mL, 加入1.9 mL含0.1% 菲啰嗪的200 mmol /LHEPES缓冲液, 反应5 min, 在562 nm波长下测定吸光值, 根据标准曲线计算Fe(II)浓度。每个样品重复3次。
1.3 DNA提取及T-RFLP分析
沉积物样品DNA采用FastDNATMSPIN Kit for soil (MP Biomedicals, Santa Ana, CA) 试剂盒提取, 具体操作参照说明书标准流程。参考Zheng等的方法进行T-RFLP分析[26], 以DNA为模版, 细菌引物为 Ba27f/Ba907r, 古菌引物为Ar109f/Ar915r进行PCR扩增。其中引物Ba27f的5′端和Ba907r的3′端标记6-羧基荧光素 (FAM)。PCR反应参数为: 94℃ 2 min预变性; 94℃变性30 s; 温度55℃ 30 s退火; 温度72℃ 1 min延伸, 反应25个循环。PCR产物经纯化后, 古菌DNA采用TaqI酶进行酶切, 细菌DNA采用MspI酶进行酶切, 酶切产物采用自动测序仪ABI PRISM 3730XL分析。
1.4 沉积物富集培养
沉积物富集培养: 采用海水富集培养基 (NH4Cl 1.5g/L, NaH2PO40.6 g/L, NaCl 11.7 g/L, NaHCO32.5 g/L, CaCl2·2H2O 0.1 g/L, KCl 0.1 g/L, MnCl2·4H2O 0.005 g/L, Na2MoO4·2H2O 0.001 g/L, MgCl2·6H2O 0.1 g/L, MgSO4·7H2O 0.1 g/L, CH3COONa 2.7 g/L, 酵母提取物 0.05 g/L)[27], 以33 mmol/L乙酸为电子供体进行富集培养。培养基分装至100 mL的西林瓶中, 每瓶40mL, 充入混合气(N2: CO2, 80 : 20)30 min, 密封。培养基通过高压灭菌锅, 121℃, 0.15 MPa灭菌20 min,冷却至室温后置于厌氧操作台进行接种, 采用无菌注射器向每瓶加入0.5 g沉积物的悬浮液, 并设置无沉积物的纯培养基作为对照, 置于适合产甲烷古菌的30℃黑暗条件, 静置培养。
富集培养期间, 每隔5 d用无菌注射器分别抽取气体和液体样品, 用配备FID检测器的气相色谱 (Agilent 7890A) 测定甲烷产量, 若样品中CH4浓度过高时, 则用N2稀释后测定。甲烷气相色谱检测方法: 用H2、N2和CO2为保护气, 以浓度为400×10–6的甲烷为标气。设置前检测器为250℃, 后检测器为330℃, 设置柱温箱为75℃, 后进样口温度为375℃, 点火完毕后使用FID检测器检测, CH4出峰时间约为1.3 min。用高效液相色谱 (Agilent 1260 Infinity Quaternary LC) 测定乙酸浓度, 用注射器 (无菌) 抽取1 mL液体样品10 000 r/min离心2 min, 取上清稀释, 过0.22mm孔径滤膜后上机检测。
1.5 数据分析
本研究中T-RFs片段所代表的属水平上的细菌或古菌的鉴定参照文献及课题组研究滨海湿地样品所建的细菌和古菌克隆文库[26,28], 并使用Greengene进行BLAST比对。利用软件CANOCO 4.5(蒙特卡洛检验, 基于499个随机非限制排列)进行微生物群落结构与环境因子之间相关性的RDA分析, 以及做微生物群落结构组成的PCA分析。微生物T-RFs片段多样性, 用香农威纳指数(Shannon Wiener, H= –SPilnP式中P=N/,N为种的个体数,为所在群落的所有物种的个体数之和) 计算并表示。采用Sigmaplot 12.5软件对产甲烷和乙酸消耗数据进行分析。通过实验结果, 估算渤海区域产甲烷潜力: 渤海区域产甲烷潜力估算值=渤海区域面积×渤海平均深度×实验室乙酸浓度×实验室中乙酸产甲烷最大转换率。
2 结果与分析
2.1 沉积物的理化性质
如表1所示, 3个区域所有站位沉积物pH值均呈碱性 (7.5~9.0)。BHB区域样品的pH相对较低; M区域各位点样品pH (8.5~8.7) 略高, 且相对稳定; 导电率相对较高; E区域位点样品pH值介于7.5~9.0, 变化相对较大; 电导率相对较低, 而铵态氮含量相对较高, 硝态氮含量较低。
2.2 渤海沉积物微生物多样性
如图2所示, 渤海不同区域沉积物优势古菌T-RFs片段均为86、181和388 bp。此外, E区域站位样品古菌T-RFs片段还包括197、221 bp; 而M区域各位点样品古菌T-RFs片段还包括197 bp和304 bp。说明渤海不同区域沉积物样品主要古菌群落相同, 同时存在区域性多样性的差异。
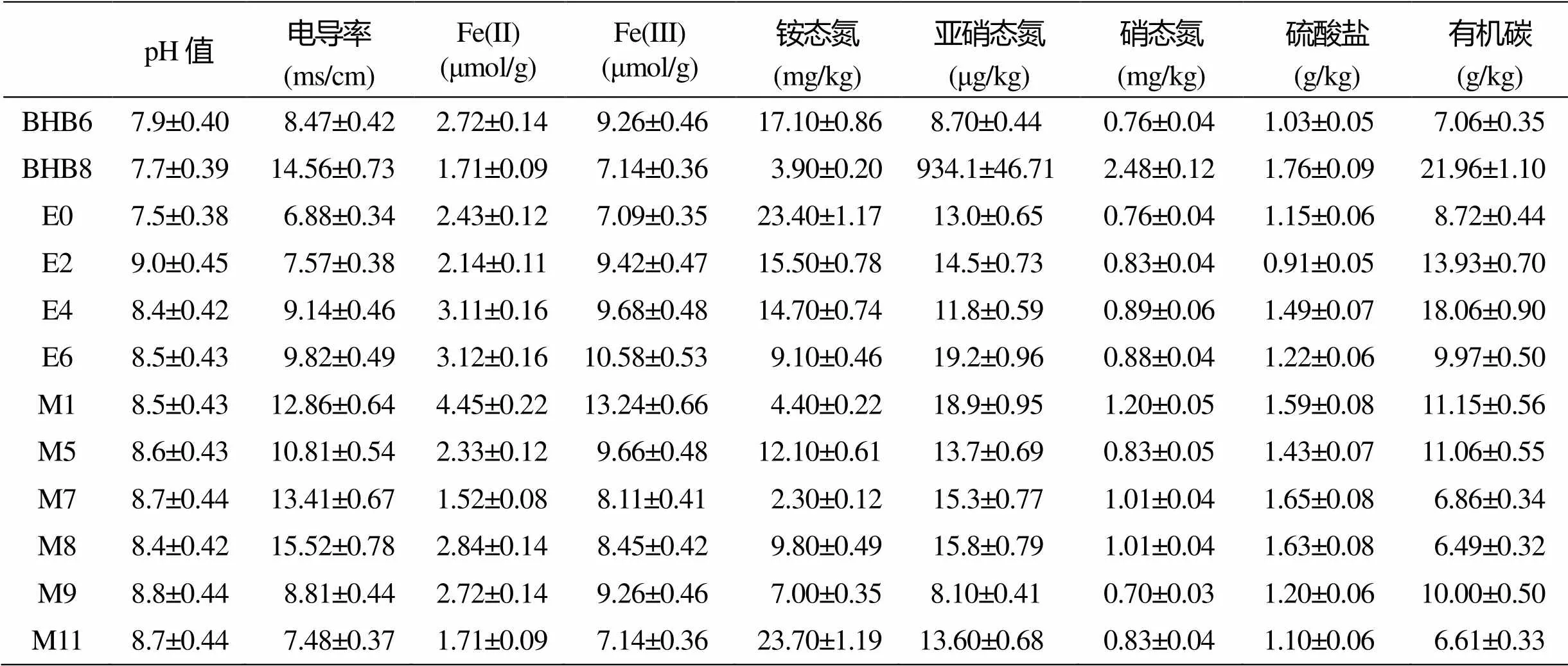
表1 不同站位沉积物理化性质(平均值±标准误差)
参照已建克隆文库, 各T-RFs片段代表的属水平上的古菌见表2。可知, 渤海沉积物共有的优势古菌T-RFs片段86 bp和181 bp分别代表甲烷杆菌属()和甲烷八叠球菌属(), 而其他T-RFs片段代表未知古菌。
由图2 (b)可知, 渤海不同区域沉积物细菌群落结构存在明显差异。细菌T-RFs 片段160、490和505 bp 为渤海不同区域沉积物样品的主要优势片段, 与M区域的主要优势细菌片段相同; E区域样品细菌T-RFs片段还包括91 bp和113 bp; BHB6样品细菌T-RFs片段还包括91、113、128、435和446 bp, 其中BHB区域代表片段多样性的Shannon指数为1.44~2.56, 相比其他区域, 细菌多样性最高。说明结果与古菌相类似, 渤海不同区域沉积物样品存在区域性多样性的差异。
各T-RFs 片段代表的属水平上的细菌见表3。160 bp和490 bpT-RFs 片段分别为脱硫弧菌属()和硫杆菌属 (); 此外, 91, 113, 128和435 bp T-RFs片段分别代表拟杆菌属 (), 脱氯菌属(), 副球菌属()和鞘氨醇单胞菌属 ()。其他T-RFs片段代表细菌未知。

表2 采用限制性内切酶Taq I产生的古菌片段构建克隆文库的16S rRNA基因系统发育关系
注: a为用Greengene进行BLAST比对的结果, b为限制性内切酶I切割后的T-RF片段长度

表3 采用限制性内切酶MspI产生的细菌片段构建克隆文库的16S rRNA基因系统发育关系
注: a为用Greengene进行BLAST比对的结果, b为限制性内切酶I切割后的T-RF片段长度
2.3 渤海沉积物微生物群落结构的主成分分析(PCA)
为了进一步分析渤海不同区域沉积物微生物群落结构组成变化, 对12个位点样品微生物群落结构做主成分分析。结果如图3所示, 除M5与E0聚集在一起外, 其他位点沉积物微生物群落结构具有明显差异。相同区域范围的不同位点样品微生物群落组成也表现出明显差异, 说明渤海不同位点沉积物样品的微生物群落结构存在较大差异, 具有较高的微生物多样性。
2.4 沉积物微生物群落结构与环境因子相关性分析
为了探究影响渤海沉积物微生物群落结构的环境因素, 对渤海沉积物细菌和古菌群落结构与环境因子之间分别做冗余分析(RDA)。结果显示(如图4a), 总铁、Fe(II)、电导率、pH、铵态氮、硫酸盐共6个变量组合, 能够保证所有变量膨胀系数都小于4, 其中硫酸盐解释量最高为15.5%, 总铁解释量最低为9.3%, 4个变量的前两个轴共解释了38.5%的古菌T-RFs片段变化, 约73.1%的群落-环境关系。BHB和E区域样品古菌群落主要受铵态氮影响, 而M区域中M5、M8、M9、M11四个位点样品古菌群落结构主要受硫酸盐和Fe(II)影响。T-RFs 221bp和388bp代表的古菌群落与铵态氮呈正相关; T-RFs 197bp和 304bp代表的古菌群落与pH、EC和Fe(II)呈正相关; 181bpT-RFs与硝态氮和亚硝态氮呈正相关。
散点图是主坐标1 (PC1)与主坐标2 (PC2)。样品的变化百分比如图中所描述的在轴上显示
The scatterplot is of principal coordinate 1 (PC1) as a function of principal coordinate 2 (PC2); The percentage of the variation in the samples described by the plotted PCs is shown on the axes
如图4b所示, 总铁解释量最高为32.4%, pH解释量最低为5.35%, 四个变量的前两个轴共解释了55.5%的细菌T-RFs片段变化, 约92.4%的群落-环境关系。可提取态总铁(TFe)是影响渤海沉积物细菌群落结构的显著环境变量(<0.05)。M1、M9、E2和E4位点细菌群落结构与pH和硫酸盐呈正相关; BHB6、E0和E7位点细菌群落结构与Fe(II)和TFe呈正相关。
2.5 渤海不同区域沉积物产甲烷量的变化
由图5可知, 在整个富集培养期间中 (0~40 d), 对照 (CK) 处理没有CH4产生, 而渤海不同区域沉积物样品产CH4量具有明显差异。在培养的0~15 d, 所有沉积物富集样品中均没有甲烷产生; 在培养的第20天以后, 所有样品开始产生CH4并积累。BHB8样品最先产生CH4且含量迅速上升, 在第25天达到最大值0.62 mmol, 之后保持相对稳定, 其产甲烷速率为1.5 mmol/d; BHB6样品在第25天后甲烷产量迅速上升, 在第35天达到最大值0.58 mmol。E4样品在第25天后甲烷产量也迅速上升, 在第35天达到最大值0.56 mmol; 而E区域中其他样品产甲烷量相对较少。M区域的M1、M8和M11样品在第25天后产CH4量迅速上升, M1在第30 天达到最大值0.59 mmol, 之后保持相对稳定, M8和M11样品在第35天分别达最大值0.60 mmol和0.65 mmol。
在整个培养期间 (0~40 d), 乙酸作为底物被消耗与CH4产量基本相对应。对照 (CK) 处理乙酸含量基本保持33 mmol/L不变。BHB6和BHB8样品乙酸含量在第20天后开始逐渐下降, BHB6在第40天乙酸被全部利用, BHB8的乙酸含量在第40 天下降为13.92 mmol/L。在培养的第30天, E4样品的乙酸就被消耗完, 而E区域其他样品在培养的最后乙酸含量均小幅降低。M1和M11样品的乙酸含量分别在第35、40天降低为0 mmol/L, M区域其他样品在培养的最后乙酸含量也均小幅降低。说明渤海不同区域沉积物样品利用乙酸为底物产CH4的情况不同, 虽然所有沉积物样品具有相同的优势产甲烷菌。E4样品细菌和古菌群落结构及产甲烷量都明显不同于E区域其他样品, 说明渤海沉积物微生物群落结构及功能具有区域特异性。通过由乙酸产甲烷 (CH3COOH→CH4+CO2) 计算发现, 最大转换率为46.46%。
3 讨论
根据底物利用类型, 产甲烷菌可分为3类: (1)乙酸营养型, 如甲烷鬃毛菌属(); (2)氢营养型, 主要利用H2和甲酸作为电子供体还原CO2产生甲烷, 如甲烷杆菌属(); (3)甲基化营养型, 通过H2还原甲基化合物中的甲基产甲烷或通过甲基化合物自身的歧化作用产甲烷, 如产甲烷球菌属()。海洋和滨海湿地盐度和硫酸盐含量较高, 而盐度和硫酸盐影响竞争性电子和产甲烷底物的种类和含量, 对产甲烷菌群落结构和甲烷产生途径有重要影响[29]。3种营养型的产甲烷菌广泛分布于淡水环境、滨海湿地和海洋沉积物中。Liu等[30]研究发现太湖沉积物中优势古菌为Methanomicrobiales目和Methanosarcinaceae科的产甲烷菌,而闽江河口区短叶茳芏潮汐淡水沼泽湿地土壤主要优势产甲烷菌为、和[9];、和为东海油气田沉积物的主要产甲烷菌。与以往研究类似[33], 本研究中沉积物主要优势古菌为产甲烷菌和, 分别为氢营养型和乙酸营养型[32], 而兼性菌还能够利用甲胺类产甲烷。因此, 渤海沉积物中3种类型有机底物都能够被利用而产生甲烷。
Baldwin等[34]对淡水湿地研究发现, 随着添加盐度的增加, 土壤中产甲烷菌群落多样性降低。Jenifer 等[35]对添加海水的淡水湿地的研究发现, 细菌和古菌的群落结构均没有随着盐度的增加而改变。在渤海沉积物中产甲烷菌群落结构与盐度没有显著相关性, 本研究中也没有发现显著影响海洋沉积物古菌多样性的环境因子, 所以站点与环境因子种类的增加是该区域进一步研究的重点。
本研究中近海沉积物样品产甲烷速率较快, 可能由于海洋沉积物中甲烷的产生速率在很大程度上受限于可降解有机质的含量[36], 而在近海区域受河流携带大量悬浮物和有机物的沉积, 使该海域沉积物中有机碳含量较高, 产甲烷菌活性较强。根据室内富集培养产甲烷量, 本研究对渤海最大产甲烷潜力进行了估算: 渤海平均深度为18 m[37], 总面积为7.7万km2[38], 按照实验室中乙酸浓度 (33 mmol/L) 与转化率 (46.46%) 计算, 整个渤海年甲烷产生潜力约为17.4亿t, 小于很多湿地环境中甲烷产生量[39-41], 可能由于海洋沉积物产甲烷底物含量低且存在更高浓度的产甲烷的竞争电子受体, 如硫酸盐、硝酸盐以及铁锰氧化物[42-44]。但本研究估算值大于李佩佩等的夏季估算值360~930 t[24], 这可能由于渤海海域有机酸输入小于实验输入值, 甲烷氧化与溶解等原因[46]。但同时说明渤海产甲烷潜力巨大 (17.4亿t/年), 随着陆源输入及人为活动的影响, 甲烷排放可能进一步升高。
4 结论
渤海不同区域沉积物细菌和产甲烷古菌群落结构组成存在差异。可提取态总铁对细菌群落结构具有显著影响,和为渤海沉积物主要优势细菌。渤海沉积物主要优势产甲烷菌为和。渤海不同区域沉积物产甲烷量具有明显差异, 表现为近岸区域沉积物产甲烷量较高。且渤海沉积物具有较高的产甲烷潜力 (乙酸转换率达到46.46 %), 潜在甲烷排放量估计值可达1.74 亿t/年。
[1] Manne A S, Richels R G. An alternative approach to establishing trade-offs among greenhouse gases[J]. Nature, 2001, 410(6829): 675-677.
[2] Lowe D C. Global change: A green source of surprise[J]. Nature. 2006, 439(7073): 148-149.
[3] 王雅苹, 史晓翀, 于少兰, 等. 青岛潮间带沉积物可培养厌氧细菌多样性的研究[J]. 海洋科学, 2015, 39(3): 92-99. Wang Yaping, Shi Xiaochong, Yu Shaolan, et al. Diversity of culturable anaerobic bacteria isolated from intertidal sediments of Qingdao[J]. Marine Sciences, 2015, 39(3): 92-99.
[4] Huber R, Kurr M, Jannasch H W, et al. A novel group of abyssal methanogenic archaebacteria (methanopyrus) growing at 110-degrees-c[J]. Nature, 1989, 342(6251): 833-834.
[5] 郑燕, 贾仲君. 新一代高通量测序与稳定性同位素示踪DNA/RNA技术研究稻田红壤甲烷氧化的微生物过程[J]. 微生物学报, 2013, 2: 173-184. Zheng Yan, Jia Zhongjun. Next generation sequencing and stable isotope probing of active microorganisms responsible for aerobic methane oxidation in red paddy soils[J]. Acta Microbiologica Sinica, 2013, 2: 173-184.
[6] 张坚超, 徐镱钦, 陆雅海. 陆地生态系统甲烷产生和氧化过程的微生物机理[J]. 生态学报, 2015, 20: 6592-6603. Zhang Jianchao, Xu Yiqin, Lu Yahai. Microbial mechanisms of methane production and oxidation in terrestrial ecosystems[J]. Acta Ecologica Sinica, 2015, 20: 6592-6603.
[7] 刘鹏飞. 甲烷胞菌对低氢和互营生长在转录水平的响应[D]. 北京: 中国农业大学, 2014. Liu Pengfei. Transcriptional responses of Methanocella methanogens to low H2and syntrophic growth conditions[D]. Beijing: China Agricultural University, 2014.
[8] 许可, 陈金全. 九龙江口海岸带沉积物甲烷相关古菌群落结构及多样性研究[J]. 安徽农业科学, 2012, 26: 12752-12753. Xu Ke, Chen Jinquan. Stratified Communities and Diversity of Methanogen in Sediments of Jiulong River Estuary[J]. Journal of Anhui Agricultural Sciences, 2012, 26: 12752-12753.
[9] 曾志华, 杨民和, 佘晨兴, 等. 闽江河口区淡水和半咸水潮汐沼泽湿地土壤产甲烷菌多样性[J]. 生态学报, 2014, 10: 2674-2681. Zeng Zhihua, Yang Minhe, She Chenxing, et al. Diversity of methanogen communities in tidal freshwater and brackish marsh soil in the Min River estuary[J]. Acta Ecologica Sinica, 2014, 10: 2674-2681.
[10] 俎千惠, 王保战, 郑燕, 等. 我国8个典型水稻土中产甲烷古菌群落组成的空间分异特征[J]. 微生物学报, 2014, 54(12): 1397-1405. Zu Qianhui, Wang Baozhan, Zheng Yan, et al. Spatial shifts in methanogenic archaeal community composition in eight Chinese paddy soils[J]. Acta Microbiologica Sinica, 2014, 54(12): 1397-1405.
[11] Houghton J E T, Ding Y H, Griggs J, et al. IPCC 2001. Climate Change 2001: the scientific basis[M]. Cambridge: Cambridge University Press, 2001: 227-239.
[12] 赵玉川, 张桂玲, 刘素美. 2009年8月底长江口海水中甲烷的分布与释放通量[J]. 海洋科学, 2011, 35(11): 81-89. Zhao Yuchuan, Zhang Guiling, Liu Sumei. Distribution and fluxes of methane at Changjiang (Yangtze River) Estuary at the end of August 2009[J]. Marine Sciences, 2011, 35(11): 81-89.
[13] Angelis M A, Scranton M L. Fate of methane in the Hudson River and Estuary[J]. Global Biogeochemical Cycles, 1993, 7(3): 509-524.
[14] 王震, 李宜良, 赵鹏. 环渤海地区海洋渔业经济可持续发展对策研究[J]. 中国渔业经济, 2015, 33(1): 38-43. Wang Zhen, Li Yiliang, Zhao Peng. A Study on the Countermeasures of Sustainable Development of Bohai Marine Fishery Economy[J]. Chinese Fisheries Economics, 2015, 33(1): 38-43.
[15] 吴莉, 侯西勇. 2000~2010年环渤海省市海岸带土地利用变化分析[J]. 海洋科学, 2015, 39(9): 101-110. Wu Li, Hou Xiyong. Analysis of land use change in the coastal zone of Circum the Bohai Sea Region during 2000 to 2010[J]. Marine Sciences, 2015, 39(9): 101-110.
[16] 宋文博, 孔俊莉, 王国向. 对渤海渔业资源衰减的思考与建议[J]. 齐鲁渔业, 2015, 5: 47-48. Song Wenbo, Kong Junli, Wang Guoxiang. Thoughts and Suggestions on the Attenuation of Fishery Resources in Bohai Sea[J]. Shandong Fisheries, 2015(5): 47-48.
[17] 王钢, 乔延龙. 渤海湾渔业资源面临的问题及其养护工作的建议[J]. 港口经济, 2012, (9): 52-53. Wang Gang, Qiao Yanlong. The Suggestions about the Problems in Fishery Resources and Maintenance Work in Bohai Bay[J]. Port Economy, 2012(9): 52-53.
[18] 徐海龙, 谷德贤, 乔秀亭, 等. 渤海湾主要渔业资源长度与体质量关系分析[J]. 南方水产科学, 2014, 10(1): 57-63. Xu Hailong, Gu Dexian, Qiao Xiuting, et al. Analysis of length-weight relationship for major fishing species from Bohai Bay[J]. South China Fisheries Science, 2014, 10(1): 57-63.
[19] 王晓磊, 冯秀丽, 刘潇, 等. 冬、夏季渤黄海表层沉积物粒度特征差异及其成因分析[J]. 海洋科学, 2015, 39(8): 63-69. Wang Xiaolei, Feng Xiuli, Liu Xiao, et al. Particle size differences of surface sediments in the Bohai Sea and the Yellow Sea between winter and summer and the genetic analysis[J]. Marine Sciences, 2015, 39(8): 63-69.
[20] 王文兴, 孙修勤, 牟敦彩, 等.渤海石油降解微生物某些生态学特征的调查研究[J]. 海洋环境科学, 1983, (4): 11-24. Wang Wenxing, Sun Xiuqin, Mu Duncai, et al. Investigation of some Ecological Characteristics of Oil Degrading Microorganisms in Bohai Sea[J]. Marine Environmental Science, 1983(4): 11-24.
[21] 高小玉, 樊景凤, 陈佳莹, 等. 大连“7.16”溢油事故对海洋石油烃降解菌和异养细菌丰度的影响[J]. 海洋环境科学, 2013, (5): 688-692. Gao Xiaoyu, Fan Jingfeng, Chen Jiaying, et al. Influence on marine hydrocarbon-degradating bacteria and heterotrophic bacteria abundance by Dalian “7.16” oil spill accident[J]. Marine Environmental Science, 2013, (5): 688-692.
[22] 孙修勤, 张进兴, 卢颖. 渤海单菌株石油微生物降解芳烃的实验室研究[J]. 海洋科学进展, 1987, (1): 37-47. Sun Xiuqin, Zhang Jinxing, Lu Ying, Experiment on Degradation of Aromatic Hydrocarbons by Microorganisms from the Bohai Sea[J]. Advances in Marine Science, 1987, (1): 37-47.
[23] 苏园园, 丘仲锋, 张艳萍. 辽东湾水体吸收系数区域性半分析反演算法[J]. 海洋科学, 2015, 39(4): 73-82. Su Yuanyuan, Qiu Zhongfeng, Zhang Yanping. A regional semi-analytical algorithm to retrieve absorption coefficients in the Liaodong Bay[J]. Marine Sciences, 2015, 39(4): 73-82.
[24] 李佩佩. 黄河口及黄、渤海溶存甲烷和氧化亚氮的分布与释放通量[D].青岛: 中国海洋大学, 2010. Li Peipei. Methane and Nitrous oxide in the Yellow River Estuary, The Yellow Sea and the Bohai Sea[D]. Qingdao: Ocean University of China, 2010.
[25] Jaisi D P, Dong H, Kim J, et al. Nontronite particle aggregation induced by microbial Fe(III) reduction and exopolysaccharide production[J]. Clays & Clay Minerals, 2007, 55(55): 96-107.
[26] Zheng S, Zhang H, Li Y, et al. Co-occurrence of Methanosarcina mazei and Geobacteraceae in an iron (III)-reducing enrichment culture[J]. Frontiers in microbiology, 2015, 6: 941.
[27] Lovley D R, Phillips E J P. Organic Matter Mineralization withReduction of Ferric Ironin[J]. Appl Environ Microbiol, 1986, 51(4): 683-689.
[28] 李莹, 郑世玲, 张洪霞, 等. 产甲烷分离物中Clostridium spp.与Methanosarcina barkeri潜在的种间直接电子传递[J]. 微生物学通报, 2017, 44(3): 591-600. Li Ying, Zheng Shiling, Zhang Hongxia, et al. Potential direct interspecies electron transfer (DIET) from Clostridium spp. to Methanosarcina barkeri in a methanogenic isolation [J]. Microbiology China, 2017, 44(3): 591-600.
[29] 王洁, 袁俊吉, 刘德燕, 等. 滨海湿地甲烷产生途径和产甲烷菌研究进展[J]. 应用生态学报, 2016, 27(3): 993-1001. Wang Jie, Yuan Junji, Liu Deyan, et al. Research progresses on methanogenesis pathway and methanogens in coastal wetlands [J]. Chinese Journal of Applied Ecology, 2016, 27(3): 993-1001.
[30] Liu F H, Lin G H, Gao G, et al. Bacterial and archaeal assemblages in sediments of a large shallow freshwater lake, Lake Taihu, as revealed by denaturing gradient gel electrophoresis[J]. Journal of Applied Microbiology, 2009, 106(3): 1022-1032.
[31] 田琪, 王佳, 范晓蕾, 等. 海洋油气田沉积物产甲烷活性及微生物生态[J]. 环境科学, 2014, 35(6): 2322- 2327. Tian Qi, Wang Jia, Fan Xiaolei, et al. Methanogenic Activity and Methanogen Diversity in Marine Gas Field Sediments[J]. Environmental Science, 2014, 35(6): 2322-2327.
[32] Narrowe A B, Angle J C, Daly R A, et al. High-resolution sequencing reveals unexplored archaeal diversity in freshwater wetland soils.[J]. Environmental Microbiology, 2017.
[33] Baldwin D S, Rees G N, Mitchell A M, et al. The short-term effects of salinization on anaerobic nutrient cycling and microbial community structure in sediment from a freshwater wetland[J]. Wetlands the Journal of the Society of the Wetland Scientists, 2006, 26(2): 455- 464.
[34] Edmonds J W, Weston N B, Joye S B, et al. Microbial Community Response to Seawater Amendment in Low-Salinity Tidal Sediments[J]. Microbial Ecology, 2009, 58(3): 558-568.
[35] Cynar F J, Yayanos A A. Enrichment and characterization of a methanogenic bacterium from the oxic upper layer of the ocean[J]. Current Microbiology, 1991, 23(2): 89-96.
[36] 李德生. 渤海湾及沿岸盆地的构造格局[J]. 海洋学报, 1980, (4): 93-101. Li Desheng. The Tectonic Frameworkers of Bohai Gulf and Coastal Basins[J]. China. Acta Oceanologica Sinica, 1980, (4): 93-101.
[37] 宋以柱. 中国黄海、渤海DMS和DMSP的浓度分布及影响因素研究[D].青岛: 中国海洋大学, 2014. Song Yizhu. Studies on the Distribution of DMS and DMSP and Influencing Factors in the Yellow Sea and Bohai Sea[D]. qingdao: Ocean University of China, 2014.
[38] Keppler F, Hamilton JTG, Brass M, et al. Methane emissions from terrestrial plants under aerobic conditions. Nature, 2006, 439(7073): 187-191.
[39] 郝庆菊, 王跃思, 江长胜, 等. 湿地甲烷排放研究若干问题的探讨[J]. 生态学杂志, 2005, 24(2): 170-175. Hao Qingju, Wang Yuesi, Jiang Changsheng, et al. A review on methane emission from wetlands[J]. Chinese Journal of Ecology, 2005, 24(2): 170-175.
[40] Munger J W. Atmospheric Methane Its Role in the Global Environment: Khalil M A K (Ed.), Springer- Verlag, Berlin, ISBN 3-540-65099-7[J]. Agricultural & Forest Meteorology, 2004, 122 (1-2): 125-126.
[41] 古丽. 渤、黄、东海沉积物中硫化物的研究[D]. 中国海洋大学, 2011. Gu Li. The study of Sulfide in the Sediment of the Bohai, Yellow and East China Seas[D]. Qingdao: Ocean University of China, 2011.
[42] 张经, 刘敏光, 陈长景, 等. 渤海湾沉积物中若干重金属的存在形式[J]. 海洋学报, 1987, 9(4): 520-524. Zhang Jing, Liu Minguang, Chen Changjing, et al. Forms of several heavy metals in sediments of Bohai Bay[J]. Acta Oceanologica Sinica, 1987, 09(4): 520-524.
[43] 石强, 陈江麟, 李崇德. 渤海硝酸盐氮和亚硝酸盐氮季节循环分析[J]. 海洋通报, 2001, 20(6): 32-39. Shi Qiang, Chen Jianglin, Li Chongde. Seasonal Cycle Analysis of the Nitrate Nitrogen and Nitrite Nitrogen in the Bohai Sea[J]. Marine Science Bulletin, 2001, 20(6): 32-39.
[44] 王金良, 李慧凤. 波浪以增大交换面积的方式影响海-气通量[J]. 海洋科学, 2015, 39(1): 79-83. Wang Jinliang, Li Huifeng. Effect of wave on air-sea flux via magnifying the exchange area [J]. Marine Sciences, 2015, 39(1): 79-83.
Diversity of archaea in the sediments from different areas of the Bohai Sea
WANG Bing-chen1, 2, ZHENG Shi-ling1, ZHANG Hong-xia1, 2, WEI Wen-chao1, 2, WANG Ou-mei3, LIU Fang-hua1
(1. Key Laboratory of Coastal Biology and Biological Resources Utilization, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Binzhou Medical University, Yantai 264003, China)
Methanogens play an important role in the carbon cycle of coastal sediments. In this study, sea water enrichment cultures with acetate as the substrate were employed to enrich methanogens using sediments of the Bohai Sea. The methane production was used to estimate potential methane productivity and terminal restriction fragment length polymorphism analysis was used to analyze the diversity of microbial communities simultaneously. Our results revealed that changes in the bacterial and the methanogens community structures in sediments from different areas of the Bohai Sea were found. The dominant methanogens wereandin sediments of the Bohai Sea, andandwere the dominant bacteria. Different areas of the Bohai Sea obviously varied on methane production, which shows that the methane emission is higher in the coastal area. Bohai Sea has great potential for methane productivity and acetic acid conversion rate (46.46%), and the estimation of potential methane production is 1.74 Gt per year.
methane; Bohai Sea; methanogens; diversity; potential methane productivity
(本文编辑: 梁德海)
[National Natural Science Foundation of China, No. 41371257, No.41573071, No.41401285, No.31600370; The Key Program, No. KZZD- EW-14; Hundred Talents Program (A) of the Chinese Academy of Sciences]
Dec. 12, 2016
Q936
A
1000-3096(2017)05-0008-09
10.11759/hykx20161024002
2016-12-12;
2017-02-07
国家自然科学基金面上项目(41371257、41573071)、国家自然科学基金青年项目(41401285、31600370), 中国科学院重点部署项目(KZZD-EW-14); 中国科学院百人计划经费资助项目(A类)
王炳臣(1989-), 男, 河北景县人, 博士研究生, 主要从事渤海沉积物微生物生态研究, 电话: 0535-2109269, E-mail: bcwang@yic.ac.cn;刘芳华, 通信作者, 研究员, 电话: 0535-2109268, E-mail: fhliu@yic.ac.cn; 王欧美, 通信作者, 副教授, 电话: 0535-6913374, E-mail: ziou79@ hotmail.com

