海洋低温淀粉酶菌株的筛选、鉴定及酶学性质研究
周新尚,逄飞,窦少华,3*,乔慧,迟乃玉
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物生物工程技术研究中心,辽宁大连116622;3.大连理工大学生命科学与技术学院辽宁大连116024)
海洋低温淀粉酶菌株的筛选、鉴定及酶学性质研究
周新尚1,2,逄飞1,2,窦少华1,2,3*,乔慧1,2,迟乃玉1,2
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物生物工程技术研究中心,辽宁大连116622;3.大连理工大学生命科学与技术学院辽宁大连116024)
以大连黄海海泥和海水为样品,采用稀释涂布平板透明圈法初筛、摇瓶发酵复筛,得到一株淀粉酶高产菌ZXS-5,测得酶活为6.25U/m L。通过形态学、生理生化及16S rDNA序列鉴定,菌株ZXS-5为荧光假单胞菌(Pseudomonasfluorescens)。该酶的最适作用温度为25℃,酶的热稳定性相对较差;最适作用pH值为8.0,属于碱性酶,该酶在酸性条件下稳定性较差;Ba2+、Cu2+、乙二胺四乙酸(EDTA)对该酶抑制性较强,Fe2+、Zn2+、Mn2+对该酶的活性影响不明显,Mg2+、Na+对该酶激活作用较弱,Ca2+对该酶激活作用较强。
低温淀粉酶;鉴定;荧光假单胞菌;酶学性质
淀粉酶是能催化淀粉水解转化成葡萄糖、麦芽糖等一系列低聚糖酶类的总称[1]。淀粉酶可从淀粉分子内部催化α-1,4糖苷键及α-1,6糖苷键水解。根据作用方式不同归类为α-淀粉酶和β-淀粉酶,水解产物为小分子单糖和高分子极限糊精等[2-4]。
淀粉酶是目前研究最多,应用范围最广的工业酶制剂之一,尤其在淀粉深加工、食品、燃料酒精、纺织品脱胶等行业起着要重要作用[4]。但目前市场所用淀粉酶多为中温酶或高温酶,在低温环境(0~20℃)下酶活性较差,限制了其在洗涤、食品等对低温要求苛刻行业上的进一步应用。而低温淀粉酶的最适反应温度≤40℃且对热敏感,相比中温或高温酶潜在的应用价值更高,因此,自20世纪70年代以来,对低温淀粉酶资源的开发成为功能酶研究的新热点[5-7]。
本研究以于大连黄海的海水和海泥为样品,初筛得到10株低温淀粉酶产生菌,复筛过程中菌株ZXS-5的酶活最高,进而对菌株ZXS-5进行形态学、生理生化和分子生物学鉴定,并对菌株ZXS-5所产低温淀粉酶酶学性质进行初步研究。以期为海洋低温淀粉酶资源的开发利用提供一定的工作基础。
1 材料与方法
1.1 材料与试剂
样品:大连黄海海水和海泥;蛋白胨、葡萄糖、磷酸氢二钾、可溶性淀粉、牛肉膏、葡萄糖、氯化钠、硫酸亚铁、硫酸镁、琼脂粉:生物工程(上海)股份有限公司;核酸Marker:大连宝生物有限公司。所用试剂均为分析纯或生化试剂。
富集培养基:可溶性淀粉30 g/L,牛肉膏3 g/L,NaCl 5 g/L,琼脂16 g/L,pH 7.0。0.1MPa灭菌30m in。
初筛培养基:可溶性淀粉30 g/L,牛肉膏3 g/L,NaCl 5 g/L,琼脂16 g/L,pH 7.0。0.1MPa灭菌30m in。
复筛培养基:可溶性淀粉10 g/L,蛋白胨6 g/L,牛肉膏5 g/L,NaCl1 g/L,MgSO4·7H2O 0.1 g/L,pH 7.0,0.1MPa灭菌30min。
种子培养基:蛋白胨10 g/L,牛肉膏3 g/L,NaCl5 g/L,pH 7.4。0.1MPa灭菌30min。
斜面保藏培养基:蛋白胨10 g/L,牛肉膏3 g/L,NaCl 5 g/L,琼脂16 g/L,pH 7.4,0.1MPa灭菌30m in。
发酵培养基:同复筛培养基。
1.2 仪器与设备
SPX-250全温振荡培养箱:常州万科仪器科技有限公司;M IR-254低温恒温培养箱:上海创奕科教设备有限公司;HH-6数显控恒温水浴锅:深圳市鼎鑫宜实验设备有限公司;DHG-914A电热恒温鼓风干燥箱:上海和呈仪器制造有限公司;UV-5100B紫外可见分光光度计:上海重逢科学仪器有限公司;LDZX-50FBS立式压力蒸汽灭菌器:上海博讯医疗器械厂;GRX-02A干热灭菌箱:上海森信实验仪器有限公司;API-9700型基因扩增仪:美国ABI有限公司;DYCP-32B型核酸电泳仪:北京六一生物科技有限公司。
1.3 方法
1.3.1 粗酶液制备方法
复筛得到的菌株接种于装液量为200m L/500m L发酵培养基中,接种量4%,20℃、150 r/m in培养36 h。发酵液于4℃、8 000 r/m in离心15min,上清液即为粗酶液。
1.3.2 淀粉酶酶活测定方法
淀粉酶酶活测定参照OKOLO BN等[8]方法。反应体系如下:25m L具塞比色管中加入2.0m L 2%的可溶性淀粉糊化液、2m L醋酸-醋酸钠缓冲液(pH 6.4),25℃预热5min,加入1.0m L粗酶液,25℃、160 r/m in振荡反应5m in,加入终止反应试剂3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)2m L,移液抢吹打混匀,煮沸5m in。取出后流水冷却,加去离子水定容至20m L。空白对照:将1.0m L酶液替换为1.0m L醋酸-醋酸钠缓冲液(其余条件同上),在波长525 nm条件下比色测定吸光度值[9]。淀粉酶酶活单位定义:在分析条件下,1m in释放1μmol的还原糖所需的酶量定义为1个酶活力单位,酶活力单位为U/m L。还原糖以葡萄糖为标准品,采用二硝基水杨酸(DNS)法进行测定[10]。
1.3.3 菌株筛选
(1)菌种初筛:大连黄海海水和海泥各15份,海泥取2.0 g,海水10m L加入装有50m L无菌生理盐水的三角瓶中,剧烈振荡5min,静置30min取上清液2m L接种于富集培养基中,在20℃、150 r/min振荡培养3 d,取2m L菌液接种于相同的富集培养基中再次定向富集3 d。采用平板划线法,将富集培养后的菌液梯度稀释,涂布在平板筛选培养基上。20℃培养2~5d,以菌落周围是否出现透明圈(卢戈氏碘液染色法)为初筛标准,挑取带有透明圈的单菌落进一步平板划线纯化,保藏初筛菌株,进行后续实验[11]。
(2)菌种复筛:将初筛菌株接种于100m L/250m L发酵培养基中,20℃、150 r/min培养36h,以发酵液中低温淀粉酶的酶活作为复筛标准,复筛得到产低温淀粉酶酶活最高的菌株[12]。
1.3.4 菌落形态特征
在初筛培养基上观察菌落的形状、大小、颜色等形态学特征,通过革兰氏染色在光学显微镜(10×100)下观察菌体形态。
1.3.5 鉴定菌株生理生化特征
根据《常见细菌系统鉴定手册》(第8版)[13]细菌鉴定相关标准设计实验,主要包括葡萄糖氧化发酵测定、氧化酶反应、接触酶反应、硝酸盐还原试验、产生吲哚试验、淀粉水解试验、糖、醇类发酵试验、脲酶试验、硫化氢产生、含碳化合物的利用、柠檬酸盐的利用等。
1.3.6 菌株分子生物学鉴定
采用TIANGEN柱式细菌基因组DNA抽提试剂盒提取菌株DNA。以提取到的ZXS-5菌株DNA为模板,16S rDNA扩增引物采用细菌通用引物进行聚合酶链反应(polymerase chain reaction,PCR)。其引物如下:正向引物P1(5'-AGAGTTTGATCCTGGCTCAG-3')和反向引物P2(5'-AA GTCGTAACAAGGTAACC-3')进行PCR扩增。将PCR扩增产物进行核酸电泳,同时将PCR扩增产物送交上海生工生物有限公司测序,将测序结果提交到GenBank数据库中,经基本局部比对搜索工具(basic localalignmentsearch tool,BLAST)序列比对,利用MEGA5软件构建系统发育树[14]。
1.3.7 酶学性质研究
(1)酶的最适作用温度:将粗酶液分别置于10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃和60℃条件下,按照低温淀粉酶的酶活力测定方法测定酶活,以同组最高酶活为100%计算相对酶活,进行3组平行实验。
(2)酶的热稳定性:将粗酶液分别置于30℃、40℃、50℃、60℃、70℃水浴中持续保温60min,并分别在10m in、20min、30m in、40min、50min和60m in测定低温淀粉酶剩余酶活力,以同组最高酶活为100%计算相对酶活,每次进行3组平行试验。
(3)酶的最适作用pH:在酶最适作用温度条件下,酶活测定体系中把醋酸-醋酸钠缓冲液换为pH 4.0、5.0、6.0、7.0、8.0、9.0和10.0的磷酸盐缓冲液测定低温淀粉酶酶活,以同组最高酶活为100%计算相对酶活,每次进行3组平行试验。
(4)酶的pH稳定性:分别将低温淀粉酶粗酶液至于pH 5.0、6.0、7.0、8.0、9.0、10.0磷酸盐缓冲液中,25℃保育60m in,测定低温淀粉酶酶活,以同组最高酶活为100%计算相对酶活,每次进行3组平行试验。
(5)化学试剂对酶活影响:在酶最适作用条件下,酶液中分别加入去离子水、CaCl2、NaCl、MgSO4、FeCl、CuSO4、ZnSO4、MnCl2、及乙二胺四乙酸(ethylenediam ine tetraacetic acid,EDTA)等化学试剂,各反应体系中金属离子的终浓度为10mmol/L,测定低温淀粉酶酶活,以添加去离子水为对照组计算相对酶活,每次进行3组平行试验。
2 结果与分析
2.1 菌株的筛选
实验样品经过初筛,得到10株(菌株ZXS-1~ZXS-10)能够产生透明圈的菌株,经摇瓶发酵复筛测定其低温淀粉酶淀粉酶活力,结果如表1所示,菌株ZXS-5的低温淀粉酶活力最高,其最高酶活为6.25U/m L。与国内一些研究报道相比,菌株ZXS-5所产低温淀粉酶酶活较高,可用于工业生产。

表1 菌株产低温淀粉酶酶活比较Tab le 1 Com parison of low-tem perature am ylase activity produced by strains
2.2 菌株ZXS-5的菌落及形态特征
菌株ZXS-5的菌落及细胞形态特征见图1。由图1A可知,菌株ZXS-5的菌落呈黄色、圆形、不生孢、不透明、边缘整齐,表面光滑湿润。由图1B可知,菌株ZXS-5的显微形态呈杆状,为革兰氏阴性菌。

图1 菌株ZXS-5菌落形态(A)及显微形态(B)Fig.1 Co lonialm orphology(A)and m icroscopic m orphology(B)of strain ZXS-5
2.3菌株生理生化特性

表2 菌株ZXS-5生理生化特征Tab le 2 Physiologicaland biochem ica lcharacteristics of strain ZXS-5
由表2可知,菌株ZXS-5生理生化特征为:淀粉水解试验、明胶液化试验、尿素水解试验、精氨酸双水解、过氧化氢酶试验、反硝化试验、果聚糖形成试验结果均为阳性,油脂水解试验、氧化酶试验、从甘油产生二羟基丙酮试验、氨基酸脱羧酶反应试验结果均为阴性。由生理生化试验结果可初步鉴定其为假单胞杆菌属(Pseudomonas sp.)。
2.4 16S rDNA序列分析与系统发育树的构建
菌株ZXS-5的16SrDNA扩增产物经过琼脂糖凝胶电泳分析,结果见图2。由图2可知,获得一条清晰的条带,根据Maker定量分析菌株ZXS-5的16SrDNA序列大小为1498bp。

图2 菌株ZXS-5 16S rDNA PCR扩增电泳图Fig.2 PCR am plification electrophoretogram of 16S rDNA of strain ZXS-5
将菌株ZXS-5的16S rDNA序列输入美国国家生物技术信息中心(national center of biotechnology information,NCBI)数据库中Nucleotide BLAST与GenBank数据库中同源性最高的己知分类菌株序列进行比较,用软件MEGA5以邻接(neighbor-joining,NJ)法进行系统发育树构建如图3所示。由图3可知,菌株ZXS-5与荧光假单胞菌Pseudomonas fluorescensstrain(NR 114476.1)同源性最高为99%,因此可以鉴定菌株ZXS-5为荧光假单胞菌(Pseudomonasfluorescens)。
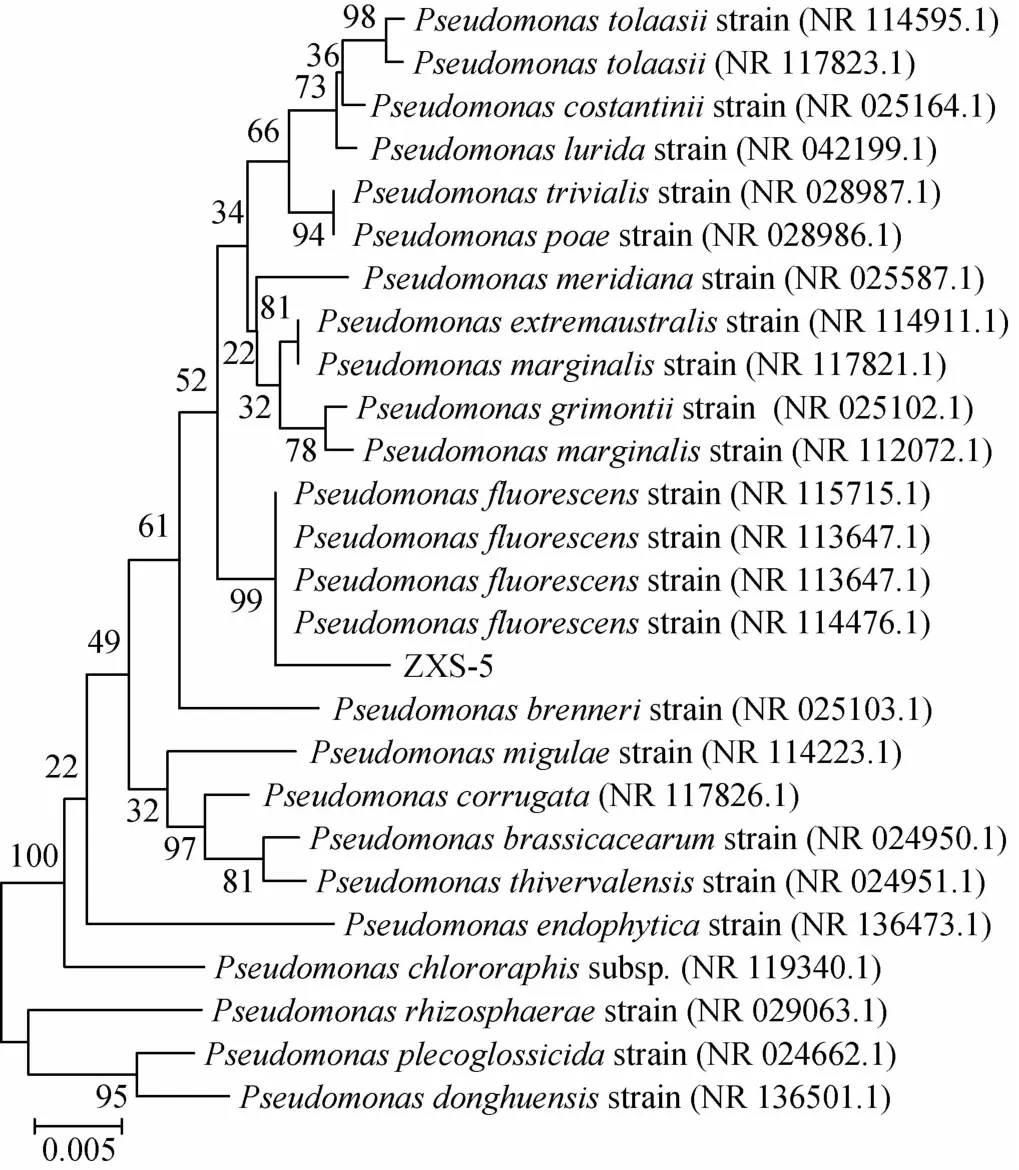
图3 菌株ZXS-5 16S rDNA序列系统发育树Fig.3 Phylogenetic tree of strain ZXS-5 based on 16S rDNA sequence
2.5 酶学性质研究
2.5.1 低温淀粉酶的最适反应温度
由图4可知,低温淀粉酶的最适酶促反应温度为25℃,而酶在40℃以后活力迅速下降,但是低温淀粉酶在10℃仍有一定的酶活力,低温淀粉酶的这种特性符合低温酶的标准[15]。这对于需要加热的淀粉工业来说,低温酶减少了能量消耗、降低了生产成本具有重大的现实意义。
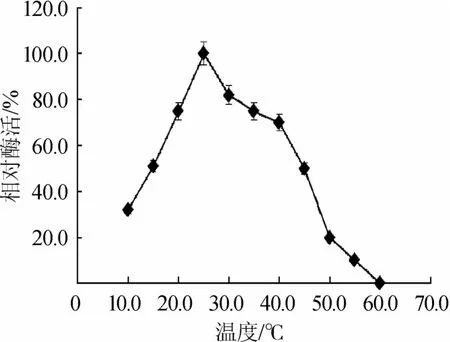
图4 低温淀粉酶的最适作用温度曲线Fig.4 The optimum tem perature curve o f low-temperature amylase
2.5.2 低温淀粉酶的热稳定性
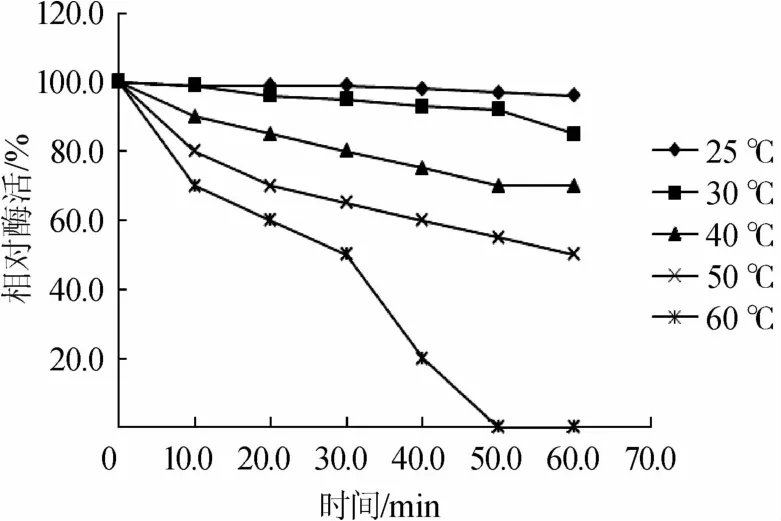
图5 低温淀粉酶的热稳定性Fig.5 Therm alstability of low-temperature am ylase
由图5可知,低温淀粉酶在20~40℃之间酶活保持较高,酶的活性相对稳定热;从50℃开始,酶活急剧下降;60℃处理1 h,酶活基本为0。所以低温淀粉酶在相对宽泛的温度环境下,热稳定性较差,这也表明低温淀粉酶在某些特殊生产工艺中有重要的应用价值[16]。
2.5.3 低温淀粉酶的最适作用pH
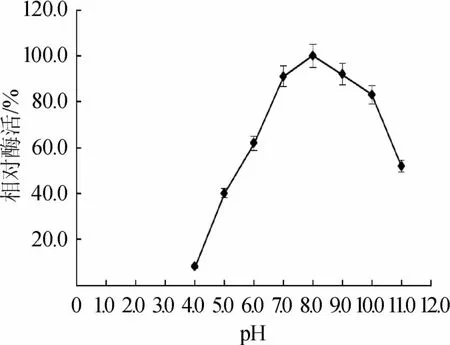
图6 pH对低温淀粉酶酶活的影响Fig.6 Effect of pH on the activity of low-temperature am ylase
由图6可知,该酶在pH4.0~7.0时酶活迅速下降,在pH 8.0时酶活最高,在pH 8.0~10.0时酶活略有下降,说明该低温淀粉酶的最适酶促反应pH值为8.0,该酶属于碱性酶。此外该碱性淀粉酶在洗涤行业中具有广阔的应用前景。2.5.4低温淀粉酶的pH稳定性

图7 低温淀粉酶pH稳定性Fig.7 pH stability of low-tem perature am ylase
由图7可知,该酶经pH 8.0的缓冲液作用60m in,酶活力基本保持不变,所以该酶的最适pH为8.0。当pH>8.0时,该酶酶活力呈下降趋势。该酶在pH8.0~9.0保持80%的相对酶活,在pH 10.0时也保持50%以上的相对酶活。但是在pH 5.0~6.0的缓冲液作用下酶活迅速下降,说明该酶是碱性酶,在酸性条件下酶的稳定性较差,所以应该在碱性条件下利用该酶。
2.5.5 化学试剂对酶活影响
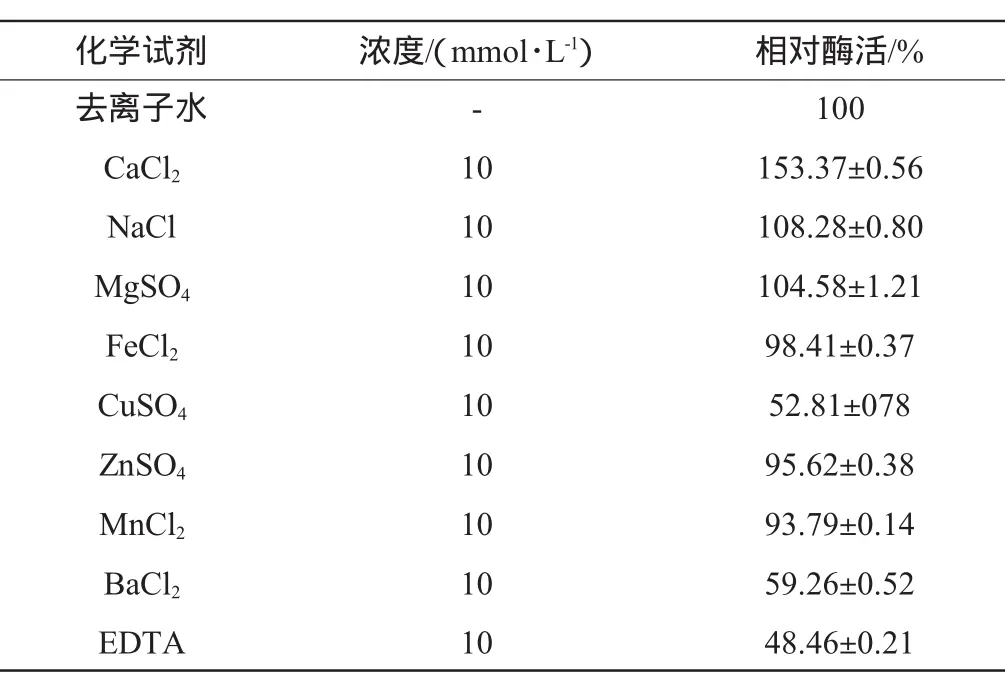
表3 金属离子与EDTA对低温淀粉酶活的影响Table 3 Effects ofm etal ions and EDTA on the activity of low-tem perature am ylase
由表3可知,Ba2+、Cu2+、乙二胺四乙酸(ethylenediam ine tetraacetic acid,EDTA)对该酶抑制性较强,Fe2+、Zn2+、Mn2+对该酶的活性影响不明显,Mg2+、Na+对该酶激活作用较弱,Ca2+对该酶激活作用较强。由此可见该酶属于金属酶类[17]。
3 结论
本实验从大连黄海海泥与海水中共筛选出10株产低温淀粉酶的菌株,其中ZXS-5具有最高的低温淀粉酶活力,为6.25U/m L。菌株ZXS-5所形成的菌落呈黄色、圆形、不生孢、不透明、边缘整齐,表面光滑湿润。经过显微观察该菌株菌体呈杆状,为革兰氏阴性菌。该菌经生理生化、16S rRNA鉴定,结果鉴定菌株ZXS-5为荧光假单胞菌(Pseudomonas fluorescens)。菌株ZXS-5与其他国内外筛选的产淀粉酶的菌株相比[18],具有适应低温环境(20℃),耐盐性极好,耐高压等优良特征。对菌株ZXS-5所产的低温淀粉酶酶学性质初步研究表明,该酶的最适作用温度为25℃,作用温度较低,属于低温酶类,最适作用pH值为8.0,属于碱性淀粉酶;该酶活性对Ca2+的依赖明显,Na+、Mg2+对该酶具有一定的促进作用,Fe2+、Zn2+、Mn2+对该酶的活性影响不明显,而Ba2+、 Cu2+及EDTA较明显的抑制该酶的活性,由此可见该酶属于金属酶类。
本研究筛选和探究了低温微生物和低温酶的一些特性,为低温淀粉酶的开发和利用做了初步的研究,该酶的分离纯化及工业发酵奠定了基础。
[1]余丽,晏爱芬.高黎贡山土壤低温淀粉酶产生菌的筛选[J].湖北农业科学,2013,52(4):784-786.
[2]王继莲,李明源,宋保健,等.产低温淀粉酶菌株的筛选、鉴定及酶学性质初步研究[J].农业生物技术学报,2016,24(3):426-434.
[3]PAQUET V,CROUX C,GOMA G,et al.Purification and characterization of the extracellular alpha-amylase from Clostridium acetobutylicum ATCC 824[J].Appl Environ M icrobiol,1991,57(1):212-218.
[4]李鑫玲,孙晓菲,李欣.α-淀粉酶产生菌的筛选鉴定及其发酵条件的优化[J].食品研究与开发,2016,37(12):163-165.
[5]CESARINIS,BOFILLC,PASTOR F IJ,etal.A thermostable variantof P.aeruginosa cold-adapted LipC obtained by rational design and saturationmutagenesis[J].Process Biochem,2012,47(12):2064-2071.
[6]戴世鲲,郑天凌,王晓颖,等.深海产低温碱性淀粉酶菌Halomonas sp. W 7的筛选及发酵条件研究[J].海洋科学,2007,31(11):27-32.
[7]刘洋,陈爱萍,朱小顺,等.一株蜡状芽孢杆菌α-淀粉酶产生菌株的分离鉴定及酶学性质研究[J].中国酿造,2010,29(8):68-71.
[8]OKOLO B N,EZEOGU L I,MBA CN.Production of raw starch digesting amylaseby Aspergillusniger grown on native starch sources[J].J Sci Food Agric,2006,69(1):109-115.
[9]孙子羽,迟乃玉,王宇,等.低温生淀粉糖化酶菌株RS01分离及其酶学性质[J].微生物学通报,2010,37(6):798-802.
[10]M ILLERG L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-429.
[11]冯旭明,迟乃玉,张庆芳.低温淀粉酶菌株C2的分离鉴定及其产低温淀粉酶的酶学性质[J].微生物学通报,2011,38(12):1762-1767.
[12]王强,李旭,窦少华,等.海洋葡甘聚糖酶菌株的分离鉴定及酶学性质研究[J].中国酿造,2016,35(6):65-69.
[13]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:43-65.
[14]石群,张庆芳,杨丽娜,等.海洋肌酐水解酶菌株的筛选鉴定及其酶学性质研究[J].中国酿造,2017,36(3):19-23.
[15]刘雪珠,杨小盼,王健鑫,等.海洋来源产淀粉酶放线菌的分离鉴定、诱变选育及培养条件优化[J].浙江大学学报:理学版,2010,37(6):680-685.
[16]高菲.浅谈低温微生物及其在环境工程中的应用[J].工程技术:全文版,2016(12):00284-00284.
[17]曾静,郭建军,顾斌涛,等.Ca2+结合位点对极端嗜热α-淀粉酶ApkA高温活性及热稳定性的影响[J].现代食品科技,2016,30(8):90-95.
[18]屈建航,尹伊,焦国宝,等.酸性α-淀粉酶菌株的筛选及其发酵条件研究[J].生物技术通报,2015,31(7):188-192.
Isolation,identification and enzymatic property ofa low-temperatureamylase-producing strain from marine
ZHOU Xinshang1,2,PANG Fei1,2,DOU Shaohua1,2,3*,QIAO Hui1,2,CHINaiyu1,2
(1.SchoolofLife Science and Biotechnology,Dalian University,Dalian 116622,China; 2.Liaoning Technology ofMarine M icrobiological Engineering Research Center,Dalian 116622,China; 3.SchoolofLife Science and Biotechnology,Dalian University ofTechnology,Dalian 116024,China)
Using seamud and seawater from Dalian Yellow Sea as samples,a higher amylase-producing strain ZXS-5 was obtained by spread plate method preliminary screening and shake flask fermentation secondary screening,and the enzyme activity was 6.25 U/m l.Through morphological, physiological and biochemical characteristics and 16S rDNA sequence identification,strain ZXS-5 was identified as Pseudomonas fluorescens.The optimum temperature of theamylasewas25℃and its thermostability was relatively poor.The optimum pH of the amylasewas8.0,and itwasalkaline amylase,and the pH stability wasweak in acidic condition.The amylase activity was strongly inhibited by Ba2+,Cu2+and ethylene diamine tetraacetic acid(EDTA).The effects of Fe2+,Zn2+and Mn2+on the amylase activity were not obvious.The amylase activity was slightly activated by Mg2+and Na+,strongly activated by Ca2+.
low-temperatureamylase;identification;Pseudomonasfluorescens;enzymatic property
Q93-331
0254-5071(2017)08-0057-05
10.11882/j.issn.0254-5071.2017.08.013
2017-05-21
国家高技术研究发展计划“863计划”项目(No.2014AA093512);辽宁省自然科学基金项目(No.2014020134)
周新尚(1990-),男,硕士研究生,研究方向为微生物工程及酶工程。
*通讯作者:窦少华(1979-),男,副教授,博士,研究方向为微生物工程及酶工程。

