复方黑骨藤对佐剂性关节炎大鼠IL- 4、IFN- γ及TGF- β1表达的影响①
冉 然 侯玉婷 黎 霞
(四川师范大学生命科学学院,成都610101)
·中医中药与免疫·
复方黑骨藤对佐剂性关节炎大鼠IL- 4、IFN- γ及TGF- β1表达的影响①
冉 然 侯玉婷 黎 霞
(四川师范大学生命科学学院,成都610101)
目的:研究复方黑骨藤对佐剂性关节炎大鼠模型血清中IL- 4、IFN- γ和TNF- α及关节滑膜组织中TGF- β1的表达水平的影响,以深入探讨复方黑骨藤对类风湿关节炎的治疗作用及其相关机制。方法:构建大鼠弗氏完全佐剂性(AA)关节炎模型,通过ELISA与免疫组化方法分别检测大鼠血液中IL- 4、IFN- γ、TNF- α的含量和大鼠膝关节滑膜组织中TGF- β1的含量。结果:模型组与正常组比较,血清的IFN- γ、TNF- α水平升高,IL- 4和滑膜组织中的TGF- β1水平降低(P<0.01)。复方黑骨藤组与模型组比较血清中IFN- γ、TNF- α水平显著下降,IL- 4、TGF- β1水平上调,与模型组有显著性差异。结论:本实验研究表明复方黑骨藤能显著抑制IFN- γ、TNF- α的表达,增强IL- 4、TGF- β1的表达,调整大鼠Th1/Th2细胞及其细胞因子失衡,从而减轻关节滑膜炎症的持续发展和软骨破坏,对实验性类风湿关节炎的滑膜组织中T细胞增生及浸润具有显著的抑制作用。
复方黑骨藤;类风湿关节炎;Th1/Th2;IL- 4;IFN- γ;TGF- β1
类风湿关节炎(Rheumatoid arthritis,RA)是以关节慢性炎症为主要表现的自身免疫疾病,其病理学改变包括滑膜的慢性炎症、淋巴细胞浸润、血管翳的形成和软骨组织的破坏,最后导致关节强直、畸形、功能丧失。RA的发病机制尚未十分明确,但近年来的研究发现RA是一种由多种细胞因子参与介导的慢性炎症性疾病,参与其致病过程的关键细胞因子有IFN- α、IFN- β 及IL- 6、7、10、12、15、21、23、1、17、18,TGF- β和TNF等[1]。目前,临床上仍缺乏有效治疗RA的药物,且长期使用非甾体抗炎药、糖皮质激素类等药物,会产生较大的毒副作用和不良反应,也不可逆转关节损伤、不能有效控制病情进展和骨破坏。生物制剂则是新型的RA治疗药物,可特异性与相应的靶点结合,起效迅速且作用明显,但是仍有高达30%的患者对其药物反应不足[2]。因此,研究开发具有显著疗效的治疗RA的药物是非常有必要的。黑骨藤Periploca forrestil Schltr.为萝藦科杠柳苷属的植物,性热、味苦,具有热解毒、活血通经及祛风湿等功效[3],药理研究表明它可用于治疗风湿痹痛,提示可能与其对炎性细胞因子的干预有密切的关系[4,5]。复方黑骨藤是以黑骨藤为主药,配以秦艽、元胡两味中药经乙醇超声提取后所得。本实验以佐剂性关节炎(Adjuvant arthritis,AA)大鼠为模型,研究复方黑骨藤对类风湿关节炎大鼠外周血Th1/Th2细胞分泌的细胞因子的变化以及大鼠滑膜组织中的TGF- β1浸润T淋巴细胞的影响,进一步在分子及组织的水平上探讨其治疗RA的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级Wistar大鼠,雄性,体质量(180±10)g,由四川省实验动物专委会养殖提供,动物合格证号为SCXK(川)2013- 24。
1.1.2 药材与药品 黑骨藤药材购买于西昌药材市场,秦艽(Gentiana macrophylla pall,批号:20130526)及元胡(Rhizoma corydalis,批号:20130605)均购买于北京同仁堂股份有限公司,经成都中医药大学张艺教授鉴定。醋酸泼尼松片(批号:H33021207,规格5 mg/片,浙江仙琚制药股份有限公司);雷公藤多苷片(批号:Z31020415,规格10 mg/片,上海复旦复华药业有限公司。);
1.1.3 试剂与仪器 弗氏完全佐剂(Freund′s complete adjuvant,FCA,Sigma公司),IL- 4、IFN- γ定量ELISA试剂盒(上海邦奕公司,批号:DRE20093、DRE20041),TGF- β1一抗(武汉博士德生物有限公司,批号:BA0290),二抗及相应试剂均购于北京中杉生物技术有限公司。酶标仪(成都军能海尔思科技有限公司,Mass),离心机(Anke TGL- 16G,上海安亭科学仪器厂),奥林巴斯BH- 2光学显微镜(日本Olympus),数字摄像仪TK- C1381(日本Vietor),BioMias计算机图像处理分析系统(四川大学图像图形研究所研发)。
1.2 方法
1.2.1 复方黑骨藤制备 复方黑骨藤由秦艽、元胡和黑骨藤药材粗粉按1∶1∶2.5混合后,提取条件:提取温度为60℃,提取时间为30 min,提取次数为2次,用50%乙醇提取,料液比为1∶10,超声波提取机的超声间隙时间5 s/3 s,功率800 W。提取液中检测到总黄酮、总萜、总生物碱、落干酸、6′- O- β- D- 葡萄糖基龙胆苦苷、獐牙菜苦苷、龙胆苦苷、獐牙菜苷、杠柳苷、延胡索乙素、四氢小檗碱和延胡索甲素含量分别为:0.949 5%、1.943 6%、0.089 1%、0.088 0%、0.150 4%、0.043 5%、1.251 8%、0.018 4%、0.115 6%、0.008 4%、0.031 5%、0.003 8%。提取液蒸干溶剂后所得浸膏用蒸馏水配制成给药所需剂量。
1.2.2 动物分组及造模 取Wistar健康大鼠70只,体重(180±10) g,适应性饲养1周后,用动物电子天平称量大鼠体重,将动物随机分为空白组、模型组、阳性对照组(醋酸泼尼松组和雷公藤多苷组)、复方黑骨藤提取物高、中、低剂量组共7组,每组10只。参照文献[5]的佐剂性关节炎造模方法,空白组在右侧后肢足垫皮下注射0.1 ml 0.9%氯化钠溶液。模型组,阳性对照组及复方黑骨藤实验组于实验第1天在每只大鼠右后足趾皮下注射0.1 ml弗氏完全佐剂致炎。
1.2.3 将致炎24 h后实验大鼠分别灌胃相应的药物 空白组、模型组分别灌胃蒸馏水;阳性组分别灌胃醋酸泼尼松5.84 mg、雷公藤多苷7.5 mg;复方黑骨藤提取物高、中、低剂量组分别灌胃剂量67、44、22 mg。每天每只大鼠灌胃1次,连续灌胃21 d。1.2.4 大鼠足肿胀的测定 于致炎前及致炎后18 h 及第2、4、7、11、14、21天分别用PV- 200足肿胀测定仪测量各组大鼠左、右足足跖容积,计算足肿胀度。肿胀度=[(第n天足容积-致炎前足容积)/致炎前足容积]×100%。

1.2.6 血浆中IL- 4、IFN- γ的含量测定 持续给药21 d后将大鼠处死,心脏取血,检测血液中IL- 4、IFN- γ的含量。测定方法为:血液放入离心管中以3 000 r/min离心10 min,取上清液,严格按照ELISA试剂盒说明书的要求:待测样品孔每孔加入40 μl样品稀释液及10 μl待测样品,于37℃孵育30 min,浸泡法洗板,除空白孔每孔加入相对应的50 μl HRP标记酶标试剂,孵育洗板后每孔先加入50 μl显色剂A,再加入50 μl显色剂B,混匀后37℃避光显色15 min,最后每孔加入50 μl终止液终止反应;以空白孔调零,测得OD450值,测定IL- 4、IFN- γ含量。
1.2.7 病理切片及免疫组织化学染色切片制备 于实验第22天治疗后处死大鼠,无菌条件下取每组每只大鼠的右后膝关节,置于10%中性福尔马林固定液中固定,稀硝酸脱钙,常规石蜡包埋,切片;制好的切片脱蜡、脱水,3%H2O2孵育,蒸馏水冲洗后PBS浸泡5 min,再用PBS稀释过的山羊血清密封,室温孵育,倒掉血清后滴加一抗或一抗工作液于PBS下冲洗3次,再滴加1%BAS- PBS稀释的生物素标记二抗,PBS冲洗3次;滴加用PBST稀释的辣根过氧化物酶标记链霉卵白素,孵育后PBS冲洗3次,最后用AEC或DAB显色剂显色,蒸馏水冲洗,复染,中性塑胶固封。
1.2.8 观察免疫组化切片指标方法 免疫组化检测TGF- β1在光镜下对每只大鼠组织切片进行观察,选取阳性表达较为显著的5个视野(×200),经计算机摄像系统采样后,采用Biomias计算机图像处理分析软件对信号强度进行分析,得出定量的各个指标阳性染色面积和积分光密度值;取每只动物的5张切片得出数据的平均值代表该样本的阳性结果。1.2.9 观察HE切片的方法 光学显微镜下观察AA大鼠膝关节的损伤情况,从滑膜组织细胞增生、炎性细胞浸润、纤维组织增生、巨噬细胞增生等方面,依病理损伤程度共分4级,正常1级(0分),轻度损害2级(1分),中度损害3级(2分),重度损害4级(3分)。

2 结果
2.1 药物对AA大鼠足肿胀度的影响 如表1所示,注射弗氏完全佐剂后,模型组从致炎第1天起持续肿胀至炎后第4天,而后开始逐渐消退,于致炎后第14天开始再次持续肿胀,第21天肿胀达到最大值,与空白组对照有极显著统计学差异(P<0.01)。高、中、低剂量复方黑骨藤组与模型组比较差异具有显著统计学意义(P<0.01),说明高、中、低剂量复方黑骨藤组均能明显减轻AA大鼠膝关节炎症,使肿胀度明显下降(P<0.01);复方黑骨藤与雷公藤多苷、醋酸泼尼松在降低大鼠肿胀度水平上无显著性差异。
2.2 药物对AA大鼠免疫器官的影响 注射弗氏完全佐剂后,模型组大鼠的胸腺出现了异常肿大以及脾脏出现了萎缩,与空白组比较差异具有显著统计学意义(P<0.05或P<0.01),说明佐剂性关节炎的发病与免疫器官失衡有关。经药物治疗后,复方黑骨藤组及雷公藤多苷组的胸腺和脾脏指数与模型组比较差异具有显著统计学意义(P<0.05或P<0.01),与空白组比较无显著差异,说明复方黑骨藤能降低胸腺指数及升高脾脏指数且与雷公藤多苷无差异但效果不及醋酸泼尼松。醋酸泼尼松组与雷公藤多苷组与空白组及模型组均有极显著差异(P<0.01),说明醋酸泼尼松对大鼠免疫器官具有极强抑制作用。
2.3 药物对AA大鼠血浆中TNF- α、IL- 4、IFN- γ含量的影响 如表2所示,模型组大鼠血浆中TNF- α为167.703±14.888,明显高于正常组74.275±13.799(P<0.01),模型组IFN- γ为1 166.123±96.74,明显高于正常组363.098±57.488(P<0.01),模型组IL- 4为65.488±10.374,明显低于正常组(P<0.01),模型组中IFN- γ/IL- 4比值为16.379±5.865,明显高于正常组3.366±0.574(P<0.01),药物醋酸泼尼松治疗后,TNF- α为142.434±29.870较模型组低(P<0.05),IFN- γ为843.748±159.88较模型组低(P<0.01)。IL- 4为92.685±10.858高于模型组(P<0.01)。IFN- γ/IL- 4比值为10.329±3.933较模型组低(P<0.01)。IFN- γ为698.315±144.346明显低于模型组(P<0.01)。药物雷公藤多苷治疗后,TNF- α为125.047±12.69较模型组低 (P<0.05)。 IFN- γ 为 698.315±144.346较模型组低 (P<0.01)。IL- 4为81.190±5.784高于模型组(P<0.05)。IFN- γ/IL- 4的比值为8.644±2.052低于模型组(P<0.01)。复方黑骨藤高、中、低剂量治疗后,TNF- α分别为138.879±33.66、104.651±36.23、89.423±29.239,中、低剂量组明显低于模型组(P<0.01)。IFN- γ分别为709.309±120.678、517.621±168.069、455.825±124.230明显低于模型组(P<0.01)。IL- 4分别为75.659±10.319、75.891±9.725、88.579±23.367,中、高剂量组高于模型组(P<0.05),低剂量组明显高于模型组(P<0.01)。IFN- γ/IL- 4比值分别为9.662±2.083、7.458±1.924、5.383±2.035,低于模型组(P<0.01)。



GroupsDosages(mg)SwellingdimensionofjointsInducedinflammatory18h2d4d11d14d21dBlank-0.058±0.0580.010±0.0480.052±0.0350.092±0.0450.134±0.0320.176±0.0380.206±0.045Model-0.946±0.0602)0.949±0.1012)0.938±0.0912)0.921±0.1462)0.988±0.0871)1.093±0.2512)1.106±0.1392)Prednisoneacetate5.840.962±0.1170.779±0.0591)0.696±0.0451)0.672±0.0671)0.619±0.0741)0.559±0.0871)0.559±0.0491)TWHF7.500.926±0.0610.806±0.0691)0.773±0.0611)0.720±0.0811)0.762±0.1331)0.778±0.1901)0.672±0.1271)Low-dose25.200.925±0.0430.814±0.0401)0.758±0.0541)0.725±0.0941)0.738±0.1761)0.764±0.1121)0.726±0.0511)Middle-dose50.400.931±0.0750.803±0.0471)0.736±0.0731)0.713±0.0631)0.662±0.1621)0.668±0.1301)0.662±0.0811)High-dose75.600.932±0.0590.794±0.0511)0.726±0.0581)0.678±0.0651)0.649±0.1431)0.628±0.0991)0.661±0.0891)
Note:Vs model group,1)P<0.01;vs blank group,2)P<0.01.
以上实验数据可看出,模型组大鼠血浆中TNF- α、IFN- γ的含量均升高,而IL- 4的含量降低,与空白组比较差异显著(P<0.01)。复方黑骨藤治疗后,大鼠血浆中的细胞因子TNF- α、IFN- γ明显降低,IL- 4水平升高(P<0.05或P<0.01),表明复方黑骨藤能显著降低大鼠血浆中TNF- α、IFN- γ的含量水平,升高血浆中IL- 4的含量水平,使IFN- γ/IL- 4比值趋向正常;复方黑骨藤组的AA大鼠的IFN- γ/IL- 4比值与模型组比较差异具有显著统计学意义(P<0.05或P<0.01)。复方黑骨藤、雷公藤多苷及醋酸泼尼松均能不同程度地降低血浆中TNF- α、IFN- γ的含量水平及IFN- γ/IL- 4比值,升高IL- 4,且与空白组无显著性差异。
2.4 药物对AA大鼠滑膜组织中TGF- β1含量的影响 光镜下观察(×200),各组AA大鼠切片可见TGF- β1阳性染色细胞,呈黄棕色或黄色颗粒状,分散存在于滑膜组织中。与空白组比较,模型组TGF- β1积分光密度总和值和面积总和值明显下降,平均光密度升高,差异具有极显著统计学意义(P<0.01);与模型组比较,复方黑骨藤组TGF- β1积分光密度总和值和面积总和值明显升高,平均光密度下降,差异具有显著统计学意义(P<0.01或P<0.05)。复方黑骨藤组与醋酸泼尼松组、雷公藤多苷组在升高TGF- β1表达水平上比较无显著性差异。结果可见表3及图1。
2.5 各组AA大鼠HE染色结果的比较 空白组大鼠滑膜组织表面光滑透明,滑膜细胞呈单层,排列整齐,无血管增生,无纤维化,未见T淋巴细胞浸润,软骨表面光滑平整,软骨未见破坏。模型组滑膜表面明显肿胀,充血肥厚,滑膜组织呈灶性增生, 具有多层滑膜细胞,排列不整齐,呈指状或绒毛状。滑膜组织中毛细管增多充血,有大量的T淋巴细胞浸润。与模型组比较,复方黑骨藤组的炎性细胞浸润、滑膜细胞增生均得到改善,滑膜肿胀、充血、血管增生下降,差异具有极显著统计学意义(P<0.01),且复方黑骨藤与雷公藤多苷组、醋酸泼尼松组比较无显著性差异。结果可见图2及表4。


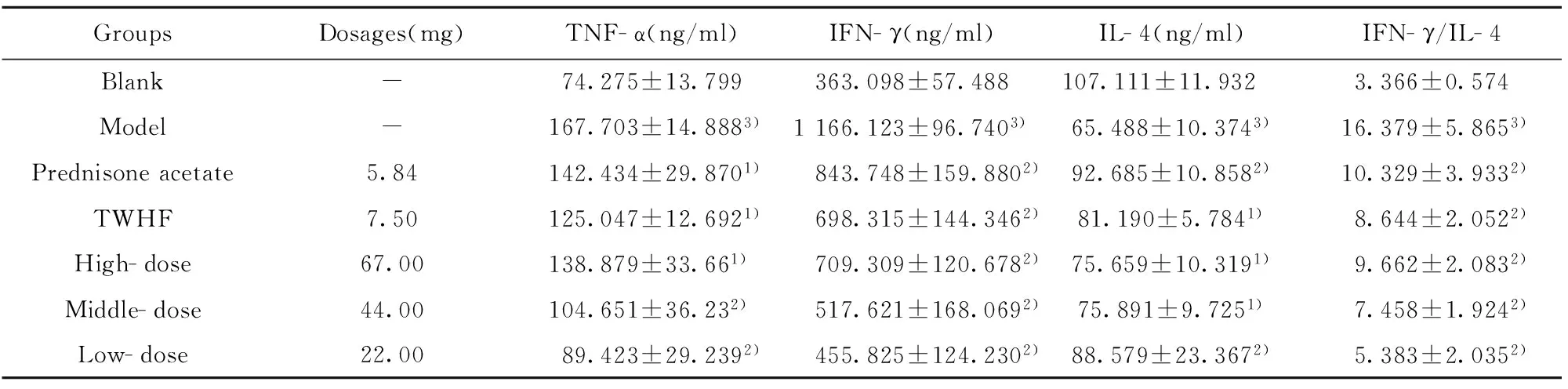
GroupsDosages(mg)TNF-α(ng/ml)IFN-γ(ng/ml)IL-4(ng/ml)IFN-γ/IL-4Blank-74.275±13.799363.098±57.488107.111±11.932 3.366±0.574Model-167.703±14.8883)1166.123±96.7403)65.488±10.3743)16.379±5.8653)Prednisoneacetate5.84142.434±29.8701)843.748±159.8802)92.685±10.8582)10.329±3.9332)TWHF7.50125.047±12.6921)698.315±144.3462)81.190±5.7841)8.644±2.0522)High-dose67.00138.879±33.661)709.309±120.6782)75.659±10.3191)9.662±2.0832)Middle-dose44.00104.651±36.232)517.621±168.0692)75.891±9.7251)7.458±1.9242)Low-dose22.0089.423±29.2392)455.825±124.2302)88.579±23.3672)5.383±2.0352)
Note:Vs model group,1)P<0.05,2)P<0.01;vs blank group,3)P<0.01.



GroupsDosages(mg)TGF-β1TotalIOD(μm)Totalarea(μm)AOD(μm)Blank-11700.32±1565.6435459.76±2933.860.19±0.01Model-3847.95±737.283)10998.45±2395.533)0.25±0.013)Prednisoneacetate5.84 7448.22±1325.102)21601.91±1649.492)0.22±0.012)TWHF7.50 9636.78±1136.122)27898.69±3980.292)0.20±0.022)High-dose67.0010758.17±632.992)30844.46±1073.292)0.21±0.022)Middle-dose44.009948.75±752.982)30039.08±1502.212)0.22±0.012)Low-dose22.007676.92±998.992)23924.08±2727.952)0.23±0.021)
Note:Vs model group,1)P<0.05,2)P<0.01;vs blank group,3)P<0.01.

图1 大鼠滑膜组织TGF- β1染色(×200)Fig.1 TGF- β1 staining- in- synovial tissues of rats(×200)Note: A.Blank group;B.Model group;C.Prednisone acetate group;D.TWHF group;E.Low- dose group;F.Middle- dose group;G.High- dose group.

图2 大鼠关节软骨HE染色(×200)Fig.2 HE staining in cartilages of rats(×200)Note: A.Blank group;B.Model group;C.Prednisone acetate group;D.TWHF group;E.Low- dose group;F.Middle- dose group;G.High- dose group.
表4 各组大鼠HE染色结果比较
Tab.4 Comparison of HE staining in cartilages of rats
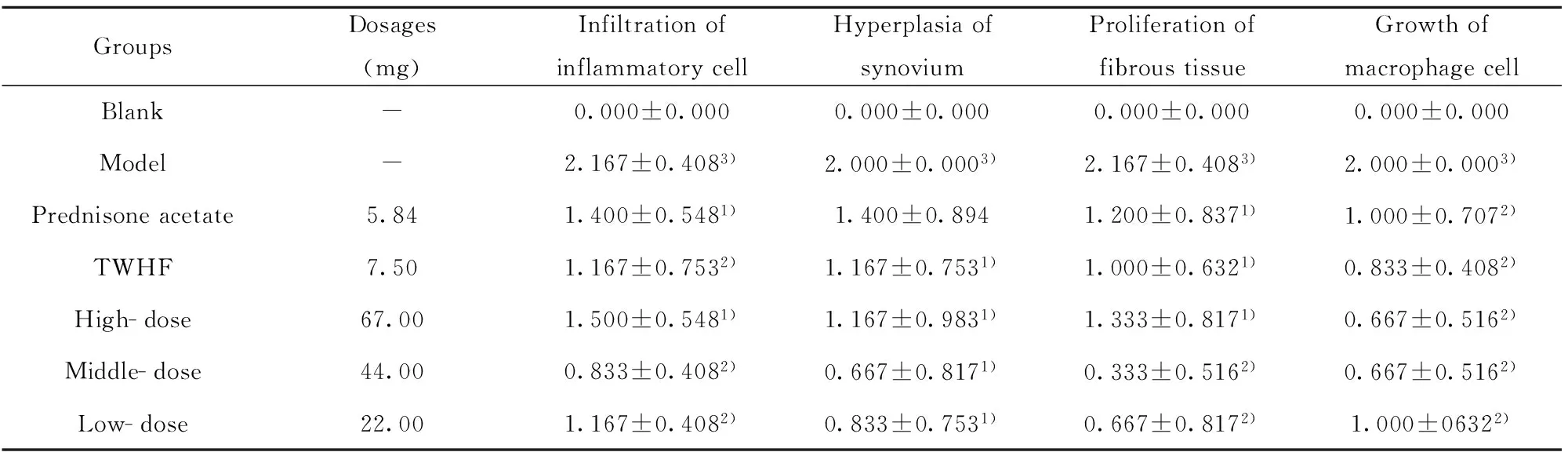
GroupsDosages(mg)InfiltrationofinflammatorycellHyperplasiaofsynoviumProliferationoffibroustissueGrowthofmacrophagecellBlank-0.000±0.0000.000±0.0000.000±0.0000.000±0.000Model-2.167±0.4083)2.000±0.0003)2.167±0.4083)2.000±0.0003)Prednisoneacetate5.841.400±0.5481)1.400±0.8941.200±0.8371)1.000±0.7072)TWHF7.501.167±0.7532)1.167±0.7531)1.000±0.6321)0.833±0.4082)High-dose67.001.500±0.5481)1.167±0.9831)1.333±0.8171)0.667±0.5162)Middle-dose44.000.833±0.4082)0.667±0.8171)0.333±0.5162)0.667±0.5162)Low-dose22.001.167±0.4082)0.833±0.7531)0.667±0.8172)1.000±06322)
Note:Vs model group,1)P<0.05,2)P<0.01;Vs blank group,3)P<0.01.
3 讨论
RA是一种以关节滑膜炎为病理特点,以全身多关节滑膜慢性炎症导致滑膜细胞增生及大量淋巴细胞浸润为特征的自身免疫疾病。胸腺、脾脏等指数的变化反映了动物机体免疫系统的基本功能,可作为初步观察药物对免疫功能影响的指标。本试验研究结果表明,复方黑骨藤能显著降低脾脏和胸腺指数,提示复方黑骨藤可能通过调节免疫器官功能来提高抗类风湿关节炎作用的能力,与雷公藤多苷无显著性差异,不及醋酸泼尼松。但醋酸泼尼松对AA大鼠的体重增长有较大的影响,并使其胸腺、脾脏出现了萎缩,表现出较强的免疫抑制作用。
RA的病理机制目前尚不十分清楚,但许多研究表明淋巴细胞、中性粒细胞、巨噬细胞、滑膜细胞等多种炎症细胞介导的异常细胞免疫在RA的病理中起着重要的作用,其中T细胞的活化及其产生的细胞因子是引起免疫损伤的主要因素[7,8]。RA滑膜组织病理学表现为大量的T淋巴细胞浸润,以辅助性T细胞(T helper cell,Th1和Th2)两个亚群占主导地位,这为RA是由T淋巴细胞介导的疾病提供了证据[9]。正常人的Th1、Th2型两种细胞亚群之间及Th1/Th2及其细胞因子间存在动态平衡,而RA患者的细胞因子网络则明显向Th1方向发生偏移[10]。Th1细胞主要分泌IFN- γ、IL- 1β、TNF- α等,以IFN- γ为代表,IFN- γ可促进Th0细胞分化为Th1细胞及炎性介质的产生,抑制Th2细胞增殖,促进免疫细胞和滑膜细胞增生及活化,参与RA关节慢性炎症的发生发展[11];Th2细胞主要分泌IL- 4、IL- 10、TGF- β1等,以IL- 4为代表,IL- 4可通过促进Th2细胞的扩增及抗炎性细胞因子的释放,抑制MMPs产生及IL- 1、IL- 6、IL- 8和TNF- α释放,进而抑制Th1细胞介导的免疫应答,从而起到保护关节软骨和改善慢性关节炎症的作用[12- 15];实验结果可见,模型组AA大鼠血液中Th1细胞分泌的IFN- γ和TNF- α含量均显著升高,明显高于空白组大鼠,而Th2型细胞因子IL- 4低于空白组大鼠,体内IFN- γ的高度表达量和IL- 4低表达量导致IFN- γ/IL- 4比值升高,IFN- γ占优势,促使淋巴细胞Th1/Th2及其细胞因子网络明显向Th1方向发生偏移,AA大鼠淋巴细胞Th1/Th2及其细胞因子间失去动态平衡,导致免疫细胞和滑膜细胞增生及活化。经药物治疗,Th1细胞因子IFN- γ和TNF- α含量均较模型组降低,Th2细胞因子IL- 4表达较模型组升高,提示复方黑骨藤促进AA大鼠血液中Th2细胞的分化及其分泌,提高IL- 4的含量,抑制AA大鼠血液中Th1细胞IFN- γ和TNF- α因子分泌,使IFN- γ/IL- 4的比值降低,提示药物治疗促进Th1/Th2向Th2方向偏移,进而使Th1/Th2恢复平衡状态。从而改善关节滑膜慢性炎症的发展。
TGF- β1是一组蛋白超家族,已证实TGF- β1可调节细胞的生长与分化[7],TGF- β1可调控和增加单核细胞的作用,阻碍T淋巴细胞繁殖,限制吞噬细胞的发育与活性,阻碍炎性细胞因子的产生[16]。实验结果显示,模型组大鼠关节滑膜组织表达的TGF- β1水平远不足空白组,提示模型组大鼠体内抑制免疫活性细胞的增殖和淋巴细胞的分化作用减弱,TGF- β1表达减少也使得细胞修复能力下降。同时,TGF- β1表达减少使其促进嗜碱性粒细胞释放组织胺减少,这似乎与现象相矛盾,但导致关节发炎红肿的途经不仅仅是TGF- β1的促进,还有IL- 1、IL- 6、IL- 8等致炎因子的作用。实验显示模型组膝关节出现大面积的炎性细胞浸润,细胞浸润面积也是最大的,进一步说明了RA的炎性细胞浸润与TGF- β1的表达有关;经药物治疗,滑膜组织中TGF- β1表达均较模型组高,尤其是复方黑骨藤高剂量差异更加明显,具有显著统计学意义(P<0.01)。说明复方黑骨藤可以促进TGF- β1的表达而抑制T淋巴细胞繁殖,改善滑膜组织炎性细胞浸润,阻碍炎性细胞因子的产生,从而阻止RA的进一步发展。
复方黑骨藤能增加TGF- β1的表达,通过抑制T、B淋巴细胞的增殖、抑制抗体的产生,减少自然杀伤细胞的产生从而减弱免疫反应。近来研究还表明,TGF- β1有可控的抑制作用且其还具有促进软骨特异性基质的合成的功能,其通过促使间充质细胞成熟分化为软骨细胞,诱导软骨基质形成,抑制多种蛋白酶对软骨基质的破坏,从而实现软骨的自我再生功能,增强了软骨本身的抗损伤能力,可以使损伤实现逆转修复。而抑制T细胞增殖的同时,提高IL- 4,降低IFN- γ和TNF- α的表达,使Th1/Th2细胞向Th2方向偏移,使得关节滑膜组织中Th1/Th2恢复平衡状态。从而改善关节T淋巴细胞浸润,阻止滑膜炎症的持续发展,阻止关节软骨基质的崩解,减轻关节软骨损伤面积。
各组AA大鼠病理学组织切片结果显示:模型组滑膜表面明显肿胀,滑膜组织增生,排列不整齐,毛细管增多充血,有大量的T淋巴细胞浸润。与模型组相比,复方黑骨藤组的炎性细胞浸润、滑膜细胞增生均得到改善,滑膜肿胀、充血度降低,差异极显著(P<0.01)。
综上所述,复方黑骨藤能显著降低AA大鼠关节滑膜及软骨组织的损伤,修复被破坏的组织,并较好的减缓、阻止了类风湿性关节炎的发展。复方黑骨藤的实验研究为应用于RA的临床治疗提供了理论依据。
[1] 伍 斌,鲁延富,姜凤良.类风湿关节炎发病机制的研究进展[J].医学综述,2014,20(23):4249- 4251.
[2] Malemud CJ,Blumenthal DE.Protein kinase small molecul- einhibitors for rheumatoid arthritis:Medicinal chemistry/clinicalperspectives[J].World J Orthop,2014,5(4):496.
[3] 陈 芳,汪 毅.苗药黑骨藤的研究及开发应用[J].中国民族民间医药,2010,19(1):6- 7.
[4] 黄进明,罗春丽,郭 刚,等.黑骨藤抗类风湿性关节炎作用及其分子机制[J].中国实验方剂学杂志,2011,17(22):174- 177.
[5] 陆墨姼,张 宏,刘 刚,等.复方黑骨藤提取物对佐剂性关节炎大鼠滑膜组织中TNF- α、MMP- 9和TIMP- 1的影响[J].时珍国医国药,2011,22(11):2593- 2595.
[6] 李仪奎,金若敏,王钦茂,等.中药药理实验方法学[M].上海:科学技术出版社,2006:721- 722.
[7] 范为民,李 艳.清络饮对佐剂关节炎大鼠血清 TNF- α、IL- 1β的影响[J].中西医结合研究,2016,8(1):23- 25.
[8] Zhou X,Hua X,Ding X,etal.Trichostatin differentially regulates Th1 and Th2 responses and alleviates rheumatoid arthritis in mice[J].J Clin Immunol,2011,31(3):395- 405.
[9] Pedersen JK,Kjaer NK,Svendsen AJ,etal.Incidence of rheumatoid arthritis from 1995 to 2001:impact of ascertainment from multiple soutces[J].Rheumat Int,2009,29(4):411- 415.
[10] Velázquez JR,Garibay- Martínez L,Martínez- Tejada P,etal.An amebic anti- inflammatory peptide down- regulates ex vivo IL- 1β expression in patients with rheumatoid arthritis[J].Reumatología Clínica,2012,8(6):315- 320.
[11] Hussein YM,El- Shal AS,NA,etal.Influence of interleukin- 4 gene polymorphisms and interleukin- 4 serum level on susceptibility and severtity of reeumatoid arthritis in Egyptian population[J].Cytokine,2013,61(3):849- 855.
[12] 董兴高.Th1 /Th2、Th17 /Treg 细胞的平衡与临床[J].湖北民族学院学报(医学版),2012,29(1):67- 69.
[13] 聂瑛洁,周晓泉,袁 军,等.IL- 4/IL- 10诱导的树突状细胞对类风湿关节炎的作用[J].中国免疫学杂志,2011,27(12):1104- 1108.
[14] Sarah EW,Danielle D,Taher E,etal.Targeted delivery of cytokine therapy to rheumatoid tissue by a synovial targeting petiptide[J] .Ann Rheum Dis,2013,72(1):129- 135.
[15] 刘 玮,李振英,陈学昱.重组人内抑素对佐剂性关节炎大鼠血清中的白细胞介素- 4和瘦素表达水平的影响[J].黑龙江医药科学,2011,34(1):100- 101.
[16] 李振英,何慧忠,刘 玮.复方独活寄生合剂治疗佐剂性关节炎大鼠的实验研究[J].黑龙江医药科学,2012,35(6):7- 8.
[收稿2016- 10- 27 修回2017- 01- 17]
(编辑 倪 鹏)
Effects of Periploca forrestil Schltr Compound extracts on IL- 4,IFN- γ and TGF- β1 of rats with adjuvant arthritis
RAN Ran,HOU Yu- Ting,LI Xia.
College of Life Sciences,Sichuan Normal University,Chengdu 610101,China
Objective:To observe the effects of Periploca forrestil Schltr Compound extract in serum interleukin- 4(IL- 4),interferon- γ(IFN- γ),tumor necrosis factor- α (TNF- α) and transforming growth factor- β1 (TGF- β1) in joint synovial tissue of rats,and further to investigate it′s therapeutic effects and related mechanism.Methods: To built the complete adjuvant arthritis (AA) model in rats,and then to detect the contents of IL- 4,IFN- γ,TNF- α in serum by ELISA,TGF- β1 in synovial tissues of rats knee was detected by immunohistochemistry.Results: The contents of IFN- γ,TNF- α were higher and IL- 4 and TGF- β1 were lower in adjuvant arthritis rats (model group) than those in blank control (P<0.01).By comparing with the model group the contents of IFN- γ and TNF- α were significantly lower in Periploca forrestil Schltr Compound treated rat group,whereas the expressions of IL- 4 and TGF- β1 were increased(P<0.05).Conclusion: The Periploca forrestil Schltr Compound can significantly inhibit the expression of IFN- γ and TNF- α,and enhance the expression of IL- 4 and TGF- β1,adjusted the Th1/Th2 cell and cytokines imbalance,to alleviate arthritis and cartilage destruction,therefore the Periploca forrestil Schltr Compound can significantly inhibit the proliferation of T lymphocyte and infiltration in synovial tissues of experimental rheumatoid arthritis.
Periploca forrestil Schltr Compound;Rheumatoid arthritis;Th1/Th2;Interleukin- 4;Interferon- γ;Transforming growth factor- β1
10.3969/j.issn.1000- 484X.2017.08.009
①本文受国家自然科学基金(31240087)资助。
冉 然(1992年-),女,在读硕士,主要从事药理学方面研究,E- mail:869840625@qq.com。
及指导教师:黎 霞(1960年-),女,硕士,教授,硕士生导师,主要从事药理学方面的研究,E- mail:676037091@qq.com。
R96
A
1000- 484X(2017)08- 1164- 07

