免疫应答中基因表达的转录延伸调控①
商营利 胡小玉
(清华大学免疫学研究所,清华大学医学院,北京100084)
·专家述评·
免疫应答中基因表达的转录延伸调控①
商营利 胡小玉
(清华大学免疫学研究所,清华大学医学院,北京100084)
基因转录是一个有序的多步骤过程,包括转录起始前、转录起始和转录延伸等几个阶段。长期以来,转录起始前及转录起始阶段调控一直被认为是基因转录的关键限速步骤。然而,近年来利用全基因组深度测序等新技术对转录过程的深入研究,发现转录起始后的转录延伸阶段也是许多基因表达调控的关键步骤,并且这种调控机制在从果蝇到哺乳动物的不同物种之间高度保守。本文综述了NELF、DSIF和P- TEFb等主要转录延伸调控因子调控RNA聚合酶Ⅱ转录暂停和高效转录延伸最新分子机制,并讨论了转录延伸调控在癌症、炎症以及病毒感染等疾病发生中的作用。
基因表达;转录延伸;RNA聚合酶Ⅱ;P- TEFb;NELF

商营利(1978年-),山东农业大学动物医学院教授、博士生导师。2000年和2003年分别毕业于山东农业大学获得学士和硕士学位,2008年毕业于中国科学院动物所获理学博士学位。2009~2015年分别在美国俄亥俄州立大学医学中心和康奈大学医学院附属纽约特种外科医院从事博士后研究。曾任清华大学医学院免疫学研究所Co- PI/副研究员。主要从事病原感染与天然免疫反应调控机制的研究,在Nat Immunol、Hepatology等国际期刊上发表论文10余篇。

胡小玉(1974年-),清华大学免疫学研究所研究员、博士生导师。胡小玉毕业于北京医科大学基础医学系,于美国康奈尔大学取得免疫学博士学位,并曾担任康奈尔医学院tenure track助理教授。主要研究领域为细胞因子和天然免疫信号转导通路对巨噬细胞功能与分化的调控,目前已发表论文30余篇,总被引用次数达2 000余次。多项研究成果发表在Nat Immunol和Immunity等免疫学国际期刊上。其作为PI领导的科研项目曾获得科技部、国家自然科学基金、美国国立卫生研究院、美国风湿病协会、美国关节炎协会、美国红斑狼疮研究所等多个机构的资助。 曾获得国际细胞因子协会杰出青年女性科学家奖、英国皇家学会牛顿高级学者、青年千人计划、国家自然科学基金委优秀青年基金、美国关节炎协会青年学者等多个奖项。参与由国家自然科学基金、教育部、NIH、美国国防部、美国风湿病协会等机构组织的重大项目评审。
真核生物基因的表达调控是一个复杂而精确的多级调控过程,包括转录前染色质活化、转录调节、转录后加工、翻译水平的调节及翻译后修饰等。其中,转录水平上的调控是多级调控中最关键的环节。基因转录是在RNA聚合酶的催化下,以DNA为模板合成RNA的过程,转录后的RNA被用来作为蛋白质翻译的模板或加工为有功能的RNA。在真核生物中,编码蛋白的基因由RNA聚合酶Ⅱ(RNA polymeraseⅡ,PolⅡ)转录成信使RNA。PolⅡ所介导的转录过程是一个多步骤的过程。一个转录循环可以分为转录起始前、转录起始、转录延伸等几个阶段[1]。基因转录的启动依赖于多种识别基因启动子区域特定序列的转录因子和PolⅡ形成的转录前起始复合物(Pre- initiation complex,PIC)的组装,此过程需要多亚基转录中介体Mediator复合物作为转录因子与PolⅡ之间的连接桥梁的参与。在PIC中,DNA双链分开,模板链移至PolⅡ的活性中心位置,从而启动由转录起始位点(Transcription start site,TSS)开始的RNA合成[2]。长期以来,转录起始前及转录起始阶段调控一直被认为是基因转录调控的关键限速步骤,并发现了大量转录前期所必需的转录因子和调控元件。然而,对于果蝇中Hsp70基因和哺乳动物细胞中c- myc和c- fos等可迅速诱导表达基因的研究发现,在这些基因的启动子区域,基因在被诱导表达前即有处于转录暂停状态的PolⅡ[3- 5]。进一步利用PolⅡ 染色体免疫共沉淀实验在全基因组水平上分析,发现启动子区域由转录暂停状态PolⅡ占据(Occupancy)是许多发育相关基因的共同特征,表明转录过程中PolⅡ在启动子区域暂停是一种普遍现象[6]。近年来,利用全基因组深度测序等新技术对转录过程的深入研究证实,转录起始后的转录延伸阶段也是一个复杂而又高度有序的基因表达调控平台,是基因表达调控的关键步骤,并且这种调控机制在从果蝇到哺乳动物的不同物种之间高度保守,是基因表达的核心调控机制之一。
1 早期转录延伸的调控机制
转录延伸是PolⅡ合成全长RNA时的一个有序的过程。PolⅡ转录延伸可以被分为早期延伸和晚期延伸(高效转录延伸)两个阶段[7]。早期延伸是指起始后PolⅡ从启动子离开到进行完全高效转录延伸之间的过渡阶段,此阶段通常包括PolⅡ在启动子相邻区暂停(Promoter- proximal pausing)的过程。在基因转录起始后,PolⅡ从基因的启动子脱离,转录一段短的初始转录RNA,然后暂停于转录起始位点TSS下游约50个核苷酸的位置,作为基因转录延伸的一个检查点[2,7- 9]。研究表明,负向延伸因子NELF (Negative elongation factor) 和DRB(5,6 dich- loro- beta- D- ribofuranosylbenzimidazole)敏感诱导因子DSIF (DRB- sensitive inducing factor) 是介导PolⅡ转录暂停的两个关键转录暂停因子。NELF和DSIF能与处于转录暂停状态PolⅡ相结合并维持其稳定性。其中,NELF是由A、B、C、D、E五个亚基组成的一个多蛋白复合物,而DSIF由SPT4/SPT5组成异源二聚体,且在所有物种均高度保守[10,11]。NELF和DSIF形成复合物的详细机制尚不明确,但已经知道NELF- E含有一个RNA结合域,一个可能的机制是转录暂停因子通过其自身与RNA的结合能力来发挥功能[12]。当细胞决定启动基因的高效转录时,需要招募活化的正向转录调节因子P- TEFb(Positive transcription elongation factor b)至基因位点(Gene locus)上。活化的P- TEFb磷酸化PolⅡ碳末端(C- terminal domain,CTD)第2位丝氨酸残基(Serine 2,Ser 2)以及NELF和DSIF从而解除PolⅡ的转录暂停状态,启动PolⅡ的高效转录延伸模式[13]。在此过程中,P- TEFb磷酸化PolⅡ可能需要其他调节因子的共同参与。研究发现,P- TEFb可以募集PAF1(Pol- associated factor 1)以及CDK12(Cyclin- dependent kinase 12)形成复合物到基因启动子共同调节暂停PolⅡ的释放[14]。
2 晚期转录延伸的调控机制
2.1 P- TEFb与 PolⅡ转录状态的转换 晚期延伸阶段即高效延伸(Productive elongation)阶段是指PolⅡ在基因体上高效连续前进的过程。该过程的起始依赖于PolⅡ从暂停模式向高效转录延伸模式的转变,而PolⅡ模式转变主要受两种重要的转录延伸复合物修饰机制调节:一是由加帽酶催化完成的初始转录RNA 5′端的加帽修饰;二是P- TEFb介导的PolⅡ磷酸化以及转录暂停因子NELF和DSIF的磷酸化[7]。
正向转录延伸调节因子P- TEFb是介导PolⅡ从暂停模式向高效延伸模式转变的关键调控因子。P- TEFb是由CDK9和Cyclin T (CYC- T) 组成的异源二聚体复合物[13,15]。已知在整个转录循环过程中,PolⅡ CTD 区受到多种磷酸化事件的修饰,其中CTD串联重复的七肽保守序列(Tyr1- Ser2- Pro3- Thr4- Ser5- Pro6- Ser7)的Ser 2和Ser 5的磷酸化最为关键[16],而PolⅡ CTD Ser 2磷酸化是由P- TEFb介导的。除了介导PolⅡ Ser 2磷酸化外,P- TEFb还磷酸化NELF的E亚基和SPT5的CTD,使转录暂停因子NELF从转录延伸复合物上解离,并将DSIF逆转为促进转录延伸的因子,从而释放暂停的PolⅡ向高效延伸模式转变[17]。在这一过程中,招募活化的P- TEFb至基因位点是释放暂停PolⅡ和启动高效转录延伸的关键步骤。
在人的细胞中,处于自由态的P- TEFb与7SK小核核糖核蛋白(small nuclear ribonucloeprotein,snRNP)结合而处于非活性状态。7SK snRNP与P- TEFb结合需要RNA结合蛋白HEXIM(Hexameth- ylene bisacetamide- inducible proteins)的协助。在活化状态下,P- TEFb从受抑制状态释放并被招募到基因位点上执行功能。在P- TEFb从7SK snRNP释放的同时,HEXIM也会被释放。在执行其功能后,P- TEFb能再次被7SK snRNP捕获而变为非活化状态[8]。P- TEFb可以通过多种方式被招募到基因启动子上,目前已知主要有以下三种模式:其一,通过转录激活蛋白直接招募。多种激活蛋白可以通过与P- TEFb相互作用直接招募P- TEFb,如转录激活蛋白c- MYC能够与P- TEFb亚基CYC- T直接相互作用[18,19]。与之相似,NF- κB的REL- A亚基也能直接与CYC- T结合而招募P- TEFb到靶基因上去[20]。除此之外,人免疫缺陷病毒(Human immunodeficiency virus,HIV)反式激活子TAT也可以与CYC- T结合而直接招募P- TEFb到5′长末端重复区[21]。其二,通过转录共激活因子招募。除了激活蛋白的直接作用外,共激活因子溴结构域蛋白4(Bromodomain protein 4,BRD4)对P- TEFb募集也起重要作用。研究发现,一旦P- TEFb与7SK snRNP分开而释放后,BRD4即能与CYC- T结合而招募P- TEFb[22,23]。因此,BRD4介导的P- TEFb募集可能是基因表达调控的一个重要机制。最新的研究发现,转录共抑制因子KAP1(又名TIF1或TRIM28)可以结合7SK snRNP而招募P- TEFb- 7SK snRNP复合物至基因启动子上,从而促进P- TEFb的募集[24]。其三,通过转录中介体Mediator复合物招募。研究发现,人细胞中转录中介体Mediator复合物的亚基MED26可以作为一个平台与包含P- TEFb的超级延伸复合物(Super elongation complex,SEC)结合[25]。
2.2 PolⅡ复合物高效延伸的调控 当PolⅡ从暂停模式转变为高效延伸模式后,与PolⅡ相结合的转录调节因子即发生急剧变化。现已发现多个调节因子对PolⅡ高效延伸的效率有重要影响。哺乳动物细胞的延伸蛋白Elongin是较早鉴定的一个促进转录延伸效率的蛋白,它是由A、B、C三个亚基组成的异源三聚体,其主要功能是抑制PolⅡ在基因体(Gene body)上转录延伸时的瞬时暂停[26,27]。在人细胞中发现Elongin相关基因ELL(Eleven- nineteen Lys- rich leukaemia)也能增强PolⅡ延伸效率,其可能作用机制与Elongin相似[28]。实际上,在PolⅡ高效延伸过程中,多个包含P- TEFb在内的转录延伸调节蛋白组装在一起形成超级延伸复合物SEC,对转录延伸起着重要调节作用。SEC包含延伸因子ELL家族蛋白(ELL1、ELL2和ELL3)、AF4/FMR2(AFF)家族蛋白AFF1、AFF4、ENL(Eleven- nineteen leukemia)和AF9(ALL1- fused gene from chromosome 9)和P- TEFb等多个转录延伸调控因子[8,29]。其中AFF4是SEC组装的脚手架蛋白,它可以分别与P- TEFb、ENL和AF9以及ELL直接相互作用而募集相关蛋白介导SEC的形成[30]。已经证实SEC在体外能够促进PolⅡ的转录延伸。最近利用AFF4 ChIP- seq发现SEC中的延伸调节因子是许多哺乳动物细胞中众多基因表达所必需的,表明SEC是促进PolⅡ高效转录延伸的关键延伸复合物。除了AFF1和AFF4外,AFF家族蛋白还包括AFF2和AFF3,而AFF2和AFF3则分别是SEC- L2和SEC- L3两种类SEC复合物中的脚手架蛋白。SEC- L2和SEC- L3复合物也包含ENL或AF9以及P- TEFb,但并不包含ELL[31]。多种不同形式的SEC为调节特定基因的表达和细胞应对不同的信号刺激提供了具有特异性分子基础。
进行转录延伸的PolⅡ转录延伸复合物在基因体上前行时,还需跨越核小体障碍[7]。细胞内存在多种调节机制能够移除或减弱核小体障碍以协助和配合执行延伸任务的PolⅡ在基因体上前行,如核小体重塑和组蛋白修饰等。目前,利用生化实验在体外已鉴定了多个参与调节Pol转录延伸复合物跨越核小体障碍的调节因子,主要包括FACT (Facilitates chromatin transcription)、SPT6、PAF(Polymerase- associated factor)复合物以及PARP[poly(ADP- ribose)polymerase]等[32]。FACT最初是从人Hela细胞核中提取物中分离鉴定的,其主要功能是使核小体上组蛋白H2A- H2B二聚体解离,以利于PolⅡ转录延伸在剩余八聚体组蛋白不被取代的情况下进行。当PolⅡ转录过后,FACT还可促进H2A- H2B二聚体与余下的八聚体重新组装成组蛋白十聚体,并保持高度活化状态[7]。FACT这一功能在果蝇体内热休克蛋白Hsp70基因上被进一步证实。SPT6蛋白具有组蛋白伴侣分子活力,能够直接与H3和H4相互作用。在转录过程中,SPT6与执行延伸的PolⅡ(Elongating PolⅡ)伴随移动,使位于核小体下游的PolⅡ在核小体上游重新聚集而促进PolⅡ转录延伸[33]。与SPT6相似,PAF复合物在体内也与执行延伸的PolⅡ伴随移动。PAF是否具有酶活性尚不清楚,但它能够作为一个平台将转录延伸复合物如SEC、FACT、组蛋白修饰酶等以及执行延伸的PolⅡ募集在一起,以促进Pol转录延伸跨越核小体障碍[6,7]。不同于以上调节因子与执行延伸的PolⅡ相结合,PARP并不与转录延伸中的PolⅡ有物理上的结合。PARP减弱核小体障碍的功能不依赖于转录,其主要功能是结合在活化的基因启动子上,促进染色体松散和核小体在基因体上快速移除[34]。表1总结了已知的参与转录延伸调节相关分子的分类和功能。
3 转录延伸调控与疾病
3.1 转录延伸调控与发育和肿瘤 转录延伸作为基因表达的一个重要检查点,在发育相关基因表达调控中发挥着关键作用。对于果蝇胚胎和小鼠胚胎干细胞全基因组分析发现,在响应外界分化刺激信号前,有大量发育相关调控基因的启动子上即预先存在PolⅡ[35- 38],这类基因一般称为暂停基因(Paused genes)。胚胎和细胞发育过程中大量PolⅡ暂停基因的存在表明转录延伸作为调节基因表达的一个重要检查点,在发育调控相关基因表达中发挥着关键作用。由于胚胎发育过程中许多基因的表达都需要在时间上和空间上精确调控,一旦转录延伸调控机制失调将导致基因异常表达,并可能引起发育异常和疾病发生。与之相对应,体外实验鉴定的多个PolⅡ转录延伸调节因子均是在果蝇、斑马鱼和哺乳动物发育过程中的重要调节蛋白。ELL是第一个被鉴定的与恶性血液肿瘤混合谱系白血病(Mix- ed lineage leukaemia,MLL)中频繁易位基因MLL的染色体易位相关基因[28]。如前所述,ELL家族蛋白与其他MLL易位伙伴蛋白AFF1、AFF4、AF9等与 P- TEFb共同形成SEC调节基因表达。体外研究发现,MLL基因染色体易位融合到任何一种SEC复合物组成基因上时,会导致SEC在MLL嵌合靶基因上的非正常募集。可见,转录延伸检查点控制失调导致MLL嵌合靶基因的过度活化,促进了MLL- SEC复合物性形成,进一步支持了异常转录延伸在白血病发病中的关键作用。已经知道,MYC基因的表达与恶性血液肿瘤等疾病的发生密切相关。最近开发的BET家族蛋白抑制剂如iBET即主要通过下调MYC基因的表达而抑制白血病细胞的分化[39]。在髓系和淋系白血病中,MYC是SEC的直接靶基因。可见转录延伸调控可能在癌症的发生、发展和转移等不同阶段都发挥重要作用。
3.2 转录延伸调控与炎症 针对各种外界环境的改变与刺激,宿主免疫细胞能够迅速做出各种反应以应对外界刺激。如脂多糖(Lipopolysaccharide,LPS)通过TLR4活化巨噬细胞,可诱导几百个炎症基因的大量表达。这些炎症基因可以被分为两大类,即初级反应基因(Primary response genes,PRGs)和次级反应基因(Secondary response genes,SRGs)。PRGs的表达不依赖于新蛋白合成,通常会在1 h内被大量诱导表达,而SRGs的诱导表达则依赖于新蛋白合成和染色体重塑,其诱导表达相对较晚[40,41]。近年来,大量的研究表明转录调控在巨噬细胞炎症基因表达调控过程中发挥着核心作用,包括调节PolⅡ至基因启动子的募集、早期转录延伸复合物的释放、生产性转录延伸等基因转录步骤。最新的研究发现,许多PRGs在静态下其启动子区域即已处于开放状态,并有PolⅡ聚集。这些炎症基因表达时,转录延伸的调控在基因转录过程发挥了关键的调控作用,是基因表达的一个限速步骤。如在未刺激的小鼠巨噬细胞中,肿瘤坏死因子基因Tnf(Tumor necrosis factor alpha)启动子区域有大量Ser5磷酸化的PolⅡ和NELF。当LPS刺激活化细胞时,P- TEFb即被招募至Tnf启动子区域,Ser2磷酸化的PolⅡ大量增加和NELF的瞬时解离,从而释放PolⅡ进行生产性转录延伸和表达Tnf[42]。除Tnf外,巨噬细胞表达的许多PRGs如Tnfaip3、Socs3、Cxcl2、Ccl2、Ccl3等基因的启动子区域均有Ser5磷酸化的PolⅡ占据,说明早期转录延伸调控是PRGs表达调控的一种普遍机制[41,43,44]。与此一致,已有多项研究证实这些炎症因子表达在早期转录延伸阶段受到正向或负向的调控。如糖皮质激素受体(Glucoco- rticoid receptor,GR)信号通过调节转录延伸抑制巨噬细胞Tnf、Ccl2、Ccl3等多个炎症因子的表达[43,44]。另外,许多启动子区域无PolⅡ停泊的基因(“non- paused” gene)也可以被迅速诱导表达[45]。如在静息状态下的巨噬细胞中,炎症趋化因子Cxcl1启动子区域并没有明显的PolⅡ占据,但LPS刺激巨噬细胞活化后,PolⅡ即被大量招募至Cxcl1基因上,从而迅速启动基因的大量表达。因此,PolⅡ的招募和转录启始在这类基因表达过程中是重要的限速步骤。有趣的是,我们最近的研究发现,转录抑制因子Hes1 (Hairy and enhancer of split1)可以通过抑制P- TEFb到Cxcl1基因上招募而抑制其表达。值得注意的是,Hes1这种调控作用主要抑制了PolⅡ的高效转录延伸而不是暂停PolⅡ的释放,说明其对Cxcl1基因表达的抑制发生在晚期转录延伸阶段。除了Cxcl1以后,我们还发现在巨噬细胞中Hes1可以作用于多个基因的晚期转录延伸而抑制基因的表达[46]。可见,炎症基因表达在早期和晚期转录延伸阶段均可受到精细调控。
表1 转录延伸调控相关分子与功能
Tab.1 Classification and function of factors related to transcription elongation
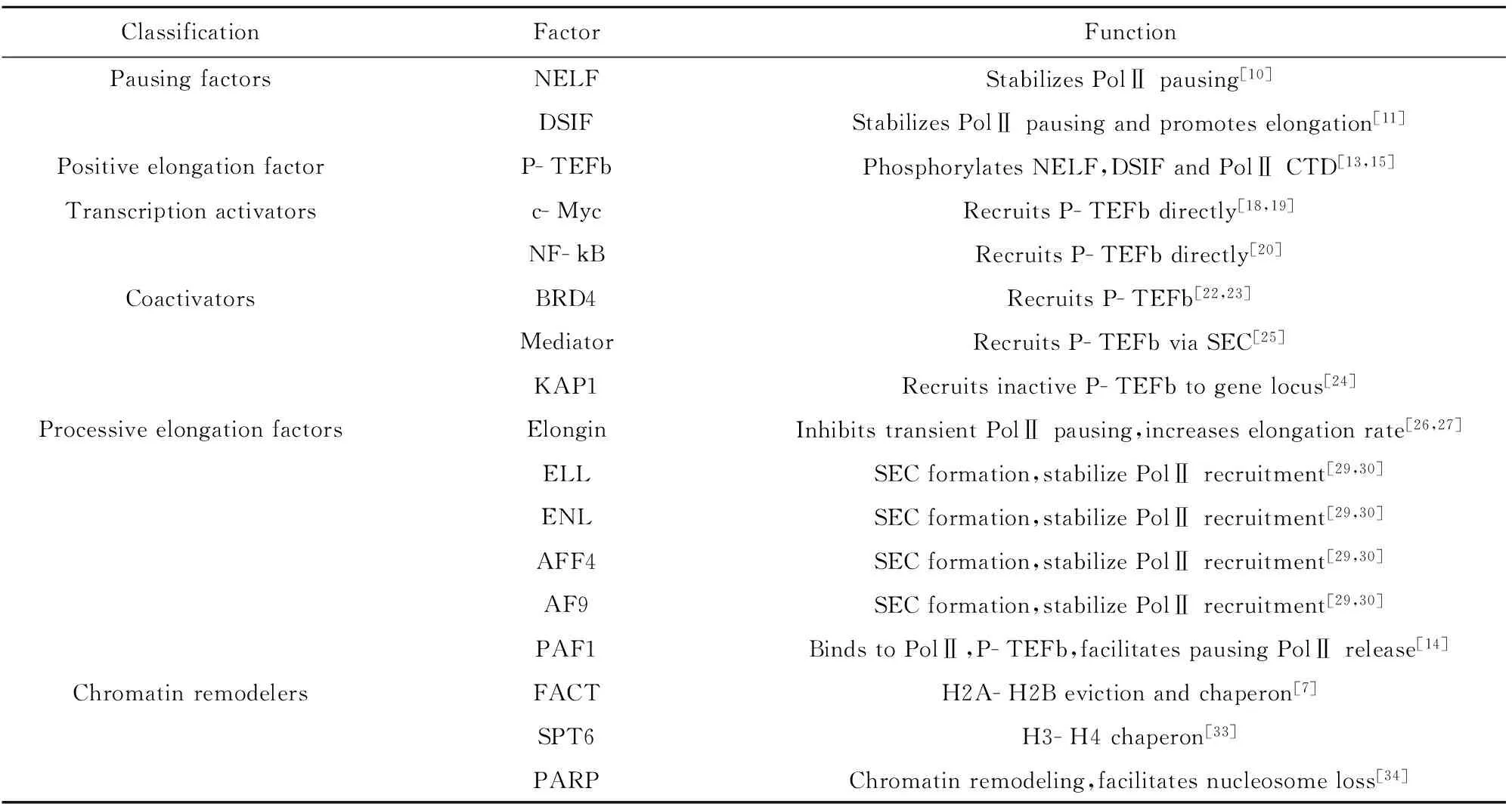
ClassificationFactorFunctionPausingfactorsNELFStabilizesPolⅡpausing[10]DSIFStabilizesPolⅡpausingandpromoteselongation[11]PositiveelongationfactorP-TEFbPhosphorylatesNELF,DSIFandPolⅡCTD[13,15]Transcriptionactivatorsc-MycRecruitsP-TEFbdirectly[18,19]NF-kBRecruitsP-TEFbdirectly[20]CoactivatorsBRD4RecruitsP-TEFb[22,23]MediatorRecruitsP-TEFbviaSEC[25]KAP1RecruitsinactiveP-TEFbtogenelocus[24]ProcessiveelongationfactorsElonginInhibitstransientPolⅡpausing,increaseselongationrate[26,27]ELLSECformation,stabilizePolⅡrecruitment[29,30]ENLSECformation,stabilizePolⅡrecruitment[29,30]AFF4SECformation,stabilizePolⅡrecruitment[29,30]AF9SECformation,stabilizePolⅡrecruitment[29,30]PAF1BindstoPolⅡ,P-TEFb,facilitatespausingPolⅡrelease[14]ChromatinremodelersFACTH2A-H2Bevictionandchaperon[7]SPT6H3-H4chaperon[33]PARPChromatinremodeling,facilitatesnucleosomeloss[34]
3.3 转录延伸调控与病毒感染 P- TEFb是启动PolⅡ转录延伸关键调节因子,许多延伸调节因子通过与P- TEFb相互作用而发挥其调节转录延伸的功能。不仅如此,在病毒感染过程中,多种病毒可以通过招募或调节P- TEFb活性而调节细胞内基因的转录而促进自身的复制。如在HIV感染过程中,HIV编码的一种反式激活因子Tat能够招募SEC促进病毒基因的转录延伸[21]。在SEC中,骨架蛋白AFF4与P- TETb的Cyclin T1直接结合形成复合物。深入研究发现,Tat蛋白不仅能够与AFF4直接相互作用,还可以直接结合Cyclin T1,而AFF4与P- TEFb结合则能显著增加Tat与P- TEFb的结合能力。Tat蛋白的另一个重要的功能是结合基因上的短的RNA。可见在HIV感染过程中,Tat蛋白作为桥梁分子通过形成Tat- AFF4- P- TEFb复合物而招募SEC与RNA结合,从而促进病毒基因的转录延伸和自身复制[47,48]。除了作用于SEC外,Tat还可以单独作用于P- TEFb。对于Tat- P- TEFb复合物的结构解析发现Tat既能结合CDK9,也能结合Cyclin T1。Tat结合可以引起P- TEFb发生构象改变,从而促进P- TEFb从非活化状态的大复合物解离[49]。因此,Tat蛋白可以通过不同的机制而促进病毒基因转录延伸和病毒复制。
流感病毒的RNA依赖的RNA聚合酶也能与P- TEFb亚基CDK9直接相互作用,从而增强自身与细胞内PolⅡ的结合,进而促进病毒基因的转录延伸和自身复制[50]。在登革热病毒(Dengue virus,DENV)感染过程中,DENV的核心结构蛋白(DENV core protein,DENV- C)能够与宿主细胞P- TEFb共定位和相互结合,进而促进细胞炎症因子如IL- 8的基因转录[51]。可见,P- TEFb在流感病毒和DENV感染和致病过程中发挥重要作用。病毒不仅可以利用P- TEFb促进基因表达,某些DNA病毒在感染早期还可能通过抑制P- TEFb活性而限制宿主基因转录延伸和表达,而为病毒自身蛋白转录和表达提供便利。如在单纯疱疹病毒感染早期,病毒编码的即刻早期蛋白ICP22(Immediate early protein 22)可以直接与CDK9相互作用并抑制CDK9酶活性,从而减缓转录延伸,以此关闭不利于病毒复制的宿主细胞基因的表达,破坏宿主的抗病毒免疫反应[52]。病毒除了通过直接作用于P- TEFb而调节病毒和宿主的基因转录延伸,还可以通过间接方式调节P- TEFb酶活性影响基因的转录延伸[53]。综上所述,多种病毒感染可以通过劫持P- TEFb,在感染的不同时期调节宿主基因的转录延伸而促进自身的复制,因此P- TEFb可能是一个理想的抗病毒药物作用靶点。
4 总结与展望
转录延伸调控是真核细胞内调节基因表达的一种精确调控(Precise regulation)机制,且在果蝇到哺乳动物细胞中均高度保守。在转录过程中,暂停PolⅡ在基因上预先占位有利于使PolⅡ延伸复合物在活化信号刺激下即时组装,从而使快速反应基因迅速激活表达。由于激活细胞基因表达的刺激信号可能是发育阶段或组织特异性信号,因此转录暂停PolⅡ的存在可能有助于该类基因的同步诱导表达,从而确保所有细胞以相同的速度做出反应。基因启动上有暂停PolⅡ的另一利好是可以保持该基因启动子区域处于活化和开放状态。鉴于暂停的延伸复合物可以直接改变染色体结构,因而暂停PolⅡ预先占位可以被视为一种重要的染色修饰标志[6]。与之相对应,目前的研究发现早期转录延伸调控主要在两大类PolⅡ暂停基因的表达中尤为重要。一类基因属于即刻早期应答基因,如热休克蛋白基因、初级反应炎症基因等[5,41,42]。这些基因在响应细胞外界刺激或信号后会迅速大量表达,以迅速应对外界环境的变化和放大信号。另一类基因是胚胎发育调控相关基因,如c- myc、c- fos等基因[3,4,45]。这类基因的表达在胚胎干细胞发育分化过程中需要受到时间上和空间上的精确调控,以准确决定细胞的命运,以保证机体的正常发育。除了启动子区域有PolⅡ暂停的基因受转录延伸调控之外,许多启动子区域无PolⅡ暂停的基因也可以被迅速诱导而大量表达,如Cxcl1等[46]。这类基因的表达也同样在转录延伸阶段受到精确调控,其调控可能主要发生在晚期转录延伸阶段,即高效转录延伸阶段。
转录延伸的调控不仅精确控制胚胎发育过程中细胞发育分化的命运,同时也在控制免疫细胞基因表达中发挥重要作用。不仅如此,多种病毒在感染时可以挟持或控制细胞的转录延伸调控因子而促进自身复制[53]。因此,PolⅡ转录延伸的调控与机体多种疾病如癌症、炎症等的发生密切相关,靶向转录延伸的药物开发将是治疗一些疾病的有效手段[54,55]。目前,已有多个针对P- TEFb亚基CDK9抑制剂的小分子如弗拉平度(Flavopiridol),作为新型抗癌药物处于临床研究阶段并显示了较好的抗肿瘤效果[54,55]。然而,虽然目前对于PolⅡ转录延伸调控的分子机制有了较深入的认识,但是仍然有许多问题尚待解决。如在早期转录延伸阶段,除了NELF和DSIF外,是否还有其他调节因子参与维持Pol的暂停?PolⅡ从暂停状态到高效转录状态的转变的机制也不完全清楚。P- TEFb在转录延伸调控中发挥着关键作用,但其与7SKsnRNP分离和再结合的机制仍有待于进一步研究,特别是P- TEFb作为一个通用转录调控因子是如何被选择性招募到特定的基因上并不清楚。另外,在晚期转录延伸阶段,细胞内其他调节因子如何与P- TEFb或SEC复合物相互作用共同精确调控基因表达也不清楚(见图1)。深入研究这些与PolⅡ转录延伸调控相关的重要科学问题,将有助于我们充分理解基因表达的精确调控机制,并为靶向转录延伸阶段的药物设计、筛选和疾病治疗提供理论基础。

图1 基因转录延伸的分子调控机制Fig.1 A schematic model of regulatory mechanisms of transcription elongationNote: After transcription initiation,PolⅡ transcribes a shortnascent RNA and pauses at about 20- 60 basesdownstream of transcription start sites of genes,which is a major restriction checkpoint of gene transcription.Paused PolⅡ is mediated by two key pause- inducing factors NEFL and DSIF at the proximal promoter region during early elongation stage.The free form of P- TEFb is sequestered by 7SK- RNP- HEXIM complex in an inactivate state.Upon activation,P- TEFb is released from sequestration into active form and phosphorylates the repressive NELF/DSIF complex and theserine 2 residue (S2) within PolⅡ CTD,leading to PolⅡ escape into productive elongation.P- TEFb can be recruited to the gene loci in several ways (1) recruited by activator proteins (e.g.NF- κ,c- Myc),(2) recruited by coactivator BRD4,(3) recruited by Mediator complex and/or Super Elongation Complex (SEC).SEC facilitates PolⅡ productive elongation in the gene body.
[1] Shandilya J,Roberts SG.The transcription cycle in eukaryotes:from productive initiation to RNA polymerase II recycling[J].Biochim Biophys Acta,2012,1819(5):391- 400.
[2] Guo J,Price DH.RNA polymerase II transcription elongation control[J].Chem Rev,2013,113(11):8583- 8603.
[3] Krumm A,Meulia T,Brunvand M,etal.The block to transcriptional elongation within the human c- myc gene is determined in the promoter- proximal region[J].Genes Dev,1992,6(11):2201- 2213.
[4] Fort P,Rech J,Vie A,etal.Regulation of c- fos gene expression in hamster fibroblasts:initiation and elongation of transcription and mRNA degradation[J].Nucleic Acids Res,1987,15(14):5657- 5667.
[5] Gilmour DS,Lis JT.RNA polymerase II interacts with the promoter region of the noninduced hsp70 gene in Drosophila melanogaster cells[J].Mol Cell Biol,1986,6(11):3984- 3989.
[6] Smith E,Shilatifard A.Transcriptional elongation checkpoint control in development and disease[J].Genes Dev,2013,27(10):1079- 1088.
[7] Kwak H,Lis JT.Control of transcriptional elongation[J].Annu Rev Genet,2013,47:483- 508.
[8] Zhou Q,Li T,Price DH.RNA polymerase II elongation control[J].Annu Rev Biochem,2012,81:119- 143.
[9] Adelman K,Lis JT.Promoter- proximal pausing of RNA polymerase II:emerging roles in metazoans[J].Nat Rev Genet,2012,13(10):720- 731.
[10] Yamaguchi Y,Takaqi T,Wada T,etal.NELF,a multisubunit complex containing RD,cooperates with DSIF to repress RNA polymerase II elongation[J].Cell,1999,97(1):41- 51.
[11] Wada T,Takaqi T,Yamaquchi Y,etal.DSIF,a novel transcription elongation factor that regulates RNA polymerase II processivity,is composed of human Spt4 and Spt5 homologs[J].Genes Dev,1998,12(3):343- 356.
[12] Yamaguchi Y,Inukai N,Narita T,etal.Evidence that negative elongation factor represses transcription elongation through binding to a DRB sensitivity- inducing factor/RNA polymerase II complex and RNA[J].Mol Cell Biol,2002,22(9):2918- 2927.
[13] Ni Z,Saunders A,Fuda NJ,etal.P- TEFb is critical for the maturation of RNA polymerase II into productive elongation in vivo[J].Mol Cell Biol,2008,28(3):1161- 1170.
[14] Yu M,Yang W,Ni T,etal.RNA polymerase II- associated factor 1 regulates the release and phosphorylation of paused RNA polymerase II[J].Science,2015,350(6266):1383- 1386.
[15] Price DH.P- TEFb,a cyclin- dependent kinase controlling elongation by RNA polymerase II[J].Mol Cell Biol,2000,20(8):2629- 2634.
[16] Heidemann M,Hintermair C,Vob K,etal.Dynamic phosphorylation patterns of RNA polymerase II CTD during transcription[J].Biochim Biophys Acta,2013,1829(1):55- 62.
[17] Peterlin BM,Price DH.Controlling the elongation phase of transcription with P- TEFb[J].Mol Cell,2006,23(3):297- 305.
[18] Kanazawa S,Souek L,Evan G,etal.c- Myc recruits P- TEFb for transcription,cellular proliferation and apoptosis[J].Oncogene,2003,22(36):5707- 5711.
[19] Eberhardy SR,Farnham J.Myc recruits P- TEFb to mediate the final step in the transcriptional activation of the cad promoter[J].J Biol Chem,2002,277(42):40156- 40162.
[20] Barboric M,Nissen RM,Kanazawa S,etal.NF- kappaB binds P- TEFb to stimulate transcriptional elongation by RNA polymerase II[J].Mol Cell,2001,8(2):327- 337.
[21] Weydert C,De Rijck J, Christ F,etal.Targeting virus- host interactions of HIV replication[J].Curr Top Med Chem,2016,16(10):1167- 1190.
[22] Yang Z,Yik JH,Chen R,etal.Recruitment of P- TEFb for stimulation of transcriptional elongation by the bromodomain protein Brd4[J].Mol Cell,2005,19(4):535- 545.
[23] Jang MK,Mochizuki K,Zhou M,etal.The bromodomain protein Brd4 is a positive regulatory component of P- TEFb and stimulates RNA polymerase II- dependent transcription[J].Mol Cell,2005,19(4):523- 534.
[24] McNamara RP,Reeder JE,McMillan EA,etal.KAP1 Recruitment of the 7SK snRNP complex to promoters enables transcription elongation by RNA polymerase II[J].Mol Cell,2016,61(1):39- 53.
[25] Takahashi H,Parmely TJ,Sato S,etal.Human mediator subunit MED26 functions as a docking site for transcription elongation factors[J].Cell,2011,146(1):92- 104.
[26] Duan DR,Paues A,Burges S,etal.Inhibition of transcription elongation by the VHL tumor suppressor protein[J].Science,1995,269(5229):1402- 1406.
[27] Aso T,Lane WS,Conaway TW,etal.Elongin (SIII):a multisubunit regulator of elongation by RNA polymerase II[J].Science,1995,269(5229):1439- 1443.
[28] Shilatifard A,Lane WS,Jackso KW,etal.An RNA polymerase II elongation factor encoded by the human ELL gene[J].Science,1996,271(5257):1873- 1876.
[29] Luo ZC,Lin C,latifard AS.The super elongation complex (SEC) family in transcriptional control[J].Nat Rev Mol Cell Biol,2012,13(9):543- 547.
[30] Lin C,Smith ER,Takahashi H,etal.AFF4,a component of the ELL/P- TEFb elongation complex and a shared subunit of MLL chimeras,can link transcription elongation to leukemia[J].Mol Cell,2010,37(3):429- 437.
[31] Luo Z,Lin C,Guest E,etal.The super elongation complex family of RNA polymerase II elongation factors:gene target specificity and transcriptional output[J].Mol Cell Biol,2012,32(13):2608- 2617.
[32] Orphanides G,LeRog G,Chang CH,etal.FACT,a factor that facilitates transcript elongation through nucleosomes[J].Cell,1998,92(1):105- 116.
[33] Saunders A,Werner J,Andralis ED,etal.Tracking FACT and the RNA polymerase II elongation complex through chromatin in vivo[J].Science,2003,301(5636):1094- 1096.
[34] Petesch SJ,Lis JT.Overcoming the nucleosome barrier during transcript elongation[J].Trends Genet,2012,28(6):285- 294.
[35] Williams LH,Fromm G,Gokeg NG,etal.Pausing of RNA polymerase II regulates mammalian developmental potential through control of signaling networks[J].Mol Cell,2015,58(2):311- 322.
[36] Zeitlinger J,Stark A,Kellins M,etal.RNA polymerase stalling at developmental control genes in the Drosophila melanogaster embryo[J].Nat Genet,2007,39(12):1512- 1516.
[37] Yao J,Ardehali MB,Fecko CJ,etal.Intranuclear distribution and local dynamics of RNA polymerase II during transcription activation[J].Mol Cell,2007,28(6):978- 990.
[38] Muse GW,Gilchrist DA,Nechaev S,etal.RNA polymerase is poised for activation across the genome[J].Nat Genet,2007,39(12):1507- 1511.
[39] Coudé MM,Braun T,Berrou J,etal.BET inhibitor OTX015 targets BRD2 and BRD4 and decreases c- MYC in acute leukemia cells[J].Oncotarget,2015,6(19):17698- 17712.
[40] Smale ST.Selective transcription in response to an inflammatory stimulus[J].Cell,2010,140(6):833- 844.
[41] Hargreaves DC,Horng T,Medzhitov R.Control of inducible gene expression by signal- dependent transcriptional elongation[J].Cell,2009,138(1):129- 145.
[42] Adelman K,Kennedy WA,Nechaev S,etal.Immediate mediators of the inflammatory response are poised for gene activation through RNA polymerase II stalling[J].Proc Natl Acad Sci U S A,2009,106(43):18207- 18212.
[43] Gupte R,Muse GW,Chinenov Y,etal.Glucocorticoid receptor represses proinflammatory genes at distinct steps of the transcription cycle[J].Proc Natl Acad Sci U S A,2013,110(36):14616- 14621.
[44] Rogatsky I,Adelman K.Preparing the first responders:building the inflammatory transcriptome from the ground up[J].Mol Cell,2014,54(2):245- 254.
[45] Lin C,Garrett AS,De Kumar B,etal.Dynamic transcriptional events in embryonic stem cells mediated by the super elongation complex (SEC)[J].Genes Dev,2011,25(14):1486- 1498.
[46] Shang Y,Copp M,He T,etal.The transcriptional repressor Hes1 attenuates inflammation by regulating transcription elongation[J].Nat Immunol,2016,17(8):930- 937.
[47] Sobhian B,Laguette N,Yatim A,etal.HIV- 1 Tat assembles a multifunctional transcription elongation complex and stably associates with the 7SK snRN[J].Mol Cell,2010,38(3):439- 451.
[48] He N,Liu M,Hsu J,etal.HIV- 1 Tat and host AFF4 recruit two transcription elongation factors into a bifunctional complex for coordinated activation of HIV- 1 transcription[J].Mol Cell,2010,38(3):428- 438.
[49] Gu J,Babayeva ND,Suwa Y,etal.Crystal structure of HIV- 1 Tat complexed with human P- TEFb and AFF4[J].Cell Cycle,2014,13(11):1788- 1797.
[50] Zhang J,Li G,Ye X.Cyclin T1/CDK9 interacts with influenza A virus polymerase and facilitates its association with cellular RNA polymerase II[J].J Virol,2010,84(24):12619- 12627.
[51] Li LL,Hu ST,Wang SH,etal.Positive transcription elongation factor b (P- TEFb) contributes to dengue virus- stimulated induction of interleukin- 8 (IL- 8)[J].Cell Microbiol,2010,12(11):1589- 1603.
[52] Zaborowska J,Baumli S,Laitem C,etal.Herpes Simplex Virus 1 (HSV- 1) ICP22 protein directly interacts with cyclin- dependent kinase (CDK)9 to inhibit RNA polymerase II transcription elongation[J].PLoS One,2014,9(9):e107654.
[53] Zaborowska J,Isa NF,Murphy S.P- TEFb goes viral[J].Bioessays,2016,38(Suppl 1):S75- S85.
[54] Morales F,Giordano A.Overview of CDK9 as a target in cancer research[J].Cell Cycle,2016,15(4):519- 527.
[55] Karp JE,Passaniti A,Gojo I,etal.Phase I and pharmacokinetic study of flavopiridol followed by 1- beta- D- arabinofur- anosylcy- tosine and mitoxantrone in relapsed and refractory adult acute leukemias[J].Clin Cancer Res,2005,11(23):8403- 8412.
[收稿2017- 01- 22]
(编辑 倪 鹏)
欢迎订阅和投稿《中国免疫学杂志》
Regulation of gene expression via control of transcription elongation during immune responses
SHANG Ying- Li,HU Xiao- Yu.
Institute for Immunology and School of Medicine,Tsinghua University,Beijing 100084,China
Transcription is a multi- stage process that coordinates several steps during the transcription cycle including pre- initiation,initiation and elongation.Recent advances by genome- wide study suggest that control of transcription elongation is a critical step for precise regulation of gene expression across species from Drosophila to mammals.Here we review the molecular mechanisms of how transcription elongation of RNA polymeraseⅡ(PolⅡ) is modulated by the major pausing factors- NELF,DSIF and the positive elongation factor P- TEFb,which is the key player in pause release.We also discuss the potential implications of regulation of transcription elongation in pathogenesis of cancer,inflammation and virus infection.
Gene expression;Transcription elongation;RNA polymerase Ⅱ;P- TEFb;NELF
10.3969/j.issn.1000- 484X.2017.08.001
①本文受国家重点基础研究发展计划(973)(No.2015CB943200)、国家自然科学基金优秀青年科学基金项目(81422019)、国家自然科学基金面上项目(81571580)、国家自然科学基金中英人才基金(81661130161)和国家自然科学基金重大研究计划培育项目(91642115)资助。
R392
A
1000- 484X(2017)08- 1121- 08

