白藜芦醇对前列腺炎大鼠模型前列腺组织中细胞因子的干预研究*
钱 余钱小强贡东卫周恩谱齐 隽卢慕峻
1. 上海市控江医院泌尿外科(上海 200093 );2. 上海交通大学附属瑞金医院泌尿外科;3. 上海交通大学附属新华医院泌尿外科;4. 上海交通大学附属仁济医院泌尿外科,上海仁济医院男科研究所
白藜芦醇对前列腺炎大鼠模型前列腺组织中细胞因子的干预研究*
钱 余1钱小强2贡东卫1周恩谱1齐 隽3卢慕峻4**
1. 上海市控江医院泌尿外科(上海 200093 );2. 上海交通大学附属瑞金医院泌尿外科;3. 上海交通大学附属新华医院泌尿外科;4. 上海交通大学附属仁济医院泌尿外科,上海仁济医院男科研究所
目的探讨白藜芦醇对慢性前列腺炎大鼠模型的治疗机制。方法50只体质量(150±15)g的雄性SD大鼠随机分为5组:阴性对照组和模型假性对照组、白藜芦醇低、中、高剂量模型组。模型组分别在第0、30天于大鼠皮下注射大鼠前列腺蛋白提纯液和弗氏完全佐剂的混悬液,同时腹腔注射百白破疫苗造模;阴性对照组以生理盐水注射参照。第45天开始,白藜芦醇低、中和高剂量模型组每日按照白藜芦醇4 mg/kg、20 mg/kg、40mg/kg灌胃给药,阴性对照组和模型假性对照组以生理盐水灌胃。第55天后处死大鼠取左侧前列腺组织,10%甲醛溶液固定,做石蜡包埋切片,HE染色,镜下观察大鼠前列腺病理形态的改变。右侧前列腺打成组织匀浆,免疫组化ELISA法检测白介素-1β(IL-1β)、IL-6、IL-8、IL-10和肿瘤坏死因子(TNF-α)的含量。计量数据用(x±s),统计分析用t检验。结果白藜芦醇高、中剂量组与模型假性对照组比较,前列腺间质中炎细胞数量显著降低,成纤维细胞数量轻度下降,腺体数量与腺腔面积明显升高;前列腺匀浆中IL -1β、IL-8、TNF-α明显降低,IL-6、IL-10含量显著上升(P<0.01)。结论白藜芦醇对慢性免疫性前列腺炎大鼠模型的治疗是通过降低前列腺内促炎性细胞因子IL-1ß、IL-8、TNF-α,提高抑炎性细胞因子IL-6、1L-10来减轻炎细胞浸润,抑制纤维组织增生完成。
前列腺炎; 大鼠; 白黎芦醇; 细胞因子类
慢性前列腺炎(chronic prostatitis,CP)是男性科的常见病和多发病,病程往往迁延难愈,严重影响患者生活质量[1-4]。临床病理提示慢性前列腺炎患者前列腺组织内炎症的发生、发展与细胞因子的异常表达密切相关,其病理变化由多种细胞因子介导:一部分细胞因子导致并促进炎症发展;另一部分又抑制炎症的发展[5-7]。白藜芦醇具有抗炎活性成分[8-11],本实验采用免疫佐剂法建立大鼠前列腺炎动物模型[12],通过白藜芦醇灌胃干预CP大鼠模型,观察前列腺组织病理和细胞因子变化,以探讨白藜芦醇治疗慢性前列腺炎的作用机制。
材料与方法
一、一般材料
(一)动物
雄性SD大鼠,2月龄80只,体质量(150±15)g;4月龄10只,体质量(400±20)g,购于上海斯莱克实验动物有限责任公司,饲养于上海新华医院动物房独立笼盒系统,室温20~25℃,相对湿度40%~60%,光照和黑暗每12h改变1次,标准饲料,自由饮水、摄食,常规饲养观察1周无异常后进行实验,实验经过动物保护和使用委员会批准。
(二)药品和试剂
0.5%TritonX-100的生理盐水溶液、弗氏完全佐剂(Freund' s complete adjuvant,FCA)(美国Sigma公司)。0.1mol/L pH 7.4的PBS缓冲液(上海生工生物工程有限公司)。百白破疫苗(pertussisdiphtheria-tetanus,PDT)(上海市虹口区卫生防疫中心提供)。白藜芦醇(杭州瑞树生化有限公司,29700-22-9)。大鼠白介素-1β(IL-1β)、IL-6、IL-8、IL-10及TNF-α ELISA试剂盒(均购自上海酶远生物科技有限公司)。
(三)仪器
AT 2501/10万电子天平(瑞士MELTTER);玻璃匀浆器,CR21GII超高速冷冻离心机(日本日立公司),Nanodrop2000微量紫外分光光度计(美国Thermo Scientific公司),EGll60组织包埋机、RM2123组织切片机、CA5030组织染色机(德国Leica公司),CHK型光学显微镜(Olympus公司)。BI-2 000图形图像分析系统(成都泰盟);Model-680酶标仪(BIO-RAD Co,USA)。
二、方 法
(一)大鼠前列腺蛋白提纯液的制作
5只体质量(400±20)g的雄性SD大鼠脱颈椎处死,消毒后放在超净台上,剪开大鼠腹部皮肤和肌肉,提起膀胱,暴露前列腺,剪下且剪碎前列腺组织,放在玻璃匀浆器中匀浆,保持低温(4℃),把匀浆充分的前列腺组织用吸管吸入离心管中,高速离心机15 000r/min离心30 min,用吸管吸去上层脂肪组织,再吸取上清液共3 mL,放入冷冻管保存备用(-20℃),取余下的上清液0.2 mL,等比稀释后依次放入96孔板,在酶标仪上读取OD值,并按照拟合的标准曲线读取上清液的浓度。从标准曲线上查出OD值对应的浓度,把蛋白提纯液稀释成60 g/L的浓度。
(二)造模与分组
动物分组及自体免疫性前列腺炎大鼠模型造模:50只体质量(150±15)g的雄性SD大鼠随机分为5组,即阴性对照组,模型假性对照组,白藜芦醇低、中和高剂量模型组,每组10只。除阴性对照组外,其他各组分别于第0、30天,在大鼠2只脚掌、腹股沟和颈部4处皮下注入大鼠前列腺蛋白提纯液与弗氏完全佐剂(FCA)等比混匀的混悬液1mL,剂量为:脚掌0.1mL×2只,腹股沟0.4mL,颈部0.4 mL,同时腹腔注射百白破疫苗0.5 mL,阴性对照组在相同的时间和部位注射相同体积的生理盐水。
(三)给药方法
阴性对照组和模型假性对照组给予生理盐水;白藜芦醇低、中、高剂量组给予不同浓度白藜芦醇(4、20、40mg/kg)。各组给药体积均为10 mL/kg,灌胃给药1次/d,连续10 d。第45天开始每日按照高剂量组40 mg/kg、中剂量组20 mg/kg和低剂量组4mg/kg白藜芦醇灌胃,阴性对照组和模型假性对照组生理盐水给药,55d后处死大鼠,剖腹,充分暴露膀胱两侧前列腺腺体,肉眼观察其外观形态;取左侧前列腺组织,10%甲醛溶液固定,做石蜡切片,HE染色及免疫组化检测。
(四)观察及检测指标
1. HE染色后光学显微镜下观察大鼠前列腺组织病理形态、炎细胞浸润级别:灌胃10d后处死大鼠,摘取前列腺,左侧叶HE染色后,镜下观察前列腺腺腔内分泌物、腺上皮情况和间质内炎细胞浸润、纤维组织增生以及腺体和腺腔的形态学变化情况。同时结合计算机图形图像分析系统,在150倍光镜下,随机选取5个视野测量前列腺间质内细胞总数,并计数炎细胞、成纤维细胞与腺体数量以及腺腔的面积。
2. 大鼠前列腺组织内IL-1β、IL-6、IL-8、IL-10及TNF-α含量检测:取前列腺右侧叶,冰浴条件下匀浆,离心后取上清液用ELISA法测定大鼠前列腺组织中细胞因子含量。
(五)统计学处理
结 果
CP大鼠前列腺组织病理改变
一、
光镜观察可见阴性对照组前列腺间质内偶见少量炎细胞浸润和成纤维细胞,腺泡上皮多为单层柱状或立方,腺腔内有大量深粉染色的分泌物。模型假性对照组前列腺间质内可见大量炎细胞浸润,纤维组织增生明显;部分腺腔萎缩、消失,腺腔内分泌物显著减少(见图1)。白藜芦醇低剂量组亦可见不同程度的上述改变,但改变程度较少。白藜芦醇高剂量组前列腺间质内炎细胞浸润明显减少,纤维组织增生减轻,腺泡上皮多恢复正常,腺腔内分泌物明显增多(见图2)。白藜芦醇中剂量组较模型组也有很大程度的改善,但改变程度不如白藜芦醇高剂量组明显。
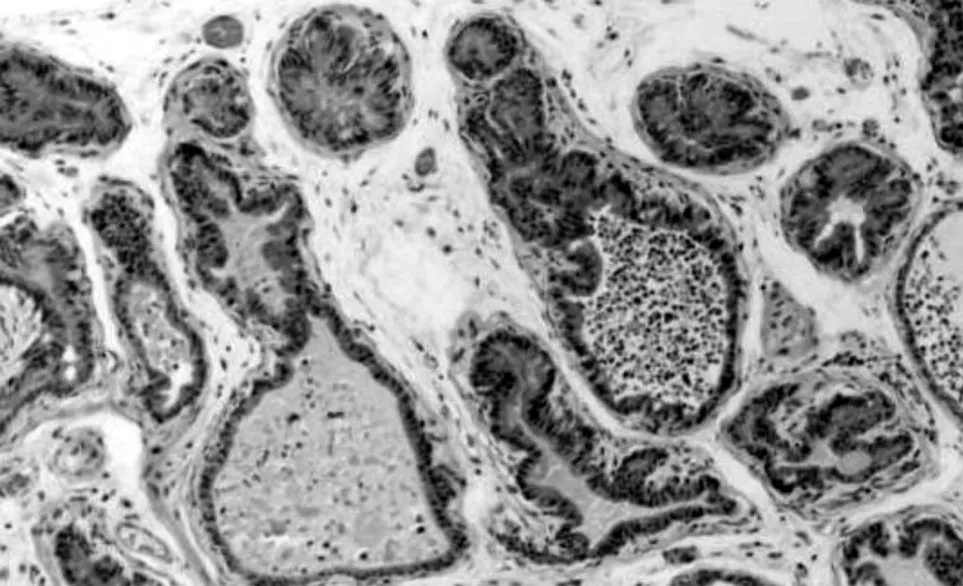
图1 治疗前模型假性对照组中前列腺组织的病理改变(HE×150)
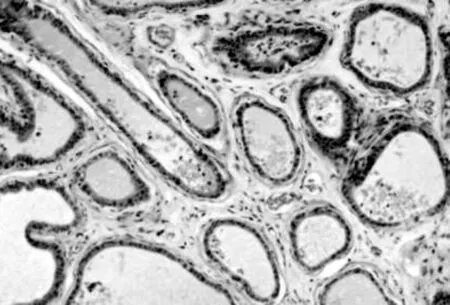
图2 经白藜芦醇灌胃治疗后前列腺组织病理变化(HE×150)
二、CP大鼠前列腺组织中各细胞因子的含量
模型假性对照组大鼠前列腺内IL -1β、IL-8、TNF-α含量均显著高于阴性对照组(P<0.01),而IL-6、IL-10含量与阴性对照组比较虽有上升趋势,但无统计学意义(P>0.05),表明在CP大鼠前列腺组织中,炎性细胞因子水平上升,而抑炎细胞因子水平相对下降。与模型假性对照组相比,白藜芦醇中、高剂量组IL-1β、IL-8、TNF-α炎性细胞因子均明显降低(P<0.01),而抑炎细胞因子IL-6、IL-10显著升高(P<0.01);白藜芦醇低剂量组IL-6升高,差异有统计学意义;其余炎性细胞因子水平变化无统计学意义(P>0.05),见表1。
讨 论
慢性非细菌性前列腺炎因炎症分泌出的炎症介质可以引起前列腺的生理功能改变和病理生理过程的形成,其前列腺体组织表现为萎缩或被破坏,腺体数量减少[13]。本实验通过免疫佐剂法制成前列腺炎大鼠模型与阴性对照组比较具有上述类似的特点:前列腺腺体部分上皮变性、坏死脱落,前列腺管腔萎缩并被中性粒细胞及巨嗜细胞的分泌物所充盈(见图1)。
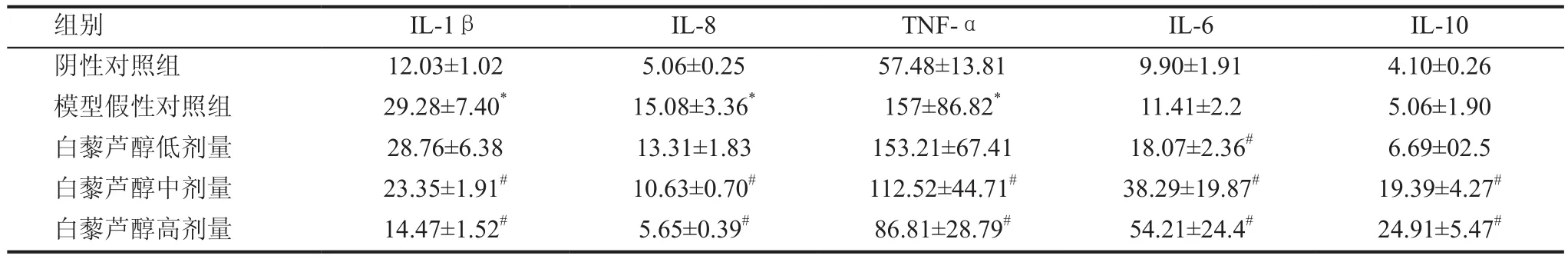
表1 前列腺组织匀桨中IL-1β、IL-8、TNF-α、IL-6及IL-10含量(pg/mL)(x±s)
本实验通过检测大鼠前列腺组织大鼠白介素-1β(IL-1β)、IL-6、IL-8、IL-10及TNF-α含量,发现模型假性对照组中IL -1β、IL-8、TNF-α含量均显著高于阴性对照组(P<0.01),而IL-6、IL-10含量与阴性对照组比较虽有上升趋势,但无统计学意义(P>0.05),表明在CP大鼠前列腺组织中,炎性细因子水平上升,而抑炎细胞因子水平相对下降,推测其机制如下:IL-1β、IL-8、TNF-α是介导炎症的主要细胞因子,目前实验研究证实慢性前列腺炎的发生发展与这3种炎性细胞因子密切相关[14,15]。在炎症时IL-1β可增加黏附分子的合成和表达。黏附分子为免疫球蛋白类黏附分子,即白细胞黏附分子1(ELAM-1)、细胞间黏附分子1(ICAM-1)和血管黏附分子1(VCAM-1)的表达。高表达黏附分子可促进炎细胞的黏着,为炎细胞的渗出创造条件。炎细胞渗出后,在趋化因子的作用下聚集于损伤部位,从而在机体防御反应中发挥吞噬作用和免疫作用,同时也对局部组织造成损伤和破坏,造成或加重炎症反应。另一方面,1L-1β还可诱导其他细胞因子如IL-8、TNF等的分泌,从而增强其介导炎症的作用。IL-8启动胸腺细胞和激活的T细胞的增殖和分化,反过来激活的T细胞又可产生IL-8,且与IL-l和TNF-α有协同作用;IL-8还可上调ICAM-1的表达。IL-8还促使中性粒细胞脱颗粒释放溶酶体,加剧局部炎症细胞浸润,促使炎症形成,从而导致炎症性比非炎症性升高显著。TNF-α与其受体结合后,启动激活多条通路,通过激活的转录因子,使单核巨噬细胞分泌IL-1β、IL-8、TNF-α,出现细胞因子级联反应(cytokine cascade)。TNF-α不仅可作为宿主防御、免疫以及内环境稳定等生理过程的介质,还是感染、炎症及损伤的病理因子。TNF-α刺激内皮细胞合成产生E-选择素并在细胞表达,介导与嗜中性粒细胞、单核细胞和某些淋巴细胞的相应受体结合,从而发生黏附;上调黏附分子的表达,增强炎细胞黏附。TNF-α同时可上调趋化因子如IL-8的表达。TNF-α通过以上诸多生物学作用促进炎症发生发展;同时通过自分泌方式作用于巨噬细胞本身而释放炎症介质(如白三烯,前列腺素等),促进炎症反应。IL-6和IL-10是二种强大的抑制炎症因子,可抑制巨噬细胞、单核细胞和T细胞的激活作用和效应作用,尤其对巨噬细胞抑制作用最为明显。从而导致了一系列炎症反应性细胞因子产生的下降,如IL-1β、IL-8、TNF-α、粒细胞-巨噬细胞集落刺激因子、与炎症反应相关的酶如环氧化酶2以及一些化学因子等。这些反应性因子释放的减少,就缩短了炎症反应的过程从而直接或间接抑制炎症反应。另外IL-10直接或间接抑制T、B细胞的分化和增生而减少炎性因子产生[16,6]。
本实验通过白藜芦醇溶液灌胃治疗前列腺炎大鼠10d,发现中、高剂量组前列腺间质浸润的炎细胞数明显减少,而腺腔数量和腺腔面积显著上升,成纤维细胞含量变化不明显可能与治疗时间短有关(见图2),说明中、高剂量白藜芦醇具有抗慢性前列腺炎作用。进一步检测其IL-1β、IL-8、TNF-α炎性细胞因子均明显降低(P<0.01),而抑炎细胞因子IL-6、IL-10显著升高(P<0.01);推测其可能作用机制是:提高了前列腺组织内IL-6、IL-10含量,抑制T、B细胞的增殖以及巨噬细胞活性,使IL-1β、IL-8、TNF-α等炎性细胞因子产生的下降,影响其与受体结合和受体后信号转导,下调内皮细胞黏附分子和趋化因子的表达和分泌,减弱炎细胞的黏附、渗出和浸润,从而减轻炎症反应,发挥了抗炎作用。
综上所述,炎症细胞因子IL-1β、IL-8及TNF-α组成复杂的细胞因子网络,相互协同,在介导炎症时发挥重要作用,它们与特异性受体结合后,通过不同的信号转导途径发挥生物学效应,加重炎症反应。IL-6、IL-10通过抑制巨噬细胞、T细胞、B细胞的激活作用和效应作用,阻止炎性细胞因子的分泌,从而直接或间接抑制炎症反应。而白藜芦醇可提高慢性免疫性前列腺炎大鼠前列腺内抑炎细胞因子IL-6、IL-10含量,降低炎性细胞因子1L-1β、IL-8、TNF-α的含量,减轻炎细胞浸润,成纤维细胞增生,恢复腺体间质与腺腔正常状态,说明白藜芦醇对慢性前列腺炎大鼠有治疗作用。
1 Wenningcr K, Heiman JR, Rothman I, et al. Sickness impact of chronic nonbacterial prostatitis and its correlates. J Urol 1996; 155(3): 965-968
2 周峥嵘, 梁朝朝. 慢性前列腺炎临床诊断的现况与研究进展. 国际泌尿系统杂志 2013; 33(6): 844-848
3 张斌斌, 白安胜. 慢性前列腺炎的发病机制及治疗进展.疑难病杂志 2014; 13(3): 326-329
4 朱勇, 孙红君, 刘正建, 等. 难治性慢性前列腺炎的治疗进展. 中国男科学杂志 2016; 30(5): 70-72
5 He L, WangY, Long Z, et al. Clinical signifcance of IL-2, IL-10, and TNF-ain prostatic secretion of patiens with chronic prostatitis. Urology 2010; 75(3): 654-657
6 Sugimoto M, Oka M, Tsunemori H, et al. Effect of aphytotherapeutic agent, Eviprostat, on prostatic and urinary cytokines/chemokines in a rat model of nonbacterial prostatitis. Prostate 2011; 71(4): 438-444
7 Zhang ZY, Schluesener HJ. HDAC inhibitor MS-275 attenuates the infammatory reaction in rat experimental autoimmune prostatitis. Prostate 2012; 72(1): 90-99
8 Pace-Asciak CR, Hahn S, Diamandis EP, et a1. The red wine phenolics trans-resveratrol and quercetin block human platelet aggregation and eicosanoid synthesis: implications for protection against coronary heart disease. Clin Chim Acta 1995; 235(2): 207-219
9 Kerry NL, Abbery M. Red wine fractionated phenolic compounds prepared from red wine inhibit low density lipoprotein oxidation in vitro. Atherosclerosis 1997; 135(1): 93-102
10 刘娅, 王光慈. 白藜芦醇生理活性作用研究进展. 中国食品添加剂 2002; (6): 19-21, 11
11 韩晶晶, 刘炜, 毕玉平. 白藜芦醇的研究进展. 生物工程学报 2008; 24(11): 1851-1859
12 王先进, 钟山, 张存明, 等. 大鼠慢性非细菌性前列腺炎模型的建立及病理组织学特征. 中华泌尿外科杂志2012; 33(4): 282-287
13 张益明, 范武林, 林国太, 等. 慢性前列腺炎在前列腺增生症发病与进展中的作用探讨. 国际泌尿系统杂志2016; 36(4): 542-544
14 Nadler RB. Koch AE. Calhoun EA, et al. IL-l beta and TNF-al-pha in prostatic secretions are indicators in the evaluation of men with chronic prostatitis. J Urol 2000; 164(1): 214-218
15 Zhang ZY, Schluesener HJ. HDAC inhibitor MS-275 attenuates the infammatory reaction in rat experimental autoimmune prostatitis. Prostate 2012; 72(1): 90-99
16 He L, Wang Y, Long Z, et al. Clinical signifcance of IL-2, IL-10, and TNF-alpha prostatic secretion of patients with chronic prostatitis. Urology 2010; 75(3): 654-657
(2017-01-05收稿)
Effects of resveratrol on cytokines in prostatic tissue of chronic prostatitis rats*
Qian Yu1, Qian Xiaoqiang2, Gong Dongwei1, Zhou Enpu1, Qi Jun3, Lu Mujun4**
1. Department of Urology, Kongjiang Hospital of Shanghai, Shanghai 200093, China; 2. Department of Urology, Ruijin Hospital,Shanghai Jiaotong University Medical School; 3. Department of Urology, Xinhua Hospital ,Shanghai Jiaotong University Medical School; 4. Department of Urology, Renji Hospital,Shanghai Jiaotong University Medical School, Shanghai 200127, China Corresponding author: Lu Mujun, E-mail: lumujun@163.com
ObjectiveTo investigate the mechanism of resveratrol in treatment of chronic prostatitis rats.MethodsTotal of 50 rats (150±15g) were randomly divided into negative control group, model control group, and resveratrol (low,middle, high) dose groups. The rats in model control group and resveratrol dose groups were immunized with 1.0ml PTHS(20mg/mL) emulsified by isopyknic Freund's complete adjuvant(FCA) intradermally in the multiple points, and simultaneously immunized with 0.5mL pertussis diphtheria-tetanus (PDT) vaccine intraperitoneally on 0 and 30th day. The rats in the control group were injected with equivalent normal saline in the same way. From the 45th day, the rats in resveratrol(low,middle,high) dose groups were given by gavage once a day according to the daily resveratrol 4 mg/kg, 20 mg/kg, 40 mg/kg lavage, the rats in negative control group and model control group with normal saline lavage. On 55th day the rats were killed and their prostatic tissue was taken for histopathological analysis. The number of infammatorycell, fbroblasts, glandular organ, and glangilar cavity area were analyzed, and their morphology changes were observed. The levels of interleukin-1ß (IL-1ß), IL-6, IL-8, IL-10 and tumor necrosis factor-α (TNF-α) in prostatic tissues were detected by enzyme linked immunosorbent assay (ELISA). Results Compared with that of model control group, the number infammatory cells and fbroblasts in resveratrol (middle, high) groups were decreased, whereas the quantity of glandular organ and area of glangula cavity in these groups were increased. Meanwhile, the levels of IL-1ß, IL-8 and TNF-α in resveratrol(middle, high) dose group obviously were decreased (P<0.0l), and the levels of IL-6 and IL-10 in these groups were remarkably increased (P<0.0l).ConclusionThe principal mechanism of resveratrol in treatment of chronic prostatitis may be related to both the decrease of proinfammatory cytokines levels (IL-1ß, IL-8 and TNF-α), and the increase of the anti-infammatory cytokine levels (IL-6, IL-10). These changes result in decrease of infltrated leucocytes and suppression of fbrous tissue hyperplasia
prostatitis; rats; resveratrol; cytokines
10.3969/j.issn.1008-0848.2017.03.003
R 697.33
资助:上海市杨浦区科委、卫计委课题(YP15M03)
**通讯作者,E-mail: lumujun@163.com

