以双侧血气胸首发的肺原始神经外胚层肿瘤一例
金亮 闫天生 马少华 梁正 宋金涛 王通 贺未 白洁
·病例报告·
以双侧血气胸首发的肺原始神经外胚层肿瘤一例
金亮 闫天生 马少华 梁正 宋金涛 王通 贺未 白洁
肺; 肿瘤; 神经外胚层瘤
原始神经外胚层肿瘤(primitive neuroectodermal tumors, PNET)由Hart于1973年首次描述报道,是一种向神经方向分化的小圆形细胞恶性肿瘤,起源于自主神经系统外的神经嵴胚胎残余,具有多方向分化能力,可发生在中枢神经系统、交感神经系统和外周神经[1]。作为一种罕见肿瘤,该病的临床表现和影像检查缺乏特异性,容易漏诊,只能通过病理学诊断,尚无明确治疗方案,且预后极差,生存期短。我院2015年11月10日收治1例女性患者,以双侧血气胸为首发表现,国内外尚无报道。现结合国内外文献复习,以提高对此肿瘤的认识及诊疗水平。
病历资料
患者女性,34岁,祖籍山东济南,建材营销商,长期接触大理石等石材,平素体健,无肿瘤家族史,二胎剖宫产后11个月,女儿9岁,儿子11个月。因咳嗽伴双侧血气胸复发1个月入急诊,近1个月内3次发作双侧气胸,左侧较重,在左侧共放置3次胸腔闭式引流管,其中2次气胸与月经周期有关。查体:心率145次/min,血压117/89 mmHg,全身浅表淋巴结无肿大,双侧呼吸音减低,双侧语音震颤减弱,双下肺叩诊浊音。双肺未闻及干湿啰音及胸膜摩擦音,余查体未见异常。胸部正侧位X线示:双侧液气胸,右侧较重,压缩70%,左侧压缩20%,见图1,血红蛋白153 g/L。行右侧胸腔闭式引流,引出暗红色血性液400 ml。初步怀疑月经相关性气胸。
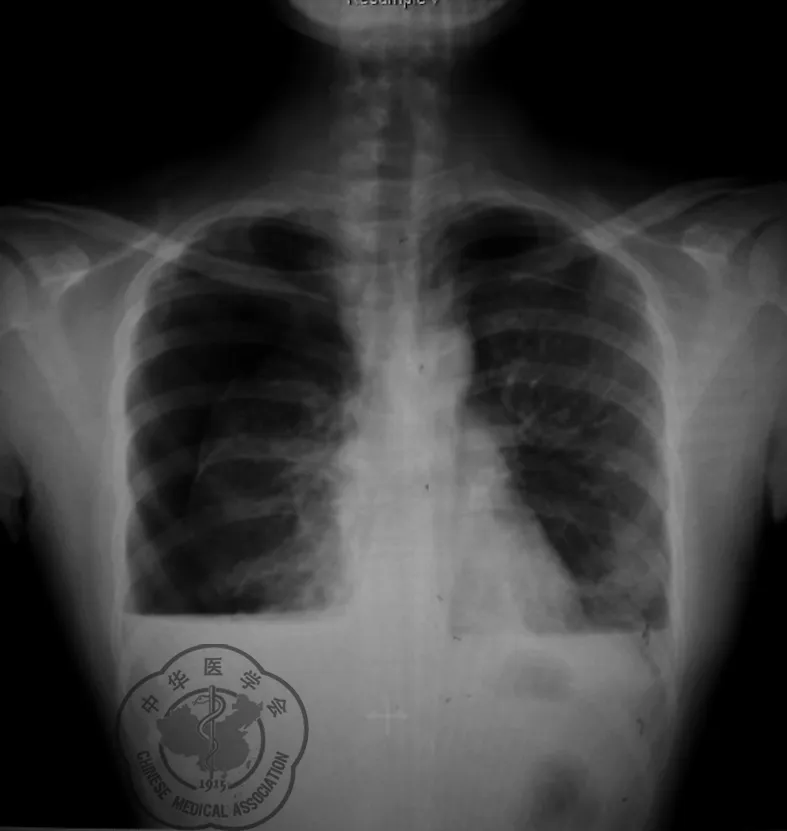
图1 术前胸部正侧位X线片
急诊行全麻双腔气管插管下胸腔镜手术治疗,先后行左侧及右侧胸腔探查,术中可见双肺脏层胸膜表面,散在分布糜烂样小结节,伴广泛点片状出血,切除部分结节送病理,电灼部分结节至萎陷,见图2。行胸膜摩擦固定,左右侧胸腔分别置前后两根多孔胸腔引流管。术中胸腔共出血500 ml,左侧400 ml,右侧100 ml。

图2 术中散在分布糜烂样小结节,伴广泛点片状出血
病理检测提示,肺组织中见多灶肿瘤,可疑原始神经外胚层肿瘤(PNET),见图3。免疫组化CD10(-),CK20(-),CK(7),ER(部分细胞+),Ki-67(10%+),Napsin A(-),PR(-),TTF-1(-)CK5/6(-),P40(-),CD31(+),CD4(-),CK混(+),EMA(+),CgA(-),Syn(弱+),GATA-3(-),Calretinin(-),FLI-1(+),WT-1(-),CD99(+)。后行18氟-脱氧葡萄糖(18F-FDG)正电子发射型计算机断层扫描显像(PET-CT)示:①右侧肾上腺软组织密度影,3.1 cm×2.0 cm,右颈部、双侧锁骨上区、纵隔、双肺门、腹膜后多发淋巴结,胸骨旁及左侧乳腺内内侧结节,L1-L3骨质改变,代谢不同程度增高,以及双侧胸膜、双侧膈肌脚、肝包膜及左侧臀大肌代谢活跃灶,均考虑恶性;②右肺多发小结节,代谢不高,转移不除外。

图3 病理切片染色(HE ×100)
患者诊断明确,考虑原发病灶肾上腺来源可能较大,TNM分期为T4N1MI,属于Ⅳ期。术后16 d双肺基本复张,拔除双侧胸腔闭式引流管,于12月2日顺利出院。后规律随访,至多家医院就诊,行中药治疗,未行放疗及化疗,治疗效果不佳,于2016年3月10日因呼吸衰竭死亡。
讨 论
一、临床特点
近年来随着免疫组化、电镜、细胞遗传和分子生物学技术的应用发展,PNET诊断率得到不断提高。PNET根据基因及表型属于尤文氏(Ewing′s)肉瘤家族,根据起源不同分为中枢性PNET(central nervous system PNET, cPNET)和外周性PNET(peripheral PNET, pPNET)[2]。cPNET主要指起源于幕上大脑组织及脊髓的一类小圆细胞恶性原始神经上皮肿瘤;而起源于颅外软组织、骨骼系统和原始神经沟早期细胞成分的残留或原始基质小圆细胞,则称为pPNET[3]。本病例为pPNET。PNET属于较为罕见的恶性肿瘤,多见于儿童和青少年,且男性多于女性。发生在青少年胸肺部的PNET称为Askin瘤,成人和肺原发的PNET相当少见[4]。该病恶性程度高,易复发,预后差,术后生存期多在12个月左右。肿瘤多发生于胸壁、肺、肾脏、肾上腺、前例腺、鼻咽部、外阴、骨、皮肤等部位,其中以胸腔、腹腔及躯干多见,约占全部病例的70%左右[5-10]。PNET起病隐匿,临床上多表现为生长迅速的肿块,以及肿块压迫及骨质破坏时引起的疼痛。肺部PNET最常见的临床表现是胸痛、呼吸性窘迫、胸部包块及胸腔的血性积液[11-12]。本例患者因血气胸反复发作1个月,可能与肺部PNET转移至胸膜有关,证实了其为高度侵袭性和易转移的恶性肿瘤。
二、影像特点
PNET的影像学表现缺乏特征性,诊断比较困难。CT平扫密度均匀,小于胸壁肌肉密度。增强扫描为早期轻至中度强化,并有延迟强化的倾向。当肿瘤坏死、液化时,肿瘤密度不均,呈混杂密度影,肿瘤的边缘常较清楚,可区分于肺部常见肿瘤,如肺癌及肺错构瘤。PET-CT在保留PET功能显像特色的同时,结合了CT精确的解剖显像,在PNET的诊断上发挥了重要的作用,SUVmax≥2.5为摄取增高,作为鉴别良、恶性肿瘤的阈值[13]。本例患者PET-CT提示该病变为恶性肿瘤,肾上腺原发灶来源可能,已有全身多发转移。Demir等[14]认为PET-CT在PNET患者的评估上起着重要作用。
三、病理特点
病理检查是PNET诊断和鉴别的唯一方法。PNET的病理特点为光镜下见大量形态单一的原始小圆细胞,瘤细胞小且密集,排列成实性、片状、分叶状、腺泡状、条索状或巢状,核浓染、胞浆少,核浆比例高,可见纤维结缔组织分隔成小叶状。PNET可见典型的Homer-Wright菊形团结构或菊形团排列趋势,局部区域可见明显神经细胞分化,部分区域瘤细胞的胞质透亮,是与Ewing′s肉瘤鉴别的重要依据[15-16]。免疫组织化学检查对CD99、EMA、Syn、NSE、Vimentin等多种标记呈阳性,其中CD99具有较高特异性,90%以上PNET表达,敏感性较高[17]。另外检测CD99还可用于PNET与其他小圆细胞肿瘤的鉴别[18]。确诊PNET的病理学依据为Homer-Wright菊形团结构的形成及2项以上的神经标记物阳性[19]。本例患者手术中取肺组织病理,行免疫组化检测显示CD99、EMA、Syn呈阳性表现,均符合PNET的诊断标准。可见PNET诊断困难,尤其是活检标本,需行多种免疫标志物检测,在排除其他恶性肿瘤后才能考虑这一诊断。
四、治疗方法
PNET目前主要采用手术根治性切除及放疗和化疗。临床上大多数患者就诊时已为晚期,PNET尚无成熟有效的治疗方案,对于局部病灶,手术切除是首选,有研究显示手术切除局部病灶的患者,其总生存期长于不手术者[20]。此外根治性的肿瘤切除,能减少局部复发和消除肿瘤细胞的耐药阻抗,从而可有效提高术后放疗和化疗效果[21]。虽然临床检查PNET多表现为局限性肿瘤,但多已存在远处微转移病灶,因此辅助治疗是必须的。常用的化疗方案主要推荐轮替使用CAV方案(长春新碱+阿霉素+环磷酰胺)及IE方案(异环磷酰胺+依托泊苷)[20]。研究发现,化疗患者合并放疗对原始神经外胚层肿瘤的生存有明显的改善,病死率降低[22]。对于肿瘤无法完整切除的患者,术后应行辅助放疗,可延长生存期。高强度化疗及造血干细胞支持有可能延长化疗敏感患者的生存期,但对于已发生转移者不能延长生存期[23]。研究报道,运用融合基因EWS-FLll的反义寡核苷酸或小RNA干扰技术下调融合基因EWS-FLll的表达可以分别在细胞和动物水平上抑制Ewing′s肉瘤的生长[24]。可以预测,分子靶向治疗有望在不久的将来从基因水平上治疗PNET。PNET是高度侵袭性肿瘤,易复发、转移,以血行转移为主,最常见转移部位依次为骨、肺、肝,25%~50%的病例初诊时就有远处转移,导致生存期明显缩短,5年生存率<25%。由于影响预后的主要因素是临床分期,初诊时应针对骨、肺、肝3大常见转移部位进行筛查,将有助于判断患者预后和确定治疗方案[25]。
本例患者为中年女性,长期接触大理石及二胎后,免疫功能紊乱,以双侧血气胸为临床表现,心率快,属急诊危重症,非常罕见。需急诊手术治疗,无法及时行PET-CT检查及穿刺病理活检明确诊断,急诊术中发现肺部异常情况,取病理行免疫组化确诊,后PET-CT检查时已发现肿瘤多发远处转移,肿瘤分期较晚,即使行新辅助化疗,亦不能改善患者预后。急诊手术方案有效抑制出血,缓解双侧气胸,改善患者症状。随访患者预后不佳,于多家医院就诊,并无有效治疗方式,于术后4个月死亡。
综上所述,PNET是一种高度侵袭,恶性度极高的肿瘤,以血气胸发病极罕见。临床表现不具特异性,术前诊断困难,诊断主要依赖病理形态、免疫组化检测。目前治疗采用手术结合放化疗的综合疗法,但预后仍较差。胸外科医师在诊断肺部肿瘤时应考虑此种类型,早期诊断和综合治疗可以改善症状,是提高生存率的关键,分子靶向治疗有望为PNET的治疗提供崭新思路。
1 张新村, 刘庆华, 刘小芳, 等. 左肺原始神经外胚层肿瘤超声表现1例[J]. 中华超声影像学杂志, 2014, 23(5): 437.
2 Parikh M, Samujh R, Kanojia RP, et al. Peripheral primitive neuroectodermal tumor of the chest wall in childhood: clinico-pathological significance, management and literature review[J]. Chang Gung Med J, 2011, 34(2): 213-217.
3 武中弼, 杨光华. 中华外科病理学[M]. 北京: 人民卫生出社, 2002: 2741-2742.
4 Askin FB, Rosai J, Sibley RK, et al. Malignant small cell tumor of the thoracopulmonary region in cildhood: a distinctive clinicopathologic entity of uncertain histogenesis[J]. Cancer, 1979, 43(6): 2438-2451.
5 Kumar V, Khurana N, Rathi AK, et al. Primitive neuroectodermal tumor of prostate[J]. Indian J Pathol Microbiol, 2008, 51(3): 386-388.
6 Bartholow T, Parwani A. Renal primitive neuroectodermal tumors[J]. Arch Pathol Lab Med, 2012, 136(6): 686-690.
7 罗春华, 肖方星, 郑启忠, 等. 鼻咽部原始神经外胚层肿瘤1例[J]. 临床与实验病理学杂志, 2009, 25(4): 452-453.
8 Dadhwal V, Bahadur A, Gupta R, et al. Peripheral neuroectodermal tumor of the vulva: a case report[J]. J Low Genit Tract Dis, 2010, 14(1): 59-62.
9 姜虹, 冯瑞娥. 皮肤原始神经外胚层肿瘤1例报道并文献复习[J]. 诊断病理学杂志, 2003, 10(15): 291-292.
10 裴再军, 付海英. 肾上腺原始神经外胚层肿瘤二例诊治分析并文献复习[J]. 中国基层医药, 2013, 20(11): 1645-1647.
11 Kiatsoontorn K, Takami T, Ichinose T, et al. Primary epidural peripheral primitive neuroectodermal tumor of the thoracic spine[J]. Neurol Med Chir (Tokyo), 2009, 49(11): 542-545.
12 陈永华, 何玉麟, 夏国金. 胸部原始神经外胚层肿瘤的影像学诊断[J]. 江西医药, 2010, 45(4): 350-352.
13 罗光明, 熊福, 祝冰晶, 等. 胸壁原始神经外胚层肿瘤1例报告并文献复习[J]. 东南国防医药, 2014, 16(2): 187-188.
14 Demir MK, Koar F, Sanli Y, et al. 18 F-FDG PET-CT features of primary primitive neuroectodermal tumor of the chest wall[J]. Diagn Interv Radiol, 2009, 15(3): 172-175.
15 Sen S, Kashyap S, Thanikachalam S, et al. Primary primitive neuroectodermal tumor of the orbit[J]. J Pediatr Ophthalmol Strabismus, 2002, 39(4): 242-244.
16 何乐健, 李佩娟, 刘淑荣, 等. 外周性原始神经外胚层肿瘤和尤文肉瘤的临床病理及免疫组化研究[J]. 诊断病理学杂志, 2000, 7(4): 249-251.
17 赵新, 王禹, 张颖超, 等. 腹腔原始神经外胚层肿瘤1例[J]. 中国实验诊断学, 2013, 17(8): 1523-1524.
18 Wada Y, Yamaguchi T, Kuwahara T, et al. Primitive neuroectodermal tumour of the kidney with spontaneous regression of pulmonary metastases after nephrectomy[J]. BJU Int, 2003, 91(1): 121-122.
19 许倩, 徐凯, 李绍东, 等. 外周性神经外胚层肿瘤的CT及MRI影像学特征[J]. 临床放射学杂志, 2011, 30(9): 1341-1344.
20 Zhang Y, Li H. Primitive neuroectodermal tumors of adrenal gland[J]. Jpn J Clin Oncol, 2010, 40(8): 800-804.
21 崔慧娟, 李京华, 李欧静, 等. 原始神经外胚层瘤10年国内文献分析[J]. 疑难病杂志, 2007, 6(4): 216-219.
22 李建雄, 焦顺昌, 杨俊兰, 等. 原始神经外胚层肿瘤化疗患者预后的研究[J]. 现代肿瘤医学, 2009, 17(4): 734-735.
23 朱燕, 赵玉亮. 肾上腺原始神经外胚层肿瘤胸腔转移一例[J]. 中华肿瘤杂志, 2006, 28(10): 800.
24 Dohjima T, Lee NS, Li H, et al. Small interfering RNAs expressed from a Pol Ⅲ promoter suppress the EWS/FIi-l transcript in an Ewing sarcomacell line[J]. Mol Ther, 2003, 7(6): 811-816.
25 周瑞锦, 刘中华, 王向阳. 肾原发性原始神经外胚层肿瘤一例报告[J]. 中华泌尿外科杂志, 2015, 36(4): 311-312.
(本文编辑:黄红稷)
金亮,闫天生,马少华,等. 以双侧血气胸首发的肺原始神经外胚层肿瘤一例[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(4): 497-499.
10.3877/cma.j.issn.1674-6902.2017.04.034
100191 北京,北京大学第三医院胸外科
闫天生, Email: yts8966@163.com
R563
B
2016-09-25)

