药物相关性分子靶标检测在儿童恶性实体肿瘤个体化治疗中的初步研究
李斯文 王 珊 杨 超 李长春 赵珍珍 孔祥如 邓晓斌 彭 亮
药物相关性分子靶标检测在儿童恶性实体肿瘤个体化治疗中的初步研究
李斯文 王 珊 杨 超 李长春 赵珍珍 孔祥如 邓晓斌 彭 亮
目的初步探讨药物相关性分子靶标检测在儿童恶性实体肿瘤个体化治疗中的临床意义。 方法 选择2014年2月至2017年3月期间于重庆医科大学附属儿童医院诊治的150例恶性实体肿瘤患儿,取其手术肿瘤组织标本150份,通过免疫组织化学(IHC)或聚合酶链式反应(PCR)测序的方法检测肿瘤药物相关性分子靶标的表达或突变,并根据靶标对应的药物分别比较间叶来源和非间叶来源的肿瘤,霍奇金淋巴瘤(Hodgkin lymphoma,HL)和非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL),神经母细胞瘤(neuroblastoma,NB)和肝母细胞瘤(hepatoblastoma,HB)对常见化疗药物的敏感性及毒副作用有无差异。 结果 ①共检测肿瘤标本化疗药物相关性分子靶标15个,包括:人切除修复交叉互补基因1(ERCC1),DNA拓扑异构酶I(TOPO I),DNA拓扑异构酶ⅡA(TOPOⅡA),DNA修复蛋白O6-甲基转移酶(MGMT),微管蛋白β3(tubulinβ3),胸苷酸合成酶(TS),CYP2C19*2,二氢叶酸还原酶[DHFR(C829T)],尿苷二磷酸-葡萄糖醛酸基转移酶(lUGT1A1*28),CYP2B6*6,亚甲基四氢叶酸还原酶[MTHFR(C677T)],巯嘌呤甲基转移酶[TPMT(A719G)],TPMT(G238C),二氢嘧啶脱氢酶[DPYD *2A(14+1G>A)]和DPYD*9(T85C)基因的表达或多态性。②根据靶标对应的相关药物进行分析,得出常用不同化疗药物在儿童恶性实体肿瘤中的总体敏感率及毒副反应情况:甲氨蝶呤敏感占100.0%,替莫唑胺/卡莫司汀/司莫司汀敏感占66.7%,蒽环类/依托泊苷、氟尿嘧啶敏感占52.2%,铂类敏感占52.1%,长春碱类敏感占51.6%,伊立替康/拓扑替康不敏感占81.5%,环磷酰胺不敏感占53.7%;甲氨蝶呤毒副反应弱占90.0%,巯嘌呤毒副反应弱占87.5%,环磷酰胺毒副反应弱占73.8%,氟尿嘧啶毒副反应弱占64.3%,伊立替康/依托泊苷毒副反应弱占55.6%。③不同来源、不同病理类型的儿童恶性实体肿瘤对同一化疗药物敏感性的差异比较:间叶源性肿瘤较非间叶源性肿瘤对伊立替康/拓扑替康敏感性较高(P<0.001),NHL较HL对蒽环类/依托泊苷敏感性较高(P<0.001),HB较NB对铂类(P=0.011)和长春碱类敏感性较高(P=0.018),差异均有统计学意义。 结论 本研究系统性检测了儿童常见恶性实体肿瘤药物相关性分子靶标的表达或多态性,根据检测结果预测药物敏感性及毒副作用,为儿童恶性实体肿瘤化疗方案的制定提供了循证学依据及进一步为个体化用药提供了指导。
儿童;恶性实体肿瘤;分子靶标;个体化化疗
儿童恶性实体肿瘤以综合治疗为主,但仍然占儿童死亡原因的第二位。化疗是针对全身的治疗,在杀灭肿瘤细胞以提高患儿生存率及提高新辅助化疗后手术切除率方面具有不可替代的作用,但由于临床广泛采用的恶性肿瘤标准化疗方案是以循证医学为依据、经过群体样本回顾性研究获得的,对于病人个体而言尚无法个体化选择,使部分患者化疗效果不好甚至无效,以及发生副作用,丧失治疗时机和造成经济损失等。个体化化疗是希望为提高个体治疗疗效、减少毒副作用寻找最特异的化疗药物[1]。目前研究已证实,药物相关性分子靶标是造成药物反应个体差异的重要原因之一[2]。因此本研究通过对150例儿童常见恶性实体肿瘤标本化疗药物相关性分子靶标的检测,分析其与儿童恶性实体肿瘤药物个体反应的差异,初步探讨其在儿童恶性实体肿瘤个体化治疗中的临床意义。
材料与方法
一、临床资料
选择2014年2月至2017年3月期间于重庆医科大学附属儿童医院就诊的恶性实体肿瘤患儿150例,包括淋巴瘤47例,其中霍奇金淋巴瘤(Hodgkin lymphoma,HL)14例,非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)33例;儿童软组织肉瘤(pediatric soft tissue sarcomas,STSs)36例,其中横纹肌肉瘤6例,纤维肉瘤、滑膜肉瘤、炎性肌纤维母细胞瘤等非横纹肌软组织肉瘤26例;神经母细胞瘤(neuroblastoma,NB)33例,肝母细胞瘤(hepatoblastoma,HB)14例;恶性生殖细胞肿瘤10例;骨肉瘤5例;肾母细胞瘤2例;胰母细胞瘤2例;Castleman病1例。
病例纳入标准:①2014年2月至2017年3月于重庆医科大学附属儿童医院首诊的患儿,经手术病理活检证实为恶性实体肿瘤;②术前未接受过其他任何形式的化疗、放疗、诱导治疗或靶向治疗;③患儿自愿接受药物相关性分子靶标检测的。
病例排除标准:①患儿入院前曾接受过其他任何形式的化疗、放疗、诱导治疗或靶向治疗;②患儿在接受本研究所需的药物反应性分子靶标检测后,拒绝按照检测结果提示的敏感性药物继续完成后续治疗的;③治疗过程中出现严重的免疫抑制导致的细菌、真菌感染或其他原因无法完成规范化诊疗的。
二、研究方法
对150例恶性实体肿瘤患儿,取其手术肿瘤标本150份,分别采用IHC或PCR测序的方法检测肿瘤药物相关性分子靶标的表达或突变。150例儿童恶性实体肿瘤根据起源不同,分为间叶来源的STSs36例和非间叶来源的恶性实体肿瘤114例(包括淋巴瘤47例,NB33例,HB14例,恶性生殖细胞肿瘤10例,骨肉瘤5例,肾母细胞瘤2例,胰母细胞瘤2例,Castleman病1例)。根据常见药物相关性分子靶标检测结果,分别比较间叶来源的肿瘤和非间叶来源的肿瘤、HL和NHL、NB和HB对药物敏感性及毒副作用有无差异。
三、统计学处理
应用SPSS20.0软件对数据进行分析,计数资料以百分比或率表示,两组间比较采用 χ2检验或Fisher确切概率法,以双侧α=0.05为检验水准,P<0.05视为差异有统计学意义。
结 果
一、常用不同化疗药物在儿童恶性实体肿瘤中的总体敏感率及毒副反应情况(表1~2)

表1 儿童恶性实体肿瘤化疗药物敏感性分子靶标检测Table 1 Genomicmarkers of sensitivity of chemotherapeutic agents in children with malignant solid tumors
药物敏感性相关分子靶标DHFR(C829T)多态性测序提示甲氨蝶呤敏感占100%(42/42),MGMT表达检测提示替莫唑胺/卡莫司汀/司莫司汀敏感占66.7%(34/51),TOPOⅡA表达检测提示蒽环类/依托泊苷敏感占52.2%(72/138),TS表达检测提示氟尿嘧啶敏感占52.2%(12/23),ERCC1表达检测提示铂类敏感占52.1%(75/144),Tubulinβ3表达检测提示长春碱类敏感占51.6%(16/31);TOPO I表达提示伊立替康/拓扑替康不敏感占81.5%(66/81),CYP2C19*3多态性测序提示环磷酰胺不敏感占53.7%(58/108)。药物毒副作用相关分子靶标MTHFR(C677T)多态性测序提示甲氨蝶呤毒副反应弱占90.0%(27/30),TPMT(A719G)和TPMT(G238C)多态性测序提示巯嘌呤毒副反应弱占87.5%(14/16),CYP2B6*6多态性测序提示环磷酰胺毒副反应弱占73.8%(79/107)DPYD*2A(14+1G>A)和DPYD*9(T85C)多态性测序提示氟尿嘧啶毒副反应弱占64.3%(9/14),UGT1A1*28多态性测序提示伊立替康/依托泊苷毒副反应弱占55.6%(35/63)。
二、不同来源、不同病理类型儿童恶性实体肿瘤对同一化疗药物敏感性及毒副反应差异的比较
根据常见药物相关性分子靶标检测结果,分别比较间叶来源和非间叶来源(表3),HL和NHL(表4),NB和HB(表5)对常用化疗药物的敏感性及毒副作用有无差异,结果显示间叶源性肿瘤较非间叶源性肿瘤对伊立替康/拓扑替康敏感性较高(P<0.001),NHL较HL对蒽环类/依托泊苷敏感性较高(P=0.001),HB较NB对铂类(P=0.011)和长春碱类敏感性较高(P=0.018),差异有统计学意义,而分别对其余药物敏感性及毒副作用进行比较,差异没有明显统计学意义。

表2 儿童恶性实体肿瘤化疗药物毒副反应相关性分子靶标检测Table 2 Genomic markers of toxicity of chemotherapeutic agents in children withmalignant solid tumors
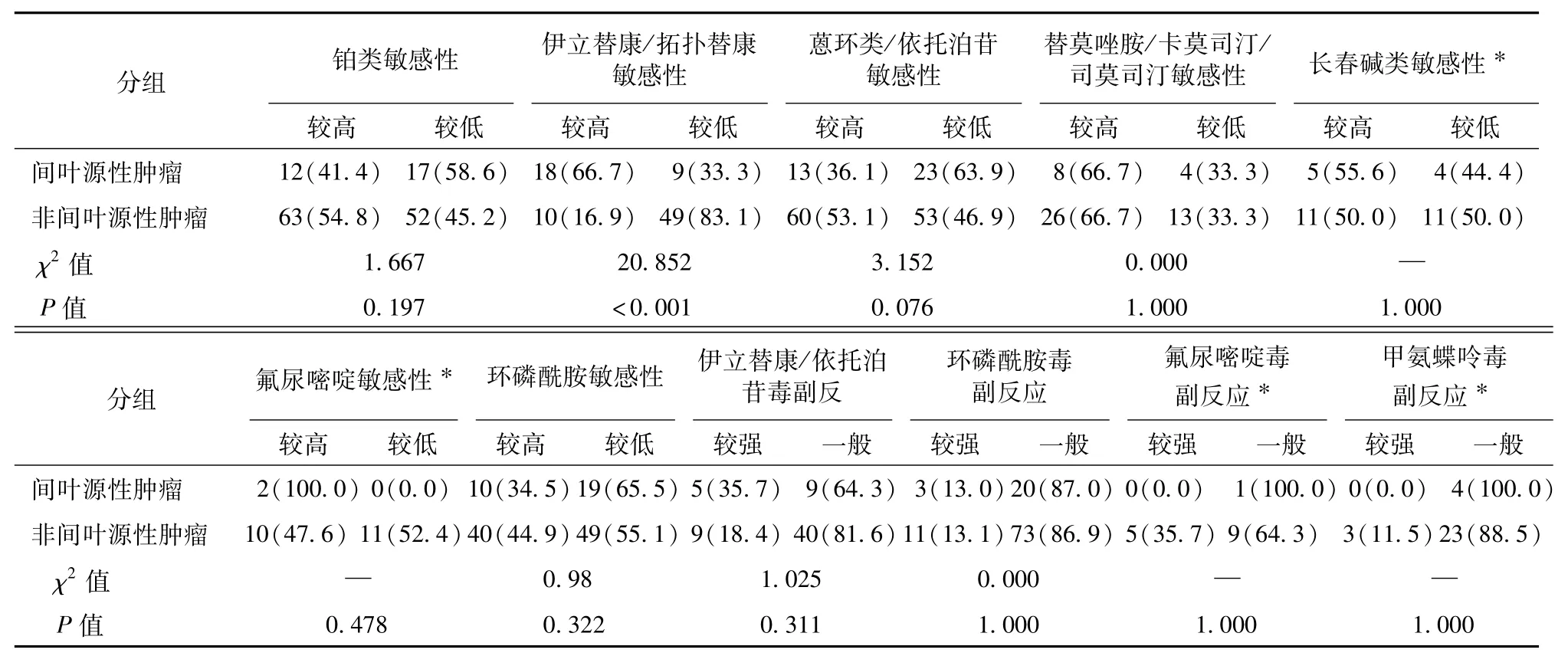
表3 间叶源性和非间叶源性肿瘤标本检测相关化疗药物敏感性及毒副作用比较[n(%)]Table 3 Comparing differences in sensitivity and toxicity to chemotherapeutic agents between mesenchymal and non-mesenchymal tumors[n(%)]

表4 HL和NHL标本检测相关化疗药物敏感性及毒副作用比较[n(%)]Table 4 Comparing sensitivity and toxicity to chemotherapeutic agents between HL and NHL[n(%)]
讨 论
化疗是儿童常见恶性实体肿瘤综合治疗不可替代的治疗手段,如何利用获得的个体基因信息来预测患者个体间或群体间存在药物疗效和不良反应的不同,并寻找个体化治疗方案,近年来已引起人们的广泛关注并成为研究的热点。但迄今为止,药物相关性分子靶标检测技术仅在少数成人肿瘤如非小细胞肺癌中有较多研究[3-5];而在儿童常见恶性实体肿瘤中国内外报道较少,且均为小样本病例的初步分析[6-7]。
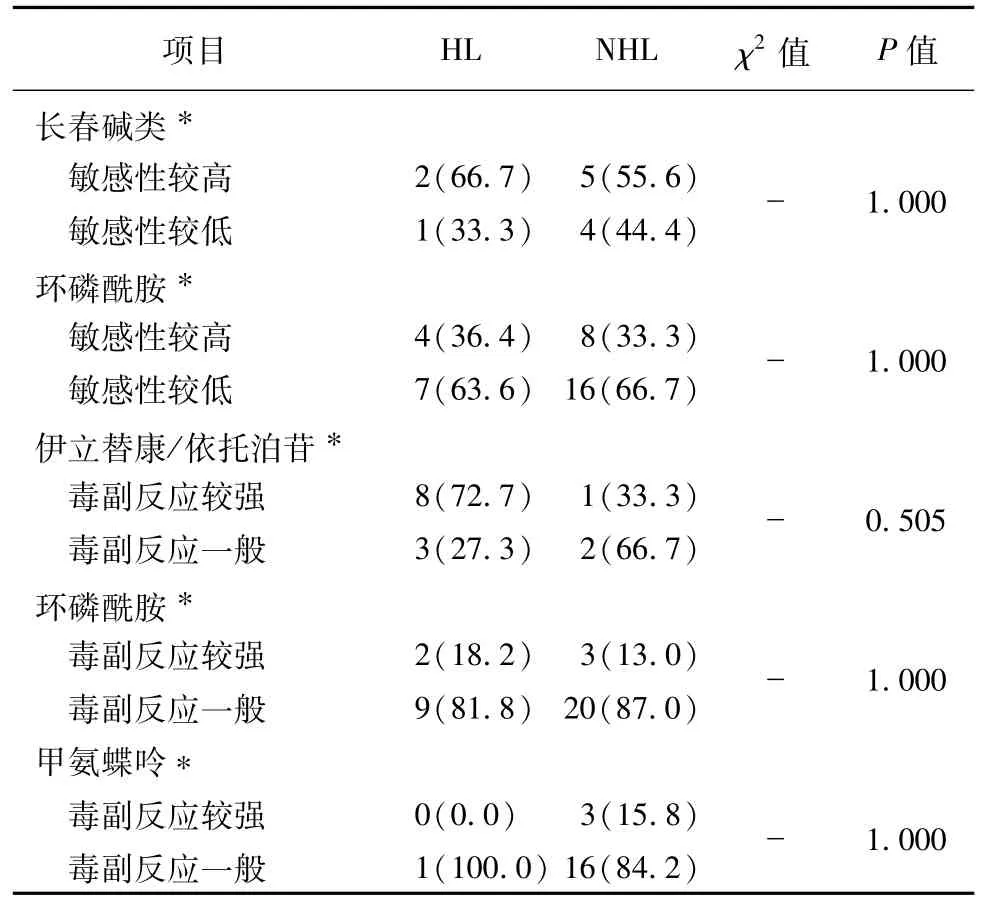
续表4 HL和NHL标本检测相关化疗药物敏感性及毒副作用比较[n(%)]Table 4 4 Comparing sensitivity and toxicity to chemotherapeutic agents between HL and NHL[n(%)]
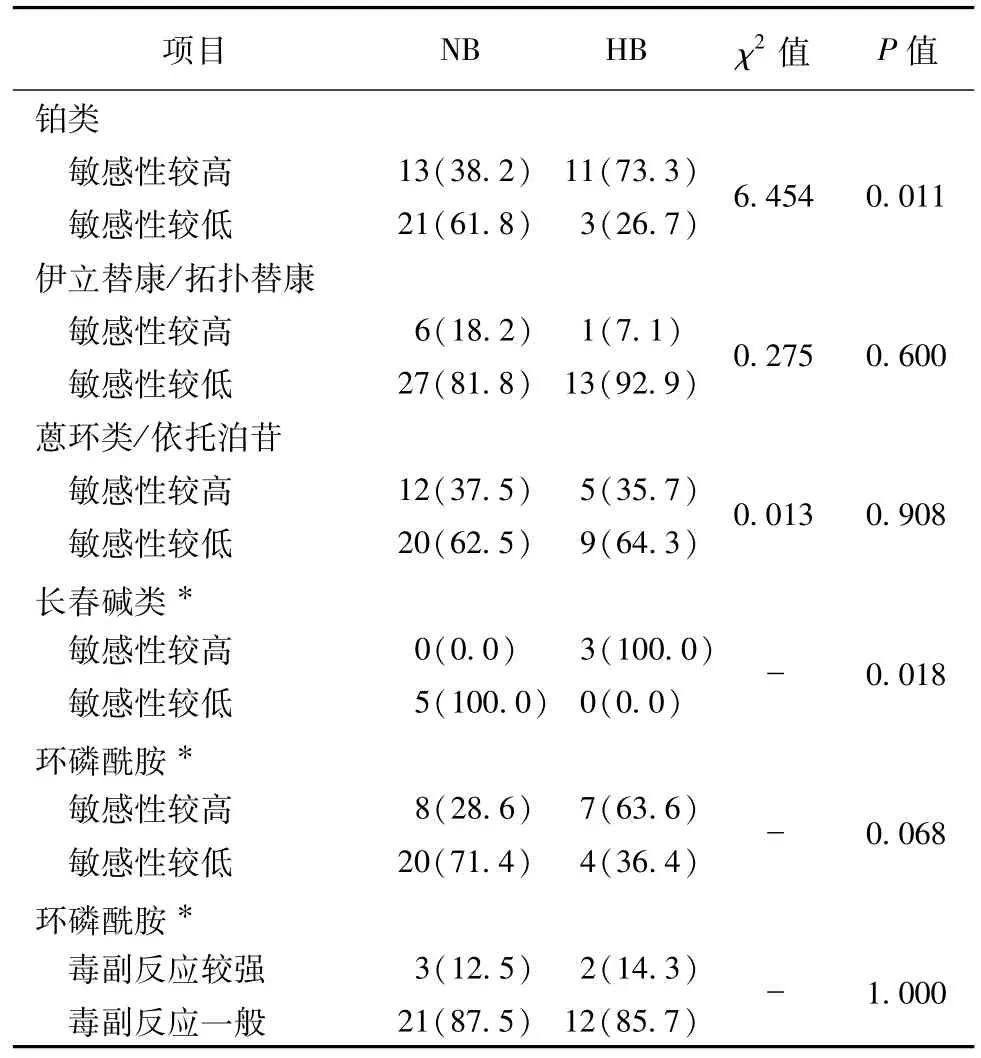
表5 NB和HB标本检测相关化疗药物敏感性及毒副作用比较[n(%)]Table 5 Comparing sensitivity and toxicity to chemotherapeutic agents between NB and HB specimens[n(%)]
本研究进一步系统性检测儿童恶性实体肿瘤药物相关性分子靶标,分析其与常见化疗药物敏感性及毒副作用的关系。研究结果显示,伊立替康/拓扑替康不敏感所占比例高达81.5%,蒽环类/依托泊苷、氟尿嘧啶、铂类、长春碱类敏感仅占50%左右,这几类药物均是儿童恶性实体肿瘤标准化疗方案中的常用药物[8-10],可见,儿童恶性实体肿瘤化疗方案需要筛选更加敏感的化疗药物,才能提高个体化化疗疗效。甲氨蝶呤敏感占100%,这与甲氨蝶呤作为常用化疗药物相符。替莫唑胺/卡莫司汀/司莫司汀敏感占66.7%,而目前这类药物仅试用于少数儿童脑肿瘤[11],也许可以根据检测结果试用于一线化疗药物耐药的患儿。药物毒副反应相关性分子靶标检测结果提示大部分对各类常用化疗药物毒副反应一般,这可能是由于某种药物的毒副反应不仅仅与某一基因表达或某一突变相关[12-13]。
通过比较间叶来源和非间叶来源的肿瘤药物反应,发现间叶源性肿瘤较非间叶源性肿瘤对伊立替康/拓扑替康敏感性较高(P<0.001),差异有统计学意义,这与蒋马伟等[6]的研究结果不同,加上本研究样本量大,可能肿瘤组织来源不同,对某些药物敏感性的确有差异,但并未发现其他药物的反应差异有统计学意义,可能与组内肿瘤差异相关。在非间叶来源肿瘤中,再分别比较HL和NHL、NB和HB的肿瘤药物反应,发现NHL较HL对蒽环类/依托泊苷敏感性较高(P=0.001),也支持临床用药规范中NHL一线方案中包含阿霉素和依托泊苷,而HL一线方案中不包含依托泊苷[14-15]。HB较NB对铂类(P=0.011)和长春碱类(P=0.018)敏感性较高,与目前临床上HB的用药方案相符,并且也从药物敏感性的角度诠释了HB对化疗效果极好,HB总体生存率较NB高[16-17]。
综上所述,药物相关性分子靶标检测不仅能够为目前儿童恶性实体肿瘤不断发展的规范化化疗方案提供循证学依据,也与临床方案大致相符。同时,对于一线化疗方案失败的患儿,依据药物相关性分子靶标检测结果选择个体化用药,对提高化疗治疗效果、提升总体生存率有重要作用。因此有必要开展药物相关性分子靶标检测在儿童恶性实体肿瘤中的临床应用研究,以提高化疗疗效、减轻毒副作用,最终建立起基于药物相关性分子靶标检测的个体化治疗规范。
1 Blom K,Nygren P,Larsson R,et al.Predictive value of exvivo chemosensitivity assays for individualized cancer chemotherapy[J].SLAS Technol,2017,22(3):306—314.DOI:10.1177/2472630316686297.
2 GarnettMJ,Edelman EJ,Heidorn SJ,et al.Systematic identification of genomic markers of drug sensitivity in cancer cells[J].Nature,2012,483(7391):570—575.DOI:10. 1038/nature11005.
3 Sudhindra A,Ochoa R,Santos ES.Biomarkers,prediction,and prognosis in non-small-cell lung cancer:a platform for personalized treatment[J].Clin Lung Cancer,2011,12(6):360—368.DOI:10.1016/j.cllc.2011.02.003.
4 Langer CJ.Individualized therapy for patients with nonsmall cell lung cancer:Emerging trends and challenges[J]. Crit Rev Oncol Hematol,2012,83(1):130—144.DOI:10. 1016/j.critrevonc.2011.09.004.
5 Guo CB,Wang S,Deng C,etal.Relationship betweenmatrix metalloproteinase 2 and lung cancer progression[J].Mol Diagn Ther,2007,11(3):183—192.
6 王奕,吴晔明,张弛,等.药物相关性分子靶标检测在指导Ⅲ —Ⅳ期儿童神经母细胞瘤治疗中的初步经验[J].中华小儿外科杂志,2016,37(4):277—281.DOI:10.3760/cma.j.issn.0253—3006.2016.04.009. Wang Y,Wu YM,Zhang C,et al.Primary identification of genomicmarkers of drug sensitivity for individualized therapy in children with neuroblastoma ofⅢ—IV stage[J].Chinese Journal of Pediatric Surgery,2016,37(4):277—281.DOI:10.3760/cma.j.issn.0253—3006.2016.04.009.
7 蒋马伟,吴晔明,周仁华,等.药物相关分子靶标检测在儿童颅外恶性实体瘤38例个体化治疗中的应用[J].中华实用儿科临床杂志,2014,29(14):1107—1111.DOI:10. 3760/cma.j.issn.2095—428X.2014.14.017. Jiang MW,Wu YM,Zhou RH,et al.Primary identification of genomicmarkers of drug sensitivity for individualized therapy in 38 children with extra-cranialmalignant solid tumors[J].Chinese Journal of Applied Pediatrics,2014,29(14):1107—1111.DOI:10.3760/cma.j.issn.2095—428X.2014. 14.017.
8 Modak S,Cheung NK.Neuroblastoma:therapeutic strategies for a clinical enigma[J].Cancer Treat Rev,2010,36(4):307—317.DOI:10.1016/j.ctrv.2010.02.006.
9 Ferrari A,De Salvo GL,Brennan B,et al.Synovial sarcoma in children and adolescents:the European pediatric Soft tissue sarcoma Study Group prospective trial(EpSSG NRSTS 2005)[J].Ann Oncol,2015,26(3):567—572.DOI:10. 1093/annonc/mdu562.
10 Katzenstein HM,Furman WL,Malogolowkin MH,et al.Upfront window vincristine/irinotecan treatment of high-risk hepatoblasto-ma:A report from the Children’s Oncology Group AHEP0731 study committee[J].Cancer,2017,123(12):2360—2367.DOI:10.1002/cncr.30591.
11 Thomas A,Tanaka M,Trepel J,et al.Temozolomide in the era of precision medicine[J].Cancer Res,2017,77(4):823—826.DOI:10.1158/0008—5472.CAN—16—2983.
12 Zhang X,Sun B,Lu Z.Evaluation of clinical value of single nucleotide polymorphisms of dihydropyrimidine dehydrogenase gene to predict 5-fluorouracil toxicity in 60 colorectal cancer patients in China[J].Int JMed Sci,2013,10(7):894—902.DOI:10.7150/ijms.5556.
13 Wang W,Huang J,Tao Y,et al.PhaseⅡand UGT1A1 polymorphism study of two different irinotecan dosages combined with cisplatin as first-line therapy for advanced gastric cancer[J].Chemotherapy,2016,61(4):197—203. DOI:10.1159/000442787.
14 中华医学会儿科学分会血液学组.儿童霍奇金淋巴瘤的诊疗建议[J].中华儿科杂志,2014,52(8):586—589. Hematology Group of Chinese Medical Association.Recommendations on diagnosis and t reatment of Hodgkin’s lymphoma in children[J].Chinese Journal of Pediatrics Surgery,2014,52(8):586—589.
15 中华医学会儿科学分会血液学组.儿童非霍奇金淋巴瘤诊疗建议[J].中华儿科杂志,2011,49(3):186—192. Hematology Group of Chinese Medical Association.Diagnosis and treatment of non-Hodgkin's lymphoma in children[J].Chinese Journal of Pediatrics Surgery,2011,49(3):186—192.
16 Yuan X J,Wang HM,Jiang H,etal.Multidisciplinary effort in treating children with hepatoblastoma in China[J]. Cancer Lett,2016,375(1):39—46.DOI:10.1016/j.canlet.2016.02.051.
17 Pinto NR,Applebaum MA,Volchenboum SL,et al.Advances in risk classification and treatment strategies for neuroblastoma[J].J Clin Oncol,2015,33(27):3008—3017.DOI:10.1200/JCO.2014.59.4648.
Prelim inary identification of drug-related genom icmarkers for individualized therapy in children w ithmalignant solid tumors.
Ob jectiveTo preliminarily explore the clinical significance of drug-related genomicmarkers for individualized therapy in children with common malignant solid tumors.M ethods Surgical specimens in150 children withmalignant solid tumorwere collected between February 2014 and March 2017.The drug-related genomic markers were examined by immunohistochemical staining and polymerase chain reaction sequencing.According to identification of genomic markers,we compared the differences of sensitivity and toxicity to common chemotherapeutic agents between mesenchymal and non-mesenchymal tumors,Hodgkin lymphoma(HL)and non-Hodgkin lymphoma(NHL),neuroblastoma(NB)and hepatoblastoma(HB)respectively.Resu lts①Fifteen genomic markers of anti-neoplastic agents correlations were examined,including gene expression or mutation of excision repair cross-complementing 1(ERCC1),topoisomerase I(TOPOI),topoisomeraseⅡA(TOPOⅡA),O6-methylguanine-DNA methyltransferase(MGMT),tubulinβ3,thymidylate synthase(TS),CYP2C19*2,dihydrofolate reductase(DHFR C829T),UDP-glucuronosyltransferase1(UGT1A1*28),CYP2B6*6,methylene tetrahydrofolate reductase(MTHFR C677T),thiopurine S-methyltransferase(TPMT A719G),TPMTG238C,dihydropyrimidine dehydrogenase(DPYD*2A14+1G>A),DPYD*9T85C.②A-mong examined specimens,100%were ofmethotrexate sensitivity and66.7%had temozolomide/carmustine/semustine sensitivity,52.2%anthracycline/etoposide and fluorouracil sensitivity,52.1%platinum sensitivity and 51.6%vincristine sensitivity.While81.5%had no sensitivity to irinotecan/topotecan,53.7%non-sensitivity to cyclophosphamide.90.0%weak toxicity tomethotrexate,73.8%weak toxicity to cyclophosphamide,64.3%weak toxicity to fluorouracil and 55.6%weak toxicity to irinotecan/etoposide.③Mesenchymal tumors had higher sensitivity to irinotecan/topotecan than non-mesenchymal tumors(P=0.000);NHL had higher sensitivity to anthracycline/etoposide than HL(P=0.000),HB had higher sensitivity to platinum(P=0.011)and vincristine(P=0.018)than NB.Based upon the above test results,therapeutic strategies for poor responderswere promptly adjusted and then they achieved preliminary effect.Conclusion Genomicmarkers of drug sensitivity or toxicity are examined in children with malignant solid tumors.It provides rationales of formulating personalized chemotherapeutic regimens.
Child;Malignant Solid Tumor;Genomic Marker;Individualized Chemotherapy
2017—7—10)
(本文编辑:王爱莲)
10.3969/j.issn.1671—6353.2017.004.008.
10.3969/j.issn.1671-6353.2017.04.008
1,国家临床重点专科建设资金项目(2013544);2,重庆市社会事业与民生保障科技创新专项(cstc2016 shms-ztzx0042)
重庆医科大学附属儿童医院肿瘤外科,儿童发育疾病研究教育部重点实验室,儿童发育重大疾病国家国际科技合作基地,儿科学重庆市重点实验室(重庆市,400014)
王珊,Email:wangshan778@163.com
Li Siwen,Wang Shan,Yang Chao,LiChangchun,Zhao Zhenzhen,Kong,Xiangru,Deng Xiaobin,Peng Liang.Departmentof Pediatric Surgical Oncology,Children’s Hospital,Chongqing Medical University,Ministry of Education Key Laboratory of Child Development&Disorders,China International Science&Technology Cooperation Base of Child Development&Critical Disorders,Chongqing Key Laboratory of Pediatrics,Chongqing 400014,China.Corresponding author:Wang Shan,Email:wangshan778@163.com
本文引用格式:李斯文,王珊,杨超,等.药物相关性分子靶标检测在儿童恶性实体肿瘤个体化治疗中的初步研究[J].临床小儿外科杂志,2017,16(4):341—346.
Citing this article as:Li SW,Wang S,Yang C,et al.Preliminary identification of drug-related genomic markers for individualized therapy in children with malignant solid tumors[J].JClin Ped Sur,2017,16(4):341—346.DOI:10.3969/j.issn.1671—6353.2017.004.008.

