Box-Behnken法优化加酸超声提取瞿麦中大黄素的工艺
杨晓宇,李程,马思跃,李建恒
(1.河北大学 药学院,河北 保定 071002;2.爱荷华大学 工程学院,爱荷华市 52240)
Box-Behnken法优化加酸超声提取瞿麦中大黄素的工艺
杨晓宇1,李程2,马思跃1,李建恒1
(1.河北大学 药学院,河北 保定 071002;2.爱荷华大学 工程学院,爱荷华市 52240)
采用响应面法优化瞿麦中大黄素的提取工艺.利用单因素法进行考察,以大黄素提取量为指标,考察液固比、超声时间、温度、盐酸质量分数及用量对大黄素提取量的影响,并结合Design-Expert软件中的Box-Behnken实验设计和响应面分析方法对超声提取瞿麦中大黄素的工艺进行优化,再与药典中虎杖提取大黄素方法进行比较,确定大黄素超声提取最佳工艺:液固比为61倍,温度为40 ℃,超声30 min,加质量分数为8%的盐酸1 mL.通过优化得到的大黄素超声提取工艺省时,稳定,且与回流法相比提取量高.
大黄素;超声提取;响应面法
超声提取法是以机械作用、热学作用及空化作用等原理为基础,利用超声波产生的扰动、击碎和搅拌等功能,增强了物质的分子运动频率和速度,使被提取的成分加速进入溶剂,且在超声过程中产生的热量还起到了一定的加热作用,进而达到快速提取的效果.超声提取法与传统乙醇回流提取法相比,避免了耗时长、试剂浪费等问题,极大地提高了提取效率,避免了高温对提取成分的影响,因此值得广泛使用[1].
瞿麦临床疗效广泛,主要用于治疗热淋、血淋、小便不通和经闭瘀阻等病症;现代药理学研究发现瞿麦还具有免疫、抑菌、抗脂质过氧化、抗肝病毒等作用[2-3].大黄素是瞿麦的主要有效成分之一,具有抗炎、抑菌、抗肿瘤、抗脑缺血损伤等作用[4].有研究表明[5]大黄素在植物体内以盐的形式存在,加酸可使之游离出来,进而提高大黄素的提取率,且药典中对于瞿麦有效成分含量的测定并没有明确的规定,对其药品质量评价带来一定难度.本文采用加酸超声提取法对瞿麦中大黄素进行提取,且采用单因素实验及Box-Behnken法进行实验设计,通过响应面分析法对大黄素的提取工艺进行优化,并通过与药典中虎杖提取大黄素的方法进行对比,以确定大黄素的最佳提取条件,为瞿麦中大黄素的测定和质量评价标准提供理论依据.
1 材料
北京创新通恒LC3000高效液相色谱仪,Apollo C18(4.6 mm×150 mm,5 μm),KQ-250B型超声波清洗器(昆山市超声仪器有限公司).
甲醇、磷酸为色谱纯,其他试剂均为分析纯;超纯水(自制);大黄素对照品(批号20160302,上海金穗生物技术有限公司);瞿麦(产地河北,经龙海大药房张药师鉴定).
2 方法与结果
2.1 大黄素定量测定方法的建立[1,5-7]
2.1.1 色谱条件
采用北京创新通恒高效液相色谱仪,Apollo C18(4.6mm×150 mm,5 μm)色谱柱;流动相为甲醇-(质量分数为0.1%)磷酸(体积比为76∶24),检测波长为254 nm,柱温为25 ℃,流速为1.0 mL/min,理论塔板数按大黄素峰计算应不低于3 000.
2.1.2 对照品溶液的制备
精密称取大黄素对照品1.49 mg,加甲醇制成每1 mL含149 μg的溶液,即得.
2.1.3 供试品溶液的制备
精密称取本品粉末0.5 g,置具塞锥形瓶中,精密加入甲醇29.5 mL,质量分数为8%的盐酸1 mL,密塞,40 ℃,超声处理(功率250 W,频率40 kHz)30 min,放冷,减压回流至10 mL,摇匀,过滤,取续滤液,即得.
2.1.4 线性关系观察
分别精密量取对照品溶液0.5、2、5、7、10、14、16、18、20 μL进样.按上述色谱条件进样测定,以峰面积(Y)对进样量(X)进行线性回归,绘制标准曲线,得回归方程Y=330 32X,r=0.999 1;结果表示进样量在0.730~29.204 μg内线性关系良好.
2.1.5 精密度考察
精密量取上述对照品溶液,在上述色谱条件下,连续进样6次,每次20 μL,测得大黄素峰面积积分值的RSD为0.12%,表明精密度良好.
2.1.6 稳定性考察
取同一供试品约0.50 g,按2.1.3项制备成供试品溶液,分别于0、2、4、6、8、12、18、24 h时进样,每次20 μL,测的大黄素峰面积积分值RSD为1.9%,表明供试品溶液在24 h内稳定.
2.1.7 重复性考察
取同一批瞿麦样品0.50 g,按2.1.3项分别平行制备6份供试品溶液,在上述色谱条件下进样测定,每次20 μL,测定大黄素峰面积积分值RSD为1.3%,表明本测定方法重复性良好.
2.1.8 回收率考察
精密称取已知含量的同一批瞿麦样品9份,每3份一组,每组分别精密加入1.49 mg的对照品,按2.1.3中方法制备并测定含量,结果见表1,平均回收率为98.29%,RSD为1.0%(n=9).
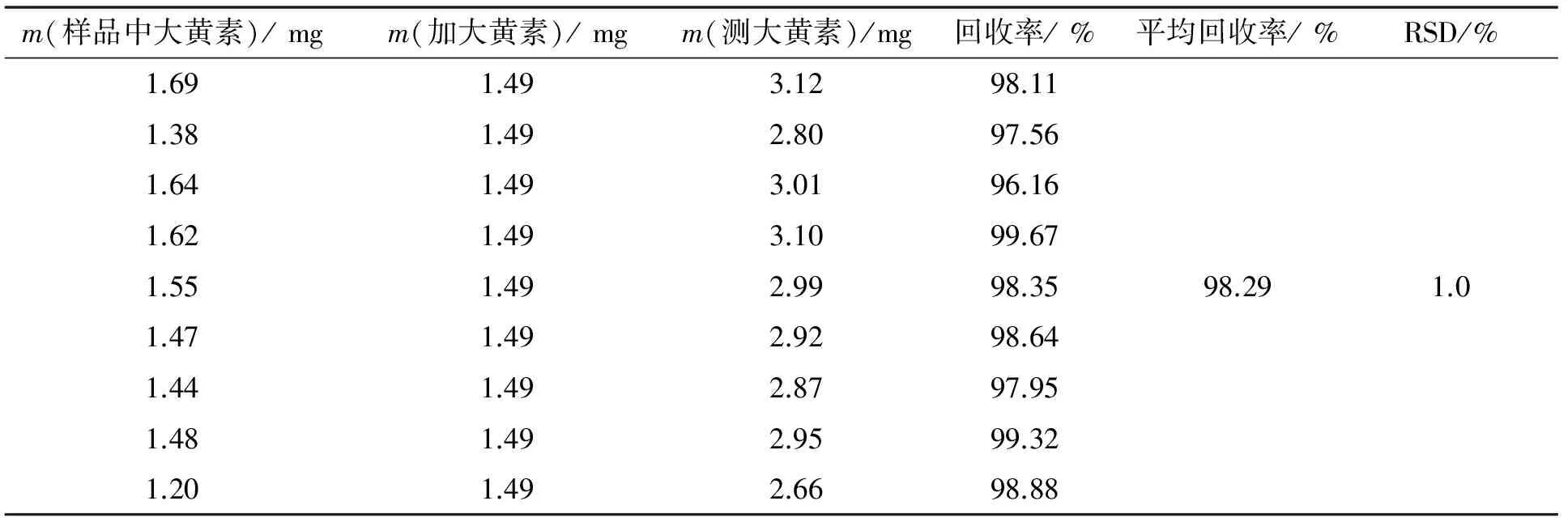
表1 大黄素加样回收率
2.2 大黄素提取工艺的优化
2.2.1 单因素实验
精密称取瞿麦适量,分别加入不同液固比的甲醇,不同质量分数及用量的盐酸,在特定温度下,超声提取一定时间,减压回流至10 mL,过滤,取续滤液,以大黄素提取峰面积为指标,选取液固比、酸浓度及用量、提取时间、温度等5个因素进行单因素实验.
2.2.2 响应面分析优化提取工艺
综合单因素实验结果,选取对大黄素提取含量影响较大的液固比、酸浓度及用量3个因素,利用Box-Behnken实验设计对提取工艺进行优化设计实验.通过Design Expert软件,对提取工艺进行响应面分析,得到最佳工艺参数.
2.3 药典法提取瞿麦中大黄素
参考药典中大黄素的提取方法,称取瞿麦粉末(过三号筛)约0.5 g,精密量取三氯甲烷25 mL和2.5 mol/L硫酸溶液20 mL,称定重量,置80 ℃水浴中加热回流2 h,冷却至室温,再称定重量,用三氯甲烷补足减失的重量,摇匀.取三氯甲烷层溶液,精密量取10 mL,蒸干,残渣加甲醇使其溶解,转移至10 mL容量瓶中,加甲醇稀释至刻度,摇匀,过滤,取续滤液,即得[2].
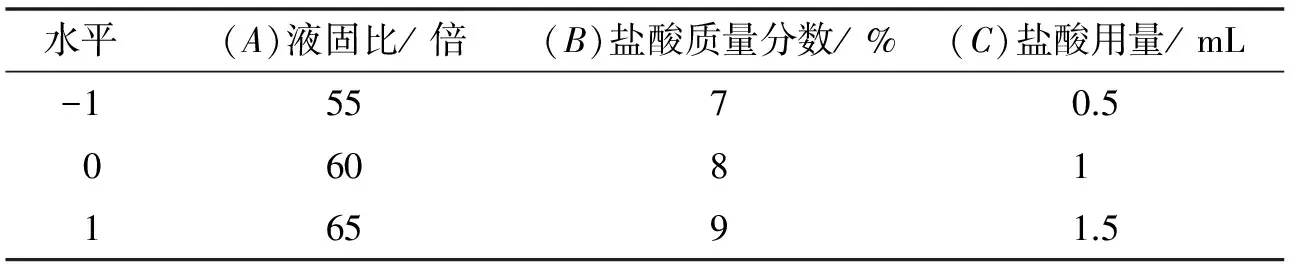
表2 Box-Behnken因素水平设计
3 结果与讨论
3.1 单因素实验
3.1.1 液固比对大黄素提取含量的影响
固定超声时间20 min,温度40 ℃,质量分数为3%的盐酸1 mL,考察液固比为20、30、40、50、60倍对大黄素提取量的影响.当液固比由20倍增加至60倍时,大黄素含量随液固比增加而增加,并在液固比为60倍时达到最大,且增幅加大,见图1.随着液固比增加,使溶液的不饱和度增加,有助于大黄素的溶出,但溶液过多会使杂质溶出增加,影响提取效果.因此实验选择液固比55~65倍为响应面分析范围.
3.1.2 盐酸质量分数对大黄素提取含量的影响
固定液固比为20倍,超声时间20 min,温度40 ℃,质量分数不同的盐酸1 mL,考察质量分数为0%、3%、6%、8%、10%的盐酸对大黄素提取量的影响,见图2.随着盐酸质量分数的增加,大黄素含量先增加后减少,在8%时达到最大.这可能是由于盐酸质量分数过高反而使大黄素的结构遭到了破坏.因此实验选择质量分数为7%~9%的盐酸作为响应面分析范围.
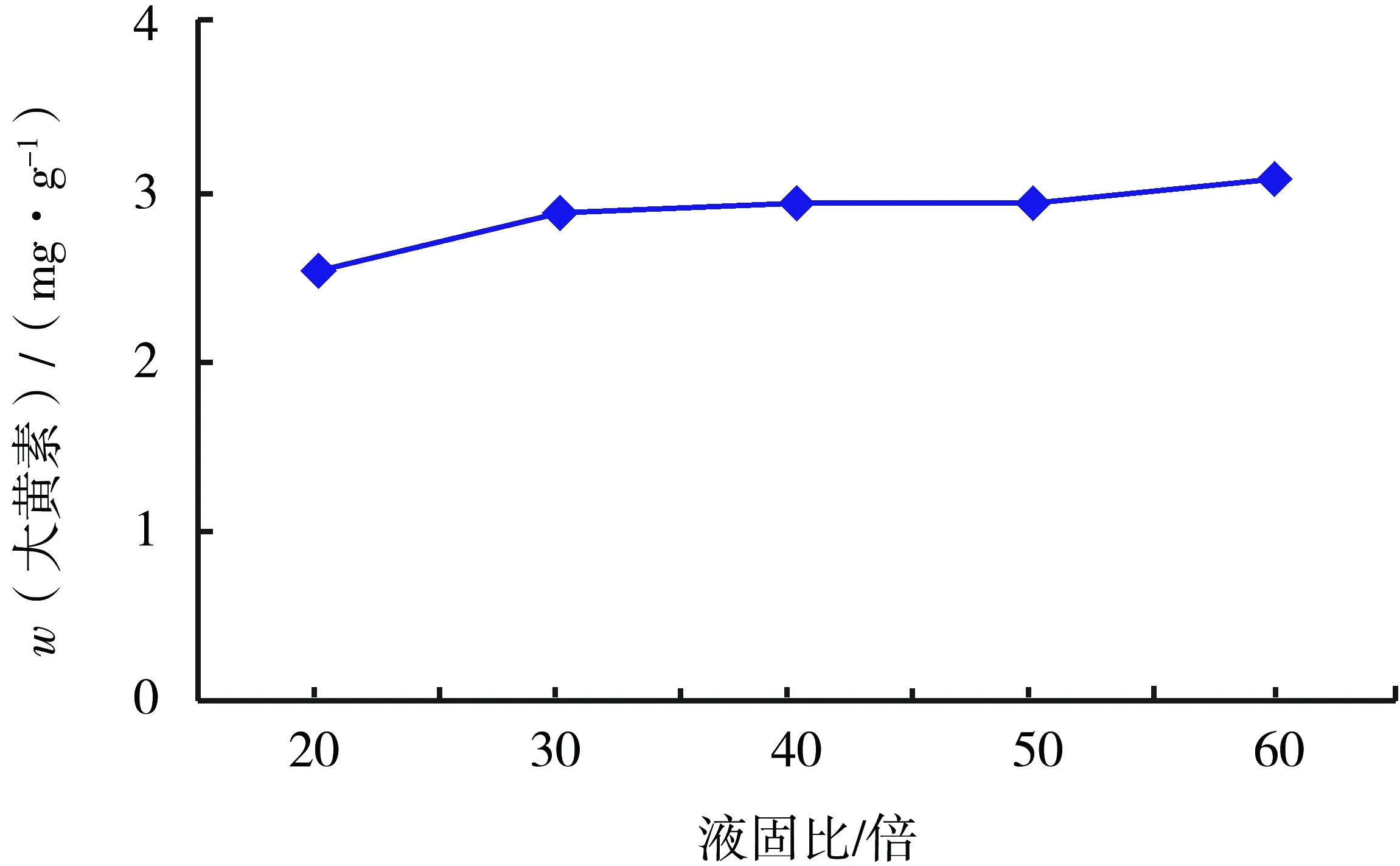
图1 液固比对大黄素含量的影响Fig.1 Liquid-material ratio to the influence of emodin content

图2 盐酸质量分数对大黄素含量的影响Fig.2 Mass fraction of hydrochloric acid to the influence of emodin content
3.1.3 酸用量对大黄素提取含量的影响
固定液固比为20倍,超声时间20 min,温度40 ℃,质量分数为3%的盐酸,考察酸用量为0、1、2、3、4 mL时对大黄素提取量的影响,见图3.当酸用量由0增加至1 mL时,大黄素含量随用量增加而增加,在1 mL时达到最大,而后逐渐降低.这可能是由于随着酸用量的增加结合型大黄素与酸结合游离溶解的同时,其他结合型物质的溶解量也逐渐增加,进而使大黄素含量减少.因此选择酸用量0.5~1.5 mL为响应面分析范围.
3.1.4 超声时间对大黄素提取含量的影响
固定液固比为20倍,温度40 ℃,质量分数为3%的盐酸1 mL,考察超声时间为10、20、30、45、60 min时对大黄素提取量的影响.大黄素的含量随着超声时间的增长先升高再降低,这可能是由于随着超声时间的增长大黄素已经基本提取完全,时间过长可能会使杂质溶出增加,且大黄素的结构可能会遭到破坏.提取含量在超声时间为30 min时达到最大,随后降低趋势并不显著,因此为了节省时间,选择30 min为最佳提取时间.

图3 酸用量对大黄素含量的影响Fig.3 Dosage of hydrochloric acid to the influence of emodin content
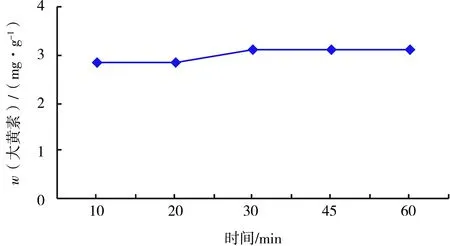
图4 超声时间对大黄素含量的影响Fig.4 Ultrasound time to the influence of emodin content
3.1.5 温度对大黄素提取含量的影响
固定液固比20倍,超声时间20 min,质量分数为3%的盐酸1 mL,考察温度为30、40、50、60、70 ℃时对大黄素提取量的影响,见图5.大黄素的含量随温度的增高先升高后降低,并在温度为40 ℃时达到最大.这可能是由于随着温度升高,大黄素的游离、溶解速度加快,使其容易被提取出来,但温度过高可能会使大黄素氧化,进而降低其含量,但由图5可看出,40 ℃后的大黄素的峰面积虽然减小但趋势缓慢,降低并不明显,因此为了方便操作,选择40 ℃为最佳温度.

图5 温度对大黄素含量的影响Fig. 5 Temperature to the influence of emodin content
3.2 大黄素提取响应面法优化分析
3.2.1 建立模型及显著性检验
根据Box-Behnken设计进行实验,共设计了17个实验点,设计及结果如表3.

表3 瞿麦提取工艺设计表及大黄素提取量
利用Design-expert软件,对表3中的数据进行多元回归拟合,选择相应值显著的各项,可得液固比(A)、盐酸质量分数(B)、盐酸用量(C)与大黄素提取量的二次多项回归方程,回归方程为:大黄素提取量=-101.359 89+2.196 03A+7.762 08B+10.642 84C-0.022 584AB-0.121 29AC+0.018 231BC-0.015 321A2-0.38 537B2-1.513 12C2,回归方程高度显著,相关系数R2=0.933 5,说明实验方法可靠.
P值表示模型及各考察因素的显著性,如表4,以大黄素提取量为响应值时,模型的P值为0.002 3<0.01,而失拟项P值为0.731 3>0.1000,则说明该二次方程模型极显著,且实验结果与数学模型拟合良好,可用该数学模型推测实验结果.还可知A、B、C、AC、A2、B2、C2各项对大黄素提取量的影响均显著,表明二次项对响应值也有很大关系,但交互作用的影响相对较小.故回归方程可较好地描述各因素与响应值之间的真实关系,可以利用该回归方程确定3个参数的最佳水平.
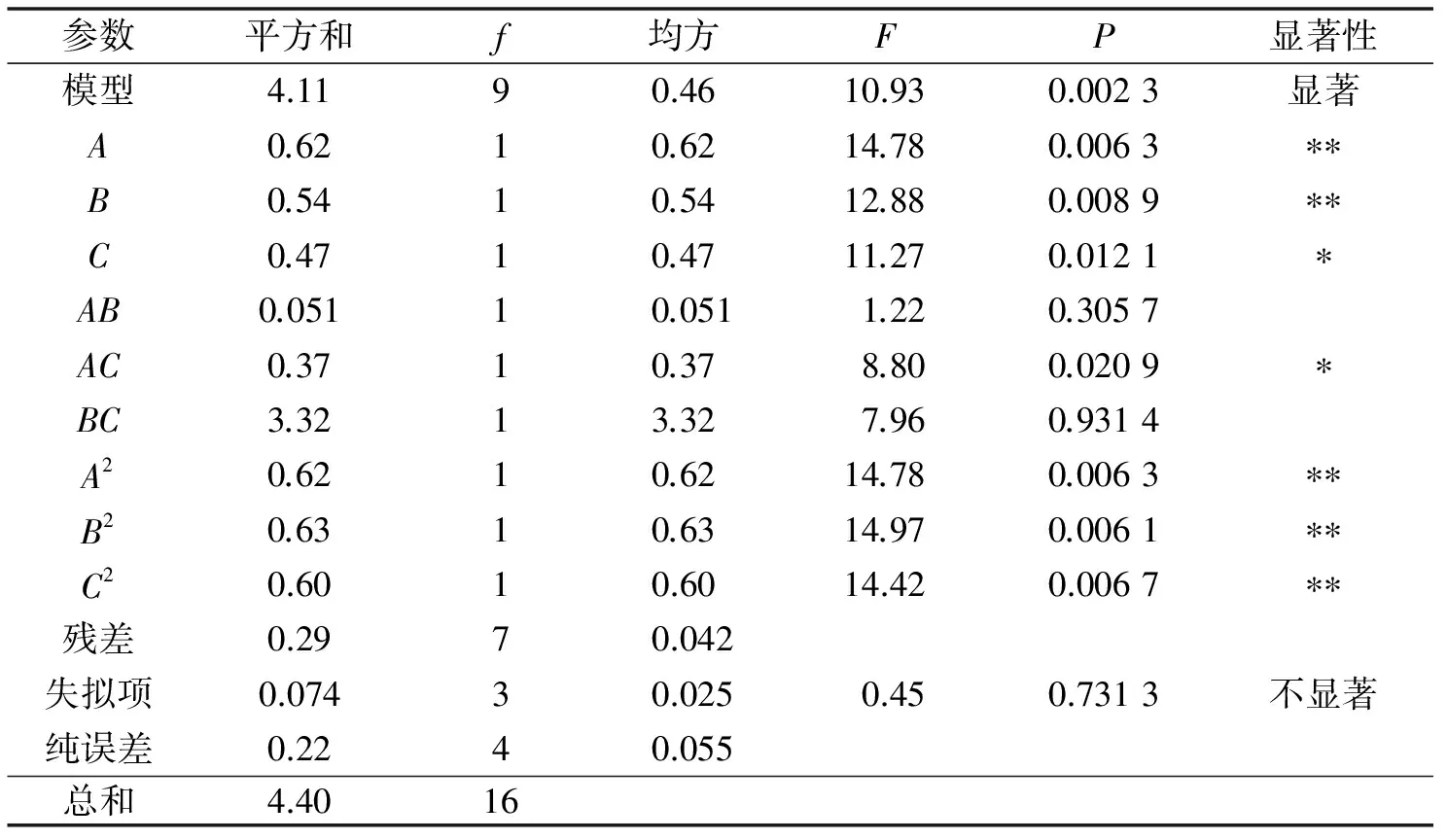
表4 响应面ANOVA分析
3.2.2 响应面交互作用分析优化

图6 液固比和盐酸质量分数对大黄素提取量的响应面和等高线Fig.6 Contour line and curved surface of response of liquid- solid ratio and mass fraction of hydrochloric acid to emodin content
通过对各考察因素之间的交互作用进行响应面分析,绘制响应面曲线图及等高线图,见图6-8.图6是液固比与盐酸质量分数对大黄素提取量的交互作用,可知随着液固比与盐酸质量分数的增加,两者之间存在增效作用,大黄素提取量随着两者的增加而提高;但当液固比增加到61倍,盐酸质量分数增加到8.5%左右时,大黄素提取量随两因素的增加而降低;图7中当液固比在55~61倍,盐酸用量在0~1.1 mL时,曲面图中的曲线坡度较陡,两者存在显著的增效作用,在此范围内大黄素提取量随两者的增加先升高,而后曲线趋于平缓;图8中盐酸用量在0~1.1 mL时,曲线先缓慢上升后下降,盐酸质量分数在7%~8%时,曲线上升且坡度较陡,而后下降但坡度平缓.
综上所述,曲面图的曲线越陡,该因素对大黄素提取率影响越大[8],等高线越接近椭圆形代表两因素间交互作用显著,而存在极值的条件应该在圆心处[8-9].可看出图7的曲线最为陡峭,等高线接近椭圆形;图8中曲线最平坦,趋近直线,等高线接近圆形.因此得出液固比与酸用量之间的交互影响最大,而酸浓度与用量之间的交互影响最小,与ANOVA分析结果吻合.

图7 液固比和盐酸用量对大黄素提取量的响应面和等高线Fig.7 Contour line and curved surface of response of liquid- solid ratio and dosage of hydrochloric acid to emodin content

图8 盐酸质量分数和用量对大黄素提取量的响应面和等高线Fig.8 Contour line and curved surface of response of mass fraction of hydrochloric acid and dosage to emodin content
3.2.3 验证实验
由各响应面立体图可知,响应值存在最大值.由分析结果得出各因素的最佳取值为液固比为61.13倍,盐酸质量分数为8.31%,用量为1.12 mL,模型预测大黄素的最高提取量是3.93 mg/g.根据实际生产的现状,将以上参数进行优化,最终得到的超声提取大黄素的工艺:液固比为61倍,盐酸质量分数为8%,用量为1 mL,并在此条件下重复3次实验,瞿麦中大黄素的实际平均提取量为3.87 mg/g,与理论预测值的相对误差为1.5%.因此,响应面对瞿麦中大黄素提取条件的优化是可行的.
3.3 与药典法进行对比
为了验证优化工艺的优越性,与药典中虎杖提取大黄素的方法进行比较.由图9可知,同一样品使用加酸超声法可大大缩短提取时间,还可以显著提高瞿麦中大黄素的提取量,且在单因素实验中也体现出了加入盐酸的优越效果.
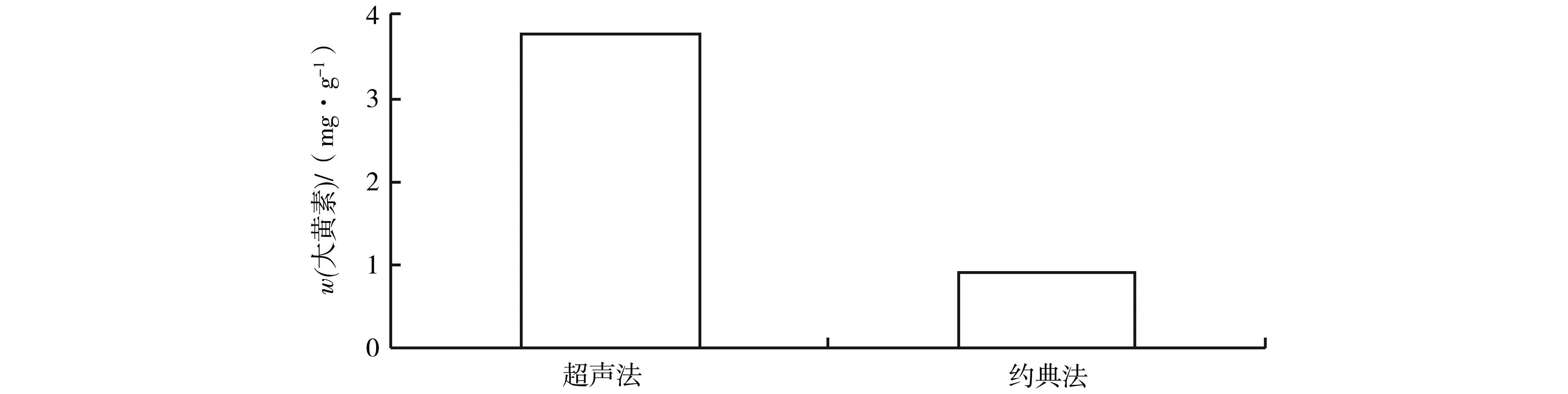
处理工艺图9 优化工艺与传统工艺比较Fig.9 Comparison table of extracting between optimization process and traditional process
4 结论
在单因素的基础上进行响应面实验,通过实验结果分析确定了最佳提取条件:液固比为61倍,超声时间30 min,40 ℃,质量分数为8%的盐酸1 mL,在此条件下大黄素提取量与预测值基本相符,并与药典中虎杖提取大黄素的方法进行对比.最终表明加酸超声提取法是可以应用于提取瞿麦中大黄素的方法,为其资源的进一步开发提供理论基础.
[1] 邬方宁.超声提取技术在现代中药中的应用[J].中草药, 2007,38(2):315.
[2] 国家药典委员会.中华人民共和国药典[S].北京:化学工业出版社,2015.
[3] 刘晨, 张凌珲, 杨柳, 等.瞿麦药学研究概况[J].安徽农业科学, 2011,39(33): 20387-20388,20392.DOI: 10.13989/j.cnki.0517-6611.2011.33.084. LIU C, ZHANG L H, YANG L,et al.Overview of pharmacological research onDianthussuperbusL.[J].Journal of Anhui Agri Sci, 2011,39(33): 20387-20388,20392.DOI: 10.13989/j.cnki.0517-6611.2011.33.084.
[4] 刘静, 王丽.大黄素的研究进展[J].中国药房, 2014,25(35): 3351-3354.
[5] 张新乐, 黄泽光, 薛晓英, 等.加酸提取何首乌中大黄素工艺的探讨[J].时珍国医国药, 2007,18(3): 571-572. ZHANG X L, HUANG Z G, XUE X Y, et al.HCl plus extract thchnology for emodin from radix polygoni multiflori[J].Lishizhen Medicine and Mareria Medica Research, 2007,18(3): 571-572.
[6] 蔡进章, 林崇良, 王贤亲, 等.6种蓼科植物药材大黄素含量比较[J].中华中医药学刊, 2012,30(6): 1372-1374. DOI: 10.13193/j.archtcm.2012.06.190.caijzh.066. CAI J Z, LIN C L, WANG X Q, et al.Determination and comparison of emodin in six kinds of polygonaceae herbs[J].Chinese Archives of Traditional Chinese Medicine, 2012, 30(6): 1372-1374.DOI: 10.13193/j.archtcm.2012.06.190.caijzh.066.
[7] 邹晶晶, 承伟.瞿麦中大黄素的含量测定[J].安徽农业科学, 2012,40(6): 3284-3285.DOI: 10.13989/j.cnki.0517-6611.2012.06.085. ZOU J J, CHENG W.Determination of emodin content inDianthussuperbusL.[J].Journal of Anhui Agri Sci, 2012,40(6): 3284-3285.DOI: 10.13989/j.cnki.0517-6611.2012.06.085.
[8] 侯学敏, 李林霞, 张直峰, 等.响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J].食品科学, 2013,34(06): 124-128. HOU X M, LI L X, ZHANG Z F, et al.Total flavonoids from Mentha haplocalyx Criq Leaves: optimization of extraction process by response surface methodology and antioxidant activity[J].Food Science, 2013,34(06): 124-128.
[9] 杨文鸽, 谢果凰, 颜伟华, 等.响应面分析法优化海鳗的湿腌工艺[J].中国食品学报,2010,10(1):133-139.DOI: 10.16429/j.1009-7848.2010.01.010. YANG W G, XIE G H, YAN W H, et al.Optimization of wet-salting technology for Muraenesox Cinereus using resonse surface analysis[J].Journal of Chinese Instiute of Food Science and Technology, 2010,10(1): 133-139.DOI: 10.16429/j.1009-7848.2010.01.010.
(责任编辑:梁俊红)
Optimization of ultrasound extraction technology with acid of emodin from herba dianthi by response surface methodology
YANG Xiaoyu1, LI Cheng2, MA Siyue1, LI Jianheng1
(1.College of Pharmaceutical Sciences, Hebei University, Baoding 071002, China; 2.College of Engineering, The University of Iowa, Iowan 52240, America)
Response surface methodology was used to optimize the optimal ultrasound extraction technology of emodin from herba dianthi.With the amount of extraction of emodin as an indicator, single-factor test was used to investigate the effect of ethanol volume fraction, solid-liquid ratio, ultrasound time, temperature, mass fraction of hydrochloric acid and dosage on the amount of extraction of emodin.The results were combined with Box-Benhken design of design-expert software and response surface analysis to optimize the technology parameters for extraction process of herba dianthi, and compare with extraction technology of emodin from Polygonum cuspidatum in the Pharmacopoeia.Obtain the optimal ultrasound extraction technology under the following conditions: liquid- solid ratio was 61, 40 ℃,30 min, hydrochloric acid mass fraction 8%, 1 mL.Ultrasound extraction technology of emodin by response surface methodology is time-saving, stable, and the amount of extraction is higher than condensation reflux method.It’s provide theoretical basis for quality evaluation of Dianthus superbus.
emodin; ultrasound extraction technology; response surface methodology
10.3969/j.issn.1000-1565.2017.04.007
2016-11-14
河北大学自然科学研究计划项目(3333112)
杨晓宇(1992—),女,河北邯郸人,河北大学在读硕士研究生.E-mail: 792033491@qq.com
李建恒(1964—),男,河北保定人,河北大学教授,主要从事中药药理方面的研究.E-mail:lijianheng@hbu.cn
R917
A
1000-1565(2017)04-0369-09

