锌促进的烯烃氢烷基化反应
万晓龙, 陈衍炽,孙雨人,钱群
(上海大学 材料科学与工程学院,上海 200444)
锌促进的烯烃氢烷基化反应
万晓龙, 陈衍炽,孙雨人,钱群
(上海大学 材料科学与工程学院,上海 200444)
季全碳中心的构筑一直是有机合成中的难点和热点,其中以廉价三级溴代烷为原料,通过分子间C(sp3)—C(sp3)键形成来合成该类季全碳中心更是鲜有报道.采用廉价锌粉作为还原性自由基引发剂,诱导三级溴代烷形成叔碳自由基,进而实现用烯烃捕获该自由基的策略来高效构筑C(sp3)—C(sp3)键季全碳中心.
还原偶联; C(sp3)—C(sp3)键;锌
季全碳中心的构筑一直是有机合成中的难点和热点,通过亲核试剂与亲电试剂的偶联是一种高效的构建季全碳手性中心方法[1-13].但是这种方法对于构建C(sp3)—C(sp2)键比较有效,对于构建C(sp3)—C(sp3)键比较困难[14-15].最近本课题组以锌粉作为还原剂,成功实现了镍催化烷基溴化物交叉偶联反应,在生成C(sp3)—C(sp3)键的同时,完成了季碳的构建[16].该反应可能是自由基的机理,在锌粉作为还原剂的情况下,三级烷基溴化物被还原生成叔碳自由基,启动该反应.通过自由基与烯烃加成是构建C(sp3)—C(sp3)键的另一种高效方法[17].设想能否通过叔碳自由基与烯烃加成构建季碳C(sp3)—C(sp3)键.基于本小组报道的镍催化烷基溴化物交叉偶联反应,设想采用廉价还原性金属作为自由基引发剂,诱导三级溴代烷形成叔碳自由基,进而用活化的烯烃捕获该自由基的策略来高效构筑C(sp3)—C(sp3)键季全碳中心.叔碳自由基作为一个亲核性自由基,与缺电子烯烃有较高的反应活性,因此选用α,β-不饱和羰基化合物作为烯烃底物.
1 实验部分
1.1 试剂和仪器
试剂:N,N-二甲基乙酰胺(DMA, Acros),二甲基亚砜(DMSO, Aladdin),碘化钠(NaI, 韶远),锌粉(Zn,Aldrich),溴化镁(Alfa Aesar),氯化锌、溴化锌、氯化钙、溴化钙、溴化铁 ( Aldrich),其他实验所需试剂来自安耐吉.
仪器:核磁共振波谱仪(AV500 MHz, Bruker).
1.2 条件优化
通用操作步骤A:在手套箱中氮气条件下,向schlenk管中加入烯丙基酯1a (48.6 mg; 0.3 mmol),锌粉(39 mg, 0.6 mmol) 和 NaI (45 mg, 0.3 mmol),然后塞上橡皮塞,拿出手套箱.随后向其中加入1.0 mL 超干 DMA (dimethylacetamide),最后用微量注射器将四级烷基溴 2a注入其中,室温搅拌12 h.反应液中加入饱和氯化铵(10 mL)和乙酸乙酯(10 mL)淬灭反应.分液,水相用乙酸乙酯洗涤2次.合并有机相,无水硫酸镁干燥,抽滤,旋干,粗品柱层析分离V(石油醚)∶V(乙酸乙酯) =25∶1.
1.2.1 添加剂的选择
根据通用操作步骤A,首先筛选了不同的卤素来源为添加剂,0.1 mol/L.的NaI给出最好的结果(表1,编号9),给出59%的收率.


表1 反应条件优化
* 添加剂浓度0.1 mol/L.
1.2.2 NaI用量选择
接下来对NaI的用量进行了筛选(表2),0.1 mol/L.的NaI给出最好的结果,NaI的投入量太高或太低都不利于反应收率.对比实验表明,不加锌粉时,反应不能发生.
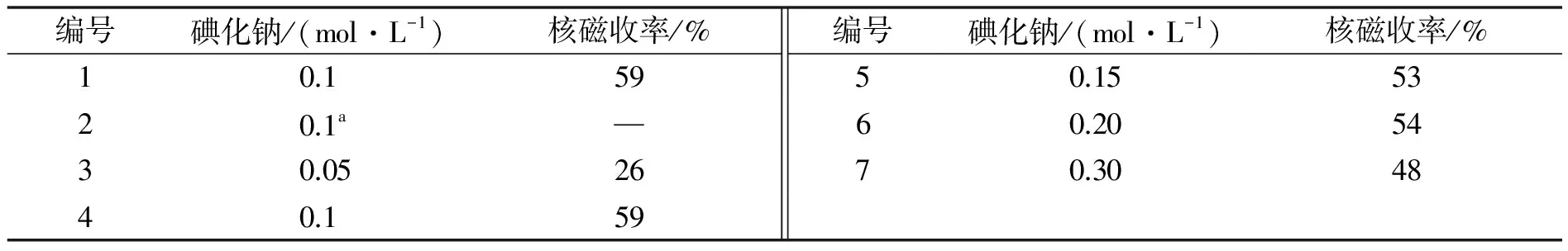
表2 NaI的用量筛选
a.不加Zn粉.
1.3 三级烷基溴化物的合成
通用操作步聚B: 由三级醇制备三级烷基溴化物的方法参照文献[18].0 ℃下,于三级醇(10 mmol)的二氯甲烷溶液中加入含有LiBr (1.80 g, 20 mmol)的HBr(质量分数为48 %)的水溶液.反应液恢复至室温搅拌过夜.反应结束后,加入乙醚稀释,有机相依次用水、饱和碳酸氢钠和食盐水洗涤,无水硫酸镁干燥,抽滤,旋干,柱层析分离即可得到目标化合物.
1c:根据通用操作步骤B由(3-羟基3-甲基丁基)苯甲酸酯合成得到.硅胶柱层析分离(V(石油醚)∶V(乙酸乙酯)=50∶1)得到目标产物1c(收率70%,无色液体).1H NMR(500 MHz, CDCl3):δ8.07~8.00(m, 2H),7.59~7.53(m,1H),7.47~7.39(m,2H),4.58 (t,J=6.7 Hz, 2H),2.31(t,J=6.7 Hz,2H),1.86(s,6H).13C NMR (125 MHz,CDCl3):δ166.6,133.1,130.2,129.7,128.5,64.4,63.2,45.6,34.9.HRMS (ESI) calculated mass calculated for [M+Na+] (C12H15BrNaO2):m/z293.0148;found:293.0150.
1d:根据通用操作步骤B由(3-羟基3-甲基丁基)4-甲氧基苯甲酸酯合成得到.硅胶柱层析分离(V(石油醚)∶V(乙酸乙酯)=20∶1)得到目标产物1d(收率65%,无色液体).1H NMR (500 MHz,CDCl3):δ7.98 (d,J=8.9 Hz, 2H), 6.91 (d,J=8.9 Hz, 2H), 4.54 (t,J=6.7 Hz, 2H), 3.85 (s, 3H), 2.29 (t,J=6.7 Hz, 2H),1.85 (s, 6H).13C NMR (125 MHz, CDCl3):δ166.3,163.5,131.8,122.6,113.8,64.5,62.9,55.6,45.6,34.9.HRMS (ESI) exact mass calculated for [M+Na+] (C13H17BrNaO3):m/z323.0253;found: 323.0256.
1e:根据通用操作步骤B由(3-羟基3-甲基丁基)4-氯苯甲酸酯合成得到.硅胶柱层析分离V(石油醚)∶V(乙酸乙酯)=50∶1得到目标产物 (收率70%,无色液体).
1H NMR(500 MHz, CDCl3):δ7.96 (d,J=8.6 Hz,2H),7.40(d,J=8.6 Hz,2H), 4.57 (t,J=6.8 Hz,2H), 2.29(t,J=6.8 Hz, 2H),1.84 (s, 6H).13C NMR (125 MHz,CDCl3):δ165.7,139.6,131.1,128.9,128.7,64.1,63.5,45.5,34.8.HRMS (ESI) exact mass calculated for [M+Na+] (C12H14BrClNaO2):m/z326.9758;found:326.9761.
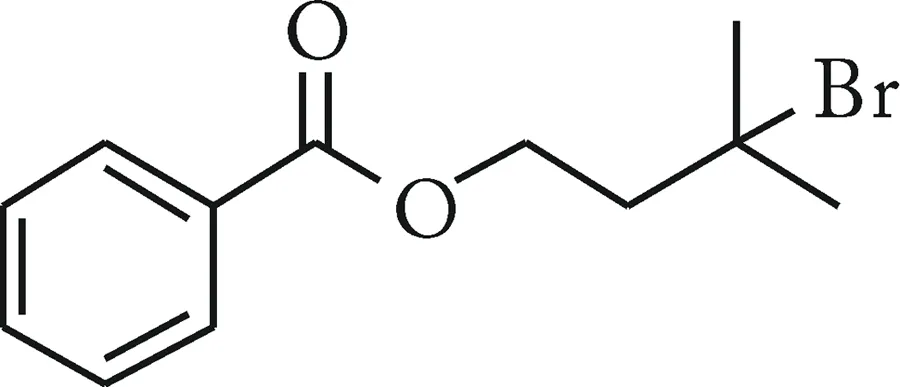
3-Bromo-3- methylpentyl benzoate (1c).

3-Bromo-3-methylbutyl 4-methoxybenzoate (1d)

3-Bromo-3-methylbutyl 4-chlorobenzoate (1e)
1.4 目标产物的合成
在得到最优条件后,对烷基溴化物的官能团兼容性进行了考察(图1):更长碳链(3b);不同电性(3c-3e)及不同碳链(3h、3i)的苯甲酸酯;杂环容易被氧化的负电子呋喃环(3f);在自由基反应中易发生亲原子攫取的苄基(3g);在自由基反应中末端烯烃往往有更高的反应活性的内烯烃(3ab、3bb及3cb)都能得到相应目标产物.
2 结果与讨论
以丙烯酸苄酯(1a)和溴代叔丁烷(2a)作为标准底物,对反应条件进行了优化.在以0.2 mol/L.的单质Zn作为催化剂,0.1 mol/L.的ZnCl2作为添加剂,1 mL的DMA作为溶剂的条件下,室温反应12 h, 就能以37%的核磁收率得到目标产物3a.受之前工作的启发,考虑到添加剂在反应中可能起到重要作用,首先对添加剂进行了筛选.从表1中可以看到,当使用氯化铜作为添加剂时,在核磁上仅能观察到产物.可见阳离子对反应有重要影响.对其他氯盐筛选时,发现当使用0.1 mol/L.的CaCl2作为添加剂时收率可以进一步提升至52%.而使用TBAI作为添加剂时目标产物的核磁收率达到53%,进一步的优化发现,当使用NaI作为添加剂时反应收率可以提升至59%,后续对其他金属盐的筛选无法使反应的收率进一步提高.随后对NaI的用量也进行筛选(表2),发现仍然是0.1 mol/L.的NaI反应效果最佳,降低用量收率大幅降低,而增加其用量收率稍有减少.后续的进一步优化并没有使反应的收率进一步提高.对照实验发现,当反应中不加入单质Zn时,反应无法发生.在此基础上,以丙烯酸苄酯1a作为限制试剂,0.2 mol/L.的三级烷基溴化物作为反应试剂,在以0.2 mol/L的单质Zn作为介导试剂,0.2 mol/L的碘化钠作为添加剂,DMA作为溶剂的条件下对该反应的底物普适性进行了考察.
从图1中可以看到,对于大多数底物反应的收率并不是太高,标准底物1a以47%的分离收率得到目标产物.对于三级烷基溴化物,该反应具有一定的官能团容忍性,卤素如氯原子(3cb)在该反应中是可以兼容的,这样得到的产物可以通过偶联等反应进一步转化.杂环呋喃(3f)在反应中同样可以得到兼容.对丙烯酸酯的考察表明,β-甲基取代丙烯酸酯在该反应中以45%的分离收率得到产物3ab.

图1 反应目标产物Fig.1 Substrate scope
3i及3db的原料在标准反应条件下无论是与丙烯酸苄酯(1a)还是丁烯酸苄酯都无法得到相应的目标产物(3i及3db).可能是由于3i的原料在发生单电子转移生成的碳自由基易发生分子内1,5-氢迁移[19],生成新的自由基4,因而未能得到目标物(图2).

图2 中间体4的1,5-氢迁移反应Fig.2 1, 5- hydrogen transfer reaction of 4
根据以前的报道[12],可能存在如下的反应机理(图3):首先,单质溴与三级烷基溴化物发生单电子转移生成三级烷基自由基,该自由基具有良好的亲核性,快速与亲电试剂丙烯酸酯发生自由加成反应,此时亲核的自由基转变成亲电的自由基中间体,该中间体与一价锌相互作用生成二价锌中间体,最后,处理得到目标产物.

图3 反应可能的机理Fig.3 Possible mechanism of reaction
3 总结
以廉价金属Zn作为介导试剂,使用三级烷基溴化物作为烷基源,实现了丙烯酸酯类化合物烯烃的氢烷基化反应,为构筑含有季全碳中心的化合物的提供了新的思路.虽然目前反应的效率并不是太高,但该反应的发生说明此反应的进行是具有现实可能性的.目前本课题组仍然在对该反应作进一步优化.
[1] TERAO J, TODO H, BEGUM S A, et al.Copper-catalyzed cross-coupling reaction of grignard reagents with primary-alkyl halides: remarkable effect of 1-Phenylpropyne [J].Angewandte Chemie International Edition, 2007, 46: 2086-2089.DOI: 10.1002/anie.200603451.
[2] REN P, STERN L A, HU X L.Copper-catalyzed cross-coupling of functionalized alkyl halides and tosylates with secondary and tertiary alkyl grignard reagents [J].Angewandte Chemie International Edition, 2012, 51: 9110-9113.DOI: 10.1002/anie.201204275.
[3] YANG C T, ZHANG Z Q, LIANG J, et al.Copper-catalyzed cross-coupling of nonactivated secondary alkyl halides and tosylates with secondary alkyl grignard reagents [J].Journal of the American Chemical Society,2012, 134: 11124-11127.DOI: 10.1021/ja304848n.
[4] HINTERMANN L, XIAO L, LABONNE A.A general and selective copper-catalyzed cross-coupling of tertiary grignard reagents with azacyclic electrophiles [J].Angewandte Chemie International Edition, 2008, 47: 8246-8250.DOI: 10.1002/anie.200803312.
[5] IWASAKI T, TAKAGAWA H, SINGH S P, et al.Co-catalyzed cross-coupling of alkyl halides with tertiary alkyl grignard reagents using a 1,3-butadiene additive [J].Journal of the American Chemical Society, 2013, 135: 9604-9607.DOI: 10.1021/ja404285b.
[6] THAPA S, KAFLE A, GURUNG S K, et al.Ligand-free copper-catalyzed negishi coupling of alkyl-, aryl-, and alkynylzinc reagents with heteroaryl iodides [J].Angewandte Chemie International Edition, 2015, 54: 8236-8240.DOI: 10.1002/anie.201502379.
[7] MARTIN R, BUCHWALD S L.An improved protocol for the Pd-catalyzed α-arylation of aldehydes with aryl halides [J].Org Lett, 2008, 10: 4561-4564.DOI: 10.1021/ol8017775.
[8] JOSHI-PANGU A, WANG C Y, BISCOE M R,Nickel-catalyzed kumada cross-coupling reactions of tertiary alkylmagnesium halides and aryl bromides/triflates [J].Journal of the American Chemical Society, 2011, 133: 8478-8481.DOI: 10.1021/ja202769t.
[9] ZULTANSKI S L, FU G C.Nickel-catalyzed carbon-carbon bond-forming reactions of unactivated tertiary alkyl halides: suzuki arylations [J].Journal of the American Chemical Society, 2013, 135: 624-627.DOI: 10.1021/ja311669p.
[10] GHORAI S K, JIN M, HATAKEYAMA T, et al.Cross-coupling of non-activated chloroalkanes with aryl grignard reagents in the presence of iron/N-heterocyclic carbene catalysts [J].Org Lett,2012, 14:1066-1069.DOI: 10.1021/ol2031729.
[11] TSUJI T, YORIMITSU H, OSHIMA K. Cobalt-catalyzed coupling reaction of alkyl halides with allylic grignard reagents [J].Angewandte Chemie International Edition, 2002, 41: 4137-4139.DOI: 10.1002/1521-3773(20021104)41:21<4137::AID-ANIE4137>3.0.CO;2-0.
[12] DUNSFORD J J, CLARK E R, INGLESON M J.Direct C(sp2)—C(sp3) cross-coupling of diaryl zinc reagents with benzylic, primary, secondary, and tertiary alkyl halides [J].Angewandte Chemie International Edition, 2015, 54: 5688-5692.DOI: 10.1002/anie.201411403.
[13] HUANG C Y, DOYLE A G.Electron-deficient olefin ligands enable generation of quaternary carbons by Ni-catalyzed cross-coupling [J].Journal of the American Chemical Society, 2015, 137: 5638-5641.DOI: 10.1021/jacs.5b02503.
[14] WANG X, WANG S L, XUE W C, et al.Nickel-catalyzed reductive coupling of aryl bromides with tertiary alkyl halides [J].Journal of the American Chemical Society, 2015, 137: 11562-11565.DOI: 10.1021/jacs.5b06255.
[15] ZHAO C L, JIA X, WANG X, et al.Ni-catalyzed reductive coupling of alkyl acids with unactivated tertiary alkyl and glycosyl halides [J].Journal of the American Chemical Society, 2014, 136: 17645-17651.DOI: 10.1021/ja510653n.
[16] XU H L, ZHANG Y W, WANG S L, et al. Optimization of ligands in nickel-catalyzed cross-coupling of alkyl halides [J].Journal of Shanghai University(Natural Science Edition) 2014, 20: 221-227.DOI: 10.3969/j.issn.1007-2861.2013.07.006.
[17] QIN T, MALINS L R, EDWARDS J T, et al.Nickel-catalyzed barton decarboxylation and giese reactions: a practical take on classic transforms [J].Angewandte Chemie, 2017, 129: 266-271.DOI: 10.1002/ange.201609662.
[18] DUDNIK A S, FU G C.Nickel-catalyzed coupling reactions of alkyl electrophiles, including unactivated tertiary halides, to generate carbon-boron bonds [J].Journal of the American Chemical Society 2012, 134: 10693-10697.DOI: 10.1021/ja304068t.
[19] ZHANG J, LI Y, ZHANG F, et al.Generation of alkoxyl radicals by photoredox catalysis enables selective C(sp3)-H functionalization under mild reaction conditions [J]. Angewandte Chemie International Edition, 2016, 55: 1872-1875.DOI: 10.1002/anie.201510014.
(责任编辑:梁俊红)
Zinc promoted alkylation of olefins with hydrogen
WAN Xiaolong, CHEN Yanchi, SUN Yuren, QIAN Qun
(School of Materials Science and Engineering, Shanghai University, Shanghai 200444, China)
The construction of the quaternary carbon center has been a difficult and hot issue in organic synthesis.In particular, the synthesis of quaternary carbon center by the formation of the intermolecular C(sp3)—C(sp3) bond with cheap tert-alkyl bromides is rarely reported.Recently, our group reported that nickel-catalyzed reductive coupling of aryl bromides with tertiary alkyl halides.Based on this, we proposed that using cheap reductive metal as a free radical initiator, mediated the formation of tertiary carbon free radicals from tert-alkyl bromides, and then the free radical captured by olefin to build C(sp3)—C(sp3) bond quaternary carbon center efficiently.Herein, we report the application of this strategy in constructing quaternary carbon center by Zn powder mediated reductive coupling reaction.
reductive coupling; C(sp3)—C(sp3) bonds; Zinc
10.3969/j.issn.1000-1565.2017.04.006
2016-12-10
国家自然科学基金面上项目(21372151)
万晓龙 (1983—),男,吉林农安人,上海大学在读博士研究生,主要从事有机合成研究. E-mail:wanxiaolong1983@163.com
钱群(1968—),女,上海人,上海大学副教授,博士,主要从事有机合成研究. E-mail:qianqun@shu.edu.cn
O621
A
1000-1565(2017)04-0364-05

