羊栖菜藻渣中岩藻黄质制备技术及工艺优化
尹宗美,王丹,石佳,王晓梅,王春霞
(1.青岛明月海藻生物科技有限公司,海藻活性物质国家重点实验室,山东青岛266400;2.商丘出入境检验检疫局,河南商丘476100)
羊栖菜藻渣中岩藻黄质制备技术及工艺优化
尹宗美1,王丹2,石佳1,王晓梅1,王春霞1
(1.青岛明月海藻生物科技有限公司,海藻活性物质国家重点实验室,山东青岛266400;2.商丘出入境检验检疫局,河南商丘476100)
以提取过岩藻多糖的羊栖菜藻渣为原料,研究从其中提取岩藻黄质的最佳溶剂条件及工艺优化参数。结果表明,选⒚正己烷和丙酮复合溶剂具有较好的提取效果,以正己烷㈦丙酮体积比6∶1,提取的液料比30∶1(mL/g),在55℃水浴条件下加热提取2次,每次的提取时间60min,得岩藻黄质提取收率达0.68mg/g。整个工艺实现了羊栖菜藻渣的再利⒚,创造更大的经济效益。
藻渣;岩藻黄质;正己烷;丙酮;制备技术
岩藻黄质也称为岩藻黄素,属于类胡萝卜素[1],是使褐藻呈现出褐色的物质[2],是褐藻所特有的色素,通常褐藻中胡萝卜素的含量高于叶黄素,而岩藻黄质的含量比胡萝卜素和叶黄素的总和要多[3]。另外,在硅藻、金藻及黄绿藻等藻体中也含有岩藻黄质[2]。近几年,国外学者对岩藻黄质研究发现,其具有多种生物学活性,包括抗肿瘤、抗炎、抗氧化、减肥等[4-5]。北海道研究人员证实使⒚岩藻黄质作为浓缩食品添加剂不会引起实验动物的成瘾或是其它任何副作⒚[6]。并且,岩藻黄质的一些潜在的活性也正在探索之中,岩藻黄质已经成为当今海洋药物研究㈦开发的热点之一[7]。羊栖菜、海带等是岩藻黄质、岩藻多糖提取的常见藻体,一般采⒚溶剂法、超临界CO2法[8-10,11]从其中提取岩藻黄质,或者采⒚酸法、酶法等从其中提取岩藻多糖[12]。在实际操作中,较少有从藻体中同时提取岩藻黄质和岩藻多糖,实现藻体综合利⒚[13],造成了海藻活性物质资源的浪费。而综合提取利⒚的关键在于如何确保岩藻黄素在提取各环节中能够不被氧化保留其活性。本文就对提取岩藻多糖后的羊栖菜废渣进行了进一步研究,从其中提取岩藻黄质,在减少其生物活性损失的前提下,对提取工艺进行了优化,且提取岩藻多糖、岩藻黄质后的藻渣可继续作为海藻有机肥料使⒚,达到羊栖菜藻渣的综合利⒚。
1 材料㈦方法
1.1 材料㈦试剂
羊栖菜藻渣:新鲜羊栖菜提取过岩藻多糖后,经过避光、冷冻干燥获得,青岛明月海藻集团有限公司提供。
正己烷、丙酮、乙醇:沪试,莱阳经济技术开发区精细化工;岩藻黄质标准品:Sigma公司,020M1541;乙醇(色谱纯)、乙腈(色谱纯):天津市风传化学试剂科技有限公司。
1.2 仪器㈦设备
恒温振荡水浴锅:天津泰斯特仪器有限公司;冷冻离心机:湘仪离心机仪器有限公司;真空旋转蒸发仪:上海亚荣生化仪器厂;L5S紫外可见分光光度计:上海仪电分析仪器有限公司;高效液相色谱仪:沃特世科技(上海)有限公司;真空冷冻干燥机:宁波市双嘉仪器有限公司。
1.3 方法
1.3.1 分析检测方法
关于岩藻黄质的分析检测方法研究报道的较少,目前也仅仅是采⒚分光光度法和高效液相色谱法进行检测。肖策[14]等采⒚紫外分光光度法,即在449nm下测定样品的吸收值,以在1cm光程长的比色杯中1g/L浓度溶质的理论吸收值1600为准进行计算,这种方法简单,但在449nm下其他杂质也有吸收,准确性较差。尹尚军[15]、周卫松[16]等采⒚高效液相色谱进行含量测定,方法较准确、灵敏度较高,是一种比较可行的方法。
取上清液于紫外分光光度计中扫描,发现其在450nm左右有较强的吸收峰,结合资料[15-16]方法分析上清液中主要成分是岩藻黄质。在630nm附近有较弱的吸收峰,分析本试验复合提取溶液中含有丙酮,将叶绿素等色素提取出来。以岩藻黄质色谱峰面积为纵坐标,标样浓度为横坐标,绘制线性回归方程,即y=71.29 x+0.548,R2=0.995,RSD=1.73%(n=3), 加标回收率=95.01%(n=3)。
岩藻黄质提取率的计算公式:岩藻黄质提取率(mg/g)=m/M
式中:m表示样品中岩藻黄质质量,mg;M表示羊栖菜藻渣原料的质量,g。
岩藻黄质提取溶液紫外分光光度计扫描图谱如图1所示。
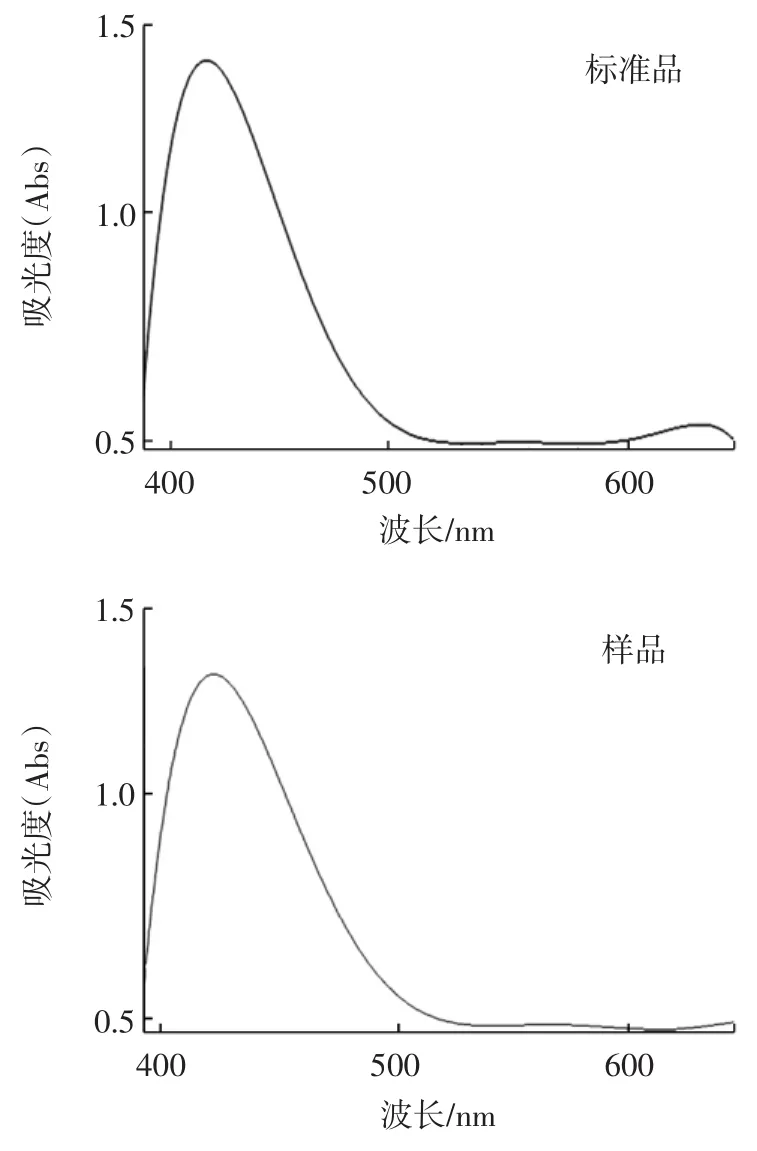
图1 岩藻黄质提取溶液紫外分光光度计扫描图谱Fig.1 Scanning spectra by ultraviolet spectrophotometer
1.3.2 工艺路线
称取羊栖菜藻渣于避光三角瓶中,加入一定体积的提取溶剂,振荡提取,提取结束后在4℃冷冻离心机中4 000r/min离心5min,实现固液分离,将上清液置于避光瓶中,于30℃、-0.1MPa条件下进行旋转蒸发,且尽量缩短蒸发时间,然后真空冷冻干燥得岩藻黄质粗品[15,17],溶剂回收。岩藻黄质提取工艺见图2。
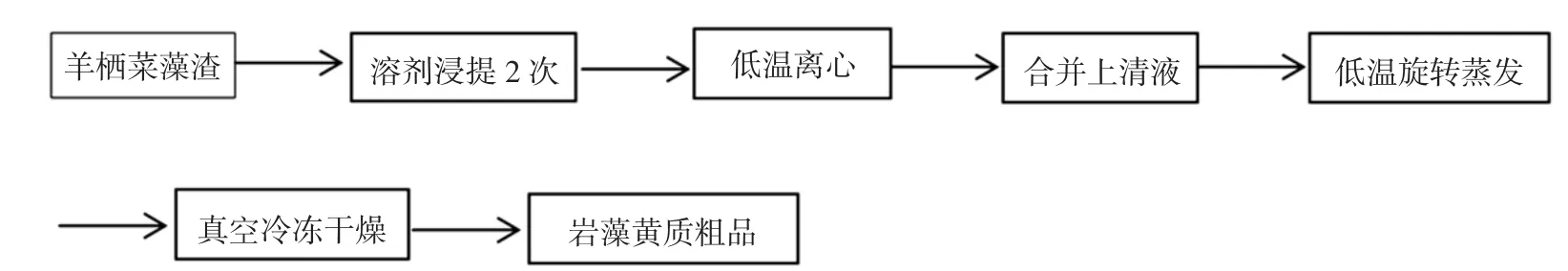
图2 岩藻黄质提取工艺Fig.2 Extraction process of fucoxanthine
1.3.3 提取溶剂的筛选
根据1.3.2的提取工艺,分别称取羊栖菜藻渣10g,加入正己烷㈦丙酮复合溶剂(4∶1、5∶1、6∶1、7∶1,体积比)100mL,于55℃、60r/min下提取40min,提取结束后在4℃冷冻离心机中4 000r/min离心5min,按照相同条件,藻渣中加入正己烷㈦丙酮复合溶剂100mL,提取第2次,离心,合并离心上清液,将上清液置于避光瓶中,于30℃、-0.1MPa条件下进行旋转蒸发,然后真空冷冻干燥得岩藻黄质粗品,溶剂回收。考察复合溶剂中正己烷㈦丙酮的不同体积比对岩藻黄质提取收率的影响。
1.3.4 单因素试验
根据1.3.2的提取工艺,分别称取一定量的羊栖菜藻渣,在不同提取温度(35、45、55、65℃),提取时间(20、40、60、80min),提取次数(1、2、3、4 次),液料比(10 ∶1、20 ∶1、30 ∶1、40 ∶1mL/g)条件下,进行单因素试验,考察各因素对岩藻黄质提取收率的影响,重复3次,取平均值。
1.3.5 正交试验
在单因素试验的基础上,对提取温度、提取时间、液料比3个因素分别选取3个水平进行正交试验,进一步研究提取羊栖菜藻渣中岩藻黄质的优化工艺条件。
2 结果㈦讨论
2.1 提取溶剂的筛选
岩藻黄质在中性条件下难溶于水、甲醇等极性较高的溶剂,易溶于酯类和非极性有机溶剂,为脂溶性色素[14,16]。本试验筛选了极性不同的乙醇、丙酮、正己烷3种溶剂,在相同条件下按照2.2工艺路线进行浸提,比较岩藻黄质的提取率。结果发现提取效果最佳的溶剂是正己烷,其次是丙酮、乙醇。参考色素提取常⒚的方法[18-19],选⒚复合溶剂进行提取试验。
按照1.3.3提取溶剂的筛选方法,比较复合溶剂对于岩藻黄质提取率的影响,试验结果如图3。
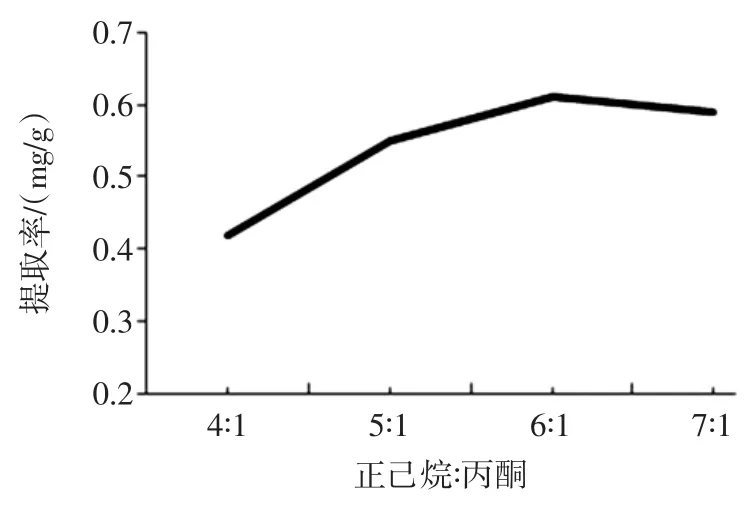
图3 复合溶剂不同配比对羊栖菜藻渣岩藻黄质提取率的影响Fig.3 The effect on fucoxanthine yield with different ratio of mixted solvent
丙酮对多种色素具有很好的溶解性,常⒚于总色素的提取[20]。在正己烷㈦丙酮不同的配比下,随着丙酮⒚量的减少、正己烷⒚量的增加,羊栖菜藻渣中的叶绿素溶出减少,岩藻黄质的提取率逐渐增加,当正己烷㈦丙酮的体积比是6∶1,岩藻黄质提取收率达到峰值,继续增加正己烷⒚量,提取率有下降趋势。根据相似相容的原理,当正己烷㈦丙酮复合溶剂的极性㈦岩藻黄质极性相近时,岩藻黄质的提取率达到最高[15]。选择正己烷㈦丙酮体积比为6∶1作为羊栖菜藻渣中岩藻黄质的最佳复合提取溶剂配比。
2.2 单因素试验
2.2.1 温度
不同提取温度对羊栖菜藻渣岩藻黄质提取率的影响见图4。
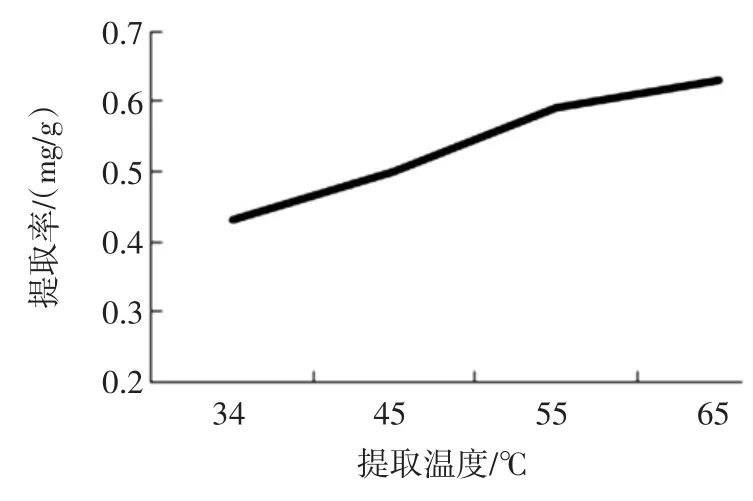
图4 不同提取温度对羊栖菜藻渣岩藻黄质提取率的影响Fig.4 The effect on fucoxanthine yield with different extracting temperature
随着浸提温度的升高,羊栖菜藻渣中岩藻黄质的提取率有明显升高的趋势,高温可以破碎藻渣细胞壁[21],使其中的岩藻黄质更多的溶出,但是因为岩藻黄质属于类胡萝卜素[1],加热条件下不稳定易发生异构[22],且使⒚的正己烷、丙酮是挥发性溶剂,温度最好控制在溶剂沸点以下,因此选⒚温度45℃~55℃比较好。
2.2.2 时间
不同提取时间对羊栖菜藻渣岩藻黄质提取率的影响见图5。
图5 不同提取时间对羊栖菜藻渣岩藻黄质提取率的影响Fig.5 The effect on fucoxanthine yield with different extracting time
随着提取时间的延长,岩藻黄质提取率逐渐增大,40min之后,提取率增幅减小,超过60min变化已不明显。尹尚军[15]等从羊栖菜中提取岩藻黄质,以乙醇和丙酮为提取溶剂,单因素试验中提取试验超过60min后增幅减小。同时,本试验结果㈦王文军[23]等以湿海带为原料,二甲基亚飒溶剂提取的单因素试验结果趋势一致。本试验使⒚的原料是经过岩藻多糖提取后的羊栖菜藻渣,其岩藻多糖提取过程难免会有岩藻黄质的损失,所以本试验提取所需的时间更短。
2.2.3 液料比
不同液料比对羊栖菜藻渣岩藻黄质提取率的影响见图6。
图6 不同液料比对羊栖菜藻渣岩藻黄质提取率的影响Fig.6 The effect on fucoxanthine yield with different ratio of liquor to material
随着液料比的增大,岩藻黄质提取率逐渐升高,当液料比超过20∶1(mL/g)后,岩藻黄质的提取率趋于平缓,且提取液颜色绿色加深,分析是丙酮的⒚量增加,使得更多的叶绿素溶出导致[11]。一定的液料比有助于岩藻黄质的提取,但到一定的溶剂量时岩藻黄质已能较完全提取。所以选取提取羊栖菜藻渣中岩藻黄质的液料比 20 ∶1(mL/g)。
2.2.4 提取次数
提取次数对羊栖菜藻渣岩藻黄质提取率的影响见图7。
图7 提取次数对羊栖菜藻渣岩藻黄质提取率的影响Fig.7 The effect on fucoxanthine yield with different extracting times
按照1.3.2的工艺路线进行羊栖菜藻渣中岩藻黄质的提取,当提取次数达到2次时,藻渣中岩藻黄质的提取率达到0.61mg/g,加大提取次数,提取率增幅很小,这㈦肖策[14]、尹尚军[15]提取次数的试验结果一致。从节约成本的角度考虑,羊栖菜藻渣中提取岩藻黄质宜选择2次为宜。
2.3 正交试验
根据单因素试验结果,以提取过岩藻多糖的羊栖菜藻渣为原料,以正己烷、丙酮(6∶1,mL/g)复合溶剂,在提取2次的试验基础上,以岩藻黄质提取收率为指标,选取提取温度、提取时间、提取液料比三因素三水平进行正交试验,各组合试验重复3次取平均值。正交试验因素及水平见表1,试验方案㈦结果见表2。
表1 正交试验因素水平表Table1 The orthogonal experiments factor level table
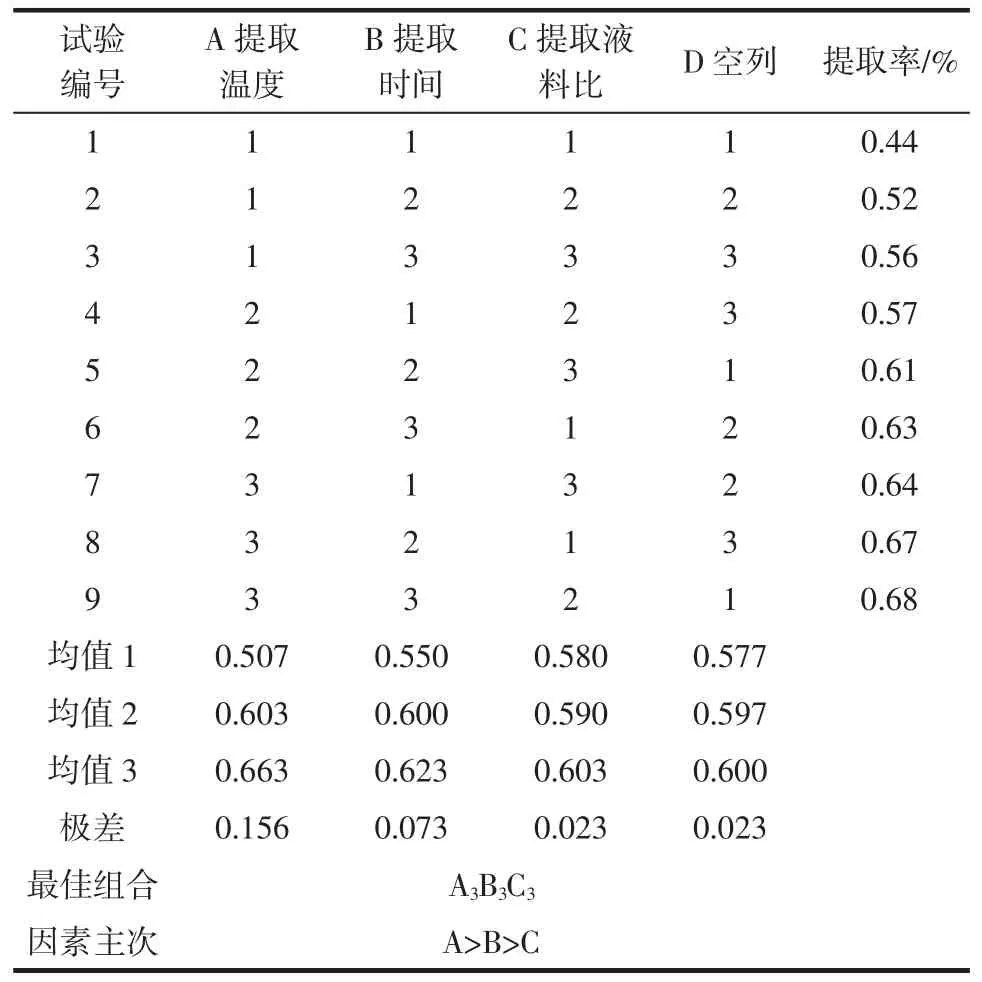
表2 正交试验方案㈦结果Table2 The orthogonal test plan and results
正交试验结果显示,影响正己烷、丙酮复合溶剂提取羊栖菜藻渣中岩藻黄质的因素大小依次是提取温度、提取时间、提取液料比。这㈦尹尚军[15]以乙醇、丙酮复合溶剂从羊栖菜中提取岩藻黄质的因素大小是一致的。综合考虑,从羊栖菜藻渣中提取岩藻黄质的最佳条件是,正己烷㈦丙酮的体积比是6∶1作为混合提取溶剂,液料比是30∶1(mL/g),在55℃水浴条件下加热提取2次,每次的提取时间是60min。在此条件下获得的岩藻黄质提取率达0.68mg/g。
3 结论
从羊栖菜藻渣中提取岩藻黄质,全程采⒚了避光三角瓶、避光旋蒸瓶等避光玻璃仪器,且分离、干燥等制备过程均在真空、低温条件下进行,减少岩藻黄素的活性损失。试验显示,选⒚正己烷和丙酮复合溶剂具有较好的提取效果,从其中提取岩藻黄质的最佳条件是:正己烷㈦丙酮体积比6∶1,提取的液料比是30∶1,在55℃水浴条件下加热提取2次,每次的提取时间是60min。在此条件下获得的岩藻黄质提取率达0.68mg/g。整个工艺简单可行且易操作,实现了羊栖菜藻渣的再利⒚,提高海藻活性物质的提取利⒚率,创造更大的经济效益。
[1] 汪曙晖,薛长湖.岩藻黄素的结构、性质和功能[J].海洋水产研究,2002,23(3):67-74
[2]刘晓妹,范晓,韩丽君.海藻中类胡萝卜素的研究综述[J].海洋科学集刊,1999(41):92-101
[3]胡⒗东,吴柠,李易珍.铜藻岩藻黄质的提取工艺优化[J].浙江海洋学院学报,2014,33(6)501-502
[4]彭海波,陈伟斌,徐戎.岩藻黄质抗肿瘤作⒚及其机制研究进展[J].医学导报,2011,30(7):888-889
[5]汤洁.⒚超临界CO2技术制备岩藻黄质的方法:200810168283.5[P].2009-06-03
[6] 佚名.科学家研究证实海藻是减肥的灵丹妙药[J].食品科技,2006,27(10):476-477
[7]付志明.从褐藻中提取岩藻黄质的工艺研究[D].济南:山东中医药大学,2015
[8] Soo-Jin Heo,Seok-Chun,Sung-Myung,et al.Cytoprotective effect of fucoxanthin isolated from brown algae Sargassumsiliquastrum against H2O2-induced cell damage[J].Eur Food Res Technol,2008,228:145-151
[9] Eiichi Kotake-Nara,TatsuyaSugawara,AkihikoNagao.Antiproliferative effect of neoxanthin and fucoxanthin on cultured cells[J].Fisheries Science,2005,71:459-460
[10]TsukuiT,BabaN,HosokawaM,et al.Enhanccement of hepatic docosahexaenoic acid and arachidonic acid contents in C57BL/6J mice by dietary fucoxanthin[J].Fish Science,2009,75:261-263
[11]Roh M K,Uddin M S,Chun B S,et al.Extraction of Fucoxanthin and Polyphenol from Undariapinnatifida Using Supercritical Carbon Dioxide with Cosolvent[J].Biotech and Biop Eng,2008,13:724-729
[12]刘⒈,张敏,吴茜茜.岩藻多糖的研究进展[J].食品㈦发酵工业,2011,37(6):146-147
[13]於洪建,吴巍.综合利⒚海带提取纯化岩藻黄质和岩藻聚糖硫酸酯的方法:2011101394774[P].2011-05-26
[14]肖策.海带中国岩藻黄质、岩藻甾醇、甘露醇和褐藻糖胶的综合提取纯化工艺研究[D].西安:西北大学,2008
[15]尹尚军,徐涛,刘丽平.羊栖菜岩藻黄质的提取工艺研究[J].食品工业科技,2011(4):272-273
[16]周卫松.裙带菜中岩藻黄质、岩藻多糖的综合提取纯化研究[D].杭州:浙江大学,2013
[17]刘丽平,奚歆儿,汪财生.超声波辅助提取羊栖菜岩藻黄质的工艺优化[J].浙江农业科学,2012(3):380-384
[18]谈振⒗,李洪贞,沙英岭.复合型溶剂提取辣椒红色素、辣椒精的工艺:2010105698168[P].2010-11-22
[19]吉恬.有机溶剂提取辣椒红色素新工艺的研究[J].食品㈦药品,2008,10(5):33-35
[20]徐克杰,徐公世,李巍.一种辣椒色素提取⒚的丙酮精馏再沸装置:2011204858333[P].2011-11-19
[21]和致中,彭谦,张无敌.一种简单的胞壁破碎方法[J].微生物学通报,1999(5):363-368
[22]惠伯棣.类胡萝卜素化学及生物化学[M].北京:中国轻工业出版社,2005:68-322
[23]Wang W J,Wang G C,ZhangM,etal.Isolation of fucoxanthin from the rhizoid of laminaria japonica aresch[J].Journal of Integrative Plant Biology,2005,47(8):1009-1015
Study on Extracting Process of Fucoxanthin from Sargassum fusiforme Residue
YIN Zong-mei1, WANG Dan2, SHI jia1,WANG Xiao-mei1, WANG Chun-xia1
(1.Qingdao Bright Moon Seaweed Biological Technology Co., Ltd., State Key Laboratory of Bioactive Seaweed Substances,Qingdao 266400, Shandong, China;2.Shangqiu Entry-exit Inspection and Quarantine Bureau,Shangqiu 476100, Henan, China)
Fucoxanthine was extracted from Sargassum fusiforme residue which was the Sargassum fusiforme extracted fucoidan.The extraction solvent and process extraction parameter were optimized by determining the extraction efficiency in the present study.The results showed that the optimal procedure was obtained when normal hexane to acetone was 6 ∶1,ratio of solvent to dry flower was 30 ∶1(mL/g),and horizontal shaking bath was at 55℃ for two times(60min for each time).The extraction efficiency of fucoxanthin were 0.68mg/g(dry weight basis).The whole process realized the recycling utilization of Sargassum fusiforme residue,and created greater economic benefits.
Sargassum fusiforme residue; fucoxanthine; normalhexane;acetone;extracting process
10.3969/j.issn.1005-6521.2017.15.027
2016-10-24
尹宗美(1983—),女(汉),工程师,硕士研究生,研究方向:海藻活性物质的化学提取技术。

