上市前药物引起肝损伤的临床评估
安娜,唐健元,何如意
上市前药物引起肝损伤的临床评估
安娜,唐健元,何如意*
(国家食品药品监督管理总局药品审评中心北京100038)
药物及其代谢产物对肝脏产生的毒性称为药物性肝损伤(Drug Induced Liver Injury,DILI),是致药物撤市和不被批准上市的最常见原因之一。上市前药物引起肝损伤的临床评估是药品审评的重要内容,本文将从肝损伤的信号与海氏法则、临床评估和药物肝损伤的经验教训等方面进行介绍助力新药研发。
药物性肝损伤海氏法则临床评估肝毒性新药
新药上市前肝损伤的临床评估,不论是中医还是西医,在药品审评方面都很重要。在美国药品市场,曾经有很多批准入市的药因为在使用中引起肝损伤不得不被撤下来。从表1可以看出,自1979年起,每隔几年就有一种药被从市场上撤出。但是从2000年到2016年就再也没有类似的事情发生,主要是FDA从2000年起,已经知道如何评审这种药物了。也就是说,从2000起,凡是会引起肝损伤的药物,FDA基本上都没有批。由表2可见,1990年至2007年,每隔几年就有一种申请注册上市的适应症为高血压、关节炎等的药物因会引起肝损伤而不被批准。2007年10月,FDA发表了《药物肝毒性评价技术指导原则》(草案),2009年10月发布正式稿,制药企业对FDA的要求进行了明确,知道了如何评估药物是否会引起肝损伤,因此自2007年起至今,就没有再次发生因为检测出会引起肝损伤而导致药品被拒绝上市的情况。肝损伤是最常见的人体检查项目,也是导致药物撤市、不被批准、变成二线用药最常见的原因之一。因此,无论是中药还是西药,也无论是在中国还是在美国,制药企业都应该知道如何评估药物引起的肝损伤。而新药审批单位,不应该仅仅审评新药,更应该为制药企业提供服务,指导企业完善临床检测。
在FDA对于药物引起肝损伤的评估实践中,严重肝损伤(导致病人死亡或需要肝移植)的发生率是每10 000名患者发生1例,即被认为是不可接受的。但是在美国,一个典型的新药申请案例,临床实验一般仅做1 000到3 000个病例。严重肝损伤万分之一的发生率,在普通临床实验中几乎不会被发现的。因此,如何通过其他指标预测药物是否会引起严重肝损伤是十分重要的。
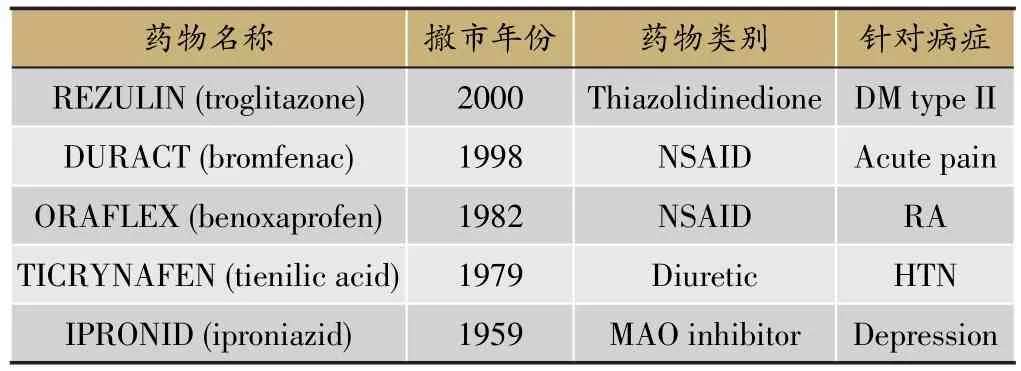
表1 由于肝损伤而撤市的药品

表2 由于肝损伤而没有被FDA批准上市的药品

图1 药物引起肝损伤的程度分类

图2 常用肝脏临床检验
一般来说,药物引起的肝损伤主要有以下特点[1-4]:①发生率低,大约1/10 000;②目前无法预测哪一类人群容易发生肝损伤;③无明显量效关系;④动物实验不能有效预测人体严重肝损伤,动物实验阳性的一般不会进入临床;⑤适应性(持续给药ALT增高转正常,适应性不代表肝损伤不严重或没有严重肝损伤);⑥尚未发现基因,代谢等特征可预测严重肝损伤。
1 肝损伤信号与海氏法则(Hy's Law)
由图1可知,药物引起肝损伤的程度分为6级。其中,第2级检出有轻度肝功能降低时,就需要引起警惕,需要采取措施预防病人进入更严重或不可逆的肝损伤阶段。
肝脏是一个代偿性非常强的器官,许多肝细胞损伤后能够恢复。但是太多肝细胞损伤,肝功能将有损害。临床检验中,血清酶增高并不代表肝功能的改变,而是代表肝损伤。临床常用的几项检测指标中,丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)的升高代表肝细胞损伤,碱性磷酸酶(alkaline phosphatase,ALP)和Υ-谷氨酰转移酶(Υ-glutamyl transferase,GGT)代表的是胆汁淤积;胆红素(bilirubin)的升高和凝血因子的下降代表的是肝功能的改变[5-6],如图2所示。
肝损伤的检测中,高比例ALT/AST≥3倍正常值上限(upper limit of normal,ULN)是最初药物性肝损伤(drug induced liver injury,DILI)信号,这个信号敏感性高,特异性差,安慰剂组也可出现。FDA批准的很多药品都存在转氨酶升高的现象,例如Aspirin,Tacrine等。Tacrine是治疗老年痴呆症的药物,50%的人服用此药物转氨酶都升高,但从来不会过渡到严重肝损伤。肝素是常用的药物,10%-20%的病人吃肝素都有不同程度的肝损伤,但并不会造成肝衰竭。高比例明显的ALT/AST升高(10-15倍ULN)是更特异一点的指标,很少见于自发的病例,但这个指标虽然敏感性高,特异性仍然不是很好。肝损伤最特异的指标是临床实验中一个或多个病人不但转氨酶升高,而且胆红素也升高,并能排除其他原因(例如ALP检测<2倍ULN),证明肝功能降低,则基本可以确定肝损伤。
由此总结Hy's法则病例定义如下:①与无肝毒性的对照药物或安慰剂相比,试验组高比率病例ALT或AST常升高至正常值上限(ULN)的3倍或以上;②在ALT/AST升高的受试者中,转氨酶高于正常值上限的3倍,血清总胆红素(TBL)升高大于正常值上限(ULN)的2倍,血清碱性磷酸酶活性(ALP)少于2倍ULN;③无其他原因可以解释转氨酶(AT)和TBL联合升高,如病毒性甲、乙或丙型肝炎、先前已存在的或急性肝病,或能引起所观察到的损伤的其他药物[7-11]。
依据Hy's法则进行药物临床试验,若发现一例符合Hy's法则指标的病例,情况就十分危险,发现2例,就是高度预测药物将造成严重的DILI。同时需要注意的是,药物引起的肝细胞损伤伴有黄疸是严重的损伤,有10%-50%的死亡的可能。在新药申请临床检测实践中,如果3 000例受试者中没有发现1例严重肝损伤的病例,基本可以认为该药是安全的,这个临床检测的正确率在95%以上。
2 DILI临床评估
Hyman J Zimmerman认为,药物引起的肝损伤无论在组织学还是在临床上,与其他肝病非常相似,做活体检测时,无法检测出是药物引起的肝损伤还是其他疾病造成的(例如病毒性肝炎),所以需要临床上仔细分析和判断[12-15]。
2.1 病人的选择
新药申请临床检测试验有以下原则:①病人ALT升高或有既往肝病史不应排除于临床试验之外;②肝病病人并不较其他人更易得DILI;③Ⅰ期、Ⅱ期临床试验先在正常肝指标病人进行,如没有肝损伤,再应用慢性肝病病人(Ⅲ期临床试验)。
2.2 DILI的检测
在新药临床试验的前3个月,ALT、AST、ALP、TBL每2-4周检测一次。在长期试验中,如果在合理的暴露期间后无肝损伤的体征,如3个月,则监测间隔可延长至每2-3个月一次。如果无肝毒性征象,后面的试验也可使用更低频度的肝化学监测;
2.3 DILI的确认
如果血清转氨酶增加至正常值的3倍以上就应紧接着在48-72小时内对四项常规血清学指标ALT、AST、ALP、TBL进行重复检查,确认异常情况并询问症状情况。如果症状持续或重复检查表明基线测量值正常的受试者转氨酶升高超过正常值上限的3倍,或者接受药物治疗前转氨酶已升高的受试者转氨酶比基线值高2倍,则应密切观察确定异常得到改善还是继续恶化。
2.4 密切观察
对于确认出现异常的病患,每周重复进行肝检查2-3次。如果异常状况稳定或者研究药物已停用且受试者无症状,则重复检查的频率可降为每周一次[15]。确认病患是否曾服用中药,了解症状及先前并发疾病更详细的病史。此外,还要排除其他原因引起的肝损伤,例如病毒性肝炎、酒精性肝炎、自身免疫性肝炎、胆道疾病、心血管疾病、先天性非溶血性黄疸等[16-18]。
2.5 停药标准
在新药临床检测中,如果病患出现了不良反应,在以下情况中,需要停止给药:①ALT或AST超过正常上限8倍;②ALT或AST持续2周以上超过正常上限5倍;③ALT或AST超过正常上限3倍,且TBL超过正常上限2倍;④ALT或AST超过正常上限3倍,且INR超过1.5;⑤ALT或AST超过正常上限3倍,且伴有体力衰竭、恶心呕吐、黄疸、高烧、皮疹。
对于出现副反应的病患,停止给药不一定会立即得到改善,但可能是唯一的治疗手段。停止给药后,应继续跟踪病人到其肝化学指标到正常或恢复到基线(给药停止后也可能出现DILI或DILI进展)。FDA对于出现副反应的病患,除非该药物是必须的,没有其他选择,或有足够证据证明该药没有或不会引起严重肝损伤,否则如果ALT>5倍ULN,就不支持再给药试验。存在免疫反应的DILI,如嗜酸粒细胞增多、皮疹、发热,再给药容易引起严重副反应,大多数病人能适应新化合物再给药,但再给药无反应不代表没有DILI[20-21]。对于可以接受再给药试验的病例,要告知病人危险,签署再给药知情同意书。
3 药物肝损伤的经验教训实例
3.1 DURACT溴芬酸(bromfenac)
DURACT是用于治疗关节炎的药物,临床实验中,其短期试验用于测试治疗疼痛未出现肝损伤;长期试验用于测试治疗慢性关节炎,有近3%的病人出现ALT超过正常上限3倍的情况。因此,该药获得了短期(小于10天)治疗关节疼痛的上市批准。但该药上市后,病人长期服用,6个月内出现几例急性肝衰竭、2例肝移植。当时的解决办法是修改药品说明书并通知医生警惕该药的毒性并留意病人的反应,但效果有限,最终该药不得不撤市。由此得出的经验教训是,非特异性肝损伤,短期用药没有造成肝损伤,绝不等于长期用药是安全的,也很难防止病人私下违规长期用药。
3.2 REZULIN曲格列酮(troglitazone)[22]
REZULIN是用于治疗糖尿病的药物,上市前临床实验做了2500例,其中近1.9%出现ALT超过正常上限3倍的情况,1.7%出现ALT超过正常上限5倍,5人出现ALT超过正常上限30倍,还有2例出现了Hy’s法则症状。审评员认为这2例情况特殊,没有引起注意,因此该药于1997年获批上市,上市后很快发现多例肝损伤、肝移植、甚至病人死亡的案例。1997年到1999年,FDA针对此药四次通知医生注意并提醒医生对服用此药的病人每月测一次肝功,但很难产生效果。经统计,用该药的病人总共发生94例肝损伤,其中19例从发现症状到病人死亡或进行肝移植,平均只有24天。因此仅仅通知医生对病人每月测一次肝功根本于事无补。2000年,该药被撤市。由此得出的经验教训是,临床试验出现符合Hy's法则的病例一定要引起注意。
3.3 EXANTA希美加群(ximelagatran)
EXANTA是一种口服抗凝剂,这个药是一个革命性的创新。该药针对所有适应症都做了长期和短期的临床实验,短期用药(36 mg,7-10天)用于预防静脉血栓;中期用药用于有过静脉血栓病史的病人预防再次发病(24 mg,18个月);长期用药用于预防房颤引起的脑卒中(36 mg,终生服用)。该药一共针对306 98个病人随机做了82项临床研究,175 93个病人是用药组,其中693 1人用药超过35天,502 4人用药超过半年,350 9人用药超过一年,远远超过了基本要求。实验中有18个病人在撤药后再给药,其中2例是阳性,37例出现ALT超标3倍以上且TBL超标2倍以上,其中排除其他因素引起的肝损伤,还有13例符合Hy's法则症状。因此,2004年该药没有在美国被批准上市,2006年从22个被批准上市的国家撤市。
4 总结与展望
通过以上新药上市案例,可以得到以下结论:①Hy's法则是可信赖的预测严重肝损伤的方法;②短期服用无肝损伤不能预测长期服用肝损伤;③持续服用药物后,转氨酶由阳转阴代表这个病人适应了这一药物,但不代表该药物在其他病人不引起严重肝损伤;④阳性病人再给药转阴性也不代表该药物在其他病人不会引起肝损伤。新药上市前肝损伤的临床评估,对临床试验者及在药品审评员都十分重要。
此文主要参考美国FDA“上市前药品引起肝损伤的临床评估指南”,作者之一何如意是该指南的起草和修订小组的负责人。
1Lee W M.Drug-induced hepatotoxicity.N Engl J Med,2003,349(5): 474-485.
2Yuan L,Kaplowitz N.Mechanisms of drug-induced liver injury.Clin Liver Dis,2013,17(4):507-518.
3Larrey D.Epidemiology and individual susceptibility to adverse drug re⁃actions affecting the liver.Semin Liver Dis,2002,22(2):145-155.
4Chalasani N,Fontana R J,Bonkovsky H L,et al.Causes,clinical fea⁃tures,and outcomes from a prospective study of drug-induced liver inju⁃ry in the United States.Gastroenterology,2008,135(6):1924-1934.
5Zimmerman H J.Drug-induced liver disease.Clin Liver Dis,2000,4(1): 73-96.
6Maddur H,Chalasani N.Idiosyncratic drug-induced liver injury:a clini⁃cal update.Curr Gastroenterol Rep,2011,13(1):65-71.
7Lewis J H.‘Hy's law,'the‘Rezulin Rule,'and other predictors of severe drug-induced hepatotoxicity:putting risk-benefit into perspective. Pharmacoepidemiol Drug Saf,2006,15(4):221-229.
8Björnsson E.Drug-induced liver injury:Hy's rule revisited.Clin Phar⁃macol Ther,2006,79(6):521-528.
9Navarro V J,Senior J R.Drug-related hepatotoxicity.N Engl J Med, 2006,354(7):731-739.
10 Reuben A.Hy's law.Hepatology,2004,39(2):574-578.
11 Zimmerman H J,Lewis J H.Chemical-and toxin-induced hepatotoxici⁃ty.Gastroenterol Clin North Am,1995,24:1027.
12 Suzuki A,Brunt E M,Kleiner D E,et al.The use of liver biopsy evalua⁃ tion in discrimination of idiopathic autoimmune hepatitis versus druginduced liver injury.Hepatology,2011,54(3):931-939.
13 Kleiner D E.The pathology of drug-induced liver injury.Semin Liver Dis,2009,29(4):364-372.
14Cullen J M.Mechanistic classification of liver injury.Toxicol Pathol, 2005,33(1):6-8.
15 Lee W M.Drug-induced hepatotoxicity.N Engl J Med,1995,333(17): 1118-1127.
16 Polson J,Lee W M,American Association for the Study of Liver Dis⁃ease.AASLD position paper:the management of acute liver failure.Hep⁃atology,2005,41(5):1179-1197.
17 Czaja A J.Drug-induced autoimmune-like hepatitis.Dig Dis Sci,2011, 56(4):958-976.
18 Rigas B.The evolving spectrum of amiodarone hepatotoxicity.Hepatolo⁃gy,1989,10(1):116-117.
19Farrell G C.Drugs and steatohepatitis.Semin Liver Dis,2002,22(2): 185-194.
20 Andrade R J,Lucena M I,Kaplowitz N,et al.Outcome of acute idiosyn⁃cratic drug-induced liver injury:Long-term follow-up in a hepatotoxici⁃ty registry.Hepatology,2006,44(6):1581-1588.
21 Björnsson E,Davidsdottir L.The long-term follow-up after idiosyncrat⁃ic drug-induced liver injury with jaundice.J Hepatol.2009,50(3):511-517.
22 Graham D J,Green L,Senior J R,et al.Troglitazone-induced liver fail⁃ure:a case study.Am J Med,2003,114(4):299-306.
Premarketing Clinical Evaluation of Drug-induced Liver Injury
An Na,Tang Jianyuan,He Ruyi
(Center for Drug Evaluation,China Food and Drug Administration,Beijing 100038,China)
The liver injury caused by drug and/or its metabolites is one of the most common reasons for drugs to be withdrawn or disapproved.Premarketing clinical evaluation of drug-induced liver injury(DILI)is extremely important to drug evaluation.Signals of DILI and Hyman's Law(Hy's Law),clinical evaluation and lessons of DILI were discussed tohelp developing new drugs.
Drug-induced liver injury,Hy's law,clinical evaluation,hepatotoxic.ity,new drug
10.11842/wst.2017.06.007
R969
A
(责任编辑:张娜娜,责任译审:王晶)
2017-03-20
修回日期:2017-06-11
**通讯作者:何如意,CDE首席科学家,主要研究方向:药品监管科学、政策法规和临床评价。

