结直肠癌组织和细胞株中TSPAN1蛋白、mRNA的表达变化
石刚,张睿,任宇鹏,陈悦,廉波,马思平,孟庆凯,陈玉泽,刘放
(1中国医科大学肿瘤医院,沈阳 110042;2辽宁省肿瘤医院)
·临床研究·
结直肠癌组织和细胞株中TSPAN1蛋白、mRNA的表达变化
石刚1,2,张睿1,2,任宇鹏1,2,陈悦1,2,廉波1,2,马思平1,2,孟庆凯1,2,陈玉泽1,2,刘放1,2
(1中国医科大学肿瘤医院,沈阳 110042;2辽宁省肿瘤医院)
目的 观察结直肠癌组织和细胞株中TSPAN1蛋白、mRNA的表达变化,并探讨其意义。方法 结直肠癌患者31例,手术治疗中留结直肠癌组织、癌旁组织及距离肿瘤5 cm以上的正常结直肠组织各31例份,分别采用Western blotting法及qRT-PCR法检测TSPAN1蛋白、mRNA,并分析TSPAN1蛋白表达与结直肠癌临床病理参数的关系;另选结直肠癌细胞株Colo-205、HCT-116、HT-29、SW620,分别采用Western blotting法及qRT-PCR法检测各组TSPAN1蛋白、mRNA。结果 结直肠癌、癌旁、正常组织中TSPAN1蛋白相对表达量分别为29.3±4.1、12.8±4.6、10.1±3.7,TSPAN1 mRNA相对表达量分别为1.6±0.4、0.6±0.5、0.5±0.3,结直肠癌组织与癌旁、正常组织比较,P均<0.05。组织中TSPAN1蛋白表达与结直肠癌肿瘤浸润深度、淋巴结转移、远处转移、神经浸润及血管浸润有关(P均<0.05)。Colo-205、HCT-116、HT-29、SW620细胞中TSPAN1蛋白相对表达量分别为12.7±2.1、13.6±2.9、11.8±2.4、23.6±3.5,TSPAN1 mRNA相对表达量分别为1.1±0.3、1.2±0.3、0.9±0.2、1.8±0.1,Colo-205、HCT-116、HT-29细胞与SW620细胞比较,P均<0.05。结论 TSPAN1蛋白、mRNA在结直肠癌组织和细胞株中均呈高表达,可能与结直肠癌的转移及浸润恶性行为有关。
结直肠癌;结直肠肿瘤;结直肠癌细胞株;TSPAN1蛋白
结直肠癌是消化系统恶性肿瘤,其发病率及病死率均居恶性肿瘤第3位[1];浸润生长、远处转移及淋巴结转移是结直肠癌恶性行为的主要表现,也是结直肠癌致死的主要原因[2]。原发病灶浸润深度、淋巴结转移、血管浸润及神经浸润是结直肠癌预后的重要因素,是评价其浸润及转移等恶性行为的主要标志[3]。结直肠癌的不同发展阶段有不同的致病因素及基因参与,四跨膜蛋白超家族(TM4SF)是一组跨膜蛋白,在多种恶性肿瘤中均呈高表达,与肿瘤的恶性行为发展有相关性[4]。TSPAN1蛋白是TM4SF家族重要成员之一,其在胰腺癌、肝癌及前列腺癌等恶中表达上调[5,6]。本研究观察了结直肠癌组织和细胞株中TSPAN1蛋白、mRNA的表达变化,并探讨其意义。
1 资料与方法
1.1 临床资料 选取2016年1~12月收治的结直肠癌患者31例,男17例,女14例;年龄49~78岁;肿瘤位于左侧16例,右侧15例;直径>1/2周径17例,≤1/2周径14例;浸润深度T1、T2 9例,T3、T4 22例;有淋巴结转移20例,无淋巴结转移11例;有远处转移6例,无远处转移25例;高中分化20例,低分化11例;有神经浸润8例,无神经浸润23例;有血管浸润7例,无血管浸润24例。手术留结直肠癌组织、癌旁组织及距离肿瘤5 cm以上的正常结直肠组织各31例份,手术切除标本后立即给予取样,采用液氮罐中进行保存。结直肠癌细胞株(HCT-116、Colo-205、SW620、HT-29)在中国医科大学实验中心进行培养,并进行传代及保存;引物由大连宝生技术有限公司进行设计及合成;TSPAN1多克隆抗体购自立陶宛Fermentas公司;BCA试剂盒及RT-PCR逆转录及扩增试剂盒购自北京金山生物科技公司,miRNA提取试剂盒购自深圳深安生物科技公司;All-in-OneTMqPCR Mix试剂盒(美国Abcom公司)。
1.2 TSPAN1蛋白检测方法 采用Western blotting法。剪取各种组织约100 mg,在250 μL的蛋白裂解液中进行剪碎,在冰上静置30 min,在4 ℃、11 000 g 条件下离心30 min,按BCA试剂盒说明对蛋白浓度进行准确定量。对各组培养的细胞中采用250 μL蛋白裂解液,进行摇匀及震荡,提取总蛋白,提取上清液体测定蛋白浓度。组织及细胞株的蛋白标准溶液样品定量为30 mg/mL,稀释为0.5 mg/mL的终浓度,10%SDS-PAGE分离蛋白并电转移至PVDF膜。5%脱脂奶粉在4 ℃下封闭90 min,分别加入一抗,孵育过夜后加入相应二抗,再次孵育,应用化学发光法显色,β-actin为内参照。应用QuantityOne进行灰度值检测,蛋白相对表达量=目标蛋白灰度值/内参照蛋白灰度值。
1.3 TSPAN1 mRNA检测方法 采用qRT-PCR法。剪取各种组织标本约100 mg,液氮条件下进行物理研磨,细胞株总RNA的提取并纯化按照RNA分离试剂盒及TRIzol试剂盒的说明书步骤进行操作,将RNA样本浓度稀释至1 g/L,采用紫外吸收法测定RNA液浓度及纯度,变性琼脂糖凝胶电泳进行RNA完整性测定。然后进行样品cDNA合成、梯度稀释标准品及待测样品管家基因(β-actin)的实时定量PCR、制备用来绘制梯度稀释标准曲线DNA模板,然后对待测基因进行实时定量PCR,反应体系如下:1.SYBR Green 1染料10 μL,2.上游引物1 μL,3.下游引物1 μL,4.dNTP 1 μL,5.Taq聚合酶2 μL,6.待测样品cDNA 5 μL,7.ddH2O 30 μL,8.总体积 50 μL。将配制好的PCR反应溶液置于Realtime PCR仪上进行PCR扩增反应。反应条件:93 ℃预变性2 min,然后按94 ℃、1 min,56 ℃、1 min,73 ℃、1 min,共40个循环,最后73 ℃、7 min延伸。得到目的基因及内参照基因Ct值, Ct=ΔCt(目的基因)-Ct(内参基因),ΔΔCt=ΔCt(研究样本)-ΔCt(对照组样本);计算2-ΔΔCt即目的基因mRNA相对表达量,结果以相对表达量进行表示。

2 结果
2.1 TSPAN1蛋白、mRNA在结直肠癌及癌旁和正常组织中的表达比较 结果见表1。

表1 TSPAN1蛋白、mRNA在结直肠癌及癌旁和正常组织中的表达比较
注:与癌旁组织、正常组织比较,*P<0.05。
2.2 组织中TSPAN1蛋白表达与结直肠癌临床病理参数的关系 结果见表2。由表2可知,组织中TSPAN1蛋白表达与结直肠癌肿瘤浸润深度、淋巴结转移、远处转移、神经浸润及血管浸润有关(P均<0.05)。
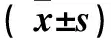
表2 TSPAN1蛋白表达与结直肠癌临床病理参数的关系
2.3 TSPAN1蛋白和mRNA在Colo-205、HCT-116、HT-29、SW620细胞中的表达比较 结果见表3。

表3 TSPAN1蛋白和mRNA在Colo-205、HCT-116、HT-29、SW620细胞中的表达比较
注:与SW620细胞比较,*P<0.05。
3 讨论
近年来,无论是在欧美还是在中国结直肠癌发病率均呈明显上升趋势[7],随着研究的深入与人群筛查的逐渐普及,尤其是靶向治疗药物的发展,结直肠癌病死率在近20年显著下降,晚期肝转移性结直肠癌在靶向及化疗综合治理基础上,3年生存率及5年生存率均有大幅提高。对结直肠癌恶性行为预测基因的研究是热点,也是靶向治疗靶点研究的基础[8]。
文献[9]报道,TSPAN1在胰腺癌表达上调,且与肿瘤淋巴结转移及复发呈正相关性;但也有研究[10]认为,在胃癌组织中TSPAN1是作为抑癌基因出现的,受到mir573调控。TSPAN1往往与整合素或黏附因子组成跨膜四超分子富集区域,对细胞的行为进行调控,这种复合体集中在细胞的前缘,是细胞移动性及黏附性增高的基础,同时也是肿瘤细胞迁移及种植等恶性行为的前提因素[11]。
本文结果显示,结直肠癌组织中TSPAN1蛋白、mRNA相对表达量均高于癌旁及正常组织,这表明在RNA水平TSPAN1可能已经参与结直肠癌恶性行为的调控,并在蛋白水平高表达。进一步研究显示,结直肠癌组织中TSPAN1蛋白高表达与肿瘤浸润深度、淋巴结转移、远处转移、神经浸润、血管浸润相关,这说明TSPAN1或许与结直肠癌转移及浸润等恶性行为相关,可能是作为上游基因发挥调控作用,也可能是作为下游基因受到其他基因的调控。刑娜娜等[12]对体外人结直肠癌细胞中TSPAN1表达进行了下调,结直肠癌细胞的增殖及侵袭能力下降,认为TSPAN1通过TGF-β受体及雌激素受体通路调控结直肠癌细胞增殖及侵袭行为。Wang等[11]认为,TSPAN1同家族成员CD151、TSPAN12与整合素α6β1、α6β4形成复合体,调控肿瘤生长、浸润、迁移及转移,并和信号传导及化疗药物敏感性等具有关联。而对结直肠癌治疗过程中影响化疗敏感性及耐药性的基因也是目前研究的热点,对于治疗方案的制定具有越来越明显的决定作用[13]。
Colo-205、HCT-116、HT-29细胞来自结肠癌原发灶,SW620细胞来自结肠腺癌转移淋巴结,TSPAN1在来自转移淋巴结的SW620细胞中表达高于来自原发灶的细胞株。本文结果显示,SW620细胞TSPAN1蛋白、mRNA相对表达量均高于Colo-205、HCT-116、HT-29细胞,这表明TSPAN1可能与结直肠迁移的恶性行为有关。Liu等[14]认为,通过小干扰RNA转染下调在TSPAN1同族成员TSPAN12表达,结直肠癌细胞的转移能力减弱,上调后转移能力增强,进一步证明TSPAN家族成员与肿瘤细胞的转移能力具有调控作用,但其调控机制尚需进一步研究探讨。Detchokul等[15]研究认为,肿瘤细胞从原发病灶脱离,重新在细胞间质塑形,进行迁移、识别和穿过内皮细胞间隙进入循环系统,在其他部位种植及生长是转移的主要过程,在这一过程中细胞骨架的激活和重建是主要因素,并决定着肿瘤细胞的黏附和运动,而TSPAN等膜蛋白家族成员在细胞骨架的塑形中具有基础及决定性的作用,并调控肿瘤细胞的迁移及肿瘤细胞、内皮细胞之间的关系,这在癌症浸润及转移中是极为重要的。
总之,TSPAN1蛋白、mRNA在结直肠癌组织和细胞株中高表达,可能与结直肠癌的发生发展有关。
[1] Chow CJ, Al-Refaie WB, Abraham A, et al. Does patient rurality predict quality colon cancer care: a population-based study[J]. Dis Colon Rectum, 2015,58(4):415-422.
[2] 曾云龙,李俊.结直肠癌肝转移预后临床及病理相关因素研究进展[J].中国肿瘤外科杂志,2016,8(5):287-293.
[3] 钟敏儿,徐徕,徐琼,等.阳性淋巴结对数比分期预测Ⅲ期结肠癌预后的价值[J].中国医学科学院学报,2016,38(3):294-299.
[4] 何磊.四跨膜蛋白在肝癌中的作用[J].中国肿瘤临床,2011,38(18):1175-1178.
[5] 石刚,董明,盛伟伟,等.Tspan1及Integrin α6在人胰腺导管腺癌中的表达及其与临床特征的关系[J].中华外科杂志,2014,52(10):781-786.
[6] Xu F, Gao Y, Wang Y, et al. Decreased TSPAN1 promotes prostate cancer progression and is a marker for early biochemical recurrence after radical prostatectomy[J]. Oncotarget, 2016,7(39):63294-63305.
[7] 张志,吴亚运,何宋兵,等.257例大肠癌患者的临床特征、病理及预后分析[J].中国血液流变学杂志,2016,26(1):76-78.
[8] Burz C, Aziz BY, Bălăcescu L, et al. Tumor markers used in monitoring the tumor recurrence in patients with colorectal cancer[J]. Clujul Med, 2016,89(3):378-383.
[9] Hou FQ, Lei XF, Yao JL, et al. Tetraspanin 1 is involved in survival, proliferation and carcinogenesis of pancreatic cancer[J]. Oncol Re, 2015,34(6):3068-3076.
[10] Lu Z, Luo T, Nie M, et al. TSPAN1 functions as an oncogene in gastric cancer and is downregulated by miR-573[J]. FEBS Lett, 2015,589(15):1988-1994.
[11] Wang HX, Li Q, Sharma C, et al. Tetraspanin protein contributions to cancer[J]. Biochem Soc Trans, 2011,39(2):547-552.
[12] 邢娜娜,张慧慧,谢佳琪,等.敲除TSPAN1抑制人结肠癌细胞的生长和侵袭[J].医学研究杂志,2016,45(1):29-33.
[13] Hu T, Li Z, Gao CY, et al. Mechanisms of drug resistance in colon cancer and its therapeutic strategies[J]. World J Gastroenterol, 2016,22(30):6876-6889.
[14] Liu J, Chen C, Li G, et al. Upregulation of TSPAN12 is associated with the colorectal cancer growth and metastasis[J]. Am J Transl Res, 2017,9(2):812-822.
[15] Detchokul S, Williams ED, Parker MW, et al. Tetraspanins as regulators of the tumour microenvironment: implications for metastasis and therapeutic strategies[J]. Br J Pharmacol, 2014,171(24):5462-5490.
国家自然科学基金资助项目(81672427);辽宁省博士科研启动基金资助项目(201601417)。
刘放(E-mail: liufang@cancerhosp-ln-cmu.com)
10.3969/j.issn.1002-266X.2017.31.011
R735.8
B
1002-266X(2017)31-0041-03
2017-04-07)

