金铁锁灌胃对兔膝骨关节炎的治疗作用及其机制探讨
王胜民,刘毅,熊华章
(遵义医学院附属医院,贵州遵义 563000)
金铁锁灌胃对兔膝骨关节炎的治疗作用及其机制探讨
王胜民,刘毅,熊华章
(遵义医学院附属医院,贵州遵义 563000)
目的 观察金铁锁对兔膝骨关节炎(OA)的治疗作用,并探讨其可能机制。方法 120只兔随机分为4组各30只,模型组、金铁锁组、氨基葡萄糖组均制备OA模型,空白组不制备模型;制模后金铁锁组和氨基葡萄糖组分别灌胃金铁锁、氨基葡萄糖,模型组和空白组给予等量生理盐水。观察各组兔膝关节软骨大体、病理学变化,比较兔膝关节软骨白细胞介素1β(IL-1β)、基质金属蛋白酶3(MMP-3)、基质金属蛋白酶抑制剂1(TIMP-1)的mRNA及蛋白。结果 与空白组比较,模型组膝关节肉眼观及病理学变化明显,且随制模时间变化而变化;与模型组比较,氨基葡萄糖组、金铁锁组上述情况好转,金铁锁组治疗效果更佳。与空白组比较,模型组IL-1β、MMP-3、TIMP-1 mRNA及蛋白表达升高;与模型组比较,氨基葡萄糖组、金铁锁组IL-1β、MMP-3 mRNA及蛋白表达降低,TIMP-1表达升高;与氨基葡萄糖组比较,金铁锁组IL-1β、MMP-3 mRNA及蛋白表达降低,TIMP-1表达升高。结论 金铁锁对兔膝OA有治疗作用,其机制可能与下调膝炎症因子IL-1β、MMP-3表达及上调TIMP-1表达有关。
金铁锁;中药;骨关节炎;白细胞介素1β;基质金属蛋白酶3;基质金属蛋白酶抑制剂1
骨关节炎(OA)是一种以关节软骨退变为主要特征的慢性关节疾病[1],其好发于60岁以上老人(约66%),且女性多于男性[2]。近年OA呈高发病率、高致残率和病程久的趋势,给患病人群带来了巨大的经济负担。白细胞介素1β(IL-1β)是OA重要的致炎因子之一,其主要由滑膜及关节软骨等产生[3]。基质金属蛋白酶(MMPs)属蛋白水解酶类,并主要依靠锌离子发挥降解细胞外基质和基底膜的作用[4]。MMPs可以使OA关节软骨细胞外基质的合成与降解平衡紊乱并进一步引起关节软骨的破坏及变性[5]。IL-1β与其相应受体结合后,可激活丝裂原活化蛋白激酶信号通路,引起MMPs的增高及降解细胞外基质等过程,进而引发OA[6]。目前,西医对OA的治疗取得较好效果,但局限于关节腔注射药物及手术治疗等,且并发症较多。中医认为OA属“痹证”范畴,主要病因由肝肾亏损、外感风寒等导致[7]。金铁锁属于石竹科的植物,在贵州等西南地区居多[8],主要用于跌打损伤、风湿疼痛,可抑制肿瘤坏死因子-α、IL-1β、氧自由基等,具有抗炎、消肿和镇痛的作用[9,10]。本研究观察了金铁锁对兔膝OA的治疗作用,并探讨其可能机制。
1 材料与方法
1.1 实验动物 成年健康新西兰大白兔120只,体质量约2.5~3.0 kg,雌雄不限,兔龄12周,由中国人民解放军第三军医大学实验动物中心提供;由遵义医学院动物实验基地负责分笼喂养,兔自由饮水,生活环境温度(20±2)℃,自然光照与黑暗时间为12 h交替。实验过程对兔的操作均符合国家科学技术部发布的《关于善待实验动物的指导性意见》[11],且得到了遵义医学院伦理委员会的批准。
1.2 主要仪器及试剂 SM2000R型病理组织切片机;ND-1000型核酸蛋白测量仪;CFX96 TouchTMReal-Time PCR Detection System;ICyeler iQS型荧光定量PCR仪;DNX-9620A型电脑洗板机;DNM-9602G型酶标分析仪;Centrifuge 5804R型高温低速离心机。IL-1β酶联免疫吸附法(ELISA)试剂盒、基质金属蛋白酶3(MMP-3)ELISA试剂盒、基质金属蛋白酶抑制剂1(TIMP-1)ELISA试剂盒;总RNA提取试剂盒;Prime ScriptTMRT Reagent Kit;SYBR Premix Ex TaqTMⅡ;PCR引物(IL-1β、MMP-3、TIMP-1)。
1.3 金铁锁制作 首先拣选、粗碎(20目)的金铁锁根茎500 g(产地贵州,检验符合药典规定);其次加水提取3次(第1次5倍量水1 h、第2次4倍量水1 h、第3次3倍量水1 h),滤过合并滤液;再者浓缩(常压)、收膏、加入淀粉混匀干燥;最后粉碎并加入淀粉补足100 g混匀。
1.4 动物分组、模型制备及金铁锁灌胃 120只新西兰大白兔随机分为空白组、模型组、金铁锁组、氨基葡萄糖组各30只,每组再按制模后4、6、8周分3个亚组各10只。除空白组外其余各组均按改良Hulth法制备OA模型[12]。按照兔体质量计算麻醉剂剂量,耳缘静脉注射戊巴比妥钠(25 mg/kg),手术区域常规备皮并消毒、铺巾,在兔右膝行内侧切口,依次切开皮肤、皮下、筋膜,暴露右膝关节腔,切除前交叉韧带及内侧半月板并进行前抽屉实验确保膝关节的前交叉韧带已完全断裂,逐层缝合。各组兔术后予以肌注青霉素钠20万U/kg,连用4 d;分笼饲养并每日驱赶兔活动约1 h/d。由于氨基葡萄糖治疗膝OA的效果肯定,本实验中作为阳性药物对照[13]。模型制备成功的标准参考Mankin评分标准。术后给药剂量主要根据《药理实验方法学》中的人和动物体表面积折算的等效剂量比率表来折算[14]。金铁锁组和氨基葡萄糖组分别于制模当日灌胃给予12.8 mg/(kg·d)的金铁锁及氨基葡萄糖,空白及模型组灌服等量生理盐水,总量均为10 mL,1次/d。
1.5 兔及兔膝关节软骨肉眼观察 分别于术后4、6、8周观察兔的精神状态、饮食情况、体质量变化及膝关节肿胀程度等。
1.6 兔膝关节软骨病理学观察 将实验动物处死后取右膝股骨内侧髁及胫骨平台内侧的负重区关节软骨,生理盐水冲洗干净,肉眼观察后分别放于液氮(-196 ℃)及10%甲醛固定,待测。10%甲醛固定胫骨平台标本3 d,随后继续用EDTA脱钙液脱钙25 d。常规脱水、剥离胫骨平台内侧负重区的关节软骨、石蜡包埋、行5 μm厚度切片,二甲苯梯度浓度脱蜡,乙醇梯度浓度水化。HE染色:苏木精染色5 min,盐酸酒精分化20 s,伊红染色4 min;番红染色:番红染色3 min,二甲苯梯度透明,中性树胶封片,镜检。
1.7 兔膝关节软骨IL-1β、MMP-3、TIMP-1 mRNA检测 取材同1.6。IL-1β、MMP-3、TIMP-1 mRNA检测采用逆转录-聚合酶链式反应(RT-PCR)法:①总RNA提取:液氮环境下剥离及研磨股骨内侧髁负重区关节软骨,严格按照试剂盒说明书操作,提取的mRNA稀释50倍之后用ND1000型核酸蛋白测量仪检测OD260和OD280。保证OD260/OD280值在1.8~2.0。②cDNA的合成:5×Prime Script Buffer(for Real Time)4 μL,Prime Script RT Enzyme Mix I 1 μL,Oligo dT Primer 1 μL,Random 6 mers 1 μL,Total RNA 6 μL,Rnase Free ddH2O 7 μL;总反应体系20 μL,在37 ℃、15 min,85 ℃、5 s,4 ℃、Forever的条件下严格按照说明书操作逆转录成cDNA。③基因扩增:以cDNA作为扩增的模板进行RT-PCR检测,体系:Rnase Free ddH2O 6.4 μL,SYBR Premix Ex Taq Ⅱ(2×)10.0 μL,cDNA 2.0 μL,上、下游引物(Sangon Biotech合成,详见表1)各0.8 μL,总体积20.0 μL;扩增条件:95 ℃预变性30 s,1循环;95 ℃变性10 s,40个循环;退火延伸60 ℃、30 s,40个循环;溶解55~95 ℃,5 s。用2-ΔΔCt法(Ct为荧光达到阈值时所需PCR的循环数)分析IL-1β、MMP-3、TIMP-1 mRNA相对表达量。
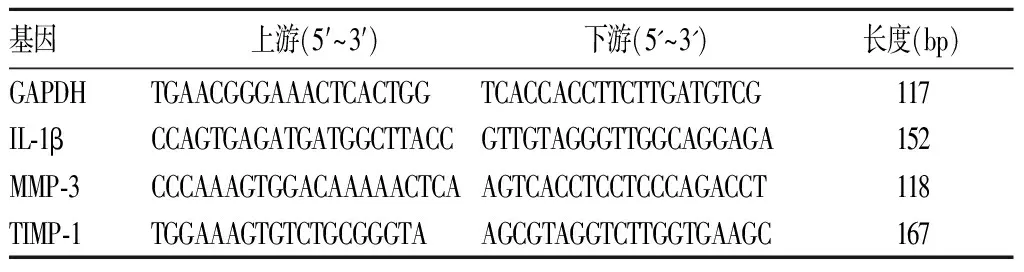
表1 RT-PCR目的基因引物的序列及产物的长度
1.8 兔血浆IL-1β、MMP-3、TIMP-1蛋白检测 分别在制模4、6、8周分别取兔耳缘静脉取血(2 mL),并装于乙二胺四乙酸二钾(EDTAK2)抗凝管,将抗凝管上下颠倒混匀3次,静置后在离心机上以3 000 r/min离心20 min,分离血浆后装在Eppendorf中,-80 ℃保存,待测。IL-1β、MMP-3、TIMP-1蛋白检测采用ELISA法:在相应反应板孔内加入100 μL标准液和100 μL血浆;充分混匀30 s,盖好反应板孔,在37 ℃环境下温育约60 min。洗板:甩尽反应板内液体,反应板反复用洗涤液洗涤,反复拍打,重复5次。每孔加入100 μL 1×Biotin,轻轻摇匀30 s,封住反应板孔,37 ℃温育60 min;再次洗板。每孔加入100 μL 1×HRP,轻轻混匀30 s,封住板孔,37 ℃温育60 min;再次洗板。每反应孔加入100 μL的TMB显色液,混匀10 s,在37 ℃的暗处环境内温育25 min。每反应孔内加入100 μL的反应终止液,混匀30 s,在30 min内用酶标仪在450 nm处测吸光度值。绘制标准曲线,以标准品浓度的对数作为横坐标,用OD值作为纵坐标,计算相应检测指标蛋白浓度。

2 结果
2.1 各组兔膝关节软骨肉眼观及病理学变化 ①肉眼观:空白组兔活动自如,毛发光亮,右膝关节无肿大;制模4、6、8周前后体质量无明显增减,关节软骨透明,表面光滑、平整,色泽鲜亮,无骨赘形成。模型组兔制模后4、6、8周的活动逐渐受限,右膝关节肿胀程度随时间的延长而加重;6周时兔体质量开始出现明显减轻,右膝开始明显肿胀,出现跛行,毛发暗淡;8周时兔跛行明显,关节软骨表面可见溃疡,可见明显骨赘及部分骨外露。氨基葡萄糖组兔活动随时间延长而减少,膝关节肿胀程度随时间增加而加重;制模6周时,体质量开始减轻,右膝开始肿胀,出现跛行,毛发暗淡;制模8周时,跛行较前加重,关节软骨局部可见轻度溃疡,可见少量骨赘。金铁锁组制模后4周时,兔活动、关节肿胀情况与模型组比较,均无明显差别,体质量未见明显增减,关节软骨表面稍粗糙,有小的裂隙,无明显骨赘形成,色泽暗淡;制模后6、8周时,兔活动较之前明显减少,关节肿胀情况较之前加重,但均比模型组明显改善,体质量减轻不明显,可见跛行。②病理学:制模后空白组兔关节软骨透明,表面结构规则、正常;细胞数量正常,基质染色正常,潮线完整。模型组兔制模后4周时关节软骨表面粗糙,可见较多不规则裂隙形成,细胞数量弥漫性增多,基质染色轻度减少,潮线完整;6周时关节软骨表面较粗糙、不规则,可见局部关节软骨血管翳形成,软骨细胞出现大量簇集样细胞团,基质染色轻中度失染,局部潮线不完整;8周时关节软骨表面粗糙、极不规则,可见裂隙深达关节软骨的钙化层;软骨细胞的数量明显减少,基质中度或重度失染,潮线不完整。氨基葡萄糖组制模后4周关节软骨表面粗糙,结构欠规则,可见不规则裂隙形成,软骨细胞的数量弥漫性增多,基质染色轻度减少,潮线完整;6周时关节软骨表面较粗糙,可见部分软骨血管翳形成,细胞数量出现簇集样细胞团,基质染色轻中度失染,局部潮线不完整;8周时关节软骨表面粗糙、结构不规则,可见较多软骨血管翳形成,甚至裂隙深达关节软骨的放射层,软骨细胞的数量轻中度减少,基质中度或重度失染,潮线不完整。金铁锁组兔制模4周时关节软骨表面稍粗糙,局部可见少量不规则裂隙形成,细胞的数量正常,基质染色轻度减少,潮线完整;6周时关节软骨表面粗糙、不规则,可见较多不规则裂隙,细胞数量弥漫性增多,基质染色轻中度失染,局部潮线不完整;8周时关节软骨表面较粗糙、不规则,可见部分关节软骨血管翳形成,甚至裂隙深达关节软骨的过渡层,细胞的数量轻度减少,基质中度或重度失染,潮线不完整。
2.2 各组兔膝关节软骨IL-1β、MMP-3、TIMP-1 mRNA比较 结果见表2。

表2 各组兔膝关节软骨IL-1β、MMP-3、TIMP-1 mRNA表达量比较
与同组4周比较,*P<0.05;与同组6周比较,□P<0.05;与模型组比较,#P<0.05;与金铁锁组比较,○P<0.05;与空白组比较,☆P<0.05。
2.3 各组兔血浆IL-1β、MMP-3、TIMP-1蛋白比较 结果见表3。
表3 各组兔膝血浆IL-1β、MMP-3、TIMP-1蛋白水平比较
注:与同组4周比较,*P<0.05;与同组6周比较,△P<0.05;与模型组比较,#P<0.05;与金铁锁组比较,○P<0.05;与空白组比较,□P<0.05。
3 讨论
OA已经被世界卫生组织视为危害人类健康的“三大杀手”之一,给社会和家庭及个人带来了巨大的伤害。OA好发于中老年人,多表现为关节疼痛、肿胀、畸形等,症状较轻者可口服药物及关节腔注射玻璃酸钠,严重者只能行人工全膝关节置换术[15]。成功构建膝OA动物模型是研究OA药物治疗、发病机制等的前提条件。现有OA动物模型主要包括自发性和诱发性动物模型,最常用手术制模方法为改良Hulth法[16],主要是通过切断膝关节的前交叉韧带和内侧半月板以引起膝关节不稳及应力改变等,进一步构建膝OA的动物模型。
目前OA发病机制不明确,其中一种观点考虑为细胞因子所致。在OA形成过程中,关节软骨细胞及滑膜等均可产生大量细胞因子破坏关节软骨。IL-1β是由多种细胞分泌的细胞因子,主要参与细胞的免疫应答和介导炎症反应及调节细胞的生理功能等[17]。IL-1β是OA发病过程中的重要炎症因子之一,可通过一系列级联反应引起关节的破坏和炎症反应等,主要通过改变软骨细胞正常结构与功能,调节蛋白水解酶的合成与分泌,加速胶原蛋白及聚蛋白多糖的降解,进而诱发OA[18]。OA的发生、发展与诸多细胞信号通路也存在着密切的关系,其中MAPK信号通路是一组能被不同的细胞外刺激(如细胞因子、细胞应激)激活的丝氨酸-苏氨酸蛋白激酶[19]。MAPK级联激活是多种细胞信号通路的中心,在没有受到信号刺激的细胞中,MAPK处于静止状态;然而当细胞受到细胞因子(如IL-1β)等刺激时,MAPK接收MAPK激酶(MKK)和MAPK激酶激酶(MKKK)的活化信号而被激活,表现为逐级磷酸化的过程[20]。而MAPK细胞信号通路中的P38途径也是导致OA发生的重要因素之一。研究[21]表明IL-β可通过激活P38信号通路进一步诱导MMP-13的表达,降解关节软骨细胞外基质最后诱发OA。因此,研究阻断P38信号通路的方法是防止OA软骨退变的重要方向。MMP是一种具有锌与钙依赖性并在结构上拥有高度同源性的内肽酶家族,主要参与细胞外基质胶原、蛋白多糖等成分的降解[22]。Jacques等[23]发现MMP-1、MMP-3、MMP-13等与OA病情的发生及发展有关。MMP-3对关节软骨基质中的蛋白多糖具有高度的裂解活性,并可加速Ⅱ型胶原的降解,还能激活MMP-1、MMP-9等与OA相关的炎症分子,引起一系列的级联效应,从而加速OA的病程进展[24,25]。TIMP-1是MMP-3的特异性抑制剂,与MMP-3结合成1∶1的复合物,抑制MMP-3的活性及血管增殖,正常情况下两者保持平衡[26];如果失去相对平衡则关节软骨基质中蛋白分解酶的活性增高,则引起关节软骨的破坏,从而引发OA[27]。因此,通过调节MMP-3与TIMP-1之间平衡也是防治OA的重要研究方向之一。
金铁锁,别名独定子、百步穿杨等,《滇南本草》最先记录。研究[28]表明,金铁锁具有很高的药用和经济价值;三萜、三萜皂苷、环肽等为中药金铁锁的主要化学成分,此外还有氨基酸和有机酸等[29]。金铁锁入药的主要部位为地下根,气体微弱,味辛、麻,有刺喉感。金铁锁具有止痛、散瘀和消痈排脓等疗效[30]。近年来,随着各项研究的逐步深入,苗药金铁锁作为一种传统的民间药物被逐渐重视。目前,对金铁锁的研究主要集中在化学成分、植物特性等方面,而其对OA及类风湿性关节炎等作用的相关研究较少。本课题的切入点主要是针对目前OA无明确的疗效药物入手,再者中医药逐渐被重视,据此进行的深入研究。
与空白组比较,模型组膝关节肉眼观及病理学变化明显,且随制模时间变化而变化;与模型组比较,氨基葡萄糖组、金铁锁组上述情况好转,金铁锁组治疗效果更佳。与空白组比较,模型组IL-1β、MMP-3、TIMP-1 mRNA及蛋白表达升高;与模型组比较,氨基葡萄糖组、金铁锁组IL-1β、MMP-3 mRNA及蛋白表达降低,TIMP-1表达升高;与氨基葡萄糖组比较,金铁锁组IL-1β、MMP-3 mRNA及蛋白表达降低,TIMP-1表达升高。提示金铁锁对兔膝OA有治疗作用,其机制可能与下调IL-1β、MMP-3表达及上调TIMP-1表达有关。
[1] Hui W, Young DA, Rowan AD, et al. Oxidative changes and signalling pathways are pivotal in initiating agerelated changes in articular cartilage [J]. Ann Rheum Dis, 2016,75(2):449-458.
[2] Visser AW, De Mutsert R, Le CS, et al. The relative contribution of mechanical stress and systemic processes in different types of osteoarthritis: the NEO study [J]. Ann Rheum Dis, 2015,74(10):1842-1847.
[3] Blasioli DJ, Kaplan DL. The roles of catabolic factors in the development of osteoarthritis[J]. Tissue Eng Part B Rev, 2014,20(4):355-363.
[4] Li ZC, Han N, Li X, et al. Decreased expression of microRNA-130a correlates with TNF-α in the development of osteoarthritis[J]. Int J Clin Exp Pathol, 2015,8(3):2555-2564.
[5] Zhen G, Cao X. Targeting TGFβ signaling in subchondral bone and articular cartilage homeostasis[J]. Trends Pharmacol Sci, 2014,35(5):227-236.
[6] Papathanasiou I, Michalitsis S, Hantes ME, et al.Molecular changes indicative of cartilage degeneration and osteoarthritis development in patients with anterior cruciate ligament injury[J]. BMC Musculoskelet Disord, 2016,17(21):1-10.
[7] 徐卫平,王小军.中药治疗骨关节炎的现状分析[J].科技展望,2017,27(5):304.
[8] 沈放,马银海,杨黎江,等.野生和栽培金铁锁镇痛功效及有效部位的比较[J].中国实验方剂学杂志,2012,18(18):240-243.
[9] 赵保胜,桂海水,朱寅荻,等.金铁锁化学成分、药理作用和临床应用研究进展[J].中国实验方剂学杂志,2011,17(18):298-301.
[10] 王胜民,刘毅,刘晓丽,等.金铁锁对膝关节骨性关节炎兔关节软骨的保护作用及其机制[J].山东医药,2016,56(16):27-29.
[11] 程津津,任萍萍.学习《关于善待实验动物的指导性意见》后的体会[J].实验动物科学,2011,28(3):78-79.
[12] Hulth A, Lindberg L, Telhag H. Experimental osteoarthritis in rabbits. Preliminary report [J]. Acta Orthop Scand, 1970,41(5):522-530.
[13] 陈刚,毛云鹤,李箭.氨基葡萄糖治疗骨关节炎的临床应用进展[J].华西医学,2016,31(7):1161-1163.
[14] 魏伟,吴希美,李元建.药理实验方法学[M].4版.北京:人民卫生出版社,2010:69-73.
[15] Sampiero T, Cardoso J, Bush R, et al. Association of socioeconomic factors with pain and function in older adults with knee osteoarthritis[J]. J Pain, 2016,17(4S):S28.
[16] Araki S, Imai S, Ishigaki H, et al. Improved quality of cartilagerepair by bone marrow mesenchymal stem cells fortreatment of an osteochondral defect in a cynomolgus macaquemodel[J]. Acta Orthop, 2015,86(1):119-126.
[17] Assis L, Milares LP, Almeida T, et al. Aerobic exercise training and low-level laser therapy modulate inflammatory response and degenerative process in an experimental model of knee osteoarthritis in rats[J]. Osteoarthritis Cartilage, 2016,24(1):169-177.
[18] Park JS, Kim DK, Shin HD, et al. Apigenin regulates interleukin-1β-induced production of matrix metalloproteinase both in the knee joint of rat and in primary cultured articular chondrocytes[J]. Biomol Ther(Seoul), 2016,24(2):163-170.
[19] Crittenden PL, Filipov NM. Manganese modulation of MAPK pathways: effects on upstream mitogen activated protein kinase kinases and mitogen activated kinase phosphatase-1 in microglial cells[J]. J Appl Toxicol, 2011,31(1):1-10.
[20] Sánchez Y, Amrán D, Fernández C, et al. Genistein selectively potentiates arsenic trioxide-induced apoptosis in human leukemia cells via reactive oxygen species generation and activation of reactive oxygen species-inducible protein kinases(p38-MAPK, AMPK) [J]. Int J Cancer, 2008,123(5):1205-1214.
[21] Kjellerup RB, Kragballe K, Iversen L, et al. Pro-inflammatory cytokine release in keratinocytes is mediated through the MAPK signal-integrating kinases[J]. Exp Dermatol, 2008,17(6):498-504.
[22] Ji JB, Li XF, Liu L, et al. Effect of low intensity pulsed ultrasound on expression of TIMP-2 in serum and expression of mmp-13 in articular cartilage of rabbits with knee osteoarthritis [J]. Asian Pac J Trop Med, 2015,8(12):1043-1048.
[23] Jacques L, Bernard N, Alexandre P, et al. Genetic polymorphisms of MMP-1, MMP-3 and MMP-7 gene promoter and risk of colorectal adenoma[J]. BMC Cancer, 2006,6(1):1-8.
[24] Chu XQ, Wang JJ, Dou LD, et al. Cartilage oligomeric matrix protein and matrix metalloproteinase-3 expression in the serum and joint fluid of a reversible osteoarthritis rabbit model[J]. Genet Mol Res, 2015,14(4):14207-14215.
[25] Bassiouni HM, El-Deeb M, Kenawy N, et al. Phonoarthrography, musculoskeletal ultrasonography, and biochemical biomarkers for the evaluation of knee cartilage in osteoarthritis[J]. Mod Rheumatol, 2011,21(5):500-508.
[26] Szymanowski K, Mikolajczyk M, Wirstlein P, et al. Matrix metalloproteinase-2 (MMP-2), MMP-9, tissue inhibitor of matrix metalloproteinases (TIMP-1) and transforming growth factor-β2 (TGF-β2) expression in eutopic endometrium of women with peritoneal endometriosis[J]. Ann Agric Environ Med, 2016,23(4):649-653.
[27] Alameddine HS, Morgan JE. Matrix metalloproteinases and tissue inhibitor of metalloproteinases in inflammation and fibrosis of skeletal muscles[J]. J Neuromuscul Dis, 2016,3(4):455-473.
[28] Huang MJ, Huang HQ, Salam N, et al. Nocardioides intraradicalis sp. nov., isolated from the roots of Psammosilene tunicoides W. C. Wu et C. Y. Wu[J]. Int J Syst Evol Microbiol, 2016,66(10):3841-3847.
[29] Zhou X, Wang L,Tian Y,et al. Chemical constituents from roots of psammosilene tunicoides[J]. Zhongguo Zhong Yao Za Zhi, 2013,38(20):3507-3509.
[30] Wang L, Gong XJ, Zhou X, et al. Chemical constituents of psammosilene tunicoides and bacteriostatic activity[J]. Zhongguo Zhong Yao Za Zhi, 2012,37(23):3577-3580.
·作者·编者·读者·
《山东医药》关于摘要与关键词的说明
论著需附中、英文摘要(包括目的、方法、结果、结论四部分)。中文摘要300~500字,英文摘要400~500个实词。英文摘要尚应包括文题、作者姓名(汉语拼音)。论著、基础研究、临床研究、综述与讲座需标引关键词2~5个,尽量使用美国国立医学图书馆编辑的最新版《Index Medicus》中医学主题词表(MeSH)所列的词。英文关键词中的缩写词应按MeSH还原为全称。
贵州省中医药管理局资助项目(QYZZ-2016-029)。
刘毅(E-mail: 13308529536@163.com)
10.3969/j.issn.1002-266X.2017.31.010
R684.3
A
1002-266X(2017)31-0036-05
2017-07-02)

