新疆地区维吾尔族、汉族非小细胞肺癌患者胞苷脱氨酶基因多态性对比分析
王艳娜,费晶,程艳芳,孟玲利,王慧,巩平
(石河子大学医学院第一附属医院,新疆石河子832000)
·论著·
新疆地区维吾尔族、汉族非小细胞肺癌患者胞苷脱氨酶基因多态性对比分析
王艳娜,费晶,程艳芳,孟玲利,王慧,巩平
(石河子大学医学院第一附属医院,新疆石河子832000)
目的 分析新疆地区维吾尔族、汉族非小细胞肺癌(NSCLC)患者胞苷脱氨酶(CDA)基因多态性。方法 收集晚期NSCLC初治患者120例,其中维吾尔族53例(维族组)、汉族67例(汉族组),采用直接测序的方法检测两组CDA A79C、G208A基因多态性。结果 两组CDA A79C、G208A基因型频率均符合Hardy-Weinberg平衡(P均>0.05)。维族组A79C AA、AC、CC基因型频率及A、C等位基因频率分别为75.4%、18.9%、5.7%、84.9%、5.1%,汉族组分别为52.2%、29.9%、17.9%、67.2%、32.8%,两组比较,P均<0.05;维族组G208A GG、GA基因型频率和G、A等位基因频率分别为94.3%、5.7%、97.2%、2.8%,汉族组分别为77.6%、22.4%、88.8%、11.2%,两组比较,P均<0.05。结论 新疆地区维吾尔族、汉族CDA A79C、G208A这两个位点的基因多态性存在种族差异性。
胞苷脱氨酶;胞苷脱氨酶基因;非小细胞肺癌;基因多态性
吉西他滨是一种干扰影响细胞复制的二氟核苷类抗代谢物抗癌药,与顺铂联合方案已成为局部晚期和转移性非小细胞肺癌(NSCLC)的标准抗癌一线治疗方案[1,2]。临床观察发现,同一病理类型、同一分期的NSCLC患者,在使用含吉西他滨方案治疗后疗效差异很大,造成这种差异的原因可能与患者自身独特的遗传背景有关。单核苷酸多态性(SNP)是人类可遗传变异中最常见的一种,广泛且稳定的存在于人类基因组中。SNP及其所调控的基因表达是肿瘤对化疗药物产生耐药并影响药效的重要因素,而且存在种族差别。胞苷脱氨酶(CDA)是吉西他滨代谢失活的关键酶,其通过脱氨基方式使吉西他滨代谢失活[3]。CDA酶活性的基因改变在吉西他滨代谢中有重要作用[4],它编码3个单核苷酸[5],其中A79C与G208A遗传基因多态性可影响CDA酶活性。本研究对新疆地区维吾尔族、汉族NSCLC患者外周血进行基因型检测,观察两族患者CDA A79C、G208A位点基因型、等位基因是否有民族差异性。
1 资料与方法
1.1 临床资料 选取2014年8月~2016年4月石河子大学医学院第一附属医院及喀什地区第一人民医院收治的晚期NSCLC初治患者120例,男55例,女65例;年龄33~77岁,中位年龄63岁;维吾尔族53例(维族组),汉族67例(汉族组)。病理类型:鳞癌69例,腺癌51例;临床分期:ⅢB期60例,Ⅳ期60例;ECOG评分:0~1分84例,2分36例。纳入标准:所有病例均经病理确诊,且均来自新疆地区维吾尔族、汉族常住人群,相互之间无血缘关系及异族通婚史。排除标准:病理诊断不清,严重感染,多器官功能受损,多处以上转移病灶者。
1.2 CDA基因多态性检测方法 所有入选对象均采集外周血3 mL,置于EDTA管中,-80 ℃冰箱保存。根据北京天根生物科技有限公司提供的全血基因组DNA试剂盒提取DNA,查阅大量文献后,根据参考文献及软件Primer 5.0设计引物,由上海生工生物工程有限公司合成并纯化。A79C、G2081引物及扩增片段长度如下: A79C:5′-GTAGCTTCCCCTT-CCAGTAGCGTG-3′,5′-CTGCGCCTCTTCCTGTACAT-CT-3′,543 bp ; G208A:5′-GACAGTGCCAGGTTCTTGGG-3′,5′-CTGGCACATAGGAAGTCCAC-3′,300 bp。A79C位点PCR扩增条件:95 ℃预变性5 min,94 ℃变性10 s,60 ℃退火10 s,72 ℃延伸30 s,共35个循环,72 ℃延伸5 min,4 ℃永久保存;G2081A位点PCR扩增条件:95 ℃预变性5 min,94 ℃变性10 s,70 ℃ 退火10 s,72 ℃延伸30 s,共35个循环,72 ℃延伸5 min,4 ℃永久保存。PCR产物在2%琼脂糖凝胶电泳后经紫外凝胶成像系统拍照。将上述琼脂糖凝胶电泳有阳性结果的剩余PCR产物送北京博迈德基因技术有限公司进行测序。
1.3 统计学方法 采用SPSS17.0统计软件。用Hardy-Weinberg平衡检验方法进行基因型分布遗传平衡吻合度检验,两民族人群各基因型频率及等位基因频率采用χ2检验进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 基因测序结果 送检120例NSCLC患者中,A79C基因出现野生纯合基因型(AA)、杂合基因型(AC)和突变纯合基因型(CC),G208A基因出现野生纯合基因型(GG)、杂合基因型(GA),未出现突变纯合基因型(AA),见图1~图5。
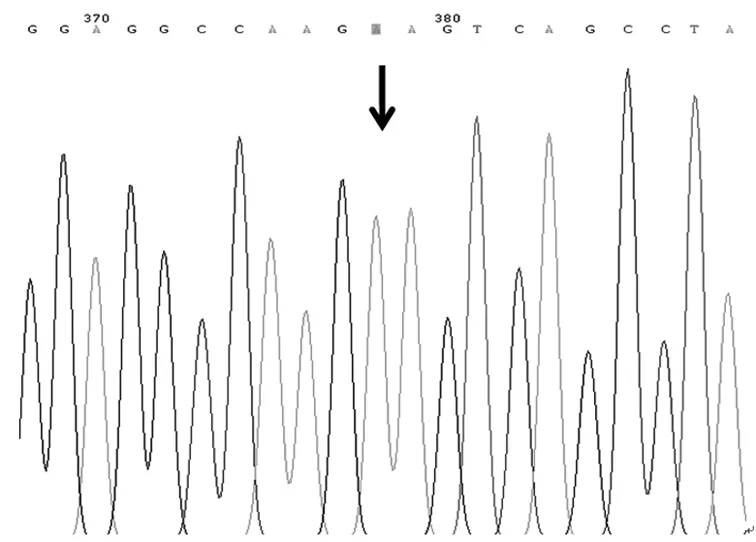
图1 A79C基因野生纯合基因型
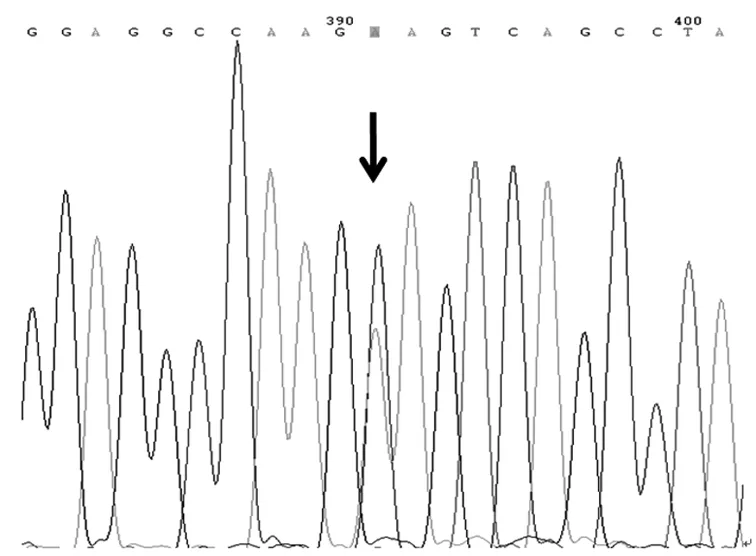
图2 A79C基因杂合突变基因型
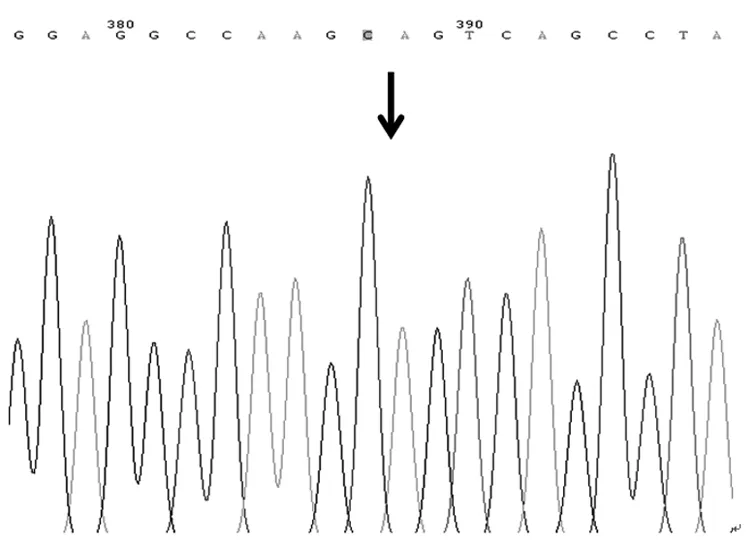
图3 A79C基因纯合突变基因型
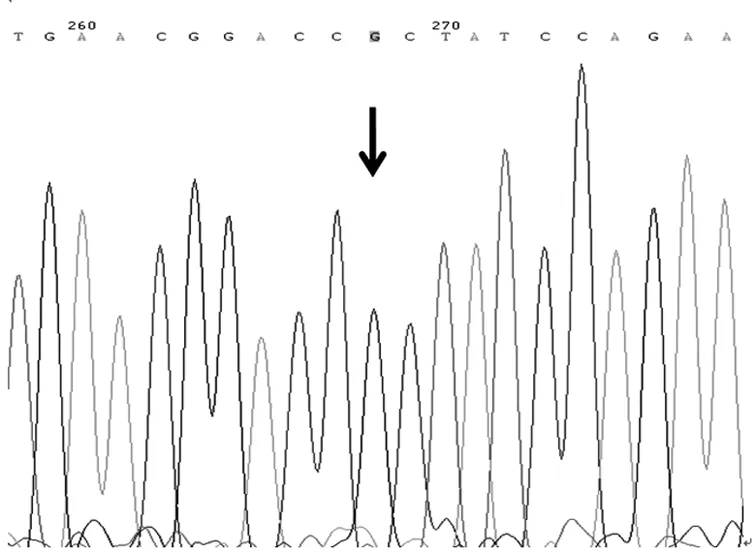
图4 G208A基因野生纯合基因型
图5 G208A基因杂合突变基因型
2.2 Hardy-Weinberg遗传平衡检验结果 纳入人群符合Hardy-Weinberg平衡定律(P均>0.05),表明本实验所选取人群的基因频率可以代表新疆地区维吾尔族、汉族人群的基因频率。
2.3 两组A79C基因型及等位基因分布比较 结果见表1。
2.4 两组G208A基因型及等位基因分布比较 结果见表2。
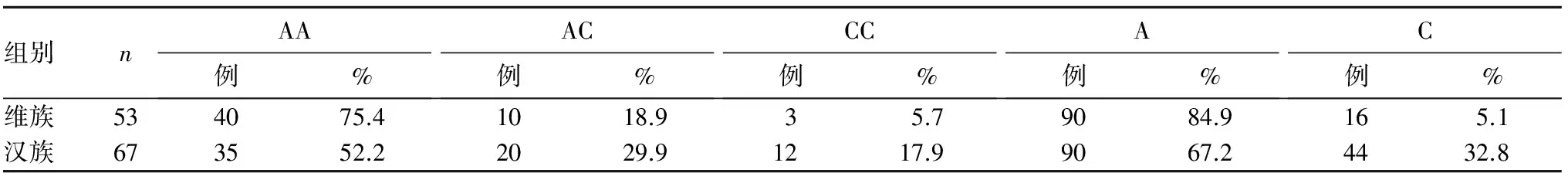
表1 两组A79C基因型及等位基因分布比较
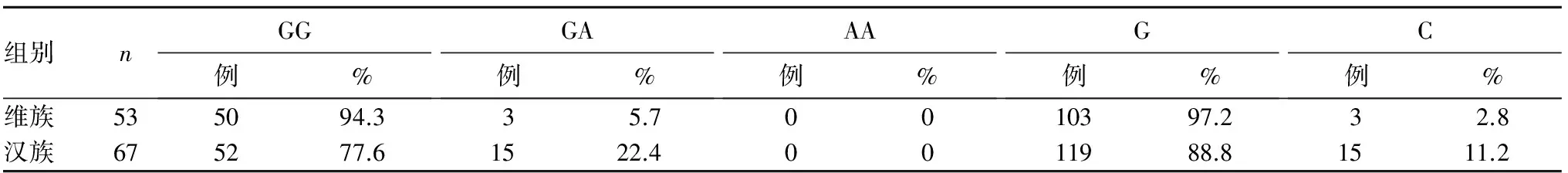
表2 两组G208A基因型及等位基因分布比较
3 讨论
吉西他滨进入体内后,其在血浆中90%的代谢产物可由CDA通过脱氨基方式降解为无活性产物,进而排出体外,因此CDA酶是吉西他滨代谢的关键酶,它位于人类第1号染色体p35~p36.2上,全长约31 kb[6]。关于CDA基因与吉西他滨相关性研究主要集中在CDA基因多态性上,CDA基因的多态性通过影响CDA酶的表达和结构影响CDA活性,从而影响吉西他滨化疗效果[7]。CDA酶活性下降可影响吉西他滨的化疗疗效,有研究[8]表明A79C基因突变型细胞可使CDA酶活性下降。意大利的研究组通过一系列研究发现,A79C中的A等位基因并非C等位基因,可造成脱氨酶活性下降[9];同样有研究[10,11]表明,携带野生型基因(AA)患者的酶活性较携带突变型基因(AC、CC)的患者低。这一结论在Tibaldi等[12]的研究中也得到证实。
在不同国家和地区,不同人种的A79C、G208A等位基因的突变率也有差异。一项来自多个国家支持的药物基因组学研究[13]报道,入组人群均为健康志愿者,在A79C基因位点上,韩国人突变基因型频率为28.0%、突变等位基因频率为15.3%,日本人分别为37.4%、20.4%,华裔美国人分别为29.0%、15.5%,美国白种人分别为55.3%、32.7%,非裔美国人分别为16.0%、8.7%;在G208A基因位点上,韩国人突变基因型频率为1.0%、突变等位基因频率为0.5%,日本人分别为4.5%、2.2%,华裔美国人、美国白种人、非裔美国人均未出现突变基因,且所有研究人群均未出现纯合突变基因型。Carpi等[14]对纳入的263例样本进行研究,发现突变等位基因频率为39.5%;Parmar等[15]的研究显示,突变等位基因频率为35%。国内徐佳林等纳入152病例,测得A79C基因位点的突变率为12%,G208A基因位点的突变率为1%。从以上研究可知,不同种族之间基因突变频率不同,G208A基因突变率较低,且仅存在与亚洲人群中。
本实验纳入54例维吾尔族和66例汉族NSCLC人群,对其CDA A79C、G208A基因多态性进行比较分析,比较前已对这两个位点进行Hardy-Weinberg检验,结果均符合Hardy-Weinberg平衡定律,提示本研究纳入的人群可以代表新疆地区维族和汉族群体,并且两位点基因突变点都能够稳定遗传。本研究显示,维族组A79C AA、AC、CC基因型频率及A、C等位基因频率分别为75.4%、18.9%、5.7%、84.9%、5.1%,汉族组分别为52.2%、29.9%、17.9%、67.2%、32.8%,两组比较,P均<0.05;维族组G208A GG、GA基因型频率和G、A等位基因频率分别为94.3%、5.7%、97.2%、2.8%,汉族组分别为77.6%、22.4%、88.8%、11.2%,两组比较,P均<0.05。因此可得出在新疆维吾尔族、汉族NSCLC患者中,CDA A79C、G208A这两个位点的基因多态性存在种族差异性。但本研究维吾尔族和汉族A79C、G208A等位基因突变率与以上文献报道突变率不同,进一步验证了基因多态性可能与种族有关,但也不排除因样本量造成偏倚的可能。本研究与徐佳林等研究的中国人基因突变频率也略有不同,可能与纳入人群有关,本研究纳入人群均为NSCLC患者,徐佳林纳入的样本为健康人群和多种肿瘤患者,研究结果的不同使我们考虑是否该基因的突变与NSCLC患者之间存在某种关系,才使A79C、G208A突变率较其他研究的突变率升高,还需进一步探讨。
因此,对新疆地区维吾尔族、汉族人群与CDA A79C、G208A基因多态性的关系进一步确认仍需要做大量的工作,在今后的研究中可使用更敏感、特异的等位基因分型技术,在更多的人群中纳入足够大的样本进行更广泛深入的研究,可以为新疆地区维吾尔族、汉族NSCLC患者指导临床用药提供更坚实的遗传学基础。
[1] 陈莹,钱晓萍,刘宝瑞.非小细胞肺癌吉西他滨药物耐药相关基因研究进展[J].中国肺癌杂志,2011,14(5):421-428.
[2] 况福连.吉西他滨联合顺铂与长春瑞滨联合顺铂治疗晚期非小细胞肺癌的临床疗效观察[J].中国医药指南,2012,10(7):149-150.
[3] Wong A, Soo RA, Yong WP, et al. Clinical pharmacology and pharmacogenetics of gemcitabin[J]. Drug Metab Rev, 2009,41(2):77-88.
[4] Danesi R, Altavilla G, Giovannetti E, et al. Pharmacogenomics of gemcitabine in non-small-cell lung cancer and other solid tumors[J]. Pharmacogenomics, 2009,10(1):69-80.
[5] 周敏,戎霞君,高蓓莉,等.着色性干皮病基因组D和胞苷脱氨酶基因单核苷酸多态性与肺癌易感性的关系[J].上海交通大学学报(医学版),2011,31(10):1403-1408.
[6] 糟航,王旭,李薇.CDA基因单核苷酸多态性对中晚期非小细胞肺癌接受吉西他滨化疗患者预后的影响[J].吉林大学学报(医学版),2016,42(2):316-320.
[7] Ostanzi S, Vincenzetti S, Cristalli G, et al. Human cytidine deaminase: a three dimensional homology model of a tetrameric Metallo enzyme inferred from the crystal structure of a distantly related dimeric homologue[J]. J Mol Graph Model, 2006,25(1):10-16.
[8] Gilbert JA, Salavaggione OE, Ji Y, et al. Gemcitabine pharmacogenomics: cytidine deaminase and deoxycytidylate deaminase gene resequencing and functional genomics[J]. Clin Cancer Res, 2006,12(6):1794-1803.
[9] Giovannetti E, Laan AC, Vasile E, et al. Correlation between cytidine deaminase genotype and gemcitabine deamination in blood sample[J]. Nucleosides Nucleotides Nucleic Acids, 2008,27(6):720-725.
[10] Gilbert JA, Salavaggione OE, Ji Y, et al. Gemcitabine pharmacogenomics: cytidine deaminase and deoxycytidylate deaminase gene resequencing and functional genomics[J]. Clin Cancer Res, 2006,12(6):1794-803.
[11] Toffalorio F, Giowannetti E, De Pas T, et al. Expression of gemcitabine-and-cisplatin-related genes in non-small-cell lung cancer[J]. Pharmacogenomics J, 2009,10(3):180-190.
[12] Tibaldi C, Giovannetti E, Vasile E, et al. Correlation of CDA, ERCC1, and XPD polymorphisms with response and survival in gemcitabine/cisplatin-treated advanced non-small cell lung cancer patients[J].Clin Cancer Res, 2008,14(6):1797-1803.
[13] Sugiyama E, Le SJ, Lee SS, et al. ethnic difference of two non-synoymous single nucleotide polymorhpisms in CDA gene[J]. Drug Metab Pharmacokinet, 2009,24(6):553-556.
[14] Carpi FM, Xu JL, Vincenzetti S, et al. Rapid allele-specific pcr method for CDA 79A>C(K27Q)genotyping: a useful pharmacogentic tool and world-wide polymorphism distribution[J]. Clin Chim Acta, 2011,412(23-24):2237-4022.
[15] Parmar S, Seeringer A, Denich D, et al. Variability in transport and biotransformation of cytarabine is associated with its toxicity in peripheral blood mononuclear cells[J]. Pharmacogenomics, 2011,12(4):503-514.
·作者·编者·读者·
文后参考文献的著录方法
按GB/T7714-2005《文后参考文献著录规划》采用顺序编码制著录,依照其在文中出现的先后顺序用阿拉伯数字加方括号标出。参考文献中的作者1~3名全部列出,3名以上只列前3名,后加“,等”或其他与之相应的文字。外文期刊名称用缩写,以《Index Medicus》中的格式为准;中文期刊用全名。论文题目后加文献类型及标识,如专著[M]、期刊文章[J]等。每条参考文献均须著录起止页。作者必须认真核对参考文献原文,无误后将其按引用顺序(用阿拉伯数字)排列于文末。
Comparision of CDA gene polymorphism between Xinjiang Uygur and Han NSCLC patients
WANGYanna,FEIJing,CHENGYanfang,MENGLingli,WANGHui,GONGPing
(TheFirstAffiliatedHospitalofShiheziUniversity,Shihezi832000,China)
Objective To analyze the cytidine deaminase (CDA) gene polymorphism in Uygur and Han patients with non-small-cell lung cancer (NSCLC) in Xinjiang Uygur autonomous region. Methods Totally 120 cases of newly diagnosed advanced NSCLC patients, including 53 cases of Uygur (Uygur group) and 67 cases of Han nationality (Han group), were selected to detect the CDA A79C and G208A gene polymorphisms by direct sequencing. Results The frequencies of CDA A79C and G208A genotypes were in accordance with Hardy-Weinberg equilibrium (allP>0.05). The frequencies of A79C AA, AC, CC genotypes and A and C alleles were 75.4%, 18.9%, 5.7%, 84.9%, and 5.1%, respectively in the Uygur group, versus 52.2%, 29.9%, 17.9%, 67.2%, and 32.8% in the Han group (allP<0.05). The frequencies of G208A GG, GA genotypes and G and A alleles were 94.3%, 5.7%, 97.2%, and 2.8%, respectively in the Uygur group, versus 77.6%, 22.4%, 88.8%, and 11.2%, respectively, in the Han group (allP<0.05).Conclusion There are racial differences in the genetic polymorphisms of CDA A79C and G208A between the Uygur and Han nationalities in Xinjiang.
cytidine deaminase; cytidine deaminase gene; gene polymorphism; non-small-cell lung cancer;
国家自然科学基金资助项目(81560381);留学人员科技活动择优资助项目。
王艳娜(1990-),女,硕士,主要研究方向为肿瘤化疗与生物免疫治疗。E-mail: 1415232722@qq.com
巩平(1964-),女,教授,主任医师,博士生导师,主要研究方向为肿瘤化疗与生物免疫治疗。E-mail: 18999536479@163.com
10.3969/j.issn.1002-266X.2017.31.001
R734.2
A
1002-266X(2017)31-0001-04
2017-03-07)

