基于微流控芯片技术橙皮苷抗肺肿瘤作用机制研究
樊佳新,王 帅,2,3,孟宪生,2,3,包永睿,2,3,李天娇,2,3
(1.辽宁中医药大学药学院,2.辽宁省组分中药工程技术研究中心 116600;3.辽宁省现代中药研究工程实验室,辽宁 大连 116600)
基于微流控芯片技术橙皮苷抗肺肿瘤作用机制研究
樊佳新1,王 帅1,2,3,孟宪生1,2,3,包永睿1,2,3,李天娇1,2,3
(1.辽宁中医药大学药学院,2.辽宁省组分中药工程技术研究中心 116600;3.辽宁省现代中药研究工程实验室,辽宁 大连 116600)
目的探究橙皮苷诱导人肺癌细胞A549凋亡的作用机制。方法基于微流控芯片技术采用Hoechst 33342/PI染色法检测橙皮苷对肺癌细胞A549凋亡坏死的影响;流式细胞术检测橙皮苷对肺癌细胞周期及凋亡的影响;实时荧光定量PCR技术检测相关基因VEGF、PI3K及PTEN的表达;Western blot 技术检测橙皮苷诱导肺癌细胞中PI3K-Akt信号通路相关蛋白PI3K、Akt、PTEN及凋亡蛋白Bcl-2、周期蛋白Cyclin B1的表达。结果橙皮苷作用于细胞G0/G1期及S期,阻滞细胞分裂,并呈现浓度依赖性诱导肺癌细胞凋亡,其细胞凋亡坏死率由正常对照组的(6.7±0.6)%增至(27.9±1.1)%;经橙皮苷诱导后的肺癌细胞中VEGF和PI3K基因表达相对降低,抑癌基因PTEN表达相对增加。Western blot 结果显示,经橙皮苷诱导的肺癌细胞中凋亡蛋白Bcl-2及周期蛋白Cyclin B1相对表达降低,PI3K-Akt信号通路蛋白Akt表达量与对照组比较明显减少,PI3K蛋白表达量相对增加,PTEN表达量无明显变化。结论橙皮苷可能是通过干扰PI3K-Akt信号通路,阻碍肿瘤细胞的分裂并促进凋亡蛋白的产生,从而诱导肺癌细胞 A549 凋亡。
橙皮苷;肺癌细胞A549;微流控芯片;实时荧光定量PCR;PI3K-Akt信号通路;Cyclin B1;Bcl-2;细胞凋亡
癌症一直是危害人类健康的历史性难题,其中肺癌已逐渐成为三大癌症之一。随着分子检测技术的飞速发展和不同驱动基因的发现,肺癌已成为一类由不同分子亚型构成的异质性疾病,标志着肺癌的治疗已经正式进入靶向时代[1]。橙皮苷是黄酮类化合物的一种,不仅作为中药陈皮的主要活性成分之一,在中药荆芥中也是主要抗肺癌的活性成分,具有抗炎、提高免疫力、抑菌、降血脂、抗病毒、抗肿瘤等多种药理学活性[2-4]。多数文献报道显示其研究均采用孔板技术,为了进一步使其研究贴近人体内部微环境,本研究以橙皮苷为研究对象,采用先进的微流控芯片技术进行体外药效学研究,充分利用其微尺度条件下高效、节能的优势。并结合基因及蛋白质免疫印迹法对其作用机制进行补充,为基于微流控芯片技术的肿瘤药理学研究提供新的研究平台及研究思路。
1 材料与方法
1.1细胞与试剂人非小细胞肺癌细胞株A549(购自中国科学院典型培养物保藏委员会细胞库);橙皮苷(购自四川省维克奇生物科技有限公司,批号:160509,HPLC检测纯度≥98%);细胞凋亡与坏死检测试剂盒[Hoechst 33342和碘化丙啶(PI),碧云天生物技术研究所,批号:C1056-3];Cell Cycle Assay Kit、Annexin V-FITC/PI Apotosis Detection Kit(南京诺维赞生物科技有限公司);顺铂(江苏豪森药业股份有限公司);TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix、TransStart Top Green qPCR SuperMix(北京全式金生物技术有限公司);高效RIPA裂解液(上海索莱宝生物科技有限公司,批号:20160627);SDS-PAGE凝胶配制试剂盒(上海索莱宝生物科技有限公司);Albumin Bovine V (上海索莱宝生物科技有限公司,批号:1030D057); EasySee Western Blot Kit (北京全式金生物技术有限公司,批号:K20603);抗体β-actin、Akt、PTEN、PI3K、Bcl-2和Cyclin B1(Cell-signaling Tech.)。
1.2仪器与材料G-2U型光刻机(北京中科同志科技有限公司);HPDC-32G-2型等离子清洗机(美国Harrick Plasma公司);SC-1B型匀胶机(北京创世威纳科技有限公司);XMTD-808P程序温控仪(余姚市长江温度仪表厂);精密注射泵(LSP04-1A,保定兰格公司);CO2培养箱(美国SIM公司);ECLIPSE Ti研究级荧光倒置显微镜(日本Nikon公司);C6流式细胞仪(美国BD公司);通用电泳仪(美国BD公司);抛光单晶硅片(浙江立晶光电科技有限公司);Sylgard 184型聚二甲基硅氧烷PDMS和固化剂(美国Dow Corning公司)。

Fig 1 The schematic diagram of chip
1.3方法
1.3.1芯片的设计与制作 通过软光刻技术、模注法及等离子键合三大主要技术进行芯片制作,其中PDMS-玻璃复合芯片微流控芯片包括液阀操控层、流体通道层和玻璃基片层[5]。蓝色区域为液阀及气阀通道,红色通道为流体通道,椭圆形红色区域为4×4列细胞培养腔,4列细胞培养腔共用1个废液口,如Fig 1所示。
1.3.2细胞培养及药物配制 人肺癌细胞A549,常规培养于含10%胎牛血清的DMEM培养液中,取对数生长期的细胞接种于芯片中,待细胞贴壁后,以0.2 μL·min-1的流速经蠕动泵灌注空白培养液进行动态细胞培养。
橙皮苷(20 mg)溶于200 μL DMSO配制成浓度为100 g·L-1储存液, -20℃保存。实验时用10%胎牛血清的DMEM培养基稀释成相应浓度(DMSO终体积分数不超过0.5%)。
1.3.3荧光染色法检测肺癌细胞A549的凋亡坏死率 肺癌细胞常规培养于芯片中,待细胞密度占总面积的0.7左右时,给予不同浓度(0.005、0.01、0.05、0.1、0.5 g·L-1)的橙皮苷分别刺激36 h,采用Hoechst 33342/PI染液对细胞进行双染,使用倒置荧光显微镜对芯片进行拍照检测。
1.3.4细胞周期检测 同肺癌细胞培养的步骤一致,取单细胞悬液接种于6孔板中,加入浓度为0.533 g·L-1的含药培养液以及浓度为6 mg·L-1的阳性对照药(顺铂)刺激36 h后,分别收集细胞,参照周期检测试剂盒的操作说明,避光反应30 min,流式细胞仪检测。
1.3.5细胞凋亡坏死检测 同肺癌细胞培养的步骤一致,取单细胞悬液接种于6孔板中,分别加入浓度为0.533 g·L-1的含药培养液以及浓度为6 mg·L-1的阳性对照药刺激36 h后,分别收集细胞。参照细胞凋亡试剂盒的详细说明书进行操作,流式细胞仪检测。
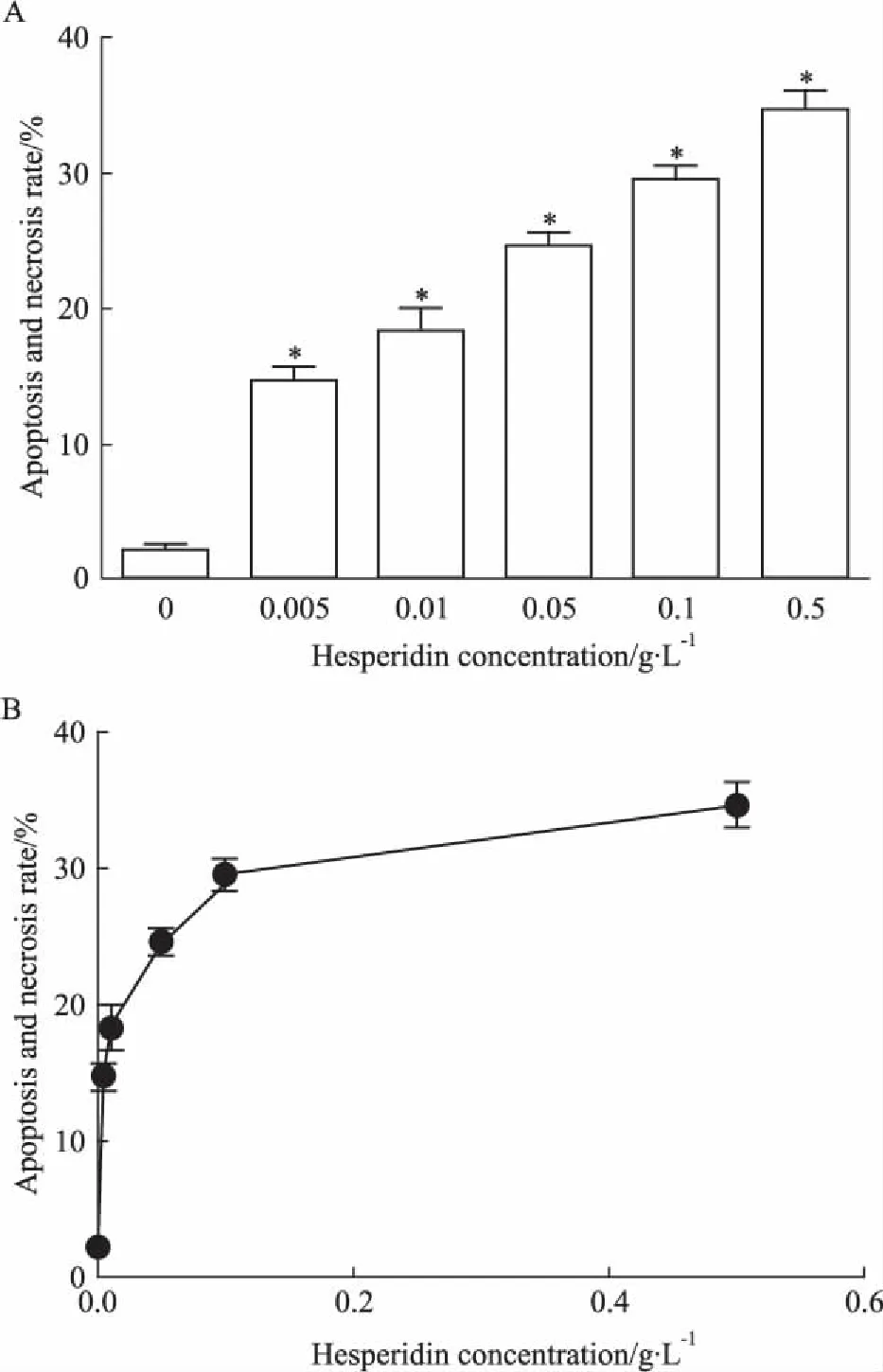
Fig 2 Effect of hesperidin on A549 lung cancer cells
1.3.6实时荧光定量PCR检测 肺癌细胞A549常规培养于6孔板中,待细胞密度占总面积的70%左右时,浓度为0.533 g·L-1的药物干预36 h实验。PBS清洗后收集细胞,所有的细胞悬液合并离心,弃上清,PBS清洗细胞沉淀1次,在细胞沉淀中依次加入1 mL TRIzol、200 μL氯仿、异丙醇、DEPC水配制的冰乙醇(体积分数为0.75的乙醇),洗涤RNA,4℃离心5 min,室温干燥至RNA沉淀由乳白色变成透明状,加入一定体积的 RNA溶解液溶解。采用Qubit® 2.0 Fluorometer 测定RNA浓度和纯度。应用TransScript First-Strand cDNA Synthesis SuperMix反转录试剂盒,根据样本浓度大小进行cDNA第一链合成,Tab 1为目的基因序列表。TransStart Top Green qPCR SuperMix试剂盒进行扩增,反应体系均为20 μL。采用三步法94 ℃ 5 min,94 ℃ 10 s,60 ℃ 15 s,72 ℃ 15 s,30个循环,最后72 ℃ 5 min的PCR扩增条件进行反应。反应产物分装于200 μL EP管中,-20 ℃保存待用。
1.3.7Western blot检测 取对数生长期的肺癌细胞A549,调整细胞密度接种于6孔板中。分别设置空白对照组、阳性对照组和橙皮苷给药组,药物诱导干预36 h后,用细胞裂解液裂解细胞,提取各组总蛋白,并使用Lowry法测定蛋白含量,使各组蛋白终浓度相同。采用10%分离胶和4%浓缩胶的SDS-PAGE,100 V电压下电泳30 min,调节电压120 V继续电泳至指示剂至分离胶底部时结束电泳,随即进行转膜及封闭实验。转膜结束后,剥离 PVDF 膜进行抗原抗体特异性结合(一抗按照1 ∶500稀释,二抗按照1 ∶5 000稀释),TBST漂洗,ECL法进行显色,采用IPP软件检测分析条带灰度值,用各组目的条带的灰度值和内参的灰度值比值表示蛋白质相对表达水平。
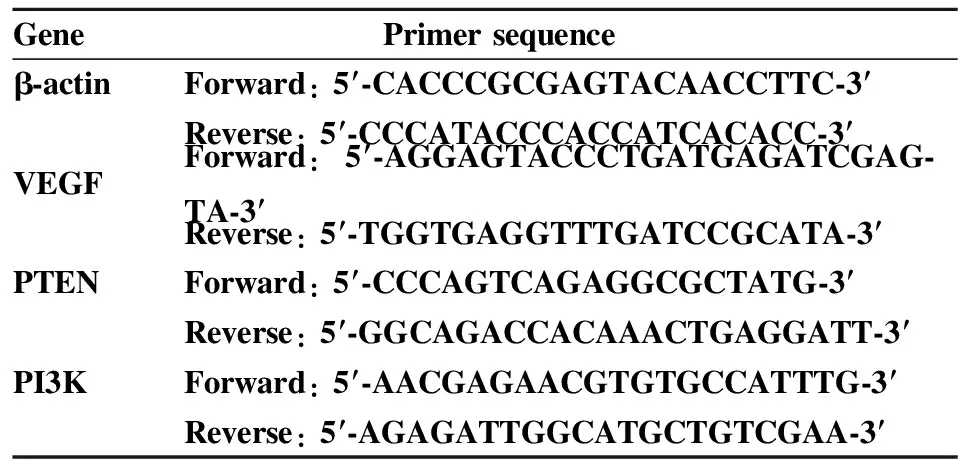
Tab 1 Primer sequences of target genes

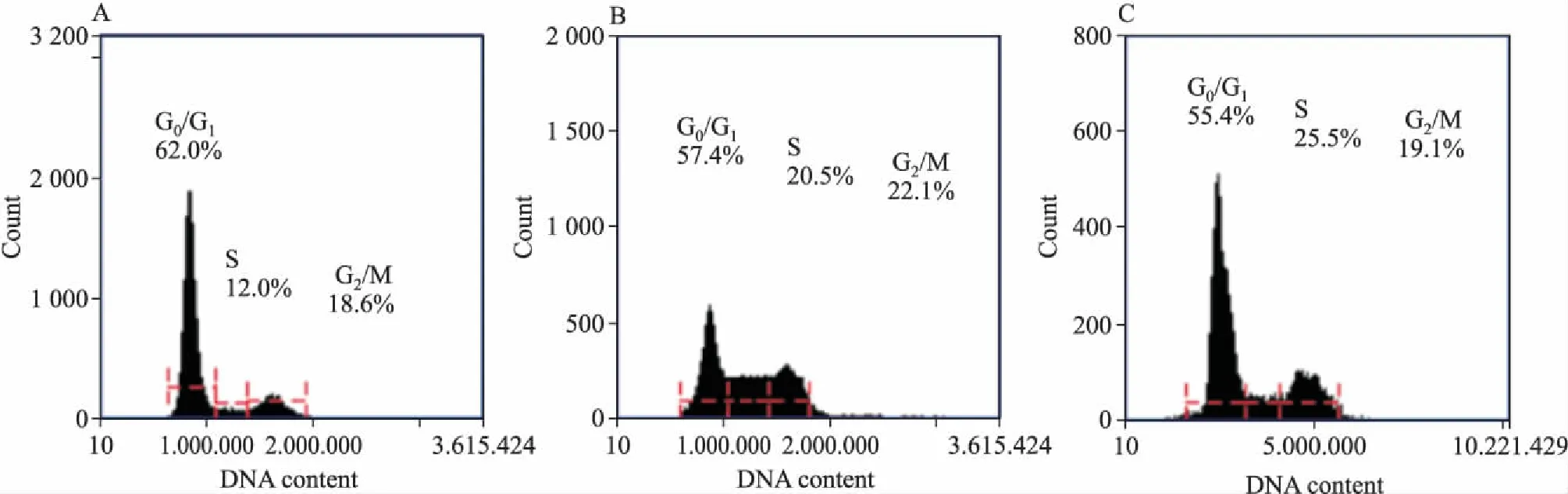
Fig 3 Influence of hesperidin on cell cycle

Fig 4 Influence of hesperidin on the cell apoptosis
Tab 2 Effect of hesperidin on apoptosisrates of A549 cells(±s,n=3)
*P<0.05vscontrol
2 结果
2.1橙皮苷能有效抑制肺癌细胞A549的增殖与空白对照组相比,橙皮苷0.005、0.01、0.05、0.1、0.5 g·L-1作用于A549细胞36 h后,凋亡坏死现象明显(P<0.05),见Fig 2A。橙皮苷作用于A549细胞36 h的半数致死浓度(IC50)为0.533 g·L-1。由Fig 2B可见,橙皮苷对肺癌细胞A549的抑制作用呈现一定的浓度依赖性。
2.2橙皮苷能抑制A549细胞周期分裂肿瘤细胞的分裂过程分为几个时相,包括G0/G1期、S期、G2/M期,不同周期具有不同的功能[6]。与空白组比较,肺癌细胞A549经橙皮苷干预后,G0/G1期所占比例由(62.0±1.1)%下降至(55.4±0.3)%,S期所占比例由(12.0±1.3)%明显上升至(25.5±1.1)%,G2/M期无明显变化,见Fig 3。提示橙皮苷可通过阻断细胞由G0/G1期向S期转化,增加S期细胞比例,从而达到抑制肺癌A549细胞增殖及分裂。
2.3橙皮苷能抑制A549细胞凋亡流式细胞仪检测结果显示,给药刺激36 h后,空白对照组与给药组差异具有显著性。随着给药浓度的增大,细胞的凋亡坏死率由(5.7±0.6)%增加至(27.9±1.1)%。见Tab 2、Fig 4。提示橙皮苷对肺癌细胞A549具有一定诱导凋亡的作用。
2.4橙皮苷调控癌症相关基因表达PI3K和PTEN均为PI3K-Akt信号通路中的相关基因,VEGF为血管内皮细胞生长因子,与PI3K-Akt信号通路具有一定的内在联系,均与肿瘤的发生、发展具有密切联系。橙皮苷对人肺癌A549细胞干预36 h后,对这3种基因产生了一定影响。其中PI3K和VEGF的表达相对降低,PTEN的表达相对增加。见Fig 5。
2.5橙皮苷对信号通路中相关蛋白的调控作用肺癌A549细胞经橙皮苷诱导36 h后,收集细胞提取总蛋白,Western blot对PI3K-Akt信号通路相关蛋白表达量进行分析。Fig 6结果显示,与空白对照组相比较,给药组中凋亡蛋白Bcl-2、周期蛋白Cyclin B1及Akt的表达相对降低,PI3K表达相对升高,差异具有统计学意义(P<0.05),但PTEN上调效果不明显,差异无统计学意义。结果提示,橙皮苷通过调控PI3K-Akt信号通路、凋亡蛋白和周期蛋白的表达,导致肺癌细胞凋亡。

Fig 5 Effect of hesperidin on relative gene expression in A549 cells
3 讨论
肺癌已经成为呼吸系统中最常见的恶性肿瘤类疾病之一,其中80%~85%为非小细胞肺癌。并且,肺癌的发病率以及死亡率呈现明显的上升趋势[7-8]。橙皮苷为传统中药陈皮以及荆芥等药材中的主要成分之一,大量研究表明,其对正常的细胞、组织及器官无明显毒性,对肿瘤的治疗以及心血管、神经系统具有较好的药理活性[9-11]。
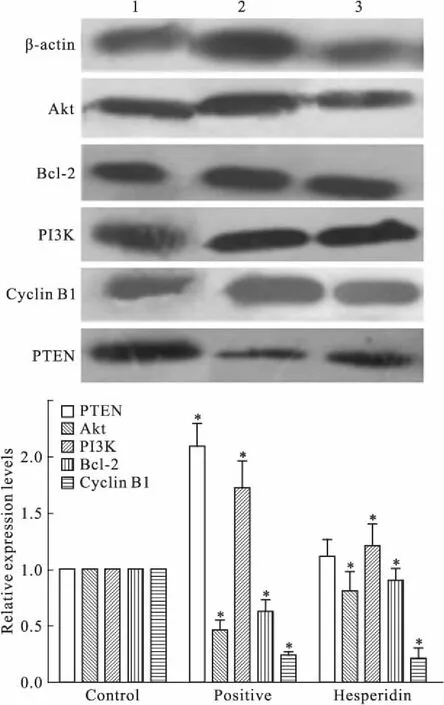
Fig 6 Effect of hesperidin on protein expression of A549 cells
本实验充分利用微流控芯片技术高通量、高灵敏、低消耗等优势开展橙皮苷体外药效学研究。细胞在微流体状态下进行动态培养,其研究结果更加贴近人体内部微环境,数据更真实可靠[12,14]。其次,给药作用48 h的试剂消耗量不足0.6 mL,其消耗量是传统孔板技术的百分之一,大大节约了研究成本,并简化了传统的复杂操作,为目前抗肺肿瘤类疾病药物的高通量筛选奠定了实验基础。流式细胞仪的检测进一步验证其药效结果,橙皮苷具有明显的诱导肿瘤细胞凋亡的作用,同时对肿瘤细胞的G0/G1期和S期有所干扰,简而言之,橙皮苷通过抑制细胞分裂进而延缓肿瘤细胞的增殖。应用实时荧光定量PCR以及Western blot技术,对其细胞凋亡及细胞周期的结果从分子水平上进行了进一步验证,明确橙皮苷对凋亡蛋白以及周期蛋白具有一定的调控作用。
PI3K-Akt信号通路是机体内重要信号通路,通过调节细胞增殖、凋亡,参与多种肿瘤发生发展。Cyclin B1 与Bcl-2与细胞的生长密切相关[15],通过干扰PI3K-Akt信号通路、周期蛋白与凋亡蛋白的表达,进而影响肿瘤细胞的增殖。综上所述,橙皮苷对于肺癌细胞具有明显的抗肿瘤活性,其通过干扰PI3K-Akt信号通路,从而影响周期蛋白以及凋亡蛋白的合成,诱导肿瘤细胞死亡。
(致谢:感谢辽宁中医药大学分析测试中心的全体老师在实验期间给予的帮助,感谢索轶平、郑义博、王焱同学给予本研究的大力支持。)
[1] 王 荣,石冬琴,谢 华,等. 非小细胞肺癌中EGFR基因突变及靶向药物治疗研究进展[J].中国药理学通报,2013,29(1):22-6.
[1] Wang R, Shi D Q, Xie H, et al. Research progress on EGFR gene mutation in non-small cell lung cancer[J].ChinPharmacolBull, 2013,29(1):22-6.
[2] Birsu C Z, Unlu M, Kiran B, et al. Anti-proliferative, apoptotic and signal transduction effects of hesperidin in non-small cell lung cancer cells[J].CellOncol, 2015,38(3):195-204.
[3] 樊佳新,王 帅,孟宪生,等. 基于微流控芯片技术的荆芥诱导肺肿瘤细胞凋亡谱效关系研究[J]. 药学学报,2017,52(1):126-31.
[3] Fan J X, Wang S, Meng X S, et al. Study on the relationship between spectrum and the effect which induce poptosis in lung cancer cells of Schizonepeta tenuifolia based on microfluidic chip technology[J].ActaPharmSin, 2017,52(1):126-31.
[4] 李雪飞,江 洪. 橙皮苷药理学作用机制及研究进展[J]. 海南医学,2016,27(14):2337-40.
[4] Li X F, Jiang H. New research progress in pharmacological activities and mechanism of hesperidin[J].HainanMed, 2016,27(14):2337-40.
[5] 徐为峰,王 帅,孟宪生,等. 用于肿瘤细胞三维培养的微流控芯片构建及培养条件研究[J]. 中国药理学通报,2016,32(4):581-5.
[5] Xu W F, Wang S, Meng X S, et al. Microfluidic chip for tumor cell 3D culturing establishment and its cultural conditions[J].ChinPharmacolBull,2016,32(4):581-5.
[6] Woo R A, Poon R Y. Cyclin-dependent kinases and S phase control in mammalian cells[J].CellCycle, 2003,2(4):316-24.
[7] Hong S, Tan M, Wang S, et al. Efficacy and safety of angiogenesis inhibitors in advanced non-small cell lung cancer: a systematic review and meta-analysis[J].JCancerResClinOncol, 2015,141(5):909-21.
[8] Hee D S, Kwang-Pyo L, Dongjun J, et al. GPR171 expression enhances proliferation and metastasis of lung cancer cells[J].Oncotarget, 2016,7(7):7856-65.
[9] 石雪萍,李 静,冉建华,等. 人参皂苷Rh2调控PI3K/AKT/GSK-3β信号通路诱导人结肠癌细胞凋亡[J]. 中国药理学通报,2017,33(1):114-9.
[9] Shi X P, Li J, Ran J H, et al. Ginsenoside Rh2 induced human colorectal cancer cell apoptosis through PI3K/AKT/GSK-3β pathway[J].ChinPharmacolBull, 2017,33(3):114-9.
[10]Bodduluru L N, Kasala E R, Barua C C, et al. Antiproliferative and antioxidant potential of hesperetin against benzo(a) pyrene-induced lung carcinogenesis in Swiss albino mice[J].ChemBioInteract, 2015,242:345-52.
[11]Lim J, Lee S H, Cho S, et al. 4-methoxychalcone enhances cisplatin-induced oxidative stress and cytotoxicity by inhibiting the Nrf2/ARE-mediated defense mechanism in A549 lung cancer cells[J].MolCells, 2013,36(4):340-6.
[12]Gholizadeh S, Draz M S, Zarghooni M, et al. Microfluidic approaches for isolation, detection, and characterization of extracellular vesicles: current status and future directions[J].BiosensBioelectron, 2017,91:588-605.
[13]Chi C W, Ahmed A R, Dereli-Korkut Z, et al. Microfluidic cell chips for high throughput drug screening[J].Bioanalysis, 2016,8(9):921-37.
[14]Ozhikandathil J, Badilescu S, Packirisamy M. A brief review on microfluidic platforms for hormones detection[J].JNeuralTransm, 2016,124(1):47-55.
[15]Riquelme E, Behrens C, Lin H Y, et al. Modulation of EZH2 expression by MEK-ERK or PI3K-AKT signaling in lung cancer is dictated by different KRAS oncogene mutations[J].CancerRes, 2016,76(3):675-85.
Studyofmechanismsofhesperidinonanti-lungcancereffectbasedonmicrofluidicchiptechnology
FAN Jia-xin1,WANG Shuai1,2,3,MENG Xian-sheng1,2,3,BAO Yong-rui1,2,3,LI Tian-jiao1,2,3
(1.CollegeofPharmacy,LiaoningUniversityofTraditionalChineseMedicine, 2.LiaoningProvinceComponentofTraditionalChineseMedicineandEngineeringResearchCenter, 3.LiaoningProvinceModernTraditionalChineseMedicineResearchandEngineeringLaboratory,DalianLiaoning116600,China)
AimTo investigate the effect of hesperidin on human lung cancer cell A549 and the possible mechanism.MethodsThe cell apoptosis and necrosis of A549 treated with hesperidin were measured by the Hoechst 33342/PI fluorescent dye based on microfluidic chip technology. Cell cycle and apoptosis rate were evaluated by flow cytometry(FCM). The expressions of the related genes were detected through the real-time fluorescent quantitative PCR technology(RT-PCR) including VEGF, PI3K and PTEN. The protein expressions of Bcl-2, Cyclin B1, PI3K, Akt and PTEN were detected by Western blot after hesperidin intervention.ResultsThe proliferation of A549 cells was significantly inhibited by hesperidin in a dose-dependent manner. FCM results showed that hesperidin could not only influence the G0/G1phase and S phase, but also promote the apoptosis of lung cancer cells. Meanwhile, the apoptosis and necrosis rate was increased from(6.7±0.6)% to(27.9±1.1)% compared with that of control group(P<0.05). From the level of molecular, the gene expressions of VEGF and PI3K were decreased, while the PTEN was increased after hesperidin stimulation. Western blot results showed that the expression of protein Bcl-2, Cyclin B1 and Akt were decreased, which all showed close relationship with cell apoptosis, cell cycle and PI3K-Akt signaling pathway. The expression of PI3K was increased, but the change of PTEN was not statistically significant compared with that of control group.ConclusionHesperidin induces lung cancer cell apoptosis through PI3K-Akt signaling pathway, which blocks cancer cell division and destroys the balance of related protein expression.
hesperidin; lung cancer cell A549; microfluidic chip technology; real-time PCR; PI3K-Akt signal pathway; Cyclin B1; Bcl-2; cell apoptosis
时间:2017-8-20 16:47 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170820.1647.030.html
2017-04-20,
2017-05-16
国家科技部“重大新药创制”科技重大专项(No 2013ZX09507005);辽宁省教育厅一般项目(No L201605)
樊佳新(1991-),女,硕士生,研究方向:药物分析,E-mail:fjx4834@163.com; 孟宪生(1964-),男,博士,教授,博士生导师,研究方向:中药组分配伍、代谢组学及药品质量分析,通讯作者,E-mail:mxsvvv@126.com
10.3969/j.issn.1001-1978.2017.09.015
A
:1001-1978(2017)09-1260-06
R284.1;R329.25;R34-33;R734.202.2

