基于核磁共振的益母草碱抗急性心肌缺血的代谢组学研究
刘成鹏,殷晓芹,李玉琴,罗珊珊,朱 清,,李俊旭,朱依谆
(南通大学1.药学院、2.附属医院药剂科,江苏 南通 226001;3. 复旦大学药学院,上海 201210)
基于核磁共振的益母草碱抗急性心肌缺血的代谢组学研究
刘成鹏1,殷晓芹2,李玉琴1,罗珊珊3,朱 清1,3,李俊旭1,朱依谆3
(南通大学1.药学院、2.附属医院药剂科,江苏 南通 226001;3. 复旦大学药学院,上海 201210)
目的应用核磁共振(NMR)代谢组学技术研究急性心肌缺血以及益母草碱给药大鼠血浆中代谢物组的变化,探讨益母草碱抗心肌缺血作用的机制。方法应用1H NMR分析假手术组、模型组、益母草碱给药组大鼠血浆代谢物组,应用模式识别多变量统计方法研究模型组与假手术组及给药组之间的代谢物组差异。结果正交偏最小二乘法-判别分析(OPLS-DA)结果显示,模型组与假手术组相比有6个代谢物(丙氨酸、赖氨酸、甘氨酸、肌酸、N-乙酰化及O-乙酰化糖蛋白)水平明显增加,而益母草碱干预治疗能明显降低模型组丙氨酸、赖氨酸、甘氨酸水平,并增加胆碱、磷酸胆碱、鲨肌醇含量。结论益母草碱能通过纠正急性心肌缺血氨基酸代谢紊乱,上调胆碱以及肌醇代谢通路发挥心肌保护作用。该研究为评价益母草碱抗心肌缺血作用提供了有力分析手段,并为研究其作用机制提供新的思路。
益母草碱;急性心肌缺血;核磁共振;代谢组学;模式识别;多变量统计
心肌缺血是由于冠状动脉功能性改变(痉挛)或器质性病变(粥样硬化导致血管腔狭窄或阻塞)引起的急性或慢性冠状动脉供血不足。心肌缺血会产生心绞痛症状,若程度严重且持续发展则会导致心肌梗死,严重危害人类的健康。益母草碱(4-胍基-n-丁酰基丁香酸酯,leonurine,Leo),是从传统中药益母草中提取的一种特异生物碱,是益母草的主要有效成分。近年来[1],不少学者发现益母草碱具有许多异于传统的药理作用,例如心血管保护作用、中枢保护作用以及抗糖尿病作用。本研究所在课题组前期对益母草碱抗心肌缺血药理作用进行了研究。结果表明[2-5],益母草碱在体外实验以及动物实验中都显示出确切的抗心肌缺血作用,其作用机制可能与其抗氧化、抗凋亡、调节心肌细胞线粒体功能、激活磷酸肌醇-3-激酶/蛋白激酶B/缺氧诱导因子-1α存活通路有关。虽然前期实验结果已证实益母草碱的抗心肌缺血作用,但是益母草碱抗心肌缺血的具体作用机制仍然不十分明确。
代谢组学(metabonomics)是一种利用高通量、高灵敏度的现代分析技术研究生物体在被扰动后,生物体液中(如血浆、尿液、组织液等)的小分子代谢物的动态变化,了解机体整体的生理状态的一门新兴学科。目前代谢组学已经在疾病诊断及发病机制研究、药效评价及作用机制研究、药物毒性及安全性评价、中药作用整体疗效研究等生命科学的多个领域展示了广阔的应用前景,对药物的研发起到巨大的推动作用[6]。目前代谢组学检测技术主要形成两种流派,即基于质谱(mass spectrometry,MS)或基于核磁共振(nuclear magnetic resonance,NMR)为主的检测方法。由于NMR技术准确性高,稳定可靠,而且样本预处理简便无损,其使用非常广泛。
肌酸激酶同工酶(creatine kinase isoenzyme MB,CK-MB)与心肌肌钙蛋白I(troponin I,Tn-I)水平升高在心肌梗死的临床诊断中具有非常高的特异性与灵敏性,它们已经成为目前最具有代表性的心肌损伤标志物[7]。本研究先观察益母草碱对于急性心肌缺血大鼠血中CK-MB、Tn-I水平以及心肌梗死面积的改善作用以确定益母草碱抗心肌缺血的有效性,然后利用基于1H NMR的代谢组学方法研究益母草碱抗心肌缺血作用及其机制。
1 材料与方法
1.1仪器与试剂Bruker AVIII 600 MHz NMR仪,其质子的共振频率为600.13 MHz,配有超低温探头(德国Bruker Biospin 公司);Milli-Q纯水仪(美国Millipore公司);益母草碱由本课题组实验室合成(经HPLC验证其纯度为98%),用生理盐水配置成浓度为1.5 g·L-1的注射液备用;其它常规化学试剂均为分析纯,购于上海国药集团化学试剂有限公司;所有试剂所配置用水均为去离子水,由Milli-Q纯水仪产生;2,3,5-三苯基氯化四氮唑(2,3,5-trihenylterzolium chloride,TTC)购于美国Sigma-Aldrich公司;CK-MB以及Tn-I试剂盒购于南京建成生物科技有限公司。
1.2实验动物与样本收集♂SD大鼠,体质量(200±10)g,由南通大学实验动物中心提供。24只大鼠随机分为3组:假手术组(Sham)、急性心肌缺血模型组(AMI)、益母草碱给药组(Leo)。假手术组与模型组大鼠给予腹腔注射生理盐水,给药组大鼠给予腹腔注射益母草碱,给药剂量为15 mg·kg-1,给药容积为10 mL·kg-1,连续给药9 d。在d 7给药0.5 h后,模型组大鼠与给药组大鼠行冠脉结扎术造模,即用3%的戊巴比妥钠40 mg·kg-1腹腔注射麻醉大鼠,仰卧位固定,四肢皮下连接肢体II导联心电图,术中心电监护。行气管插管,进行人工辅助通气。剃去胸部及颈部鼠毛,碘酒消毒,分离肋间肌,沿胸骨左缘0.5 cm处第3肋间开胸,用扩胸器撑开肋间切口,剪开心包,暴露心脏。用6.0号丝线弯针在左心耳和肺动脉圆锥之间,距主动脉根部约2.3 mm处永久性结扎左冠状动脉前降支,观察到供血区域心肌变白、并以标准肢体导联Ⅱ导联心电图ST段抬高为模型成功标准。迅速关闭胸腔,缝合皮肤,恢复自主呼吸。假手术组除不结扎冠状动脉外,其余操作相同。待大鼠呼吸稳定后,装笼。室温,相对湿度55%~65%,常规饮食、饮水及照明。手术后继续给药2 d。于冠脉结扎术后48 h,取大鼠血样,肝素抗凝,室温放置0.5 h后,4℃、3 000 r·min-1,离心15 min,吸取上清液后置于离心管中,并分装于-80℃保存,然后处死大鼠,取心肌组织。
1.3测定血浆中CK-MB酶活性与Tn-I的含量取3组大鼠血浆,按照试剂盒提供的说明书进行测定。最后用酶标仪读取并计算CK-MB的活性与Tn-I的含量。
1.4TTC染色法测定心肌梗死面积取大鼠心室,切成2 mm厚度的多个水平薄片,在1%TTC溶液中37℃水浴加热10 min,生理盐水终止反应,再置于4%多聚甲醛溶液中固定30 min。薄片经数码相机拍照后输入计算机。经Image tool图像分析软件计算梗死区面积及心室面积。梗死百分比/% = 梗死区域面积/左心室面积×100%。
1.5血浆样品预处理取各组大鼠的血浆样品,在室温下解冻,取血样样本200 μL放于1.5 mL 离心管中,加入400 μL缓冲液(45 mmol·L-1NaH2PO4/K2HPO4;NaN3:0.1%;pH:7.4;100% D2O),涡旋震荡60 s混匀后离心(4℃,16 099×g,10 min),取550 μL上清液至5 mm核磁管中待检。
1.6NMR检测与数据预处理采用Bruker AVIII 600 MHz NMR(质子的共振频率为600.13 MHz,超低温探头)对血样样本分别进行1H NMR检测。采用有预饱和压水的1D CPMG脉冲序列,检测各个样本的小分子代谢物成分。对采集的所有一维1H NMR谱图的自由感应衰减信号加上增宽因子为1Hz的指数窗函数后进行傅立叶变换,以提高信噪比,然后手动进行谱图相位和基线校正,所有样品的核磁共振谱图采用α-葡萄糖低场处的双峰定标(5.23 ppm)。利用相关软件将核磁共振谱图进行积分,参数如下:积分区间为9.0~0.5 ppm,积分间距为0.002 ppm,去除水峰(5.17~4.48 ppm)以及尿素峰(6.00~5.60 ppm)。将积分后的数据归一化后进行多变量数据统计分析。

2 结果
2.1益母草碱对急性心肌缺血大鼠血浆中CK-MB与Tn-I水平的影响如Tab 1所示,与假手术组(Sham)相比,模型组(AMI)中CK-MB与Tn-I水平明显升高(P<0.01),说明心肌缺血模型造模成功。而经过益母草碱(Leo)干预治疗后,CK-MB与Tn-I水平明显下降(P<0.05,P<0.01),说明心肌缺血情况得到明显改善。
2.2益母草碱对急性心肌缺血大鼠心肌梗死面积的影响Fig 1为3组大鼠典型的梗死心肌切片截面图,颜色染红部位表明是正常心肌,而未染成红色,颜色苍白部位则为梗死区域。肉眼可以直接观察到假手术组(Sham)心肌组织全部染红,没有梗死心肌,而模型组(AMI)心肌梗死区域很明显,经益母草碱(Leo)干预给药后,可见心肌梗死区域面积大大减少。将其使用图像分析软件计算后,所得结果见Fig 2。经统计学分析,益母草碱15 mg·kg-1干预给药能有效改善心肌缺血情况,减少心肌梗死面积(P<0.05)。

Fig 1 Typical photos of infarcted left ventricle slices of sham (A), AMI (B), and leonurine-treated (C) groups
The pale zones were the infarcted tissues.
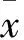
Tab 1 Effect of leonurine on levels of CK-MB and Tn-Iin plasma of acute myocardial ischemia rats(±s,n=8)
**P<0.01vssham group;#P<0.05,##P<0.01vsAMI model group
#P<0.05vsAMI model group
2.31H NMR谱图结果选择各组中具有代表性的谱图,根据相关文献[8],并结合公共数据库对核磁共振信号进行归属,如Fig 3所示。为简便起见,以M代表模型组,N代表假手术组、L代表给药组,下同。
2.4多变量统计分析
2.4.1主成分分析(PCA) PCA使用中心化换算的数据标准化方式,用得分图(score plot)来表示结果,其中得分图中每个点代表1个NMR谱,即1个样品的所有代谢物,将样品之间的差异显示在主成份(PCs)之中。模型的质量以R2X(模型的可解释变量)和Q2(模型可预测度)进行评价。首先采用PCA对所有组别进行分析,能从总体上反映各组样本之间的聚类情况。得到3D PCA得分图如Fig 4所示,其R2X为78.7%,说明主成分提取比较完全,基本可以替代原始的复杂的代谢组成分反映的样品信息;Q2为0.706较高(高于0.4),说明模型预测能力比较强,从图中明显看出3组样本之间的聚类现象比较明显,说明各组之间的代谢组存在比较明显的差异。然后将M-N以及M-L间的代谢组分别进行PCA分析。Fig 5为M-N与M-L的PCA得分图,其中M-N比较的R2X=78.4%, Q2=0.657,M-L组比较的R2X=83.8%, Q2=0.752,提示所建立的数学模型比较可靠,从图中可以看出虽然组与组之间有所重叠,但聚类现象还是比较明显,说明M组与N组、M组与L组之间代谢组的差异比较显著。
2.4.2偏最小二乘法-判别分析(PLS-DA) 采用PLS-DA法对NMR数据(X变量)和Y变量(分组信息)之间的相关关系进行分析。PLS-DA使用自适换算(unit variance scaling)的数据标准化方式。PLS-DA对模型的质量采用交叉验证法进行检验,并用交叉验证后得到的R2X、R2Y和Q2(分别代表NMR数据可解释的变量、分组信息可解释的变量和模型的可预测度)对模型有效性进行评判。在此之后,通过排列实验随机多次(n=200)改变分类变量Y的排列顺序,得到相应不同的随机Q2值对模型有效性做进一步的检验。该方法通过随机改变Y变量的顺序,观察在多次随机排列Y变量的模型与原始Y变量模型之间的差异。然后对随机产生的R2值和Q2值与原始累积的R2值和Q2值之间做回归线。回归线的斜率越大且截距越小,模型的预测能力越好,代谢组差异越明显;另外R2值和Q2值的差别越大也说明组间比较差异越明显。Fig 6为M-N组、M-L组的PLS-DA得分图和排列试验验证结果,其中M-N组比较结果R2X=0.353, R2Y=0.921, Q2=0.637 ;截距:R2=(0,0.866), Q2=(0, -0.0208);M-L组比较结果R2X=0.312, R2Y=0.917, Q2=0.459 截距:R2=(0,0.874), Q2=(0, -0.0494);从结果可以看出交叉验证结果中,R2Y值均高于0.9,说明此模型能完全反应不同组别之间的变量差异,而Q2值高于0.4,说明模型可预测度较强,再结合排列试验验证结果共同提示,所建立的数学模型比较可靠,并说明组间代谢组的差异比较明显。

Fig 3 Typical 600 MHz 1H NMR spectra of plasma from sham (N), AMI (M), and leonurine-treated (L) groups
The spectra in the region 9.0~6.0 ppm (in the dashed box) were magnified 64 times and scaled in a different chemical shift expansion. 3-HB: 3-Hydroxybutyrate; NAG: N-acetyl glycoprotein signals; OAG: O-acetyl glycoprotein signals; DMG: Dimethylglycine; Cho: Choline; PC: Phosphocholine; GPC: Glycerophosphocholine; UFA: unsaturated lipid.

Fig 4 Trajectory analysis of PCA score plot (3-D)based on 1H NMR spectra of rat plasma from sham (N), AMI (M), and leonurine-treated (L) groupsR2X=78.7%, Q2=0.706

Fig 5 Trajectory analysis of PCA score plots for 1H NMRspectra of rat plasma from different groups A: M-N; B: M-L

Fig 6 Score plots (left) and validate model plots (right) by permutation tests of PLS-DA for 1H NMR spectra of rat plasma from different groupsA: M-N; B: M-L

Fig 7 OPLS-DA scores plots (left panel) derived from 1H NMR spectra of rat plasma and correspondingcoefficient loading plots (right panel) obtained from different groups
2.4.3正交偏最小二乘法-判别分析(OPLS-DA) 使用OPLS-DA对PLS-DA模型进行正交信号矫正,以最大化地凸显模型内部两组之间的代谢组差异。OPLS-DA使用自适换算的数据标准化方式,用得分图(scores plot)和相关系数标注的载荷图(coefficient loading plot)表示结果。载荷图用颜色对每个代谢物的相关系数(correlation coefficients)进行编码,都直观的显示每个代谢物对组间区分的贡献程度。红色编码的代谢物要比蓝色编码的代谢物对组间区分贡献更大。图中出现的正峰表示该代谢物在N组或L组含量高,而出现负峰则说明该代谢物在M组含量高。模型的评价指标分别用Q2和R2X来描述,R2X表示对自变量X解释程度,Q2表示交叉验证后累积预测程度,反映预测结果的真实性,即Q2>0.4时认为预测结果可接受[9]。 Fig 7为M组与N组、M组与L组的OPLS-DA得分图与相关系数负载图,所有数学模型的Q2>0.4,说明所有模型都比较可靠。OPLS-DA的相关系数载荷图上直观的显示出在两组之间差异存在显著性的代谢物。
2.5差异代谢物的筛选及鉴定根据OPLS-DA的相关系数负载图结果,通过皮尔森相关系数显著性差异检测确定相关系数|r|=0.666(n=8)作为代谢物含量变化是否具有显著性差异的阈值(P<0.05)。即相关系数r>0.666或r<-0.666代表其代谢物组间比较差异有统计学意义。M组与N组、M组与L组差异有统计学意义的代谢物的鉴定与相应的相关系数归纳在Tab 2中。结果表明,与假手术组(N)比,模型组(M)的丙氨酸(alanine)、赖氨酸(lysine)以及甘氨酸(glycine)水平增加,而经过益母草碱预处理后能逆转这一变化。急性心肌缺血还会导致N-乙酰糖蛋白(N-acetyl glycoprotein)、O-乙酰糖蛋白(O-acetyl glycoprotein)、肌酸(creatine)水平增加,益母草碱预处理后对其变化影响不大。模型大鼠血浆中胆碱(choline)、磷酸胆碱(phosphocholine)、鲨肌醇(scyllo-inositol)水平变化不明显,但是益母草碱预处理后这3者含量增加。

Tab 2 OPLS-DA correlation coefficients andsignificant change of metabolites derived from NMR data of ratplasma obtained from different groups
aThe correlation coefficients of |r|>0.666 was used as the cutoff value for the statistical significance at the level ofP=0.05 and df (degree of freedom)=7.b“-” means the level in the former is lower than the latter;c“+” means the level in the former is higher than the latter;dNAG: N-acetyl glycoprotein signals, OAG: O-acetyl glycoprotein signals.
3 讨论
本研究采用核磁共振 (1H-NMR)法结合多变量数据分析方法对假手术组、心肌缺血模型组和益母草碱给药组大鼠血浆中代谢组进行分析,找出了具有特异性变化规律的9个代谢物,涉及氨基酸、急性期炎症反应蛋白、肌酸、胆碱以及肌醇代谢等途径。
结扎冠状动脉左前降支造模是用于评价药物心肌缺血保护作用的经典模型,其临床相关性好,会造成心肌缺血缺氧和梗死、心肌细胞损伤、线粒体及内质网等细胞器功能紊乱[10]。本研究结果显示,模型组大鼠血浆中特异性标志物CK-MB及Tn-I水平增加,并出现明显的心肌梗死,说明造模成功。NMR代谢组学分析显示心肌缺血导致血浆中丙氨酸、赖氨酸、甘氨酸、肌酸、N-乙酰化及O-乙酰化糖蛋白类水平增加。心肌必须持续产生大量三磷酸腺苷(ATP)提供能量来维持其持续性节律性收缩与舒张。在生理情况下,心肌中ATP主要通过利用脂肪酸以及葡萄糖作为底物进行有氧呼吸(三羧酸循环)获得,还有一小部分ATP是通过葡萄糖无氧糖酵解产生。急性心肌缺血时,有氧呼吸受限,无氧糖酵解通路增强,所以乳酸以及丙酮酸增加,然后过多的丙酮酸在丙氨酸氨基转移酶(ALT)催化下生成丙氨酸,所以丙氨酸生成增加。甘氨酸与赖氨酸均属于生糖氨基酸,可代谢转变成琥珀酸或草酰乙酸进入三羧酸循环。甘氨酸与赖氨酸的含量升高可能由于有氧呼吸受限,使糖异生受抑制所致。肌酸是胞质中高能磷酸储备,能为机体快速提供能量,它以精氨酸与甘氨酸为底物并由甲硫氨酸提供甲基而合成。有文献报道[11],在急性心肌缺血早期阶段,精氨酸与一氧化氮(NO)代偿性生成增加,以增强心肌对缺血缺氧的适应能力。因此,可以推测,由于心肌缺血供能障碍,在急性期出现代偿性反应,精氨酸和甘氨酸水平增加,导致肌酸生成增加,从而快速补充心肌能量。心肌缺血导致心肌组织损伤,在急性期会导致非特异的炎症反应,从而导致一些急性期反应蛋白(APRs)增加,这是心肌在缺血状态下自适应代偿反应。大部分APRs为血清中的一些糖蛋白[12]。有文献报道[13],乙酰化糖蛋白类物质为急性期反应蛋白,与炎症反应相关。因此本研究中观察到模型组N-与O-乙酰化糖蛋白类物质水平增加。
给予益母草碱预处理后,造模大鼠的血浆中CK-MB活性及TnI水平向正常水平回落,梗死面积大大降低,充分表明了益母草碱对急性心肌缺血的保护作用。代谢组学分析显示,模型大鼠血浆中含量升高的丙氨酸、赖氨酸、甘氨酸经益母草碱干预给药后均被逆转,说明益母草碱能维持心肌线粒体功能,纠正心肌缺血导致的代谢紊乱。另外造模大鼠经益母草碱预处理后,血浆中胆碱、磷酸胆碱以及鲨肌醇含量增加,而这3个物质模型大鼠与假手术组相比并无明显改变。胆碱是磷脂酰胆碱(细胞膜的主要磷脂)的主要成分,也是神经递质乙酰胆碱的前体物质,同时还可以氧化后生成甜菜碱,其可以在代谢通路中作为甲基供体而生成S-腺苷甲硫胺酸,还可以影响DNA与组蛋白的甲基化[14]。磷酸胆碱是合成磷脂酰胆碱的中间产物,由胆碱与ATP在胆碱激酶的催化下形成。它与三磷酸胞嘧啶(CTP)在胆碱磷酸胞嘧啶核苷基移换酶的催化下生成胞磷胆碱。益母草碱干预给药后,导致胆碱与磷酸胆碱含量增加,这有可能是其抗心肌缺血作用的机制之一。如胆碱增加,会导致磷脂酰胆碱合成增加,有利于缺血心肌细胞膜的稳定;能使乙酰胆碱生成增加,降低心率,减慢窦房节和房室节的传导,轻微减少心肌收缩幅度,从而减少心肌耗氧量,改善心肌缺氧状况,防止快速心律失常的发生[15]。另外,胞磷胆碱也可能合成增加,有文献[16]表明胞磷胆碱具有良好心肌保护作用,能够减轻缺血/再灌注心肌的损伤。另外有文献报道,鲨肌醇是肌醇的立体异构体,是一种细胞有机渗透压调节剂,为细胞膜重要组成成分。有文献报道[17],乙酰胆碱M受体兴奋,会导致细胞内渗透压调节物质(如肌醇、鲨肌醇、Tau蛋白、以及甘油磷酸胆碱)外流,从而保持细胞膜的稳定性。因此,益母草碱干预给药可能通过上调胆碱代谢通路,兴奋M胆碱受体,使细胞外鲨肌醇含量增加,保护心肌细胞膜完整性,维持心肌细胞的功能。
综上所述,益母草碱能通过纠正急性心肌缺血氨基酸代谢紊乱,上调胆碱以及肌醇代谢通路发挥心肌保护作用。本研究为评价益母草碱抗心肌缺血作用提供了有力分析手段,并为研究其作用机制提供新的思路。
(致谢:感谢南通大学药学院暨江苏省炎症与分子药靶重点验室、复旦大学药学院为本实验所提供的优越条件和平台。衷心感谢导师和同学对我的指导和帮助!)
[1] 贺春晖,赵懿清,李 霞,周路遥. 益母草碱药理作用的分子机制研究进展[J].中国临床药理学与治疗学,2013,18(12):1419-23.
[1] He C H, Zhao Y Q, Li X, Zhou L Y. Research progress in molecular mechanism of the pharmacological actions of leonurine[J].ChinJClinPharmacolTherap, 2013,18(12):1419-23.
[2] Liu X H, Chen P F, Pan L L, et al. 4-Guanidino-n-butyl syringate (Leonurine, SCM 198) protects H9c2 rat ventricular cells from hypoxia-induced apoptosis[J].JCardiovascPharmacol, 2009,54(5): 437-44.
[3] Liu X H, Xin H, Hou A J, Zhu Y Z. Protective effects of leonurine in neonatal rat hypoxic cardiomyocytes and rat infarcted heart[J].ClinExpPharmacolPhysiol, 2009,36(7): 696-703.
[4] Liu X H, Pan L L, Chen P F, Zhu Y Z. Leonurine improves ischemia-induced myocardial injury through antioxidative activity[J].Phytomedicine, 2010,17(10): 753-9.
[5] Liu X, Pan L, Gong Q, Zhu Y. Leonurine (SCM-198) improves cardiac recovery in rat during chronic infarction[J].EurJPharmacol, 2010, 649 (1-3):236-41.
[6] 牟 菲,段佳林,边海旭,等. 降香水提物和挥发油对心肌缺血/再灌注损伤大鼠预防作用的代谢组学研究[J].中国药理学通报,2016,32(10):1377-82.
[6] Mu F, Duan J L, Bian H X, et al. Metabolomic study on preventive effect of Aqueous extract and volatile oil of Dalbergia Odorifera on myocardial ischemia/reperfusion injury in rats[J].ChinPharmacolBull, 2016,32(10):1377-82.
[7] 方 瑜,孙 瑶,简 洁. 九龙藤总黄酮对垂体后叶素致大鼠急性心肌缺血的保护作用[J].中国药理学通报,2013,29(11):1592-6.
[7] Fang Y,Sun Y,Jian J. Protective effects of Bauhinia championii flavones on pituitrin-induced acute myocardial ischemia in rats[J].ChinPharmacolBull, 2013,29(11):1592-6.
[8] Shen G P, Li Z, Zhang Y, et al.1H NMR-based metabolomics study on the physiological variations during the rat pregnancy process[J].MolCellEndocrinol, 2016,423: 40-50.
[9] 斯皮热古丽·阿布都卡地,阿里木·帕塔尔,古孜力克孜·阿布都克热木. 基于NMR的免疫抑制小鼠模型血清代谢组学研究 [J]. 中国药理学通报,2016,32(6):853-7.
[9] Sipireguli A, Alimu P, Guzilikezi A. Metabolic analysis of immune suppression mice based on NMR [J].ChinPharmacolBull, 2016,32(6):853-7.
[10] 汪 晋, 张玉峰, 邵 青, 范骁辉. 三七总皂苷对急性心肌缺血大鼠血清代谢物组的影响研究[J]. 中国中药杂志,2010,35(23): 3199-202.
[10] Wang J , Zhang Y F, Shao Q, Fan X H. Serum metabolome analysis reveals effect of panax notoginosides on ischemic rat after acute myocardial infarction[J].ChinJChinMaterMed, 2010,35(23): 3199-202.
[11] Vegh A, Szekeres L, Parratt J. Preconditioning of the ischaemic myocardium; involvement of the l-arginine nitric oxide pathway[J].BrJPharmacol,1992,107(3): 648-52.
[12] Cubedo J, Padró T, Badimon L. Coordinated proteomic signature changes in immune response and complement proteins in acute myocardial infarction: the implication of serum amyloid P-component[J].IntJCardiol, 2013,168(6):5196-204.
[13] Deja S, Porebska I, Kowal A, et al. Metabolomics provide new insights on lung cancer staging and discrimination from chronic obstructive pulmonary disease[J].JPharmBiomedAnal, 2014,100:369-80.
[14] Wang Z, Tang W H, Buffa J A, et al. Prognostic value of choline and betaine depends on intestinal microbiota-generated metabolite trimethylamine-N-oxide[J].EurHeartJ, 2014,35(14):904-10.
[15] Lewartowski B, Mackiewicz U. The non-neuronal heart’s acetylcholine in health and disease[J].JPhysiolPharmacol, 2015,66(6):773-8.
[16] Coskun C, Avci B, Yalcin M, et al. Protective effect of CDP-choline on ischemia-reperfusion-induced myocardial tissue injury in rats[J].IrJMedSci, 2014 ,183(4):539-48.
[17] Valeria R, Luisa S, Adele M, et al. Changes in the NMR metabolic profile of live human neuron-like SH-SY5Y cells exposed to interferon-α2[J].JNeuroimmunePharmacol, 2016,11(1):142-52.
◇消息◇
《2016中国科技期刊引证报告》出炉,《中国药理学通报》2项第一、2项第二
2016年10月,中国科技信息研究所在北京发布《2016中国科技期刊引证报告》,《中国药理学通报》核心影响因子0.992(2/44),总被引频次3345(2/44),综合评价总分71.89(1/44),基金论文比0.98(1/44),2项指标列我国药学类期刊第1名。
(黄河胜)
1HNMR-basedmetabolomicsstudyofinterventioneffectsofleonurineonacutemyocardialischemiainrats
LIU Cheng-peng1, YIN Xiao-qin2, LI Yu-qin1, LUO Shan-shan3, ZHU Qing1,3, LI Jun-xu1, ZHU Yi-zhun3
(1.SchoolofPharmacy,NantongUniversity,NantongJiangsu226001,China; 2.AffiliatedHospitalofNantongUniversity,NantongJiangsu226001,China; 3.SchoolofPharmacy,FudanUniversity,Shanghai201210,China)
AimTo investigate metabolomic profiles of acute myocardial ischemia (AMI) in rat plasma and explore the intervention effects and its mechanism of leonurine using a metabolomics approach based on nuclear magnetic resonance (NMR).MethodsThe plasma metabolomic characteristics in rats of sham group, AMI model group, and leonurine-treated group were detected by1H NMR, and the different metabolites between AMI group and sham group or leonurine-treated group were analyzed by pattern recognition and multivariate data analysis.ResultsOrthogonal partial least squares discriminant analysis (OPLS-DA) demonstrated that six metabolites related to AMI were screened out, including alanine, lysine, glycine, creatine, N-acetyl glycoprotein, and O-acetyl glycoprotein and all their levels were elevated in AMI group compared to sham group. Treatment of leonurine decreased the levels of alanine, lysine, and glycine, and increased the levels of choline, phosphocholine, and scyllo-inositol compared with the model group.ConclusionsLeonurine can improve amino acid metabolism disorder under AMI conditions and enhance the function of choline and inositol pathway, which may explain its cardioprotective effect. The developed metabolomics approach in this study is a powerful tool for the investigation of the cardioprotective effect of leonurine and provide a new insight to understand its pharmacological mechanism.
leonurine; acute myocardial ischemia; NMR; metabolomics; pattern recognition; multivariate statistics
时间:2017-8-20 16:47 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170820.1647.022.html
2017-05-30,
2017-07-01
国家自然科学基金资助项目(No 81373390);国家重点基础研究发展计划资助项目(No 2010CB912600);江苏省自然科学基金资助项目(No BK20130396)
刘成鹏(1991 -),男,硕士生,研究方向:心血管药理学,E-mail:1028210401@qq.com; 朱 清(1978-),男,博士,副教授,硕士生导师,研究方向:心血管药物研发及药物代谢,通讯作者, E-mail: zhuqing@ntu.edu.cn
10.3969/j.issn.1001-1978.2017.09.011
A
:1001-1978(2017)09-1235-08
R-332;R284.1;R445.2;R542.202.2;R542.205.31

