糖尿病视网膜病变者房水及玻璃体中TF、VEGF的定量检测及分析
徐晨 苗林 陈丽娟 陈辉
·临床研究·
糖尿病视网膜病变者房水及玻璃体中TF、VEGF的定量检测及分析
徐晨 苗林 陈丽娟 陈辉
目的 测定糖尿病视网膜病变(DR)患者房水及玻璃体中的组织因子(TF)和血管内皮生长因子(VEGF)的浓度及与DR程度的相关性。方法 病例组选取2014年1月至2015年12月上海市普陀区人民医院眼科住院就诊的拟行白内障手术及玻璃体切除联合白内障手术的2型糖尿病患者。共分为5组,正常对照组(A组)、糖尿病患者无视网膜病变组 (B组)、DR组 (C组),增生型DR组 (D组),玻璃体对照组(E组)。收集A、B、C、D组房水标本、D、E组玻璃体标本。采用双抗体夹心酶联免疫吸附试验法定量检测房水及玻璃体中TF和VEGF含量。结果 房水中的TF与VEGF浓度随着DR的不同程度呈增高的趋势,在增生型DR病变组TF与VEGF浓度明显增高(P<0.001),该组患者玻璃体TF与VEGF含量明显增高,与玻璃体对照组(E组)比较有显著性差异(P<0.001)。各组中房水及玻璃体中的VEGF与TF二者有显著正相关性,差异有统计学意义(P<0.01)。结论 TF和VEGF高表达可能在DR病程进展及病情严重程度中起着关键的促进作用。
组织因子;血管内皮生长因子;糖尿病性视网膜病变;房水;玻璃体
[临床眼科杂志,2017,25:302]
[J Clin Ophthalmol,2017,25:302]
糖尿病性视网膜病变(diabetic retinopathy,DR)是糖尿病常见且严重的并发症,是糖尿病患者致盲的重要原因。其发生机制尚不完全清楚。DR在病理学上属于一种细胞增殖性疾病,其发生、发展必然与细胞增殖的调控失常有关。细胞因子在细胞增殖的调控中起重要作用,参与视网膜微血管系统受损。近年来研究发现组织因子(tissue factor, TF) 即凝血因子Ⅲ,具有血管新生,信号传导受体的功能等多种病理、生理过程[1]。血管内皮生长因子(VEGF)是最重要的生长因子, 其作用有诱导增加血管的通透性,新生血管的生成。因此,我们研究DR患者眼内液TF和VEGF定量分析,以探讨两者在DR发展变化中的作用。
资料与方法
一、对象
选取2014年1月至2015年12月上海市普陀区人民医院眼科住院就诊的拟行白内障手术及玻璃体切除联合白内障手术的2型糖尿病患者,对所有患者进行充分散瞳后详细检查眼底,并拍摄眼底彩色照相,部分可疑患者做荧光素钠眼底血管造影(术前因晶状体混浊看不清眼底的患者,于术后l周进行眼底检查)确定被检者有无DR,玻璃体大量积血无法窥清眼底者行眼部B型超声检查。研究对象共50例,分组为A组:正常对照组,共10例(男性5例,女性5例),平均年龄(66.2±8.88)岁。 B组:无DR组(non diabetic retinopathy,NDR):共10例(男性6例,女性4例),平均年龄(64.3±3.24)岁。C组:非增生性DR组(non proliferative diabetic retinopathy,NPDR):共10例(男性6例,女性4例),平均年龄(63.7±6.15)岁。D组:增生性DR组(proliferative diabetic retinopathy,PDR):共10例(男性6例,女性4例),平均年龄(66.4±3.2)岁。E组:玻璃体对照组为单纯黄斑裂孔或外伤等不伴有增生性玻璃体视网膜病变(PVR)患者(D组):共10例(男性6例,女性4例) ,平均年龄(65.4±4.3)岁。
二、方法
对所有研究对象收集房水标本及玻璃体标本。标本采集:开睑后以0.5 g/L碘伏稀释液消毒结膜囊,无菌生理盐水反复冲洗,无菌纱布吸尽结膜囊中残液。0.45 mm针头接l ml针管刺入前房缓慢抽取房水约100~200 μl,立即注入0.5 ml无菌Eppendorf管中。在玻璃体腔灌注前由睫状体平坦部抽取玻璃体液样本,约0.2 ml标本移至已消毒并硅化的0.5 ml Eppendorf管。在管外部标注好所取患者的住院号,置-80 ℃冰箱备用,测定前室温复融。人TF和VEGF定量测定均采用双抗体夹心ELISA法,人TF、VEGF ELISA试剂盒购自R&D公司,严格按照说明书操作。
三、统计学处理
结 果
A、B、C、D四组房水中TF水平具有统计学差异(F=289.82,P<0.001)。四组间两两比较,差异均有统计学意义。其中,B组 vs. A组,P=0.024; C组 vs. B组,P=0.014;其余比较,均有P<0.001(表1)。实验组D组玻璃体与E组比较, D组玻璃体TF水平明显高于E组,有显著性差异(t=47.01,P<0.001)(表1) 。
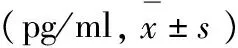
表1 各组房水及玻璃体中TF水平比较
a:与A组比较,差异具有统计学意义;b:与B组比较,差异具有统计学意义;c:与C组比较,差异具有统计学意义;*:差异有统计学意义,E组 vs. D组,t=47.01,P<0.001
A、B、C、D四组房水中VEGF水平具有统计学差异(F=1159.53,P<0.001)。四组间两两比较,差异均有统计学意义,均有P<0.001(表2)。D组玻璃体与E组比较, D组玻璃体VEGF水平明显高于E组,有显著性差异(t=55.75,P<0.001)(表2)。
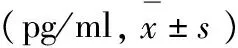
表2 各组房水及玻璃体中VEGF水平比较
a:与A组比较,差异具有统计学意义;b:与B组比较,差异具有统计学意义;c:与C组比较,差异具有统计学意义;*,差异有统计学意义,E组 vs. D组,t=55.75,P<0.001
房水中TF、VEGF浓度随着糖尿病患者眼底病变严重程度呈明显同向增高趋势。房水VEGF与TF二者有显著正相关性,差异有统计学意义(P<0.01)(图1)。2组玻璃体中TF与VEGF二者有显著正相关性,差异有统计学意义(P<0.01)(图2)。
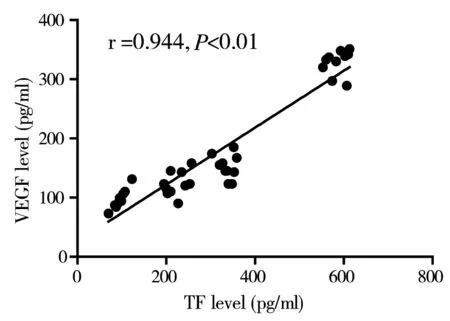
图1 各组房水中TF与VEGF相关性
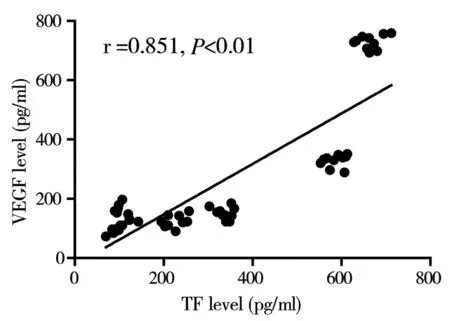
图2 2组玻璃体中TF与VEGF相关性
讨 论
DR是糖尿病最为常见和严重的微血管并发症之一,是糖尿病代谢紊乱和内分泌系统与血液系统损害在视网膜上的反映,其发病率随糖尿病病程的发展而增高,5年内DR发生率为44.4%,7年后为56%[1]。随着分子生物学技术的发展,对 DR的认识也不断深入,大量研究表明,多种基因及因子参与此过程如VEGF,色素上皮衍生因子(PEDF)、TF、肿瘤坏死因子。还有很多与DR相关因子的作用机制不断被发现、阐明,使我们对DR的认识逐步加深。
正常情况下眼部组织如结膜、葡萄膜、视网膜等不表达组织因子[2,3],但组织因子在脉络膜黑色素瘤细胞及其瘤组织内的血管内皮细胞中有表达,在翼状胬肉组织的基底细胞、深层细胞及浅表上皮细胞中也有表达[4]。
TF通过凝血途径产生凝血酶。凝血酶可通过水解跨膜PARs,不依赖血液凝结而诱导血管形成。凝血酶激活的PARs可使许多与血管形成的基因包括TF、VEGF、及bFGF与MMP-2的活性上调。这些基因可触发多种反应如内皮细胞形状改变、血管渗透性增高可触发多种反应如内皮细胞形状改变、血管渗透性增高等[5,6]。组织因子启动凝血后生成的凝血酶可促进活化的血小板(VEGF运载体)释放VEGF,VEGF也能上调TF[7],TF胞质区具有显著促进内皮细胞合成VEGF的作用,VEGF也可促进TF的表达;当TF与FⅦa结合后激活TF细胞内区酪氨酸激酶,引起第二信使Ca2+内流,通过MAPK或PKC途径信号传导引起VEGF转录的增加。TF胞内区末端3个丝氨酸残基的磷酸化是细胞内信号转导的关键所在,这种细胞内信号转导是PKC依赖性的。TF胞内区的基因突变后上述作用消失,但胞外区的基因突变后对上述作用无影响[8-10]。血管壁损伤及缺血、缺氧可使内皮细胞释放组织因子而促进凝血及血管新生,缺氧还可直接引起组织因子蛋白水平和组织因子活性的增加[11]。
正常情况下RPE、视网膜血管周细胞、内皮细胞和Müller细胞均存在较低水平的VEGF,用以维持血管稳定性和视网膜的正常发育[12]。通过激活蛋白激酶C,诱导紧密连接蛋白Occludin磷酸化,Occludin数量明显减少,视网膜血管通透性增加[13];促进细胞外基质的产生和细胞的黏附,改变内皮细胞内某些基因的激活状态 ,导致细胞外基质变性, 允许和支持新生血管和基质细胞的内向生长,有助于血管生长[14];还可诱导视网膜细胞间黏附分子-1,导致视网膜血管系统白细胞的淤滞和BRB破坏,形成白细胞栓子, 激活白细胞释放多种活性物质如氧自由基、溶酶体酶等,引起血流缓慢和血栓形成,导致视网膜局部缺血加重和新生血管形成[15]。
本研究发现本实验中各组房水中VEGF和TF显著相关。玻璃体中TF与VEGF二者明显正相关性。生长因子TF和VEGF等在DR的病理过程中具有重要地位,并且两者之间存在相互作用,共同导致了视网膜病变的发生。有必要对TF进行更深入的研究。有助于揭示DR的发病机制,为临床找到更有效防治DR的途径。
[1] Malone JI Morrison AD, Pavan PR,et al. Prevalence and significance of retinopathy in subjects with diabetes of less than 5 years duration screened for the diabetes control an complications trial. Diabetes Care,2001,24: 522-526.
[2] 张美霞,兰德,吴静,等.组织因子在脉络膜黑色素瘤中的表达及意义.眼科研究,2010,28:207-209.
[3] Walker TM, Van Ginkel PR, Gee RL, et a1. Expression of angiogenic factors Cyr61 and tissue factor in uveal melanoma. Arch Ophthalmol, 2002, 120:1719-1725.
[4] Ando R, Kase S, Ohashi T, et a1. Tissue factor expression in human pterygium. Mol Vis, 2011, 17:63-69.
[5] Ruf,W, Edgington,T.S. Structural biology of tissue factor, the initiator of thrombogenesis in vivo. Faseb J,1994,8:385-390.
[6] Yamahata H, Takeshima H, Kuratsu JI, et al. The role of thrombin in the neo-vascularization of malignant gliomas: An intrinsic modulator for the up regulation of vascular endothelial growth factor. Int J 0ncol,2002, 20:921-928.
[7] Takano S, Tsuboi K, Tomono Y, et a1. Tissue factor, osteopontin, alphavbeta3 integrin expression in microvasculature of gliomas associated with vascular endothelial growth factor expression. Br J Cancer, 2000, 82:1967-1973.
[8] Versteeg, H. H, Spek, C. A, Peppelenbosch, M. P. et al. Tissue factor and cancer metastasis: the role of intracellular and extracellular signaling pathways. Mol Med, 2004,10:6-ll.
[9] Mechtcheriakovs D,Wlachos A,Holzmuller H, et al. Vascular endothelial cell growth factor-induced tissue factor expression in endothelial cells is mediated by EGR-1.Blood,1999,93:381l-3823.
[10] Bromberg ME,sandaram R,Homer RJ, et al. Role of tissue factor in metastasis:functions of the cytoplasmic and extracecullar domains of the molecule.Thromb Hacmost,1999,82:88-92.
[11] Sun L, Lin S, Zhao R, et a1. The saponin monomer of dwarf lilyturf tuber, DT-13, reduces human breast cancer cell adhesion and migration during hypoxia via regulation of tissue factor. Biol Pharm Bull, 2010, 33: 1192-1198.
[12] Nicoletti,V.G, Nicoletti,R, Ferrara,N. et al. Diabetic Patients and retinal proliferation:an evaluation of the role of vascular endothelial growth factor(VEGF). Exp Clin Endocrinol Diabetes.2003, lll:209-214.
[13] Harhaj NS, Felinski EA, wolpert EB, et a1.VEGF activation of protein kinase c stimulates occluding phosphorylation and contributes to endothelial permeability.Invest 0phthalmol Vis Sci, 2006, 47:5106-5115.
[14] Kuiper EJ, Hughes JM, Van Geest RJ, et al. Effect of VEGF-A on expression of profibrotic growth factor and extracellular matrix genes in the retina. Invest Ophthalmol Vis Sci, 2007, 48:4267-4276.
[15] Zhang XL, Wen L, Chen YJ, et al.Vascular endothelial growth factor up-regulates the expression of intracellular adhesion molecule-1 in retinal endothelial cells via reactive oxygen species, but not nitric oxide .Chin Med J,2009,122:338-343.
(收稿:2017-03-15)
Quantitative analyses of tissue factor and vascular endothelial growth factor levels in aqueous humor and vitreous in patients with diabetic retinopathy
XuChen,MiaoLin,ChenLijuan.
ShanghaiPutuoDistrictPeople’sHospital, 200333;ChenHui.AffiliatedHospitalofNantongMedicalUniversity,Nantong,Jiangsu226000,China
Objective To investigate the correlation between the concentrations of tissue factor (TF) and vascular endothelial growth factor (VEGF) in aqueous humor and vitreous and the degree of diabetic retinopathy. Methods 50 patients who
cataract surgery and/or combined vitrectomy in our hospital between Jan 2014 and Dec 2015 were selected. Subjects in this study were divided into 5 groups - group A: healthy control; group B: diabetic patients without retinopathy; group C: diabetic retinopathy; group D: proliferative diabetic retinopathy (PDR); group E, vitrectomy control. Each group had 10 subjects. Samples of aqueous humor in group A, B, C and D and vitreous specimens in group D and E were collected. Double-antibody sandwich ELISA quantitative was used to determine the concentrations of TF and VEGF in aqueous humor and vitreous. Results Levels of TF and VEGF in both aqueous humor and vitreous showed a positive correlation to the degree of retinopathy. In PDR group (group D), both TF and VEGF were significant higher compared to the other three groups (group A, B, C) (P<0.001). Meanwhile, vitreous TF and VEGF levels were significant higher in group D than in group E (P<0.001). Levels of VEGF and TF showed positive correlation significantly in both aqueous humor and vitreous (P<0.01). Conclusions Expression of TF and VEGF may play a key role in the progression of diabetic retinopathy. Therefore, inhibiting or reducing TF and VEGF level in aqueous humor and vitreous may prevent the progression of diabetic retinopathy.
Diabetic Retinopathy; Vascular endothelial growth factor; Tissue factor;Aqueous;Vitreous
10.3969/j.issn.1006-8422.2017.04.005
200333 上海市普陀区人民医院(徐晨、苗林、陈丽娟);226000 南通大学附属医院(陈辉)
徐晨(Email:xuchen0513@126.com)

