用线粒体D-loop和Cyt b基因序列分析拉氏3个群体的遗传结构和遗传分化
杨培民,胡宗云,金广海,刘义新,王雷,骆小年
(辽宁省淡水水产科学研究院,辽宁省水生动物病害防治重点实验室,辽宁 辽阳 111000)
杨培民,胡宗云,金广海,刘义新,王雷,骆小年
(辽宁省淡水水产科学研究院,辽宁省水生动物病害防治重点实验室,辽宁 辽阳 111000)
用线粒体DNA的D-loop和Cyt b基因序列分析方法研究了吉林延吉、敦化和辽宁法台3个区域的29尾拉氏Phoxinus lagowskii Dybowsky的遗传多样性。经PCR扩增和测序,获得了783~785bp D-loop和818bp Cyt b的同源序列。两者多态性遗传参数统计显示,29尾个体分别存在47(D-loop)和89(Cyt b)个变异位点,分别检测出 15(D-loop)和 11(Cyt b)个单倍型,总群体单倍型(Hd)分别为 0.8966(D-loop)和 0.8990(Cyt b),核苷酸多样性指数(P)i分别为0.0246(D-loop)和0.0498(Cyt b),平均核苷酸差异数(K)分别为19.2857(D-loop)和40.7365(Cyt b)。分子方差分析(AMOVA)结果表明,79.02%(D-loop)和 81.69%(Cyt b)变异来自群体间,20.98%(D-loop)和18.31%(Cyt b)来自群体内。单倍型呈明显的地理差异,分成2个分支,一个以延吉群体为主,一个以法台群体为主。拉氏的遗传多样性水平较高,群体间遗传分化明显。该结果可为拉氏的种质资源保护提供参考。
拉氏;D-loop;Cyt b;遗传多样性;遗传分化
线粒体DNA(mtDNA)具有母性遗传、进化速度快、核苷酸替代率高的特点,是研究鱼类进化生物学和群体遗传的重要遗传标记[11,12]。在mtDNA上,D-loop属非编码区,是整个mtDNA上进化速度最快的区域,常用于研究群体遗传[12]。Cyt b基因是mtDNA上结构和功能解析最为透彻的蛋白质编码基因之一,进化速度适中,适于检测种群水平差异,亦用于研究种间和种内遗传分化[13,14]。本研究对拉氏线粒体D-loop序列和Cyt b基因进行PCR扩增、测定和比对分析,旨在为了解东北地区3个拉氏野生群体遗传多样性水平和群体间遗传分化程度,为保护拉氏资源提供遗传背景依据。
1 材料与方法
1.1 材料
2014年10月至2015年9月,采用地笼网采集了3个水系29尾野生拉氏样本,其中敦化群体8尾(牡丹江水系,标记为DH)、延吉群体9尾(图们江水系,标记为YJ)和法台群体12尾(太子河水系,标记为 FT)。样本体长为 9~16cm,体重为 11~42g。每尾剪取鳍条1~2g,保存于95%酒精内带回实验室。
1.2 方法
1.2.1 DNA提取、引物设计、PCR扩增及测序
取鳍条0.1g左右,利用天根生化科技有限公司的基因组提取试剂盒(DP304),按照试剂盒说明书提取总DNA。根据GeneBank中拉氏近缘种Phoxinus ujmonensis(NC_023802.1)、Phoxinus phoxinus(AB671170.1)和Rhynchocypris lagowski(iKJ641 843.1)提供的mtDNA全序列,通过比对获得目的基因两侧的保守序列,利用Primer premier5.0软件设计扩增D-loop和Cyt b序列的2对引物,由生工生物(上海)有限公司合成。D-loop引物为DF(5'-TTA GCGTGAAAGCATCGG-3')和 DR(5'-GTGTAAGTTG GGTTAGAGC-3');Cyt b 引 物 为 CF(5'-CTAATG GCAAGCCTACGA-3') 和 CR(5'-AGGATTTGCTGAGTGTAG-3')。PCR 反应体系为 25μL:含 2.5μL 10×PCR buffer(Mg2+plus,20mM)、2μL dNTP mix(2.5mM)、0.25μL Taq DNA polymerase(5U/μL)、上下游引物各 1μL(10μM)、模板 1μL,双蒸水补足至25μL。PCR扩增条件为:94℃预变性5min;35个循环,每个循环包括 94℃变性 1min,56℃退火1min,72℃延伸1min 30s;最后73延伸10min。本研究所有的PCR反应均在ABI 9700扩增仪上进行,扩增产物经1.2%琼脂糖凝胶电泳检测,获得目的条带的产物于-20℃冰箱内保存备用。PCR产物送至生工生物(上海)有限公司进行纯化,并由ABI 3730全自动测序仪双向测序,测序引物为上述PCR扩增引物。
1.2.2 数据处理
所测得的双向序列利用DNAstar软件(DNAS-tar,Inc)中的SeqMan程序进行拼接。运用MEGA6.0软件包中的Alignment by ClustalW程序排列和比对拼接后的序列,辅以人工矫正;并运用该软件包计算序列碱基组成、变异位点数和转换与颠换值;利用邻接法(Neighbor-Joining,NJ)基于 Kimura双参数法(Kimura 2-parameter,K2p)模型构建系统进化树,采用Bootstrap(1000个循环)检验节点的置信度。利用DnaSP(version 5.0)软件统计单倍型、单倍型多样性(h)、平均核苷酸差异数(K)及核苷酸多样性(Pi)。应用Arequin 3.5软件中的分子变异分析(AMOVA)方法计算遗传分化指数(Fst),分析遗传变异来源于组成。
2 结果与分析
2.1 D-loop和Cyt b基因片段的序列分析
表1 拉氏样品来源信息Tab.1 The source information on samples of fat minnow Phoxinus lagowskii Dybowsky

表1 拉氏样品来源信息Tab.1 The source information on samples of fat minnow Phoxinus lagowskii Dybowsky
群体敦化群体延吉群体法台群体简称DH YJ FT所属流域牡丹江图们江太子河取样时间2015.7 2014.10 2015.9采集地经纬度吉林省敦化市 N43°22′12.26″;E128°13′33.36″吉林省延吉市 N42°53′19.55″;E129°30′7.62″本溪市本溪县法台村N41°22′53.95″;E124°0′16.21″样品数891 2
从3个群体29尾个体的D-loop和Cytb序列中,分别获得了长度为783~785bp D-loop和818bp Cyt b的同源序列(表2)。在线粒体D-loop同源序列中检测出47个变异位点,约占总位点的6%,其中简约信息位点43个,单突变位点4个;发生碱基转换的位点有30个,A/G转换占66.75%,远高于T/C转换(23.36%);颠换的位点有17个,A/T颠换比例最大(3.05%),A/C颠换次之(2.62%),G/C颠换最小(1.9%);有2个插入/缺失位点,仅见于敦化群体(DH)。D-loop基因序列的 A、T、G、C 含量分别为30.2%、31.3%、15.8%和22.7%,A+T含量(61.5%)大于G+C含量(38.5%)。在获得的818bp Cyt b同源序列中,变异位点89个,占总位点的10.88%,其中简约信息位点87个,单突变位点2个;转换数为80,其中T/C转换占67.99%,A/G转换较小(16.07%);颠换数为10,A/T颠换比例最大(3.05%),A/C颠换次之(2.62%),G/C颠换比例最小(1.9%),缺少碱基缺失 /插入位点;Cyt b基因片段中 A、T、G、C四种碱基含量分别为 25.3%、30.7%、15.8%和 28.2%,A+T含量(56%)大于G+C含量(44%)。D-loop和Cytb碱基组成呈较明显的AT偏好和很强的反G偏歧。
2.2 拉氏3个群体的遗传多样性和遗传结构分析
3个群体总体基于D-loop序列的单倍型多样性、核苷酸多样性和核苷酸差异数分别为0.8966、0.0247和19.2857;各群体的单倍型多样性指数和核苷酸多样性指数分别为 0.5758~0.9444和0.0014~0.0198;单倍型多样性指数大小顺序为YJ>DH>FT,而核苷酸多样性指数的大小顺序为DH>YJ>FT。3个群体总体的基于Cyt b基因片段单倍型多样性、核苷酸多样性和核苷酸差异数分别为0.8990、0.0498和40.7365;各群体的单倍型多样性指数为0.4643~0.8611,YJ群体最高,FT群体次之,DH群体最小;核苷酸多样性指数为0.0021~0.0401,各群体该指数的大小顺序为DH>YJ>FT(表 2)。综合 D-loop 和 Cyt b 序列的遗传多样性参数可知,3个拉氏群体总体的单倍型多样性指数较高,除DH群体外,其余两个群体的核苷酸多样性指数均处于较低水平。
用 Kimura双参数法(Kimura 2-parameter,K2p)计算3个群体间遗传距离和遗传分化指数(表3)。基于D-loop序列的计算结果表明,3个群体的群体内遗传距离分别为 0.001~0.020,大小顺序为DH>YJ>FT;群体间遗传距离为 0.016~0.049,YJ与FT群体间距离最大,YJ与DH群体间次之,DH与FT群体间最小。基于Cyt b序列的分析结果显示:YJ与FT群体的群体内遗传距离相等且较小,仅为0.002,小于DH群体的群体内遗传距离(0.044);3个群体的群体间遗传距离为0.035~0.109,两两群体间遗传距离大小顺序与基于D-loop序列一致。遗传分化分析表明,基于D-loop和Cyt b序列的群体间遗传分化指数分别为0.3859~0.9569和0.4167~0.9786,遗传分化指数均大于0.25,达极显著水平(P<0.01),表明群体间分化显著。
表2 拉氏3个群体D-loop和Cyt b基因的遗传多样性参数Tab.2 Geneticdiversityparameters of D-loopandCyt b genes in three population soffatminnow Phoxinuslagowskii Dybowsky
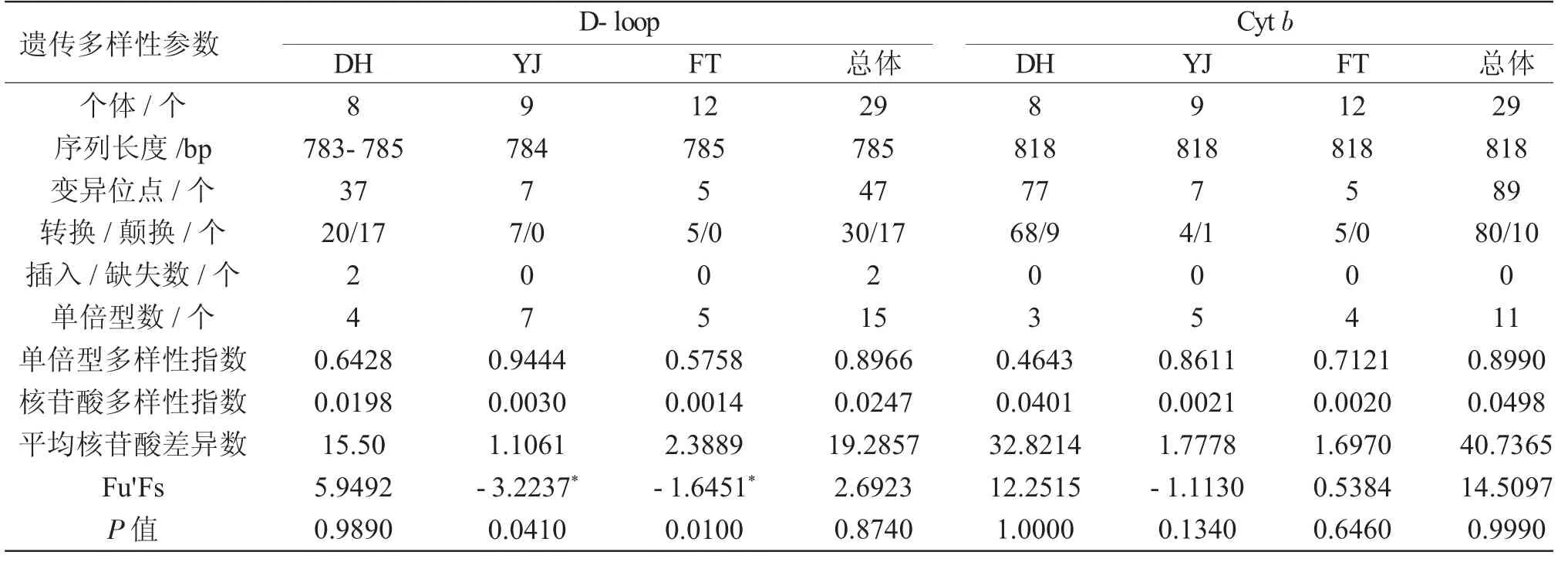
表2 拉氏3个群体D-loop和Cyt b基因的遗传多样性参数Tab.2 Geneticdiversityparameters of D-loopandCyt b genes in three population soffatminnow Phoxinuslagowskii Dybowsky
注:*P<0.05
D-loop Cyt b遗传多样性参数个体/个序列长度/bp变异位点/个转换/颠换/个插入/缺失数/个单倍型数/个单倍型多样性指数核苷酸多样性指数平均核苷酸差异数Fu'Fs P值DH 8 783-785 37 20/17 YJ 9 784 7 7/0 FT 12 785 5 5/0 DH 8 818 77 68/9 YJ 9 818 7 4/1 FT 12 818 5 5/0 24 07 05 03 05 04 0.6428 0.0198 15.50 5.9492 0.9890 0.9444 0.0030 1.1061-3.2237*0.0410 0.5758 0.0014 2.3889-1.6451*0.0100总体29 785 47 30/17 2 15 0.8966 0.0247 19.2857 2.6923 0.8740 0.4643 0.0401 32.8214 12.2515 1.0000 0.8611 0.0021 1.7778-1.1130 0.1340 0.7121 0.0020 1.6970 0.5384 0.6460总体29 818 89 80/10 0 11 0.8990 0.0498 40.7365 14.5097 0.9990
由表4可知,方差剖分显示遗传变异主要源于群体间,基于D-loop和Cyt b的方差组分为79.02%和81.69%。把3个群体归为一个整体时,总的遗传分化为 0.7902(D-loop)和 0.8169(Cyt b),二者的P=0.0000,表明群体间已出现显著分化。
表3 拉氏3个群体D-loop和Cyt b基因群体间/群体内的Kimura2-parameter遗传距离及遗传分化Tab.3 The genetic distance and genetic differentiation of Kimura2-parameter by D-loop and Cyt b genes among and within populations of fat minnow Phoxinus lagowskii Dybowsky
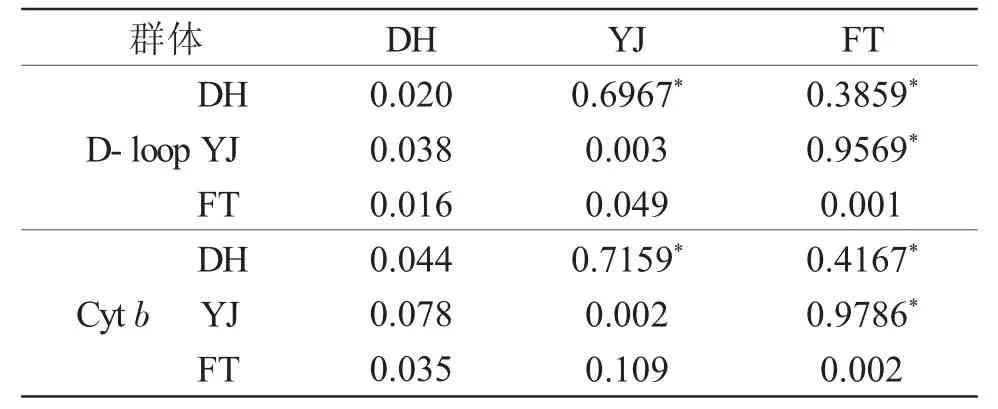
表3 拉氏3个群体D-loop和Cyt b基因群体间/群体内的Kimura2-parameter遗传距离及遗传分化Tab.3 The genetic distance and genetic differentiation of Kimura2-parameter by D-loop and Cyt b genes among and within populations of fat minnow Phoxinus lagowskii Dybowsky
注:左下角为群体间遗传距离;对角线上为群体内遗传距离;右上角为群体间遗传分化;*P<0.01
群体DH D-loop YJ FT DH Cyt b YJ FT FT 0.3859*0.9569*0.001 0.4167*0.9786*0.002 DH 0.020 0.038 0.016 0.044 0.078 0.035 YJ 0.6967*0.003 0.049 0.7159*0.002 0.109
2.3 单倍型分布与聚类分析
D-loop和Cyt b测序结果经比对分别定义了15和11个单倍型(表5)。在D-Loop序列的单倍型中,除Hap2为DH和YJ共享外,其余单倍型为各群体特有;各群体中不同单倍型的比例显示,DH、YJ和FT群体的优势单倍型分别为 Hap1、Hap2(Hap10)和Hap6。在Cyt b的单倍型中,除Hap3为YJ和DH共享外,其余单倍型为各群体特有;DH、YJ和FT群体的优势单倍型分别为Hap1、Hap9和Hap7。
基于K2p算法,D-loop序列的15个单倍型间遗传距离为0.001~0.053,总体平均遗传距离为0.028;Cyt b序列的 11个单倍型间遗传距离为0.001~0.111,总体平均遗产距离为0.061。用邻接法构建的进化树的聚类结果显示,基于D-loop和Cyt b的单倍型,进化树分为2个分支:1个分支以延吉群体为主,另1个以法台群体为主,而敦化群体的单倍型在两个分支上均有分布(图1和图2)。
表4 拉氏3个群体D-loop和Cyt b基因的AMOVA分析Tab.4 The AMOVA analysis of D-loop and Cyt b genes in three populations of fat minnow Phoxinus lagowskii Dybowsky
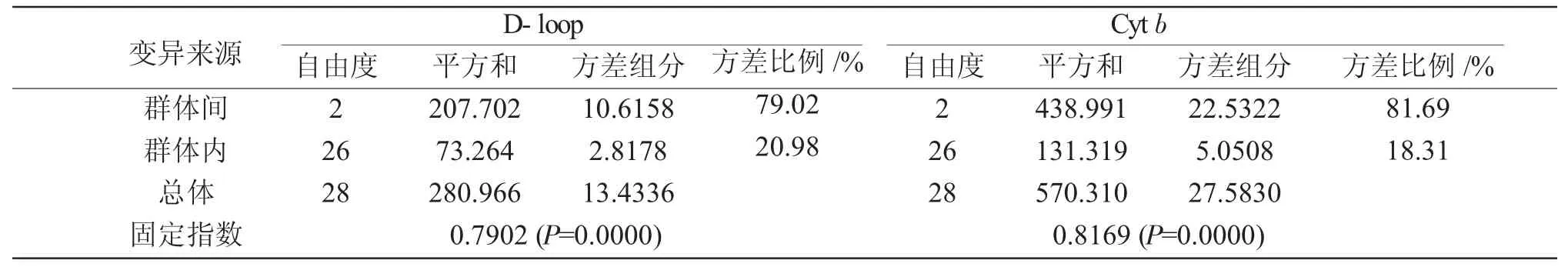
表4 拉氏3个群体D-loop和Cyt b基因的AMOVA分析Tab.4 The AMOVA analysis of D-loop and Cyt b genes in three populations of fat minnow Phoxinus lagowskii Dybowsky
变异来源群体间群体内总体固定指数自由度2 26 28 D-loop Cyt b平方和207.702 73.264 280.966方差组分10.6158 2.8178 13.4336方差比例/%79.02 20.98自由度2 26 28平方和438.991 131.319 570.310方差组分22.5322 5.0508 27.5830 0.7902(P=0.0000) 0.8169(P=0.0000)方差比例/%81.69 18.31
表5 拉氏3个群体单倍型数目、类型、频率及分布Tab.5 The haplotype number,type,frequency and distribution in three populations of fat minnow Phoxinus lagowskii Dybowsky
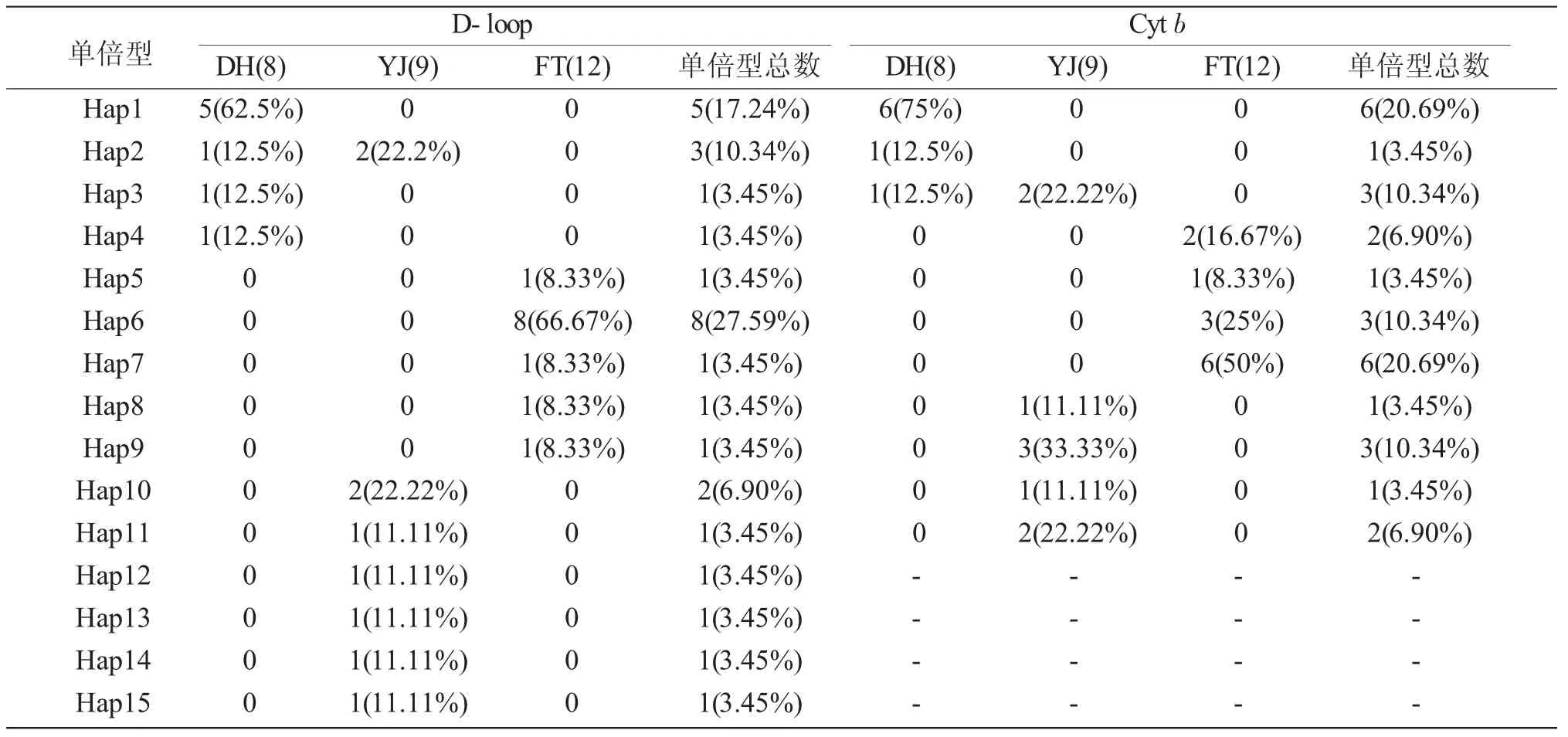
表5 拉氏3个群体单倍型数目、类型、频率及分布Tab.5 The haplotype number,type,frequency and distribution in three populations of fat minnow Phoxinus lagowskii Dybowsky
D-loop Cyt b单倍型FT(12)YJ(9)FT(12)Hap1 Hap2 Hap3 Hap4 Hap5 Hap6 Hap7 Hap8 Hap9 Hap10 Hap11 Hap12 Hap13 Hap14 Hap15 DH(8)5(62.5%)1(12.5%)1(12.5%)1(12.5%)YJ(9)0 2(22.2%)0000 DH(8)6(75%)1(12.5%)1(12.5%)00 2(22.22%)000 00000000000 0000000 1(8.33%)8(66.67%)1(8.33%)1(8.33%)1(8.33%)0000 2(16.67%)1(8.33%)3(25%)6(50%)2(22.22%)1(11.11%)1(11.11%)1(11.11%)1(11.11%)1(11.11%)000000单倍型总数5(17.24%)3(10.34%)1(3.45%)1(3.45%)1(3.45%)8(27.59%)1(3.45%)1(3.45%)1(3.45%)2(6.90%)1(3.45%)1(3.45%)1(3.45%)1(3.45%)1(3.45%)00000000----1(11.11%)3(33.33%)1(11.11%)2(22.22%)单倍型总数6(20.69%)1(3.45%)3(10.34%)2(6.90%)1(3.45%)3(10.34%)6(20.69%)1(3.45%)3(10.34%)1(3.45%)2(6.90%)----0000--------

图1 拉氏mtDNA控制区单倍型NJ树Fig.1 The NJ tree of haplotypes in mtDNA control region in fat minnow Phoxinus lagowskii Dybowsky

图2 拉氏mtDNA Cyt b单倍型NJ树Fig.2 The NJ tree of haplotypes in mtDNA Cyt b in fat minnow Phoxinus lagowskii Dybowsky
3 讨论
3.1 拉氏D-loop和Cyt b序列碱基组成
本研究获得的D-loop和Cyt b基因同源片段序列中,碱基组成的分布较为一致:T含量最高,G含量最低;A+T含量高于G+C含量。这与其他鱼类线粒体DNA碱基组成相同[15-18],符合动物线粒体基因组中4种核苷酸不均一分布这一共性[19]。测得的D-loop序列含有2个插入/缺失位点,而Cyt b中没有发现插入/缺失位点,这是因为D-loop序列为非编码基因,不受蛋白功能需要和三联体密码限制,插入/缺失位点突变后比较容易保留;而Cyt b用于编码蛋白质,带有插入/缺失突变的个体很容易被淘汰[19]。
3.2 群体遗传多样性
遗传多样性不仅是形成生物多样性的基础,也是物种进化潜能的保证[20]。一般来说,物种遗传多样性与其适应能力、生存能力和进化潜力密切相关,遗传变异是有机体适应环境的必要条件[21,22]。单倍型多样性(h)和核苷酸多样性(π)是衡量物种或种群线粒体DNA变异程度的2个重要指标[23]。根据 Grant和 Bowen[24]的分类,以 h=0.5、π=0.005 为界,本研究中的YJ和FT群体属高单倍型多样性和低核苷酸多样性类型。此类型种群通常由一个较小的有效种群经过近期快速扩张形成一个大的种群引起。这种快速群体扩张可产生许多新的突变,积累了单倍型的多样性,但缺乏足够时间积累核苷酸序列的多样化[24]。与YJ和FT群体不同,DH群体的单倍型多样性和核苷酸多样性较高,这种高h高π的遗传多样性模式通常是由一个较小的有效种群长期快速增长成一个大的种群所引起[24]。D-loop序列的Fu’Fs中性检验表明,YJ和FT群体发生了群体扩张事件,而DH群体未经历群体扩张;而Cyt b基因序列的Fu’Fs中性检验结果表明:3个群体未经历群体扩张事件,其原因有待进一步研究。虽然YJ和FT群体的核苷酸多样性指数较低,但拉氏样本种群整体核苷酸多样性指数较高,其原因可能是不同地理环境对拉氏种群的影响不同;两地拉氏核苷酸多样性指数较低,预示着捕食、污染或水利建设等因素已影响了种群规模恢复,种质资源保护工作亟待加强。
3.3 种群遗传分化
遗传分化指数(Fst)是衡量群体间遗传分化的重要指标,Fst接近于0时,表明群体间没有发生遗传分化,在0到1范围内其值越大,两种群的分化程度越高[25]。根据 Balloux等[26]的界定,Fst为0~0.05表示极小遗传分化;Fst为 0.05~0.15表示中度遗传分化;Fst为0.15~0.25表示较大遗传分化;Fst大于0.25,表示有极大的遗传分化。本研究中两两群体相比较的Fst和P值检验显示,线粒体D-loop和Cyt b两个序列均检测到两两群体间极大的遗传分化,尤其是YJ和FT群体间Fst达到了0.9569(D-loop)和 0.9786(Cyt b)接近于 1,表明两群体间几乎不存在基因交流,为相对独立的两个群体。AMOVA分析结果显示,3个群体作为1个总体的遗传分化指数达到0.7902(D-loop)和0.8169(Cyt b),表明这一总群体存在极大遗传分化;79.02%(D-loop)和81.69%(Cyt b)的群体间遗传变异在总体遗传变异中占有较大比例,表明3个群体间遗传差异较大。单倍型聚类分析也支持上述观点,3个群体均有自己独有的单倍型,DH与YJ两群体存在共享单倍型,这些单倍型聚类分成两个类群:一个以YJ群体为主,一个以FT群体为主,DH群体单倍型在两个类群中均有分布。
遗传距离表明种群之间亲缘关系,可以对种群之间的遗传关系做出预测[27]。本研究中3个拉氏群 体 间 遗 传 距 离 为 0.016~0.049 (D-loop)和0.035~0.109(Cyt b)。虽然两个基因片段得到的群体间遗传距离存在差异,但都反映了FT和DH群体遗传距离最小及FT和YJ群体遗传距离最大;这与FT和YJ群体相距最远及DH和YJ群体相距最近的地理分布并不相符。笔者认为,原因可能是FT群体距本溪市(拉氏主要销售和批发市场)最近,敦化产的拉氏有很大比例运往该地销售,人为促进了两地拉氏的基因交流;而延吉地区拉氏产量和消费量较低,很少外运销售,该地区拉氏群体处于相对“封闭”状态。
[1]熊邦喜,庄平,庄振朋,等.长江胚前和胚后发育的初步观察[J].华中农学院学报,1984,3(1):69-76.
[2] Fujimoto Y,Chiba H and Iwata M.Effect of riverbed substrates on the formation ofspawningmale school in Japanese minnowPhoxinus lagowski[iJ].Cybium,2008,32(2):319.
[3]杨培民,金广海,刘义新,等.辽河水系洛氏仔、稚鱼形态发育与生长特征[J].水产学杂志,2014,27(5):28-34.
[4]Fujita T,Oohama H,Hosoya K.The morphological characteristics and current status of Phoxinus lagowskii yamamotis (Jordan&Hubbs,1925)[J].Japanese Journal of Ichthyology,2005,52(1):21-26.
[5]骆小年,李军,金广海,等.拉氏人工繁殖试验[J].水产科学,2013,32(11):673-675.
[6]骆小年,李军,杨培民,等.拉氏池塘苗种培育试验[J].水产科学,2014,33(3):186-189.
[7]金广海,骆小年,刘义新,等.池塘主养拉氏试验[J].水产养殖,2014,06:42-44.
[8]祖岫杰,刘艳辉,刘铁钢,等.拉氏人工繁殖与苗种培育技术研究[J].水产养殖,2015(6):9-12.
[9]祖岫杰,刘艳辉,刘铁钢,等.拉氏1龄鱼种培育技术研究[J].水产养殖,2016(3):2--25.
[10]Sun Q,Wang D and Wei Q.The complete mitochondrial gemone ofPhoxinus lagowskii(Teleostei,Cypriniformes:Cyprinidae)[J].Mitochondrial DNA Part A,2016,27(2):830-831.
[11]肖武汉,张亚平.鱼类线粒体DNA的遗传与进化[J].水生生物学报,2000,24(4):384-391.
[12]郭新红,刘少军,刘巧,等.鱼类线粒体DNA研究新进展[J].遗传学报,2004,31(9):983-990.
[13]Mommsen H.Biochemistryand molecular biologyoffishes[M].London:Elsevier Science Publishiers,1993:1-38.
[14]XiaoWuhan,Zhang Yaping and Liu Huanzhang.Molecular systematics of Xenocyprinae (Telestei:Cyprinidae):taxonomy,biogeography,and coevolution of a special group restricted in east Asia[J].Moleculuar Phylogenetics and Evolution,2001,18(2):163-173.
[15]牛素芳,苏永全,王军,等.福建近海竹荚鱼线粒体DNA控制区和细胞色素b遗传多态性[J].中国水产科学,2011,18(1):66-74.
[16]李鹏飞,周永东,徐汉祥,等.美国红鱼细胞色素b基因和控制区基因序列的初步分析[J].浙江海洋学院学报:自然科学版,2008(2):119-122.
[17]TangQ,Liu H,Mayden R,et al.Comparison ofevolutionaryrates in the mitochondrial DNAcytochrome b gene and control region and their implications for phylogeny of the Cobitoidea(Teleostei:Cypriniformes)[J].Molecular Phylogenetics and Evolution,2006,39(2):347-357.
[18]杨慧荣,赵会宏,蒙子宁,等.赤眼鳟线粒体D-loop和Cyt b基因序列的对比分析[J].中山大学学报:自然科学版,2012,51(5):100-106.
[19]Brown W M.The mitochondrial genome ofanimals[A].In:Maclntyre R J(eds)Molecular evolutionary genetics[M].NewYork:PlenumPress,1985:95-130.
[20]李玉芳,李永振,陈国宝,等.基于线粒体Cyt b基因的黄鳍马面鲀种群分析[J].水产学报,2014,38(1):23-32.
[21] Conrad M.Adaptability:The significance of variability frommolecule toecosystem[M].NewYork:PlenumPress,1983.
[22]Féral J P.Howuseful are the genetic markers in attempts tounderstand and manage marine biodiversity[J].Journal of Experimental Marine Biology and Ecology,2002,268(2):121-145.
[23]Nei M.Molecular evolutionary genetics[M].New York:Columbia UniversityPress,1987.
[24]Grant W A S and Bowen B W.Shallow population histories in deep evolutionary lineages of marine fishes:insights from sardines and anchovies and lessons for conservation[J].Journal ofHeredity,1998,89(5):415-426.
[25] Wright S.Evolution and the genetics of population:variability within and among natural populations[M].Chicago:UniversityofChicagoPress,1978.
[26]Balloux F and Lugon-Moulin N.The estimation of population differentiation with microsatellite markers[J].Molecular Ecology,2002,11(2):155-165.
[27]陈兴汉,郭梁,李明明,等.中国南方沿海13种石斑鱼类的分子系统进化关系分析[J].中山大学学报:自然科学版,2014,53(4):123-130.
[28]ShakleeJB,TamaruCSandWaplesRS.Speciationandevolutionofmarinefishesstudiedbytheelectrophoreticanalysis ofproteins[J].PacificScience,1982,36(2):141-157.
Genetic Diversity and Differentiation of 3 Geographic Populations of Fat Minnow Phoxinus lagowskii Dybowsky Revealed by D-loop and Cyt b Gene Analyses
YANG Pei-min,HU Zong-yun,JIN Guang-hai,LIU Yi-xin,WANG Lei,LUO Xiao-nian
(Liaoning Key Laboratory for Prevention and Treatment of Aquatic Animal Diseases,Freshwater Fisheries Research Academy of Liaoning Province,Liaoyang 111000,China)
The genetic diversity and differentiation of fat minnow Phoxinus lagowskii Dybowsky were studied based on the sequences analysis of mtDNA(D-loop and Cyt b)in 29 individuals from 3 geographical populations including Dunhua(n=8),Yanji(n=9)and Fatai(n=12).Using PCR amplification and sequencing,783~785 bp of D-loop,which had polymorphic site number of 47,haplotype number of 15,haplotype diversity of 0.8966,nucleotide diversity of 0.0246,and average nucleotide difference of 19.2857,and 818 bp of Cyt b sequences,which had polymorphic site number of was 89,haplotype number of of 11,haplotype diversity of 0.8990,nucleotide diversity of 0.0498,and average nucleotide difference of 40.7365,were obtained.AMOVA revealed there was higher percentage variation of 79.02%among-population than that of 20.98%within-population in D-loop sequences.Similarly,the variation percentage of 81.69%was observed among-population,higher than that of 18.31%within-population in Cyt b sequences.The haplotype distribution was characterized by geographical differentiation,with two main branches of haplotypes,one from Yanjin population,and the other from Fatai population.There were high genetic diversity and the genetic differentiation between populations of fat minnow.The findings may be very useful to protect this species stock.
Phoxinus lagowskii;D-loop;Cyt b;genetic diversity;genetic divergence
S917
A
1005-3832(2017)04-0007-06
2017-03-30
辽宁省科学事业公益研究基金(2014002015).
杨培民(1979-),男,副研究员,从事水产动物繁殖与遗传育种研究.E-mail:pmyang313@163.com

