用液相色谱串联质谱法测定渔业水样中6种农药的含量
高磊,覃东立,2,吴松,黄晓丽,陈中祥,汤施展,黄丽,王鹏
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.农业部水产品质量安全控制重点实验室,北京 100141)
用液相色谱串联质谱法测定渔业水样中6种农药的含量
高磊1,覃东立1,2,吴松1,黄晓丽1,陈中祥1,汤施展1,黄丽1,王鹏1
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.农业部水产品质量安全控制重点实验室,北京 100141)
本文建立了一种快速检测渔业水质样本中酰胺类除草剂乙草胺、丙草胺、丁草胺、三嗪类除草剂莠去津、烟碱类杀虫剂噻虫嗪、三唑类杀菌剂苯醚甲环唑6种农药含量的液相色谱串联质谱法。采用乙腈-水-甲酸梯度洗脱、电喷雾电离方式、多反应监测模式测定考察检出限、线性范围、日内精密度及日间精密度。在三种加标浓度下,该方法的回收率为78.2%~104.7%。用液相色谱-四级杆-飞行时间质谱对疑似目标物质进行定性,用精确质量数、同位素丰度比和二级碎片解析方式等解析定性结构。该方法能够满足检测这六种农药的要求,能准确定性,自建的谱库可为渔业污染事故鉴定和水产品质量安全风险评估做支撑。
渔业水质;农药;液相色谱串联质谱;高分辨质谱
现代农业中大量使用的除草剂已经严重危害了环境。目前,在哈尔滨市附近渔场周边的农田稻田调研发现有乙草胺(acetochlor)、丙草胺(pretilachlor)、丁草胺(butachlor)、莠去津(atrazine)、噻虫嗪(thiamethoxam)、苯醚甲环唑(difenoconazole)等废弃外包装,其中丁草胺是我国用量最大的三种除草剂之一。丁草胺是一种酰胺类除草剂,被广泛用于防除旱地以及水田的一年生莎草[1]、禾本科杂草和某些一年生阔叶杂草。施用丁草胺后,易被土壤胶体粒子吸附,在土壤中具有明显的持留性[2]。噻虫嗪属于烟碱类杀虫剂,主要用于防治水稻、小麦、棉花及果树、蔬菜作物上的刺吸式口器害虫,如稻飞虱Nilaparvata lugens、蚜虫 Aphidoidea、叶蝉 Cicadellidae、蓟马 Thripidae、白粉虱 Trialeurodes vaporariorum Westwood等[3]。苯醚甲环唑属于三唑类杀菌剂,内息性强,杀菌谱广,可用于防治叶斑病、梨黑星病等[4]。农田、稻田所施用的除草剂杀虫剂等会渗入到养殖水体中,进入附近的土壤和水体中。
研究表明,丁草胺可引起鲶Silurus asotus的红细胞变异[5];噻虫嗪会导致斑马鱼Barchydanio rerio var肝脏细胞损伤,损伤程度随浓度和时间升高[6];苯醚甲环唑对水生生物毒性较大,0.50 a.i.mg·L-1的苯醚甲环唑可使斑马鱼的体色显著加黑、心率降低[7,8]。可见,大量使用这些农药不仅对农田造成很多负面影响,还会威胁养殖水体生态环境安全,危害水产品的品质。
检测上述农药的方法主要包括液相色谱法[9]、液相色谱串联质谱法[10,11]、气相色谱法[12-17],气相色谱质谱法[18-21]和免疫亲合法[22-24]。其中气相色谱和液相色谱通过保留时间进行定性,很容易出现假阳性结果。气相色谱串联质谱和液相色谱串联质谱很好解决了定性的问题[25]。
本研究建立了适用于渔业水质快速检测酰胺类除草剂(乙草胺,丙草胺,丁草胺)、三嗪类除草剂(莠去津)、烟碱类杀虫剂(噻虫嗪)、三唑类杀菌剂(苯醚甲环唑)的方法。本研究采用液相色谱串联质谱法检测上述农药,在此基础上,将所做的污染物加入高分辨图谱库,方便日后筛查检测。液相色谱四级杆飞行时间质谱不仅可以通过保留时间定性,还可以通过精确分子量、同位素丰度比以及二级碎片解析精确定性。最后将所做的污染物进行结构解析,加入自建的飞行时间质谱谱库,用于日后筛查污染物,为渔业污染事故鉴定和水产品质量安全风险评估提供技术支持。
1 材料与方法
1.1 材料
1.1.1 试剂耗材
色谱纯乙腈、质谱纯乙腈、色谱纯甲醇、质谱纯甲酸,0.22μm有机相微孔滤膜购于上海安谱公司;超纯水(电阻率≥18.0 MΩ·cm);氩气纯度高于99.999%;HLB固相萃取小柱。
1.1.2 仪器
液相色谱-串联三重四级杆质谱仪(ACQUITY UPLCTQ-S,美国沃特世公司),配有ESI离子源;液相色谱-四级杆-飞行时间质谱(ABSciex TOF 5600+,美国爱博才思公司),配有ESI源及APCI源;超声波清洗机(KQ-700E,昆山超声仪器有限公司);氮吹仪(N-EVAPTM111,美国 Organomation公司);涡旋混匀器(德国IKA公司);24位负压SPE装置(天津博纳艾杰尔科技有限公司);纯水器(美国Millipore公司);氮气发生器(美国毕克公司)。
1.1.3 标准溶液配置
莠去津、乙草胺、噻虫嗪、丙草胺、丁草胺和苯醚甲环唑标准品均购于北京莱耀生物科技有限公司。准确称取各农药标准品10mg(精确到0.1mg),用乙腈溶解,定容于100mL容量瓶中,配制成100mg·L-1的农药混合标准贮备溶液,-18℃保存。储备液用乙腈稀释,配制成各浓度的混合标准工作溶液,于4℃保存,现用现配。
1.2 方法
1.2.1 样品前处理方法
量取100.0mL采集后的水样,经滤纸过滤,至于250mL烧杯中。分别用2.0mL甲醇和2.0mL水过HLB小柱,再将过滤的水样过HLB固相萃取小柱。用1.0mL 3%甲醇水溶液淋洗固相萃取小柱,用1.0mL乙腈洗脱目标物。收集的洗脱液,于40℃小气流氮气吹干,加入1.0mL 5%乙腈水溶液(V乙腈∶V水∶V甲酸 =5∶95∶0.1),重新溶解残渣,超声涡旋30s。用0.22μm有机相微孔滤膜过滤到进样瓶中,待液相色谱串联质谱和液相色谱四级杆飞行时间质谱检测。按照上述前处理方法处理100.0mL超纯水,得到空白待测液。向超纯水中加入一定量标准品用于比对回收率实验。
1.2.2 仪器分析条件
液相色谱条件:ACQUITY UPLC BEH C18(50mm×2.1mm,1.7μm)色谱柱。流动相A为0.1%甲酸水溶液,B为0.1%甲酸乙腈溶液。梯度洗脱:0~2.0min,95%A;2.0~4.2min,95% ~5%A;4.2~6.4min,5%A;6.4~6.5min,5%~95%A;6.5~8.0min,95%A。流速 0.3mL·min-1,柱温 30.0℃,样品室温度 10.0℃,进样体积 2.0μL。
串联四级杆质谱条件:ESI+电离方式,毛细管电压2.5kV,偏转电压40V,离子源温度150℃,去溶剂温度450℃,脱溶剂流量800L·Hr-1,锥孔气流量250L·Hr-1,离子对及其他质谱参数见表1。

表1 六种农药的质谱检测条件Tab.1 Mass spectrum parameters of six pesticides
四级杆-飞行时间质谱仪器条件:ESI+及APCI+混合源,液相色谱流出部分进ESI源,校正液进APCI源。毛细管电压5500V,气帘气30psi,雾化器55psi,CE 为 35V,CES为 15V。
2 结果与分析
2.1 样品提取及净化
2.1.1 样品浓缩优化
水质分析中液液萃取是一种很常用的提取手段,但液液萃取需要使用与水不互溶的有机溶剂。一般用正己烷、二氯甲烷和石油醚等试剂,但这些溶剂都影响操作者的健康。选择固相萃取方式进行样品前处理,使用的有机溶剂较少,更环保,固相萃取得到的除草剂的回收率和检出限均能得到满意的结果。
2.1.2 淋洗溶剂选择
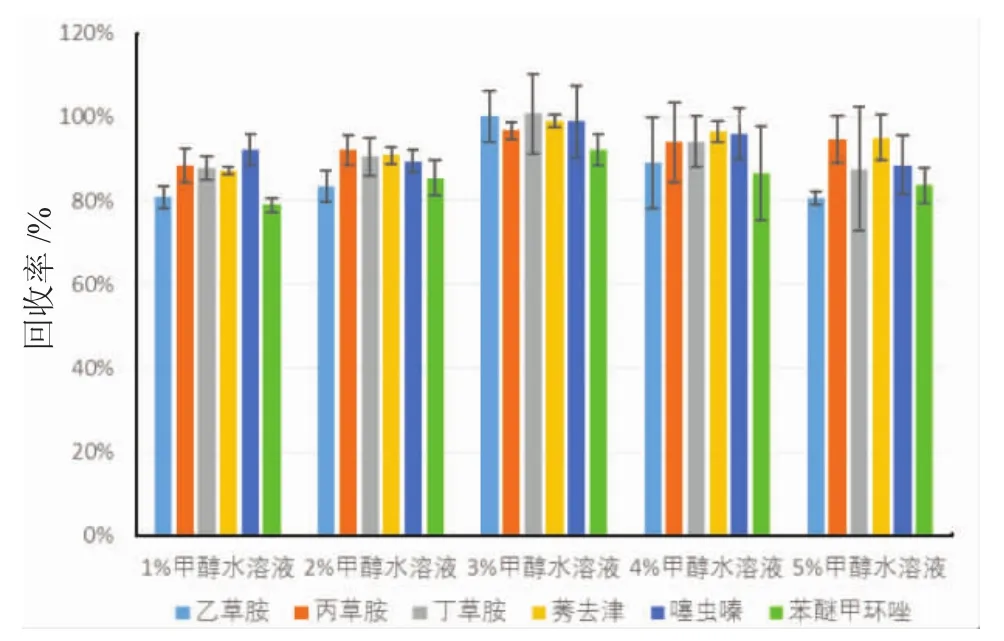
图1 淋洗溶剂对回收率的影响Fig.1 Effects of wash solution on the pesticide recovery
渔业水样基质复杂会影响农药的测定。而在富集水样时,通过淋洗,可以洗脱掉部分杂质。采用1.0mL的1%、2%、3%、4%和5%甲醇水溶液淋洗杂质。如图1所示,3%甲醇水溶液可以在保证较高回收率的前提下淋洗掉尽可能多的杂质。
2.1.3 洗脱溶剂优化
选取0.5mL、1.0mL和1.5mL的甲醇或乙腈作为洗脱剂,分别进行了试验。如图2所示,选1.0mL和1.5mL的乙腈作为洗脱剂效果最好,可选1.0mL乙腈作为洗脱溶剂。
2.2 仪器条件优化
2.2.1 色谱柱的选择
在相同长度下,粒径更小的填料拥有更大的柱效。当达到实验要求的条件下,选取更短的色谱柱可以缩短分析时间,降低分析成本。因此,应用50mm×2.1mm,填料颗粒为1.7μm的色谱柱进行分离检测。
2.2.2 串联质谱参数优化
将标准溶液分别稀释成50~100ng·mL-1,分别对每个物质采用Combine方式进行一级全扫描获取母离子,优化毛细管电压等参数,再选用子离子模式优化碰撞能量、锥孔电压等参数,得到最优的质谱条件。
2.2.3 四级杆飞行时间质谱优化
用校正液校正四级杆质量轴及飞行器。采用MSScan、Production和IDA方式采集数据。对碰撞能量进行选择,最终选择(35V±15V)作为碰撞能量。
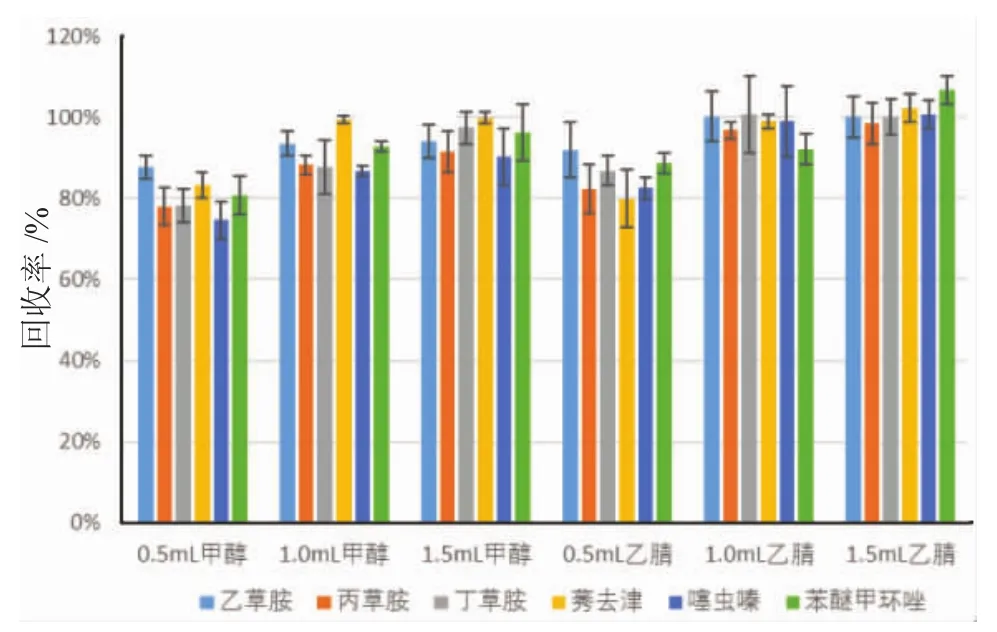
图2 洗脱溶剂种类及体积对回收率的影响Fig.2 Effects of eluting solution on pesticide recovery
2.3 方法学
考察液相色谱串联质谱法的线性范围、检出限、日内精密度以及日间精密度等方法学指标(表2)。进行1.0ng、5.0ng和10.0ng的加标回收实验,结果显示所有物质加标浓度的回收率均在78.2%~104.7%之间。
2.4 高分辨质谱谱库的建立及应用
用现有的方法,检测了养殖池塘水、部分地下水及品牌纯净水等样品。检测出哈尔滨市附近某池塘所用的养殖地下水中可能有少量莠去津的残留。可能由于样品基质复杂,样品中离子对比例相差较大,需要进一步定性。因此,应用高分辨质谱采集数据,通过母离子精确分子量,同位素丰度比进行定性。为了进一步确证结果的可信性,又解析了裂解规律,将丰度较高的二级碎片进行解析,找到峰的归属(图3),确证其确实存在少量莠去津。液相色谱串联质谱测定其含量为0.12μg·L-1,低于国家《GB 5749-2006生活饮用水卫生标准》的限量2.0μg·L-1。最后将莠去津标准品信息录入自建的高分辨质谱图谱库,为日后工作做准备。
3 讨论
建立了检测渔业水质样本中乙草胺、丙草胺、丁草胺、莠去津、噻虫嗪和苯醚甲环唑含量的液相色谱-串联质谱法。样品经过滤后固相萃取,浓缩富集净化了基质较为复杂的水样,用液相色谱串联质谱定性定量检测。当出现较为难辨认的“假阳性”样品时,应用液相色谱-四级杆-飞行时间质谱检测,通过精确分子量、同位素丰度比、二级质谱解析等对结构进行准确定性。本研究在前处理步骤中应用了3.1mL的甲醇乙腈甲酸等有机溶剂,而往往液液萃取会使用更多的有机试剂。如罗方方等[20]用73mL包含二氯甲烷正己烷有机溶剂处理水样。在仪器分析检测过程中用气相色谱分析样本时,往往需要20 min以上[16],本研究采用超高效液相色谱分离,仅仅需要8 min即可,本研究相比于气相色谱分析[16]检出限更低。
综上所述,本研究中样品处理方法简单,相对液液萃取方式应用有机溶剂更少、环境友好、分析速度快、分析灵敏度高,适用于实验室开展其他水质此类农药等污染物残留的检测。利用高分辨质谱可以更准确地定性污染物,再将污染物加入自建的高分辨谱库,所得到的高分辨图谱库可以为日后渔业污染事故鉴定及水产品质量安全风险评估奠定基础。
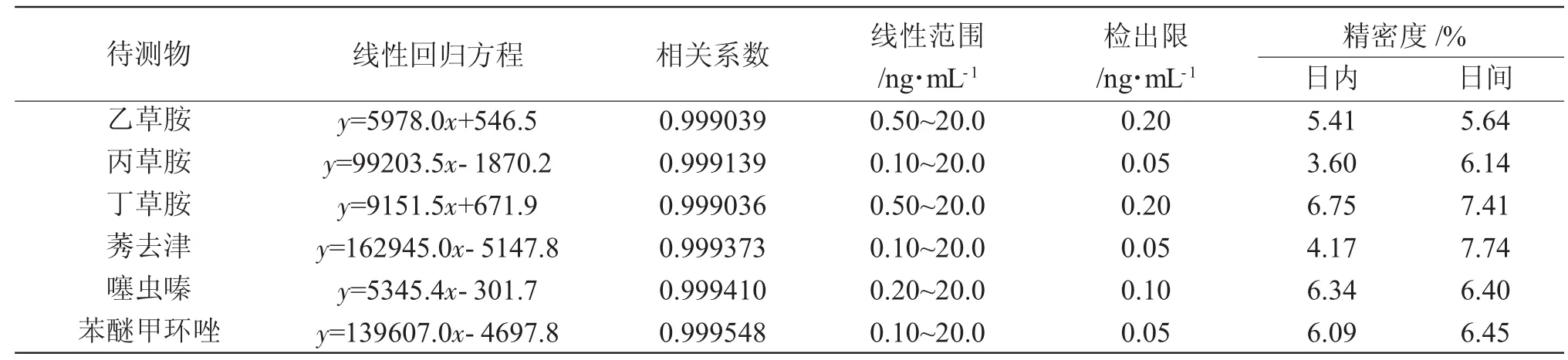
表2 六种农药的线性方程、相关系数、线性范围、检出限和日内日间精密度Tab.2 The linear regression equation,correlation coefficient,linear range,limit of detection,and intraday precision in the six pesticides

图3 疑似目标物的高分辨质谱的一级质谱全扫描(TOFMS)及二级碎片扫描(TOFMSMS)解析Fig.3 The mass spectrum of suspected compound by TOFMS and TOFMSMS
[1]张敏恒.新编农药商品手册[M].北京:化学工业出版社,2006.
[2]姚斌,徐建民,张超兰.除草剂丁草胺的环境行为综述[J].生态环境,2003(1):66-70.
[3]刘长令.世界农药信息手册[M].北京:化学工业出版社,2000:40-41.
[4]安晶晶,刘新刚,董丰收,等.超高效液相色谱-串联质谱法测定土壤、蔬菜及水果中苯醚甲环唑和丙环唑残留[J].农药,2009(7):506-508.
[5]Ateeq B,Farah MA,Ali MN,et al.Induction of micronuclei and erythrocyte alterations in the catfish Clarias batrachus by 2,4-dichlorophenoxyacetic acid and butachlor[J].Mutation Research—Genetic Toxicology and Environmental Mutagenesis,2002,518(2):135-144.
[6]陈爱梅.吡虫啉和噻虫嗪对斑马鱼氧化胁迫及DNA损伤[D].泰安:山东农业大学,2013.
[7] Hinfray N,Porcher J and Brion F.Inhibition of rainbow trout(Oncorhynchus mykiss)P450 aromatase activities in brain and ovarian microsomes by various environmental substances[J].Comparative Biochemistryand Physiology,Part C,2006,144(3):252-262.
[8] Mu X Y,Pang S,Sun X Z,et al.Evaluation of acute and developmental effects of difenoconazole via multiple stage zebrafish assays[J].Environmental Pollution,2013,175(4):147-157.
[9]李新安,陈锡岭,赵华.高效液相色谱法同时测定棉花及土壤中丁草胺和异噁草酮的残留[J].浙江农业学报,2011(6):1172-1176.
[10]Zhang Z H,Feng M,Zhu K,et al.Multiresidue analysis of pesticides in straw roughage by liquid chromatography-tandemmass spectrometry[J].Journal ofAgricultural and Food Chemistry,2016.64(31):6091-6099.
[11]江阳,王艳,魏红,等.高效液相色谱-串联质谱法同时测定饮用水中的13种农药残留[J].中国卫生检验杂志,2016(2):184-188.
[12]Zhang G J,Zang X H,Chang Q Y,et al.Solid phase microextraction using a graphene composite-coated fiber coupled with gas chromatography for the determination of acetanilide herbicides in water samples [J].Analytical Methods,2014,6(8):2756-2761.
[13] Wang Y,Jin X Y,Zhao D,et al.Molecularly imprinted solid-phase extraction coupled with gas chromatography for the determination of four chloroacetamide herbicides in soil[J].Analytical Methods,2015,7(15):6411-6418.
[14]李二虎,胡敏,吴兵兵,等.气相色谱法测定玉米中莠去津和丁草胺农药残留[J].农药科学与管理,2007(7):12-14.
[15]黄碧燕,韦宇宁,李小夏,等.气相色谱法同时测定土壤中毒死蜱、乙草胺和丁草胺残留量[J].广西科学院学报,2010(3):255-257.
[16]张肖肖,杨志富,李雪生,等.气相色谱法测定水稻中的丁草胺和草酮的残留量[J].农药,2013(10):743-758.
[17]陈小军,徐汉虹,杨益众,等.气相色谱法分析土壤中的丁草胺残留[J].农药,2009(12):904-908.
[18] Tavakoli M,Hajimahmoodi M and Shemirani F.Trace level monitoring of pesticides in water samples using fatty acid coated magnetic nanoparticles prior to GC-MS[J].Analytical Methods,2014.6(9):2988-2997.
[19]李爱军,赵冬晗,卢利军,等.气相色谱-质谱法测定粮谷中丁草胺的残留量[J].农药,2009(4):282-284..
[20]罗方方,王艳君,叶玫,等.气相色谱-质谱法测定渔业水质中8种除草剂的残留量[J].渔业科学进展,2015(4):132-138.
[21]雍莉,白利军,任琳,等.气相色谱-串联质谱法快速测定水中五种除草剂[J].预防医学情报杂志,2015(10):796-798.
[22]雷红涛,吴青,卢蓝蓝,等.置换型荧光偏振免疫检测除草剂丁草胺[J].分析化学,2013(7):1031-1036.
[23]薛钢,雷红涛,沈玉栋,等.丁草胺荧光偏振免疫分析-示踪物的合成与鉴定[J].中国农业科学,2008(11):3651-3655.
[24]裴道国,王建华,王雄,等.间接竞争酶联免疫吸附法测定花生中的乙草胺[J].黑龙江畜牧兽医,2012(1):72-74.
[25]张秀妍,覃东立,马琳.液质联用法检测海水中氯霉素的含量[J].水产学杂志,2013,26(1):50-53.
Detection of Six Pesticides in Fishery Waters by Liquid Chromatography Tandem Mass Spectrometry
GAO Lei1,QIN Dong-li1,2,WU Song1,HUANG Xiao-li1,CHEN Zhong-xiang1,TANG Shi-zhan1,HUANG Li1,
WANG Peng1
(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.Key Laboratory of Control of Quality and Safety for Aquatic Products,Ministry of Agriculture,Beijing 100141,China)
A rapid detection method of six pesticides in fishery waters by liquid chromatography tandem mass spectrometry(LC-MS/MS)was established,including acetochlor,pretilachlor,butachlor,atrazine,thiamethoxam and difenoconazole.Mixtures of acetonitrile and 0.1% (φ)formic acid solution with different mixing ratio were used as eluants in the elution,and ESI+mode was used,and multi-reaction monitoring mode was employed.The limit of detection,linear range and relative standard deviations of within-and between-day were investigated.In all three spiked levels recoveries of spiked samples were ranged from 78.2%to 104.7%,and the suspected compounds were confirmed by liquid chromatography quadrupole time of flight mass spectrometry(LC-Q-TOFMS),due to its accurate mass,isotopic pattern and MS/MS.A simple solid-phase extraction method was applied to separate the six pesticides,and the analytes were detected by LC-MS/MS and LC-Q-TOFMS.This method was shown to be more accurate and qualitative,and the self-built library provides support for the assessment of fishery pollution accident,and quality and safety risk assessment of fishery products in future.
fishery water;pesticide;LC-MS/MS;LC-Q-TOFMS
X832
A
2017-03-27
中央级公益性科研院所基本科研业务费专项资金(HSY201608).
高磊(1989-),男,硕士,研究实习员,从事渔业生态环境及水产品质量安全研究.E-mail:gaolei@hrfri.ac.cn
王鹏(1966-),男,副研究员.E-mail:wangpeng@hrfri.ac.cn
1005-3832(2017)04-0044-05

