XRCC1多态性与胰腺癌发病风险的meta分析
苏国明,黄彬洋,韩雨欣,向俊蓓,宋琪玲,张 齐,王贵年,王佳妮
(1. 四川护理职业学院 药学与检验系,四川 成都 610100;2. 川北医学院附属医院 检验科,四川 南充 637000)
·荟萃分析·
XRCC1多态性与胰腺癌发病风险的meta分析
苏国明1,黄彬洋1,韩雨欣1,向俊蓓1,宋琪玲2,张 齐1,王贵年1,王佳妮1
(1. 四川护理职业学院 药学与检验系,四川 成都 610100;2. 川北医学院附属医院 检验科,四川 南充 637000)
目的 本文旨在系统评价X线修复交叉互补基因1(X-rayrepaircross-complementatinggroup1,XRCC1)的单核苷酸多态性(singlenucleotidepolymorphisms,SNP)与胰腺癌发病风险的相关性。方法 计算机检索数据库PubMed、Embase、theCochraneLibrary、WebofScience、中国生物医学文献数据库(CBM)、万方数据库、中国期刊全文数据库(CNKI),按照纳入与排除标准筛选文献,对研究结果进行meta分析,评价发表偏倚并进行敏感性分析。结果 共纳入8篇病例-对照研究,合并结果显示:XRCC1上的Arg399Gln(rs25487G>A)突变和Arg194Trp(rs1799782C>T)突变与胰腺癌发病风险之间的关联差异无统计学意义;XRCC1上的Arg280His(rs25489G>A)突变与胰腺癌的发病风险密切相关(AvsG:OR=0.743,95%CI=0.576~0.958,P=0.022;GAvsGG:OR=0.701,95%CI=0.525~0.936,P=0.016;AA+GAvsGG:OR=0.710,95%CI=0.537~0.939,P=0.016);Egger检验显示不存在发表偏倚(P>0.05);敏感分析逐个剔除研究后meta分析结果受单个研究的影响较小。结论本研究表明XRCC1上的Arg399Gln(rs25487G>A)突变和Arg194Trp(rs1799782C>T)突变与胰腺癌的发病风险无明显相关性;XRCC1上的Arg280His(rs25489G>A)突变可能与胰腺癌的发病风险有关联。
胰腺肿瘤;癌,基因;meta分析
胰腺癌(pancreaticcancer)是全球常见的消化系统恶性肿瘤之一,发病隐匿,具有较高的病死率,在我国近10年来胰腺癌的发病率呈现上升趋势。迄今为止,胰腺癌的发病机制仍然不确定,据文献报道胰腺癌的发生可能与年龄、性别、遗传变异、胰腺癌的家族史、肥胖、糖尿病、吸烟、饮酒等危险因素有关,其中基因因素在胰腺癌发生、发展中起重要作用。X线修复交叉互补基因1 (X-rayrepaircross-complementatinggroup1,XRCC1)是影响胰腺癌风险的最重要候选基因之一,其编码的X线修复交叉互补蛋白1主要参与碱基切除修复以及单链断裂损伤修复,而DNA损伤修复对于基因组保护和癌症预防至关重要。迄今,在dbSNP数据库(http://www.ncbi.nlm.nih.gov/SNP/)中的文献报道在XRCC1上有若干单核苷酸多态性(singlenucleotidepolymorphisms,SNP),近期有多篇文献报道XRCC1上的3个SNP,即Arg399Gln(rs25487G>A)突变、Arg194Trp(rs1799782C>T)突变和Arg280His(rs25489G>A)突变与胰腺癌发病风险之间的相关性,但由于单个研究样本量小和地区差异,导致研究结果不尽一致。本文旨在通过对已发表的病例-对照研究进行meta分析,提高检验效能,以综合评价XRCC1的SNP与胰腺癌发病风险之间的关系。
1 资料与方法
1.1 文献检索 计算机检索英文数据库PubMed、Embase、CochraneLibrary、WebofScience及中文数据库中国生物医学文献数据库(CBM)、万方数据库、中国期刊全文数据库(CNKI),检索时间均为建库到2017年5月。英文检索式:“XRCC1ORrs25487ORArg399GlnORrs1799782ORArg194TrpORrs25489ORArg280His”和“pancreaticcancerORtumourORneoplasmORcarcinoma”;中文检索式:“X线修复交叉互补基因1 或者XRCC1 或者rs25487 或者Arg399Gln或者rs1799782 或者Arg194Trp或者rs25489 或者Arg280His”和“胰腺癌或者恶性肿瘤或者腺癌”。查阅相关研究的参考文献,手工检索相关学术期刊。
1.2 纳入标准 ①研究类型:病例-对照研究;②研究对象:病例组为经临床确诊为胰腺癌的患者;对照组为健康人群;③暴露因素:XRCC1上的3个SNP,即Arg399Gln(rs25487G>A)突变、Arg194Trp(rs1799782C>T)突变或Arg280His(rs25489G>A)突变;④结局指标:胰腺癌的发病风险。
1.3 排除标准 ①病例报告、会议摘要、评论、综述或系统评价;②无法获得基因型频率或等位基因频率的文献;③重复发表的数据。
1.4 文献筛选 由2名作者按预先制定的表格独自进行资料提取,如遇不一致则交由第三位作者协助裁定。资料提取内容包括第一作者姓名、发表年限、国家、种族、基因型检测方法、病例组和对照组的样本量、文献研究的基因位点及基因型频率等。
1.5 统计学方法 采用Stata13.0软件进行meta分析。首先,对纳入研究的对照组基因型进行哈迪-温伯格平衡(Hardy-Weinbergequilibrium,HWE)检验,P<0.05为不符合HWE。然后,对纳入的文献进行异质性检验(Q检验和I2检验),若P>0.10或I2<50%,选择固定效应模型合并数据进行分析;反之,则采用随机效应模型。最后,采用比值比(oddsratio,OR)及其95%可信区间(95%CI)为效应统计量,分别对Arg399Gln(rs25487G>A)突变和Arg280His(rs25489G>A)突变进行等位基因频率(AvsG)、杂合子模型(GAvsGG)、纯合子模型(AAvsGG)、显性遗传模型(AA+GAvsGG)和隐性遗传模型(AAvsGA+GG)的比较,对Arg194Trp(rs1799782C>T)突变进行等位基因频率(TvsC)、杂合子模型(CTvsCC)、纯合子模型(TTvsCC)、显性遗传模型(TT+CTvsCC)和隐性遗传模型(TTvsCT+CC)的比较,P<0.05为差异有统计学意义。Begg检验和Egger检验评价纳入文献的发表偏倚,同时通过敏感分析即逐一剔除单个研究的方法,评价余下研究的meta分析结果的稳定性。
2 结 果
2.1 文献筛选流程及结果 最初共检索到3 082篇文献,英文数据库检索文献2 795篇,中文数据库检索文献287篇。然后,阅读标题和摘要后排除不符合纳入标准文献3 068篇,查阅全文排除不符合纳入标准文献6篇,最终8篇文献满足纳入标准[1-8],其中报道Arg399Gln(rs25487G>A)突变有8篇文献,包括2 093例患者和4 462例对照者;报道Arg194Trp(rs1799782C>T)突变有7篇文献,包括1 594例患者和3 517例对照者;报道Arg280His(rs25489G>A)突变有3篇文献,包括918例患者和1 147例对照者。
2.2 纳入文献的基本特征 纳入文献的基本特征见表1。共纳入8篇文献[1-8],其中6英文文献[1-2,4-5,7-8],2篇中文文献[3,6]。HWE检验结果显示,关于Arg399Gln(rs25487G>A)突变,除Wang等[1]和Duell等[8]发表的研究外,纳入的其他研究对照组人群基因型分布均符合HWE定律(P>0.05);类似地,关于Arg194Trp(rs1799782C>T)突变,除Wang等[1]和Hou等[2]发表的研究外,纳入的其他研究对照组人群基因型分布均符合HWE定律(P>0.05);关于Arg280His(rs25489G>A)突变,除Wang等[1]发表的研究外,纳入的其他研究对照组人群基因型分布均符合HWE定律(P>0.05)。

表1 纳入文献的基本特征
注:PCR,聚合酶链反应;RFLP,限制性片段长度多态性
2.3Arg399Gln(rs25487G>A)突变与胰腺癌meta分析 共有8篇文献描述了Arg399Gln(rs25487G>A)突变与胰腺癌风险的关系。Meta分析结果显示Arg399Gln(rs25487G>A)突变与胰腺癌发病风险之间的关联差异无统计学意义(AvsG:OR=1.110,95%CI=0.951~1.297,P=0.186;GAvsGG:OR=1.080,95%CI=0.960~1.216,P=0.200;AAvsGG:OR=1.200, 95%CI=0.888~1.620,P=0.235;AA+GAvsGG:OR=1.125,95%CI=0.939~1.348,P=0.203;AAvsGA+GG:OR=1.122,95%CI=0.939~1.340,P=0.204),杂合子模型(GAvsGG)比较的森林图见图1 (其他基因模型比较的森林图未提供)。同时进行分层分析,结果显示在亚洲人中Arg399Gln(rs25487G>A)突变与胰腺癌发病风险之间的关联差异无统计学意义(表2)。排除对照组人群基因型分布不符合HWE定律的文献后,Meta分析发现Arg399Gln(rs25487G>A)突变与胰腺癌发病风险之间的关联差异无统计学意义(表2)。

图1 在杂合子模型(GAvsGG)下Arg399Gln(rs25487G>A)突变与胰腺癌发病风险的森林图
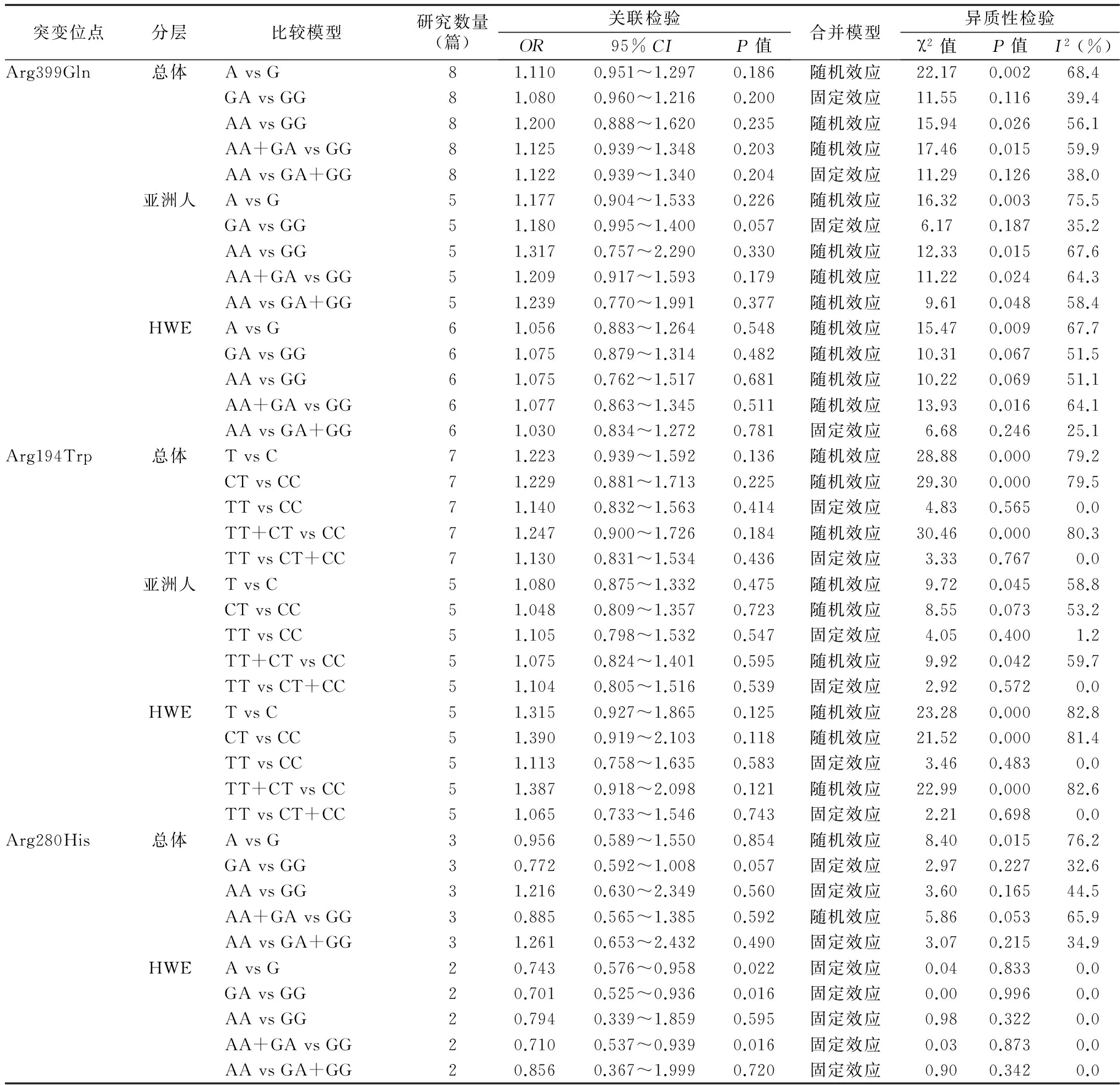
表2 XRCC1上的单核苷酸多态性与胰腺癌发病风险关系的meta分析
2.4Arg194Trp(rs1799782C>T)突变与胰腺癌meta分析 共有7篇文献描述了Arg194Trp(rs1799782C>T)突变与胰腺癌风险的关系。Meta分析结果显示Arg194Trp(rs1799782C>T)突变与胰腺癌发病风险之间的关联差异无统计学意义(TvsC:OR=1.223,95%CI=0.939~1.592,P=0.136;CTvsCC:OR=1.229,95%CI=0.881~1.713,P=0.225;TTvsCC:OR=1.140,95%CI=0.832~1.563,P=0.414;TT+CTvsCC:OR=1.247,95%CI=0.900~1.726,P=0.184;TTvsCT+CC:OR=1.130,95%CI=0.831~1.534,P=0.436),杂合子模型(CTvsCC)比较的森林图见图2(其他基因模型比较的森林图未提供)。同时进行分层分析,在亚洲人中Arg194Trp(rs1799782C>T)突变与胰腺癌发病风险之间的关联差异无统计学意义(表2)。排除对照组人群基因型分布不符合HWE定律的文献后,Meta分析发现Arg194Trp(rs1799782C>T)突变与胰腺癌发病风险之间的关联差异无统计学意义(表2)。

图2 在杂合子模型(CTvsCC)下Arg194Trp(rs1799782C>T)突变与胰腺癌发病风险的森林图
2.5Arg280His(rs25489G>A)突变与胰腺癌meta分析 共有3篇文献描述了Arg280His(rs25489G>A)突变与胰腺癌风险的关系。Meta分析结果显示Arg280His(rs25489G>A)突变与胰腺癌发病风险之间的关联差异无统计学意义(表2)。排除对照组人群基因型分布不符合HWE定律的文献后,Meta分析发现Arg280His(rs25489G>A)突变与胰腺癌的发病风险密切相关(AvsG:OR=0.743,95%CI=0.576~0.958,P=0.022;GAvsGG:OR=0.701,95%CI=0.525~0.936,P=0.016;AA+GAvsGG:OR=0.710,95%CI=0.537~0.939,P=0.016)。
2.6 发表偏倚 通过Begg漏斗图及Egger检验来评估纳入文献的发表偏倚情况。关于Arg399Gln(rs25487G>A)突变,Egger检验结果显示各基因模型比较均无统计学意义(表3),各基因模型比较的Begg漏斗图是基本对称的,各基因模型比较的Begg漏斗图见图3,表明不存在发表偏倚。
2.7 敏感性分析 在Arg399Gln(rs25487G>A)突变研究中,逐个剔除研究后关联受单个研究的影响较小,杂合子模型(GAvsGG)比较的敏感性分析图见图4 (其他基因模型比较的敏感性分析图未提供),提示本次meta分析结果是较稳定的。

表3 发表偏倚分析结果
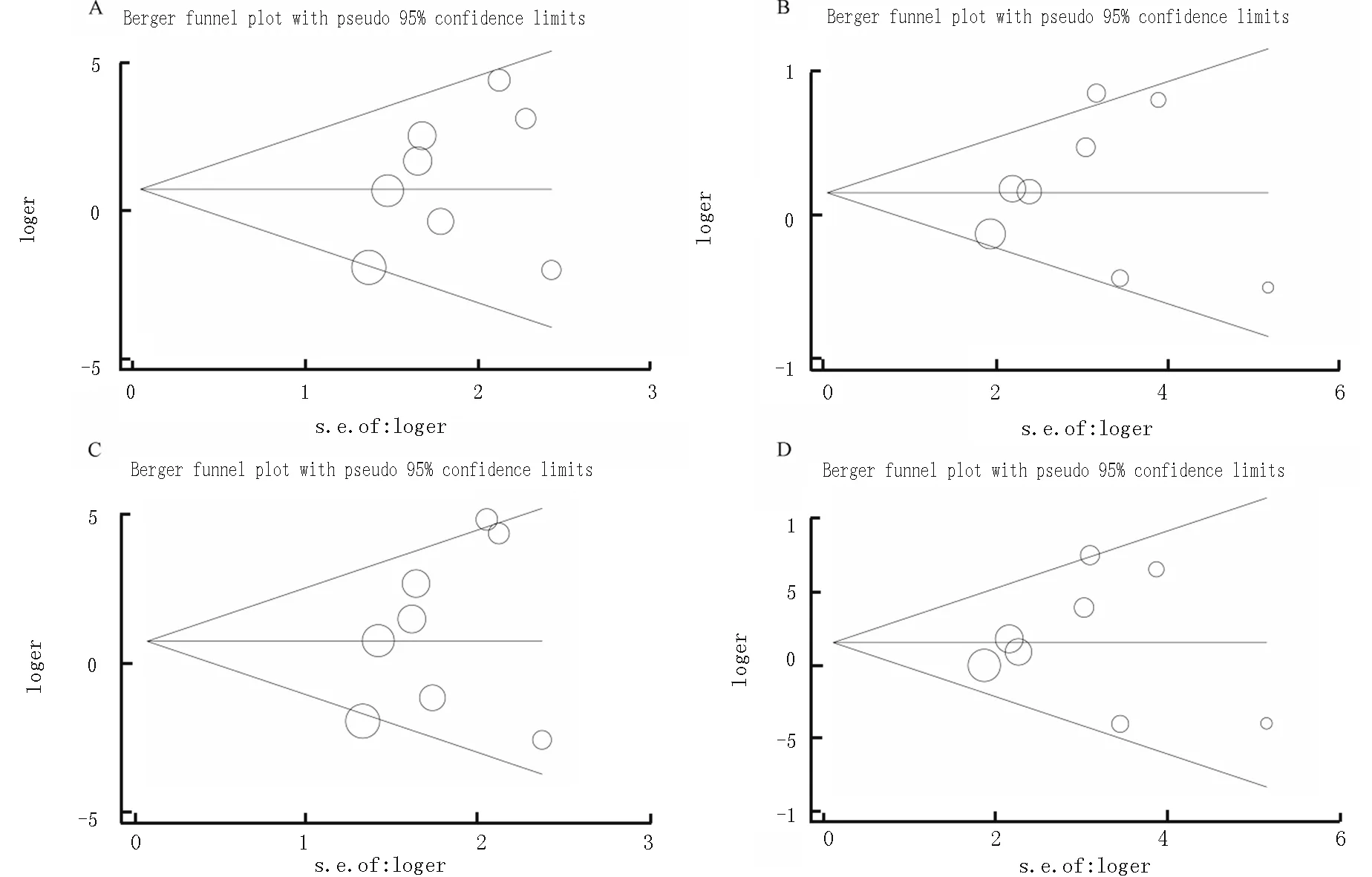
图3 在各基因模型下Arg399Gln(rs25487G>A)突变与胰腺癌风险的Begg漏斗图 (A:GAvsGG;B:AAvsGG;C:AA+GAvsGG;D:AAvsGA+GG)
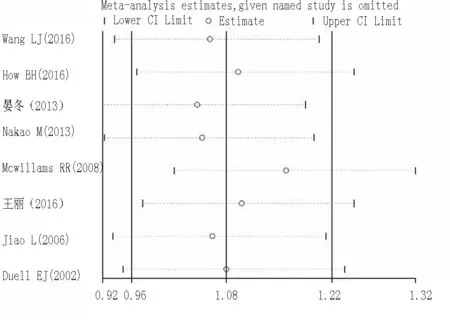
图4 在杂合子模型(GAvsGG)下Arg399Gln(rs25487G>A)突变与胰腺癌风险的敏感性分析
3 讨 论
XRCC1位于人染色体19q13.2,属于DNA损伤修复基因的一种,编码区SNP位点导致相应的氨基酸改变,致使其DNA修复能力下降,增加对诱变剂敏感性,增大癌症的发病风险,然而,在遗传流行病学研究方面有关胰腺癌的发病风险还没有得到一个公认的结论。2002年,Duell等[8]首次提出XRCC1上的SNP与胰腺癌的可能存在遗传易感性关联,目前已有多篇公开研究表明,XRCC1上的SNP与胰腺癌的发病风险可能具有相关性,但由于种族或样本量的差异导致研究结论尚不统一,因此,本文采用meta分析的方法纳入最新文献做一系统评价,在等位基因频率、杂合子模型、纯合子模型、显性遗传模型、隐性遗传模型等5种模型比较下,我们发现XRCC1上的Arg399Gln(rs25487G>A)突变和Arg194Trp(rs1799782C>T)突变与胰腺癌发病风险无明显相关性,然而,XRCC1上的Arg280His(rs25489G>A)突变可能与胰腺癌发病风险有关联。
关于XRCC1上的Arg399Gln(rs25487G>A)突变,本研究纳入8篇病例-对照研究,合并结果显示在5种遗传基因模型下Arg399Gln(rs25487G>A)突变与胰腺癌发病风险均无明显相关性。异质性检验结果显示各研究之间异质性偏大,为了减小不同研究间异质性因素对结果的影响,本研究基于亚洲人和HWE做分层分析,根据分层分析结果显示在亚洲人中Arg399Gln(rs25487G>A)突变与胰腺癌发病风险之间也无明显相关性,然而,Jiang等[9]发表的一篇meta分析表明在亚洲人中Arg399Gln(rs25487G>A)突变与胰腺癌发病风险之间有显著关联,此结论与本研究结果矛盾,与这篇meta分析对比,我们发现本研究纳入了新近发表的研究,提高了检验效能,结果更加可靠。排除对照组人群基因型分布不符合HWE定律的文献后,Meta分析发现Arg399Gln(rs25487G>A)突变与胰腺癌的发病风险无明显相关性,表明结果较稳定;针对Arg399Gln(rs25487G>A)突变,本研究分析未见任何发表偏倚存在,敏感性分析也提示meta分析结果相对稳定。
关于XRCC1上的Arg194Trp(rs1799782C>T)突变,本研究纳入7篇病例-对照研究,合并结果显示在5种遗传基因模型下Arg194Trp(rs1799782C>T)突变与胰腺癌发病风险均无明显相关性。He等[10]曾用5项研究来评估Arg194Trp(rs1799782C>T)突变与胰腺癌的关联,结果TTvsCC:OR=1.11,95%CI=0.76~1.63,P=0.583;CTvsCC:OR=1.39,95%CI=0.92~2.10,P=0.118;TT+CTvsCC:OR=1.39,95%CI=0.92~2.10,P=0.121;TTvsCT+CC:OR=1.07,95%CI=0.73~1.55,P=0.743;TvsC:OR=1.31,95%CI=0.93~1.86,P=0.125。本文结论与其一致。基于亚洲人做分层分析,结果表明Arg194Trp(rs1799782C>T)突变与胰腺癌发病风险无明显相关性。基于符合HWE定律做分层分析,结果显示Arg194Trp(rs1799782C>T)突变与胰腺癌的发病风险之间也无明显相关性,表明上述结论较可靠。
关于XRCC1上的Arg280His(rs25489G>A)突变,本研究仅纳入3篇病例-对照研究,合并结果显示在5种遗传基因模型下Arg280His(rs25489G>A)突变与胰腺癌发病风险均无明显相关性。Wang等[1]发表的研究中对照组人群基因型分布不符合HWE定律,排除这篇文献后,Meta分析结果表明Arg280His(rs25489G>A)突变与胰腺癌的发病风险有显著关联,由于纳入的文献数量较少,本论断尚需来自其他种族和更多高质量的研究进一步去验证。
本研究存在以下局限性:第一,文献检索语言为中文和英文,结果纳入2篇中文文献和6英文文献,除此之外没有其他语言文献纳入,这或许存在语言偏倚风险;第二,本研究仅对Arg399Gln(rs25487G>A)突变检验发表偏倚,由于纳入文献较少,本研究未对其他两个SNP检验发表偏倚;第三,尽管本研究做了分层分析,但仍具有较大的异质性,故应纳入更多的高质量文献,基于多种因素做meta回归分析,以明确各研究间异质性的来源,以期得到更为可靠的结论。
[1]WangLJ,WangHT,WangXX.AssociationofXRCC1genepolymorphismsandpancreaticcancerriskinaChinesepopulation[J].GenetMolRes,2016, 15(2):gmr8080.
[2]HouBH,JianZX,CuiP,etal.Associationandintragenicsingle-nucleotidepolymorphisminteractionsoftheXRCC1polymorphismsforpancreaticcancersusceptibility[J].Pancreas, 2016, 45(4): 546-551.
[3] 晏冬, 王喜艳, 李海军, 等.X线修复交叉互补基因1的单核苷酸多态性及其单体型与胰腺癌发病风险的关系[J]. 中华肿瘤杂志, 2013, 35(6): 472-477.
[4]NakaoM,HosonoS,ItoH,etal.SelectedpolymorphismsofbaseexcisionrepairgenesandpancreaticcancerriskinJapanese[J].JEpidemiol, 2012, 22(6): 477-483.
[5]McwilliamsRR,BamletWR,CunninghamJM,etal.PolymorphismsinDNArepairgenes,smoking,andpancreaticadenocarcinomarisk[J].CancerRes, 2008, 68(12): 4928-4935.
[6] 王丽, 林东昕, 陆星华, 等.DNA修复基因XRCC1和XPC多态性与胰腺癌风险关联研究[J]. 卫生研究, 2006, 35(5): 534-536.
[7]JiaoL,BondyML,HassanMM,etal.SelectedpolymorphismsofDNArepairgenesandriskofpancreaticcancer[J].CancerDetectPrev,2006, 30(3): 284-291.
[8]DuellEJ,HollyEA,BracciPM,etal.Apopulation-basedstudyoftheArg399GlnpolymorphisminX-rayrepaircross-complementinggroup1 (XRCC1)andriskofpancreaticadenocarcinoma[J].CancerRes, 2002, 62(62): 4630-4636.
[9]JiangH,WuD,MaD,etal.AssociationbetweenX-rayrepaircross-complementationgroup1rs25487polymorphismandpancreaticcancerrisk[J].TumorBiology, 2013, 34(6): 3417-3421.
[10]HeG,ChenG,ChenW,etal.LackofassociationofXRCC1rs1799782geneticpolymorphismwithriskofpancreaticcancer:ameta-analysis[J].TumorBiology, 2014, 35(5): 4545-4550.
AssociationbetweenXRCC1polymorphismsandpancreaticcancerrisk:ameta-analysis
SuGuoming1,HuangBinyang1,HanYuxin1,XiangJunbei1,SongQiling2,ZhangQi1,WangGuinian1,WangJiani1
1.DepartmentofPharmacyandLaboratory,SichuanNursingVocationalCollege,Chengdu610100,China; 2.MedicalLaboratory,theAffiliatedHospitalofNorthSichuanMedicalCollege,Nanchong637000,China
SuGuoming,Email:guomingsu77@163.com
ObjectiveTosystematicallyevaluatetheassociationbetweenXRCC1singlenucleotidepolymorphismsandpancreaticcancerrisk.MethodsAnelectronicsearchofPubMed,Embase,theCochraneLibrary,WebofScience,CBM,WanfangDataandCNKIdatabasewereconducted.Studieswereidentifiedwiththecriteriaforinclusionandexclusionformeta-analysis.Publicationbiaswasexaminedandsensitivityanalysiswasalsoperformed.ResultsAtotalofeightcase-controlstudieswereincludedinthemeta-analysis.ThecombinedresultsshowedthattherewasnosignificantassociationbetweenXRCC1Arg399Gln(rs25487G>A)mutantandArg194Trp(rs1799782C>T)mutantandpancreaticcancerrisk.TherewassignificantassociationbetweenXRCC1Arg280His(rs25489G>A)mutantandpancreaticcancerrisk(AvsG:OR=0.743,95%CI=0.576-0.958,P=0.022;GAvsGG:OR=0.701,95%CI=0.525-0.936,P=0.016;AA+GAvsGG:OR=0.710,95%CI=0.537-0.939,P=0.016).Eggerlinearregressiontestrevealedthattherewasnopublicationbias(P>0.05).Sensitivityanalysisshowedthattheresultswererobusttotheremovalofeachindividualtrialfromthemeta-analysis.ConclusionThisstudyshowedthatXRCC1Arg399Gln(rs25487G>A)mutantandArg194Trp(rs1799782C>T)mutanthadnosignificantcorrelationwiththeriskofpancreaticcancer.XRCC1Arg280His(rs25489G>A)mutantmightbeassociatedwiththeriskofpancreaticcancer.
pancreaticneoplasms;oncogenes;meta-analysis
苏国明,Email:guomingsu77@163.com
R
A
1004-583X(2017)08-0707-06
10.3969/j.issn.1004-583X.2017.08.015
2017-04-10 编辑:武峪峰

