单倍型相合造血干细胞移植治疗恶性血液病与人类白细胞抗原相合同胞移植疗效相当
高欣宝,温树鹏,邢丽娜,牛志云,王 颖,王福旭,张学军
(河北医科大学第二医院 血液科,河北 石家庄 050000)
·论著·
单倍型相合造血干细胞移植治疗恶性血液病与人类白细胞抗原相合同胞移植疗效相当
高欣宝,温树鹏,邢丽娜,牛志云,王 颖,王福旭,张学军
(河北医科大学第二医院 血液科,河北 石家庄 050000)
目的 对单倍型相合造血干细胞移植(Haplo-SCT)及人类白细胞抗原相合同胞造血干细胞移植(humanleukocyteantigenmatchedsiblingdonortransplantation,MSDT)治疗恶性血液病进行临床观察,对比分析两者疗效。方法 回顾性分析2012年7月至2016年12月在我院接受异基因造血干细胞移植的恶性血液病患者58例,Haplo-SCT组33例,同期MSDT组25例,分析影响移植后生存的相关危险因素。结果 ①Haplo-SCT组与MSDT组移植后均获得造血重建。②两组Ⅱ~Ⅳ度急性移植物抗宿主病(acutegraftversushostdisease,aGVHD)的累积发生率分别为33.3%和24%(P=0.261),Ⅲ~Ⅳ度aGVHD累积发生率分别为18.2%和8%(P=0.611)。③两组1年无白血病生存(leukemia-freesurvival,LFS)率分别为77%和61%(P=0.211),2年总生存(overallsurvival,OS)率分别为72%和61%(P=0.118)。④多因素分析显示移植后复发是影响OS的危险因素。结论 对于缺乏HLA相合同胞供者的恶性血液病患者而言,单倍型相合供者是可供选择的干细胞来源。
造血干细胞移植;血液肿瘤;移植物抗宿主病
白血病、骨髓增生异常综合征(myelodysplasticsyndrome,MDS)、侵袭性淋巴瘤等是威胁人类健康的血液系统恶性肿瘤,早年常以化疗为主,然而近20年来异基因造血干细胞移植(allogeneichematopoieticstemcelltransplantation,Allo-HSCT)逐渐成为治疗恶性血液病的主要手段,尤其是对于高危患者[1-2],但是由于供者T淋巴细胞与受者不相合的人类白细胞抗原(HLA)产生免疫反应,从而引起了可对器官、组织等造成不同程度损害的移植物抗宿主病(GVHD)[3]。因此HLA相合的亲缘供者的移植曾是治疗恶性血液病的金标准[4],然而仅有不到1/3的患者能获得HLA同胞全合供者[5-6],并且伴随我国特殊生育政策的实施,HLA相合同胞供者更难获得。对于缺乏全合供者的恶性血液病患者,HLA不全相合的亲缘供者可作为干细胞来源[7],多于90%的患者可找到相应供者,如父母、子女甚至旁系亲属,这既节省时间,又可使再次回输供者干细胞及淋巴细胞时容易获取。因此部分学者们开始探索亲缘间单倍体供者移植治疗恶性血液病,但由于受当时移植体系的限制,移植后患者常因不能植入、重度GVHD等导致死亡,故单倍型相合仅作为替代供者。现如今随着移植技术的发展以及抗人胸腺细胞球蛋白(antihumanthymocyteglobulin,ATG)/抗人T淋巴细胞球蛋白(rabbitanti-humanT-lymphocyteimmunoglobulin,ATG-F)在移植中的使用,打破了这一瓶颈,单倍体移植大获成功。
目前,HLA不全相合的Allo-HSCT以及Allo-HSCT后急、慢性GVHD的防治成为研究主题。本研究对单倍型相合供者造血干细胞移植(Haplo-SCT)患者与HLA同胞全相合移植(MSDT)患者进行随访观察,分析两组间疗效差异及影响Allo-HSCT后生存的危险因素。
1 资料与方法
1.1 病例选择 2012年7月至2016年12月河北医科大学第二医院血液内科病区因患恶性血液病行Allo-HSCT患者共58例,其中33例为Haplo-SCT,25例为MSDT。Haplo-SCT组中,男18例,女15例,年龄6~54岁,中位年龄48岁;急性髓细胞白血病(AML)13例,急性淋巴性细胞白血病(ALL)11例,其中Ph染色体(philadelphiachromosome)阳性4例;2例慢性粒细胞白血病(CML)加速期、1例CML急淋变;4例MDS中,RCMD亚型1例、RAEB-Ⅰ亚型1例、RAEB-Ⅱ亚型2例,IPSS-R分期均为高危及以上;急性混合细胞白血病(mixedphenotypeacuteleukemia,MAL)伴Ph染色体阳性1例;T淋巴母细胞淋巴瘤1例。MSDT组中,男11例,女14例,年龄23~57岁,中位年龄39岁;AML9例,ALL8例,其中Ph阳性1例;CML加速期2例、慢性期1例;MDS3例,RCMD伴骨髓纤维化1例,RAEBⅠ、Ⅱ亚型各1例,IPSS-R分期均为高危;浆细胞白血病(plasmacellleukemia,PCL)1例。所有患者均通过细胞形态学、分子生物学及细胞遗传学等检查确诊,符合恶性血液病诊断标准[8]。
根据患者移植前原发病状态分为稳定期和进展期:将AML-CR1、CR2,ALL-CR1,CML慢性期,MDS-RA型,MAL、PCL-CR1定义为稳定期;其他为进展期[9]。Haplo-SCT组稳定期为17例(51.5%),MSDT组稳定期16例(64%)。Haplo-SCT33例中,1~2点位不合1例(3%),3~4点位不合12例(36.4%),余为5个点位不合(60.6%)。供受者及家属充分知情并签署相关知情同意书。
1.2 预处理方案Haplo-SCT组主要以阿糖胞苷(Ara-C)+白消安(Busulfan,Bu)+环磷酰胺(Cyclophosphamide,CTX)+ATG/ATG-F+司莫司汀(Me-CCNU)为主,ATG和ATG-F用量分别为10mg/kg和20mg/kg;MSDT组,若供、受者中年龄≥40岁则加用ATG/ATG-F(7例,28%),用量分别为5mg/kg和10mg/kg;个别患者予全身照射(Totalbodyirradiation,TBI)+CTX或Bu+CTX+依托泊苷(VepesideVP-16)+ATG方案。
1.3 干细胞动员、采集和回输 两组多数患者采用骨髓+外周干细胞,少数患者单独用外周干细胞进行移植;动员剂常用重组人粒细胞集落刺激因子(Granulocytecolony-stimulatingfactor,G-CSF),以5~10μg/(kg·d)皮下注射,常规动员5天;于第4天在腰硬联合麻醉下行骨髓采集,采集量800~1 000ml,采髓期间回输自体血800ml,晶体液2 000ml,目标单个核细胞数(mononuclearcell,MNC)计数>2×108/kg;外周干采集量200ml/次,1~2次,目标MNC>3×108/kg。供受者ABO血型相合者直接回输,不合的去红细胞和去血浆后立即回输。骨髓+外周干细胞CD34+计数达到2×106/kg。
1.4GVHD的预防及治疗 急、慢性GVHD的诊断和分级符合西雅图Przepiorka等[10]、Filipovich等[11]标准。常规预防采用吗替麦考酚酯(MMF)+环孢素A(CsA)+短疗程甲氨蝶呤(MTX),若患者出现急性移植物抗宿主病(acutegraftversushostdisease,aGVHD),首先调整CsA用量,同时予甲泼尼龙1~2mg/kg,3天后如果病情进展或5~7天后症状未缓解,则联合二线药物,如益赛普(注射用重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白)、抗CD25单克隆抗体(巴利昔单抗)等。
1.5 其他并发症的防治及支持治疗 移植患者均入住层流病房,口服联磺甲氧苄啶片、氟康唑、盐酸小檗碱、诺氟沙星等预防感染;静脉予前列地尔预防肝静脉闭塞症(hepaticveno-occlusivedisease,VOD);移植过程中应用水化、碱化及美司钠预防出血性膀胱炎(hemorrhagiccystitis,HC);别嘌醇片、苯妥英钠预防其他药物不良反应;血制品需经25Gy辐照后输注;定期检测感染性指标。
1.6 观察指标 干细胞回输后中性粒细胞连续3天>0.5×109/L为中性粒细胞植入;连续7天不输注血小板,其计数>20×109/L的第1天为血小板植入。移植后15天骨髓细胞形态学检查及移植后嵌合状态动态分析;30天除上述检查外,需检测微小残留病、移植后免疫重建,供受者性别、血型不合需检测性染色体错配、ABO血型等。所有病例定期随访,观察终止时间为患者死亡时间或截止至2016年12月底。两组疗效指标包括急、慢性GVHD累积发生率、总生存(OS)率、移植相关死亡率(transplant-relatedmortality,TRM)、无白血病生存(LFS)率、复发率(relapserate,RR)及影响OS的危险因素。
1.7 统计学方法 采用SPSS19.0统计软件分析,计数资料及两样本均数用t检验;计数资料用χ2检验;Kaplan-Meier计算GVHD累积发生率、生存率、生存曲线;组间生存比较应用Log-Rank检验;对影响OS的多因素分析采用Cox比例风险回归。P<0.05为差异有统计学意义。
2 结 果
2.1 基线资料比较 两组性别、年龄、移植前疾病种类及状态、供受者性别匹配、输注MNC、CD34+细胞数等方面差异无统计学意义(P>0.05)。但两组在预处理方案是否加用ATG,差异有统计学意义(P<0.01),Haplo-SCT组均加用ATG或ATG-F,而MSDT组仅7例(28%)使用ATG或ATG-F,见表1。

表1 两组基线资料比较
2.2 造血重建Haplo-SCT组与MSDT组中性粒细胞植入率分别为97%(32/33)和100%(P>0.05),Haplo-SCT组中有1例患者,移植后出现消化道出血,后粒细胞、血小板均不能植入,于移植后25天死亡(不纳入统计),中性粒细胞植入的中位时间分别为11(8~19)天、11(9~19)天,两组差异无统计学意义(P=0.203)。两组血小板的植入率分别为97%(32/33)和92%(23/25)(P>0.05),MSDT组中2例血小板未植入患者中,其中1例移植后>28天尚未植入,后因aGVHD死亡,1例于移植后19天死于感染(不纳入统计)。血小板植入中位时间分别为15(10~28)天、12(6~22)天,两组差异无统计学意义(P=0.416)。
2.3GVHD的累积发生率Haplo-SCT组33例中11例发生Ⅱ~Ⅳ度aGVHD,累积发生率为33.3%,供受者类型中:男供女5例、男供男5例、女供男1例,父母供子女3例、子女供父母3例、同胞类型供者5例(均为年幼供年长);11例患者中多数发生于肠道(9例),其余2例为皮肤型GVHD。Ⅲ~Ⅳ度aGVHD的累积发生率为18.2%(6/33),其中男供女2例、男供男3例、女供男1例,父母供子女1例、子女供父母2例、同胞类型供者3例(均为年幼供年长);6例患者均有肠道aGVHD。在移植后100天以上的患者中,cGVHD发生率为30%(9/30),其中广泛型3例,局限型6例。
MSDT组25例中发生Ⅱ~Ⅳ度aGVHD6例,累积发生率为28%,供受者类型中:男供女2例、男供男2例、女供男2例,长供幼2例、幼供长4例;6例均有肠道GVHD表现。发生Ⅲ~Ⅳ度aGVHD2例,累积发生率为8%,男供女1例、女供男1例,幼供长2例;其中1例为肠道GVHD,1例为肠道、皮肤、肝脏多器官损害,2例均死于aGVHD。在移植后100天以上的患者中,8例发生cGVHD,发生率为36.4(8/22),其中广泛型3例,局限型5例。两组aGVHD与cGVHD的累积发生率比较差异无统计学意义(P>0.05),见图1、2。
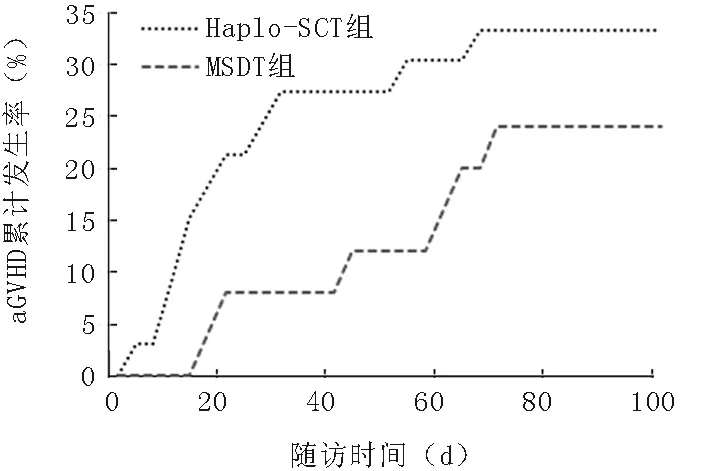
图1 两组Ⅱ~Ⅳ度aGVHD的累积发生率比较(P=0.261)
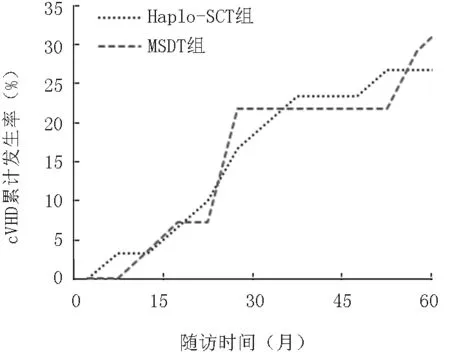
图2 两组cGVHD的累积发生率比较(P=0.629)
2.4 移植后病毒感染累积发生率Haplo-SCT组与MSDT组EB病毒(Epstein-Barrvirus,EBV)血症的累积发生率分别为51.5%和20.0%(P=0.028),巨细胞病毒(Cytomegalovirus,CMV)血症的发生率分别为75.8%和40%(P=0.007)。Haplo-SCT组EBV、CMV的发生率明显高于MSDT组。
2.5 原发病复发情况 随访至2016年12月末,Haplo-SCT组中7例(21.2%)复发,其中诊断为AML3例:AML-M7CR2 1例、AML-M2 2例,均于移植前基因学复发;ALL患者2例:ALLCR3 1例,存在中枢神经系统浸润、Ph染色体阳性ALL1例;CML患者2例:1例CML急淋变、1例CML加速期;供受者类型:男供女1例、男供男4例、女供男2例,父母供子女3例、子女供父母3例、弟供兄1例;这7例患者移植前原发病均为进展状态;其中3例患者已死于原发病复发,1例予联合化疗后再缓解。
MSDT组复发6例(24%),AML-M2 3例:移植前复发(原始细胞3%)1例、CR2 1例、血液学缓解(hematologicalcompleteremission,HCR)1例;ALL2例;MAL1例;供受者类型:男供女2例、男供男2例、女供男1例、女供女1例,长供幼2例、幼供长4例;6例患者中4例移植前疾病状态为进展期,其中已有4例患者因复发死亡,AML-M2(伴AML1-ETO融合基因阳性)1例,移植后3个月复发,后经淋巴细胞输注(DLI)治疗,随后出现DLI相关GVHD,且原发病仍为复发状态,于移植后约6.2个月死亡,另1例AML-CR2(伴AML1-ETO融合基因阳性)经过2次供者淋巴细胞回输(donorlymphocyteinfusion,DLI)后缓解。MSDT组原发病复发率略高于Haplo-SCT组,但差异无统计学意义(P=0.801),见图3。

图3 两组复发累积发生率比较(P=0.801)
2.6 移植相关死亡及相关并发症Haplo-SCT组中,因GVHD、VOD、感染、脏器功能衰竭等移植相关死亡共5例(15.2%),其中因感染死亡1例,因GVHD死亡2例,因消化道出血及VOD各1例;MSDT组中移植相关死亡6例(24%),因感染死亡3例,因GVHD死亡3例;两组TRM率差异无统计学意义(P=0.504)。Haplo-SCT组中发生VOD、HC、纯红细胞再生障碍性贫血(Pureredcellaplasia,PRCA)、毛细血管渗漏综合征(capillaryleaksyndrome,CLS)等移植早期并发症12例(36.4%),其中HC的发生率过半,为58.3%(7/12),发生PRCA2例(16.7%),CLS1例,2例VOD中1例因此死亡。MSDT组发生相关并发症3例(12%),均为HC;Haplo-SCT组移植早期并发症发生率高于MSDT组,且差异有统计学意义(P=0.036)。
2.7 生存分析Haplo-SCT组随访生存中位时间为25个月,1年LFS率为77.0%,2年OS率为72.0%;MSDT组随访中位时间为16个月,1年LFS率为61.0%(P=0.211),2年OS率为61.0%(P=0.118);Haplo-SCT组LFS率及OS率均略高于MSDT组,但差异无统计学意义,见图4、5。对于移植前处于稳定期患者,Haplo-SCT组与MSDT组2年OS率分别为94%和76.0%(P=0.323),而处于进展期患者Haplo-SCT组与MSDT组2年OS率仅为54.0%和44.0%(P=0.482);由此可见稳定期患者比进展期患者更有生存优势,见图6、7。
单因素分析结果显示,移植前疾病状态、原发病复发、aGVHD与OS密切相关(P<0.05),进一步行多因素COX比例风险模型分析结果显示,移植后原发病复发是OS的危险性因素(P=0.033),其他各指标对OS无明显影响,差异无统计学意义。见表2。

图4 两组无白血病生存率比较(P=0.777)
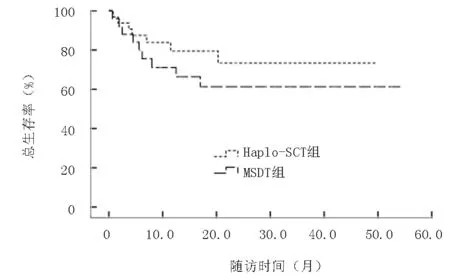
图5 两组总生存率比较(P=0.330)
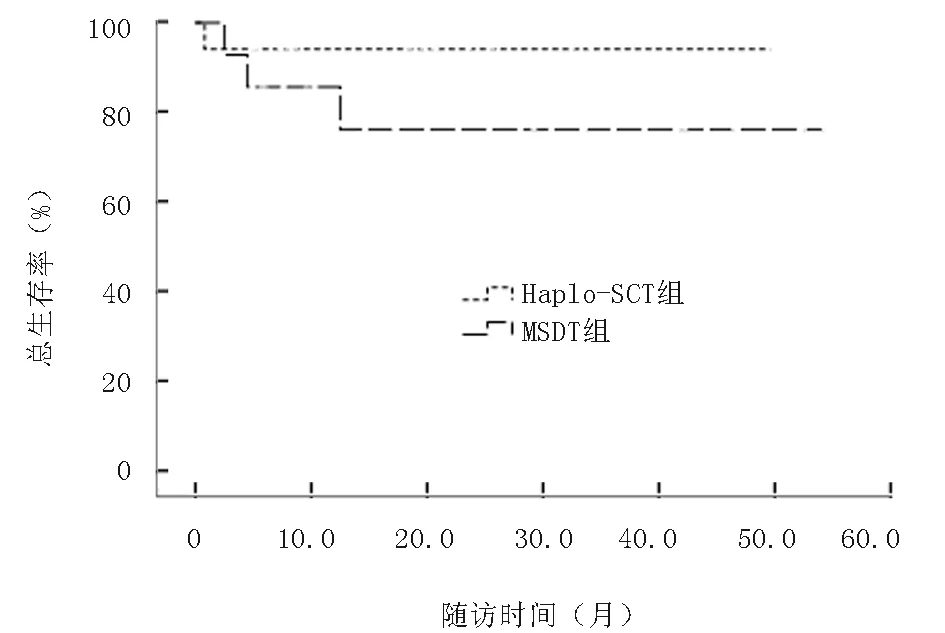
图6 两组稳定期总生存率比较(P=0.323)

图7 两组进展期总生存率(P=0.482)
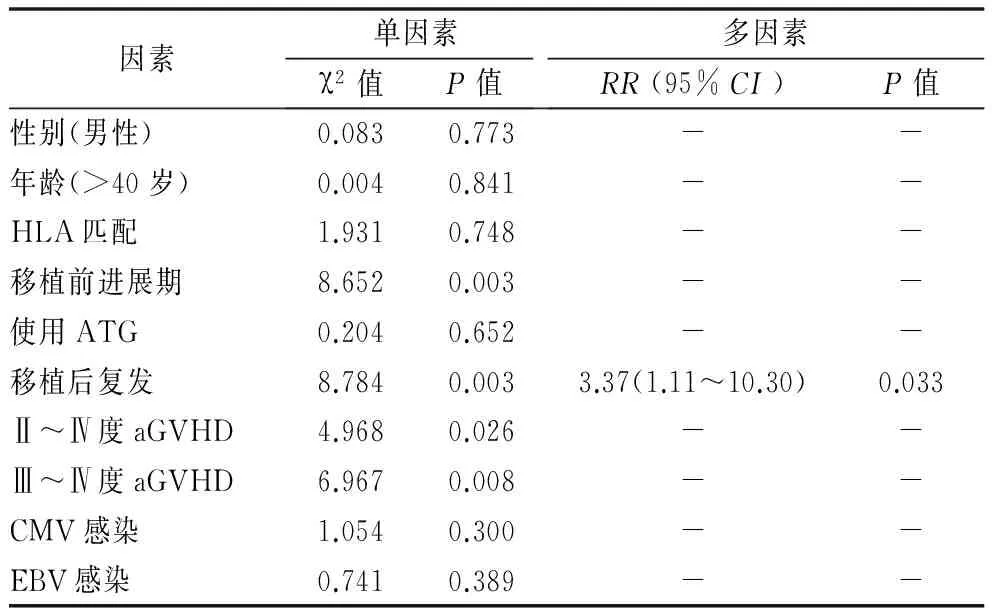
因素单因素χ2值P值多因素RR(95%CI)P值性别(男性)0.0830.773--年龄(>40岁)0.0040.841--HLA匹配1.9310.748--移植前进展期8.6520.003--使用ATG0.2040.652--移植后复发8.7840.0033.37(1.11~10.30)0.033Ⅱ~Ⅳ度aGVHD4.9680.026--Ⅲ~Ⅳ度aGVHD6.9670.008--CMV感染1.0540.300--EBV感染0.7410.389--
3 讨 论
Allo-HSCT是治愈恶性血液病并使患者长期获益的有效手段,甚至是唯一手段。但由于HLA基因产物可产生GVHD,HLA相合同胞移植可减少发生GVHD的风险及严重程度,但同胞全合供者来源较少、无关供者等待时间长;然而随着移植技术的发展,Haplo-SCT由于供者来源广泛,且安全性及有效性不断提高,加上移植方式的改善,越来越多的应用于临床。本研究旨在对比亲缘Haplo-SCT与MSDT在治疗恶性血液病时疗效及可能影响HSCT后生存的危险因素。
本研究结果显示,Haplo-SCT组与MSDT组在造血重建、急、慢性GVHD发生率、移植后复发率、TRM、OS率及LFS率方面的差异无统计学意义(P均>0.05)。而两组在EBV、CMV发生率及移植早期并发症的发生率上差异有统计学意义,Haplo-SCT组发生率均高于MSDT组。此外,在多因素分析中,移植后原发病复发是影响OS的独立危险因素。
本研究中两组GVHD发生率、OS率及LFS率差别无统计学意义,这与早年陆道培等[12]研究相符,该研究将135例Haplo-SCT与158例MSDT相比较,并在Haplo-SCT组中加入ATG,结果所有患者均成功植入,两组在aGVHD发生率、TRM、移植后复发率上差别均无统计学意义,两组OS分别为71%、72%(P>0.05),2年LFS分别为64%、71%(P>0.05)。也与近年Wang及Chang等[13-14]的报道相似。以往认为Haplo-SCT具有植入失败率高,造血、免疫重建延迟、GVHD发生率高等特点[15-16],然而现在能与MSDT疗效相当,这很可能是由于通过G-CSF动员过的移植物及在预处理中加入了ATG或其他免疫抑制剂的联合应用, 跨越了人类HLA的异基因屏障,使得Haplo-SCT在较短的时间内达到造血重建[9,17]。在本研究中,Haplo-SCT组LFS及OS均略高于MSDT组,且Haplo-SCT组移植后复发率也略低于MSDT组,但差异并无统计学意义,可能与纳入统计的病例数较少有关,但可以推断出Haplo-SCT效果与MSDT相当,甚至略优于MSDT组;这一推断提示我们,Haplo-SCT更适合应用于或者更应该应用于高危的恶性血液病患者,而非MSDT。
值得注意的是,本研究中Haplo-SCT组中EBV、CMV感染发生率明显高于MSDT组,这与国内相关报道结果相似[18],且该文献指出,CMV感染是导致继发性血细胞减少、植入功能不良的独立危险因素。而导致这一结果的原因可能是由于本研究Haplo-SCT组均在预处理中使用了ATG的缘故。国内外一些研究证实,预处理方案中使用ATG是EBV、CMV感染发生的重要危险因素[19-23],系因ATG具有较长的半衰期及较强的T细胞去除作用,免疫抑制作用强大;而Allo-HSCT预处理过程应用大剂量免疫抑制剂,使机体免疫功能受损,且免疫重建缓慢,病毒被激活。CMV感染是Allo-HSCT后常见合并症,也是导致患者死亡的主要原因之一[24]。且病毒感染往往能增加GVHD的发生率,二者可相互促进。Jiang等[25]研究证实低剂量ATG可使T细胞较早恢复,从而降低病毒感染发生率;而较高剂量则能更有效的降低GVHD的发生。本研究中还将两组移植早期并发症发生率作比较,Haplo-SCT组明显高于MSDT组,且以发生HC为主(58.3%,7/12);有文献报道[26-27]HLA不相合、CMV感染、GVHD、应用ATG及供受者性别差异等因素与HC发生密切相关。因此移植后对CMV-DNA、EBV-DNA的监测及对ATG的合适使用剂量的研究颇为重要。这些研究结论提示我们,对于低危、具有MSDT供者、既往有病毒感染史的恶性血液病患者可能更适合MSDT。
此外,在本研究关于影响OS的单因素分析中显示重度GVHD、移植前原发病为进展状态及复发是影响OS的危险因素,这与其他中心多样本研究结果相似[4,9]。并且在本研究的多因素分析中,发现移植后原发病的复发仍是影响HSCT后患者生存的独立危险因素(RR=3.37, 95%CI=1.11~10.30)。一项新研究显示[28],移植后复发的危险因素与疾病种类、移植前疾病状态、诱导缓解的疗程等有关,其中ALL患者、移植前疾病为进展状态及超过1个疗程达到缓解的复发率较高。而本研究与之相似,多数复发患者移植前原发病状态处于进展期。对于高危类型白血病患者移植后复发率可高达50%~70%[29]。因此在移植前应尽量诱导原发病达到CR,减少白血病细胞,以降低患者移植后复发风险。另外及时的逐渐减少免疫抑制剂的用量以及预防性的进行DLI,均可降低复发风险,延长生存期。本研究中,Haplo-SCT组复发率略低于MSDT组,这可能与Haplo-SCT在免疫重建后产生的移植物抗白血病效应(GVL)可杀伤白血病细胞有关。但是,与DLI一样,在增强GVL作用的同时往往可引起严重的GVHD、骨髓抑制等,这也是影响生存的因素。我国学者[29-33]对此作了进一步探索,将G-CSF动员后的供者外周干细胞进行回输,而非单纯的淋巴细胞回输,随后予CSA、MTX预防DLI相关的GVHD,此法取得了较好疗效,提高了患者的生存率;而且将其与化疗联合应用可使移植后复发再缓解率达64%。
本研究初步结果表明,Haplo-SCT与MSDT在治疗恶性血液病时疗效差异无统计学意义,对于高危的恶性血液病患者,在现有移植体系下,进行Haplo-SCT是安全可行的,并且高危患者也更适合进行Haplo-SCT。但Haplo-SCT增加了移植后病毒或细菌、真菌感染的风险,对此我们应提高警惕,定期监测相关指标变化以及积极预防尤为重要。此外,为减少移植后复发,提高生存率,移植前应尽量使患者在移植前处于CR状态。本研究旨在通过分析能够提示在临床工作中如何选择更有效的移植方式治疗原发病。但本研究为单中心研究,病例数较少。因此需要更多移植中心、更大样本量的研究。
4 结论
对于缺乏HLA相合同胞供者的恶性血液病患者而言,单倍型相合供者是可供选择的干细胞来源。
[1]LjungmanP,BregniM,BruneM,etal.Allogeneicandautologoustransplantationforhematologicaldiseases,solidtumoursandimmunedisorders:currentpracticeinEurope2009[J].BoneMarrowTransplant, 2010, 45(2): 219-234.
[2]Xiao-JunH,Lan-PingX,Kai-YanL,etal.HLA-mismatched/haploidenticalhematopoieticstemcelltransplantationwithoutinvitroTcelldepletionforchronicmyeloidleukemia:improvedoutcomesinpatientsinacceleratedphaseandblastcrisisphase[J].AnnMed, 2008,40(6):444-455.
[3] 陈瑶,陆道培,刘开彦. 异基因造血干细胞移植后急性移植物抗宿主病151例危险因素分析[J]. 中华血液学杂志,2005,26(2):13-16.
[4] 王莉红, 任汉云, 李渊.HLA相合同胞和不全相合血缘关系供者造血干细胞移植的临床对比研究[J]. 中华血液学杂志, 2008,29 (8):507-511.
[5]AppelbaumFR.Allogeneichematopoieticcelltransplantationforacutemyeloidleukemiawhenamatchedrelateddonorisnotavailable[J].HematologyAmSocHematolEducProgram, 2008:412-417.
[6] 于嗣俭, 戴敏, 孙竞, 等.亲缘HLA不相合与无关HLA全相合供者造血干细胞移植治疗血液肿瘤疗效比较[J].中华血液学杂志,2014,35(9): 826-830.
[7] 王福旭. 造血干细胞移植治疗高危急性髓细胞白血病的研究进展[J].国际输血及血液学杂志,2013,36(5): 412-417.
[8] 张之南, 沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007.
[9] 王萌,董玉君,邱志祥. 83例单倍体相合造血干细胞移植治疗恶性血液病的临床疗效及预后分析[J]. 中国实验血液学杂志,2016,24(3):833-839.
[10]PrzepiorkaD,WeisdorfD,MartinP,etal. 1994ConsensusConferenceonAGVHDGrading[J].BoneMarrowTransplant, 1995, 15(6):825-828.
[11]FilipovichAH,WeisdorfD,PavleticS,etal.NationalInstitutesofHealthconsensusdevelopmentprojectoncriteriaforclinicaltrialsinchronicgraft-versus-hostdisease: Ⅰ.diagnosisandstagingworkinggroupreport[J].BiolBloodMarrowTransplant, 2005, 11(12): 945-956.
[12]LuDP,DongL,WuT,eta1.ConditioningincludingantithymocyteglobulinfollowedbyunmanipulatedHLA-mismatched/haploidenticalbloodandmarrowtransplantationcanachievecomparableoutcomeswithHLA-identicalsiblingtransplantation[J].Blood, 2006, 107(8): 3065-3073.
[13]WangY,LiuQF,XuLP,etal.Haploidenticalvsidentical-siblingtransplantforAMLinremission:amulticenter,prospectivestudy[J].Blood, 2015, 125(25): 3956-3962.
[14]ChangYJ,WangY,HuangXJ.Haploidenticalstemcelltransplantationforthetreatmentofleukemia:currentstatus[J].ExpertRevHematol, 2014,7(5): 635-647.
[15] 向茜茜,孔佩艳,李杰平. 亲代间单倍体相合造血干细胞移植治疗血液病45例临床分析[J]. 解放军医学杂志,2012,37(2):121-125.
[16] 黄河. 以低剂量抗T淋巴细胞免疫球蛋白为基础、非体外去T细胞的亲缘HLA单倍体相合造血干细胞移植与全相合同胞供者移植、非血缘供者移植疗效的比较[J].中华内科杂志,2015,54(2):150.
[17] 纪树荃,陈惠仁,王恒湘.G-CSF预处理供者单倍体相合骨髓移植加用CD25单克隆抗体预防急性GVHD的临床研究[J]. 中国实验血液学杂志,2002,10(5):447-451.
[18] 林志娟, 孔圆, 王昱, 等.异基因造血干细胞移植术后继发性造血细胞减少的危险因素分析[J].中华血液学杂志,2014,35(1): 4-8.
[19] 张永平,胡凯勋,孙琪云,等. 非清髓异基因外周血造血干细胞移植后巨细胞病毒感染的危险因素分析[J].中国实验血液学杂志, 2014, 22(2): 458-463.
[20]GeorgeB,KerridgeIH,GilroyN,etal.Ariskscoreforearlycytomegalovirusreactivationafterallogeneicstemcelltransplantationidentifieslow-,intermediate-,andhigh-riskgroups:reactivationriskisincreasedbygraft-versus-hostdiseaseonlyintheintermediate-riskgroup[J].TransplInfectDis, 2012, 14(2): 141-148.
[21] 张钦,张斌,陈虎. 造血干细胞移植后EB病毒感染的细胞免疫治疗[J]. 中国实验血液学杂志,2015,23(6):1763-1768.
[22] 陈欢, 刘开彦, 许兰平, 等.异基因造血干细胞移植后实时定量聚合酶链反应在巨细胞病毒感染诊断和治疗中的应用[J].中华血液学杂志,2009,30(2): 77-81.
[23] 韩婷婷, 许兰平, 刘代红, 等.异基因造血干细胞移植后EB病毒感染情况分析[J].中华血液学杂志,2013,34(8): 651-654.
[24] 刘开彦. 造血干细胞移植患者巨细胞病毒感染的诊治进展[J]. 中国实用内科杂志, 2007, 10(27) : 1597-1598.
[25]LiuJ,XuLP,BianZetal.Differentialimpactoftwodoseofantithymocyteglobulinconditioningonlymphocyterecoveryuponhaploidenticalhematopoieticstemcelltransplantation[J].JTranslMed, 2015,13:391.
[26] 张红宇,黄晓军,许兰平,等. 异基因造血干细胞移植后出血性膀胱炎发生率及其危险因素分析[J].中华血液学杂志,2007,28(4).243-246.
[27]RuggeriA,Roth-GuepinG,BattipagliaG,etal.Incidenceandriskfactorsforhemorrhadiccystitisinunmanipulatedhaploidenticaltransplantrecipients[J].TransplInfectDis,2015,17(6):822-830.
[28] 舒晓艳,闫侠芳,董磊. 异基因造血干细胞移植后白血病复发的危险因素分析和治疗[J]. 中国实验血液学杂志,2016,24(4):1137-1142.
[29] 刘代红,黄晓军,陈欢. 异基因造血干细胞移植后供者外周血造血干细胞输注预防高危白血病复发[J]. 中华血液学杂志,2006,29(1):6-9.
[30]HuangXJ,WangY,LiuDH,etal.Modifieddonorlymphocyteinfusion(DLI)fortheprophylaxisofleukemiarelapseafterhematopoieticstemcelltransplantationinpatientswithadvancedleukemia-feasibilityandsafetystudy[J].JClinImmunol, 2008, 28 (4): 390-397.
[31]HuangXJ,WangY,LiuDH,etal.Administrationofshort-termimmunosuppressiveagentsafterDLIreducestheincidenceofDLI-associatedacuteGVHDwithoutinfluencingtheGVLeffect[J].BoneMarrowTransplant, 2009, 44(5): 309-316.
[32]WangY,LiuDH,XuLP,etal.PreventionofrelapseusinggranulocyteCSF-primedPBPCsfollowingHLA-mismatched/haploidentical,T-cell-depletehematopoieticSCTinpatientswithadvancedstageacuteleukemia:aretrospectiverisk-factoranalysis[J].BoneMarrowTransplant, 2012, 47(8): 1099-1104.
[33] 黄河. 异基因造血干细胞移植术后复发防治策略[J]. 中国实用内科杂志,2014,34(2):122-126.
HaploidenticalhematopoieticstemcelltransplantationforhematologicmalignanciesisequivalenttoHLAmatchedsiblingtransplantation
GaoXinbao,WenShupeng,XingLina,NiuZhiyun,WangYing,WangFuxu,ZhangXuejun
DepartmentofHematology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China
WenShupeng,Email:hebih@126.com
ObjectiveTocomparetheclinicalefficacyfortreatmentofmalignanthematologicaldiseaseinhaploidenticalhematopoieticstemcelltransplantation(Haplo-SCT)andhumanleukocyteantigenidenticalsiblinghematopoieticstemcelltransplantation(humanleukocyteantigenmatchedsiblingdonortransplantation,MSDT).MethodsFifty-eightpatientswithhematologicmalignanciesundergoingrelatedhaploidentical(n=33)andHLA-identicalsibling(n=25)inourhospitalwereenrolledforaretrospectiveanalysis.Theclinicalefficacyandrelatedriskfactorsofposttransplantationoverallsurvival(OS)wereanalyzed.Thetherapeuticeffectsofthetwotreatmentsandtheriskfactorsrelatedtooverallsurvival(OS)wereevaluated.Results①Haploidenticalandidenticalsiblingcohortsweresuccessfullyengrafted. ②ThecumulativeincidencesofgradesⅡtoⅣacutegraft-versus-hostdisease(aGVHD)andgradesⅢtoⅣaGVHDinthemismatchedandmatchedcohortswere33.3%versus24%(P=0.261)and18.2%versus8%(P=0.611),respectively. ③One-yearleukemia-freesurvival(LFS)andtwo-yearOSinmismatchedandmatchedcohortswere77%vs61% (P=0.211)and72%vs61% (P=0.118),respectively. ④Multivariateanalysisshowedthatonlyrelapseafterallo-HSCT(P=0.033)wereriskfactorsforOS.ConclusionForpatientswithhematologicalmalignancieslackingmatchedsiblingdonor,HLA-haploidenticaldonorswereanalternativestemcellsource.
haploidenticalstemcelltransplantation;hematologicneoplasms;graft-versus-hostdisease
温树鹏,Email:hebih@126.com
R
A
1004-583X(2017)08-0665-07
10.3969/j.issn.1004-583X.2017.08.006
2017-04-11 编辑:张卫国

