骨软骨一体化仿生支架的研究现状与展望
张学亮,刘舒云,郭维民,张雨,陈明学,荆晓光,张增增,张彬,沈师,李建伟,郭全义
骨软骨一体化仿生支架的研究现状与展望
张学亮,刘舒云,郭维民,张雨,陈明学,荆晓光,张增增,张彬,沈师,李建伟,郭全义
关节软骨在日常关节活动中发挥着重要的作用,而随着社会人口老龄化所导致的退行性软骨损伤与年轻患者不恰当的运动带来的运动损伤等,使得关节软骨损伤的发病率在不断地上升,且损伤患者也渐趋于年轻化。关节软骨虽有其相应的代谢活动,但因其缺乏神经、血管及淋巴组织,软骨一旦破坏便难以自我恢复与再生。如图 1 所示,常见的关节软骨损伤中,按其损伤程度大体可以分为三种类型:部分软骨损伤、全层软骨损伤与骨软骨缺损。若部分软骨损伤与全层软骨损伤早期未及时发现并做相应的处理,进一步向下恶化便会演变成严重的骨软骨缺损[1];相应的软骨下骨损伤后,向上侵袭上层的软骨层也会造成整体的骨软骨损伤。因此无论是自上而下所致的骨软骨损伤还是自下而上导致的骨软骨损伤,都严重影响人体关节的正常活动,其不仅给患者的日常生活带来极大的不便,而且给患者造成巨大的经济与心理负担,同时也消耗着大量的社会公共医疗资源。因此,寻求一种有效的骨软骨修复策略,既是社会的迫切需求与盼望,也是临床医生与科学家亟待解决的临床科学问题之一。
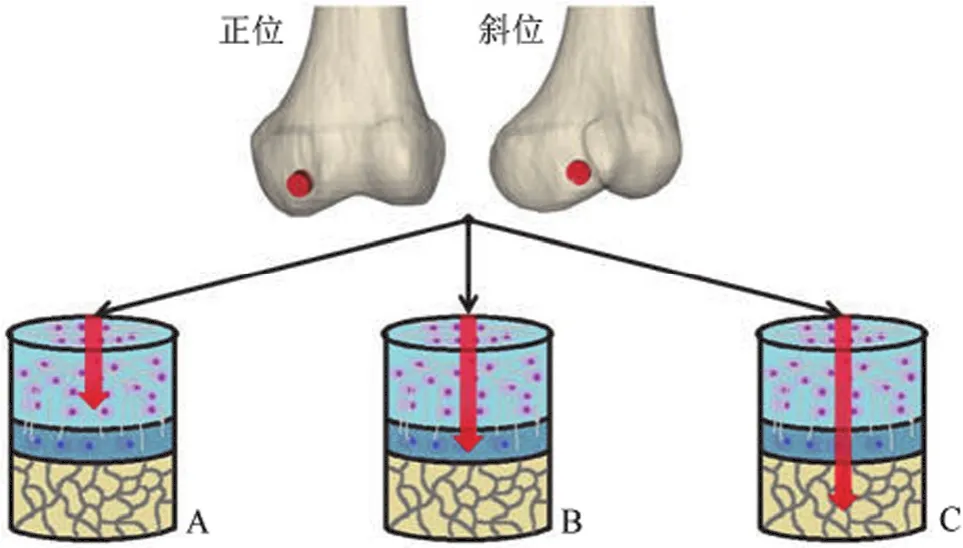
图1 常见的骨软骨缺损类型(A:部分软骨损伤;B:全层软骨损伤;C:骨软骨缺损)
近年来,随着组织工程再生医学的出现和不断发展,为骨软骨损伤后的修复与再生带来了新的希望。组织工程再生医学主要包括三个因素:生物支架、种子细胞与生长因子[2],其中生物支架作为骨软骨缺损修复再生过程中种子细胞和周围正常组织渗透募集来的细胞黏附、生长、增殖与分化的基础,不仅为缺损区的修复与再生提供适宜的生物学环境,而且生物支架的空间结构与机械强度也为骨软骨损伤后的修复与再生提供有利的力学微环境。因此,利用合适的组织工程骨软骨一体化仿生多相梯度支架,可以有效地帮助解决骨软骨损伤后修复与再生的难题,为骨软骨损伤后的修复再生治疗提供一种新的技术与方法。
1 复杂的骨软骨解剖结构
根据关节软骨表面到软骨下骨的纤维走向、细胞形态与密度、糖胺多糖(glycosaminoglycans,GAGs)及各胶原含量、含水量等生物学差异与其相应的力学梯度差异,可将关节骨软骨大致分为五层:浅表层、中间层(过渡层)、深层(辐射层)、钙化层、软骨下骨层,前三层总称为透明软骨层,透明软骨层与钙化层交界处有一潮线结构,将相对较软的关节软骨组织与相对坚硬的钙化软骨连接在一起,钙化软骨层下方为软骨下骨平台,两层之间交错结合锚定,交界处形成的结构称之为粘合线[3]。
1.1 透明软骨层
浅表层占透明软骨层总厚度的 10%~20%,以胶原纤维走向与软骨表面平行且胶原纤维较细(4~12 nm),排列密集为特点。该层软骨细胞分布密度较高,细胞形态多为瘦长的扁平状细胞[4]。这一区域的软骨细胞主要负责组织的外加生长,并被称为持续型软骨细胞。在浅表层的最上层区域覆盖着薄薄的一层非细胞结构,通常只有几百纳米,其主要作用为降低关节软骨表面摩擦力[5]。这一大分子保护层糖蛋白含量较高,也被称为浅表层黏膜蛋白多糖。浅表层 II 型胶原与含水量最高,I 型胶原与 GAGs 含量最低。由于浅表层的胶原纤维的排列走向与密度、含水量及 GAGs 含量使得该层的渗透率最高,并且能够有效地优化分散来自关节的剪切应力。
位于浅表层下方的是中间层,也称为过渡层。中间层占总透明软骨层厚度的 40%~60%,胶原纤维较粗(9 ~60 nm),走向与关节软骨表面交叉,排列不整齐。该层细胞为圆形且随意排列的软骨细胞,通常称为增殖型软骨细胞[6]。从浅表层到深层,II 型胶原与含水量呈递减趋势,I 型胶原与 GAGs 含量呈递增趋势。由于该层 GAGs 含量较高,组织的渗透率也低于浅表层,因此,中间层可适度调节和支持来自关节的压缩应力[7]。
关节软骨的深层,即辐射层,占总透明软骨层厚度的20%~50%,胶原纤维粗大(60~140 nm)且排列走向与关节软骨表面垂直。该层软骨细胞呈伸长型,有的近球状,细胞密度与浅表层和中间层相比较低[8]。II 型胶原与含水量最少,I 型胶原与 GAGs 含量最高。深层的渗透率很低,几乎没有液体流动能通过该层组织。该层承受最大的界面间剪切应力[9]。部分软骨损伤的深度只涉及关节透明软骨层,损伤较轻,潮线完整保留。
1.2 潮线与钙化层
潮线介于深层与钙化层间,研究发现随年龄的增长,组织重建时,潮线的数目也相应的增加。钙化层位于潮线下方,富含磷灰石与碱性磷酸酶,组织矿化明显,细胞密度较低,多为圆形肥大的软骨细胞[10],同时来自深层的部分粗大的胶原纤维透过潮线将钙化层与透明软骨层连接起来。潮线与钙化层作为较软的透明软骨层与较硬的软骨下骨平台交界面,在生物学上,该层起着抑制来自骨层血管侵入的屏障作用,防止透明软骨层矿化的发生;在力学上,该层在关节活动时承受极大的、多变的剪切应力,为其连接的上下两层提供缓冲性的力学性能支撑。另外从关节软骨浅表层到软骨下骨平台,各层之间弹性模量差异巨大,透明软骨浅表层、深层、钙化软骨层与软骨下骨的压缩模量大约分别为 0.079、2.1、320 MPa 与 5.7 GPa[11-12],由此可见,潮线与钙化层作为骨和软骨的交界面,在一体化骨软骨的结构与功能中发挥着重要的作用。全层软骨损伤深度达到钙化软骨层的水平,潮线不同程度的缺失,但损伤尚未伤及粘合线以下部分。
1.3 软骨下骨层
软骨下骨层位于粘合线下,主要是由胶原、层粘连蛋白、纤连蛋白等各类糖蛋白及长度为 20~80 nm,厚度为 2 ~5 nm 的羟基磷灰石组成的一种纳米复合材料[13]。依据血管分布多少与孔隙率可将软骨下骨层分为两部分:相对位于上层,紧邻钙化软骨下的为骨皮质,有极少的血管分布与较低的孔隙率;位于下层较深的另一部分则为类海绵状的松质骨,这一部分则包含丰富的血管与随机排列的骨小梁多孔结构[14]。软骨下骨层的完整性是否受到破坏是骨软骨损伤的标志。
2 目前治疗骨软骨缺损方法的优势与不足
临床及实验研究观察发现,骨软骨缺损由于伤及软骨下骨,创面较深,其中严重的骨软骨缺损需进行创伤性较大的全膝关节置换,但是由于受到全膝关节置换假体的使用寿命限制,手术费用较高,术后各项功能恢复活动受限等各因素的影响,无论从患者的心理接受程度上或实际的修复效果上,都尚未令人满意。除全膝关节置换外,目前其余的方法均为缓和姑息性治疗,主要手术技术包括有:关节镜清创术、微骨折、自体骨软骨移植与镶嵌成形术、异体骨软骨移植及自体软骨细胞的移植等[15]。如表 1 所示,目前用于骨软骨缺损的临床治疗技术方案,也各有其相应的优缺点。

表1 目前膝关节骨软骨缺损的手术治疗方法
传统的骨软骨修复策略虽然具有其相应的优势,但其固有的缺陷也很明显,如关节镜清创术治疗效果不明显;微骨折术后修复易形成纤维软骨,而非正常的透明软骨;自体或异体骨软骨移植则存在移植组织来源受限,移植物来源区发病率高,缺损区的修复与周围关节软骨不吻合等相应的问题,临床实际修复效果不理想[23]。基于细胞的治疗方法,如自体软骨细胞移植与自体软骨细胞外基质移植,亦存在修复区可能产生纤维软骨、修复填充不完整、与周围组织的整合较差等问题,其实际效果也尚未得到统一认可。因此,目前临床中骨软骨损伤尚缺乏切实有效的修复治疗手段。
3 组织工程骨软骨一体化仿生支架
3.1 骨软骨缺损治疗的新思路
组织工程技术的发展为骨软骨缺损的治疗提供了一种新的思路。通过利用组织工程骨软骨一体化仿生支架,并结合现有治疗方法中的相关优势,优化支架植入时的手术路径与手术操作,同时制定系统化、个性化的术后康复理疗方案,从而获得更好的远期修复效果。系统地回顾研究国内外组织工程骨软骨一体化支架修复材料的现状,发现目前应用于骨软骨缺损修复的生物支架主要集中于负载细胞或因子型支架与非负载型支架两个方面[24-25]。
部分实验研究发现,由于受到支架为细胞或因子提供的微环境与实验动物体内的局部微环境相差甚远,且种植于支架内的细胞极易流失,在其培养与传代过程中细胞去分化现象严重,也易污染等科学性问题的影响;同时受到细胞来源与相应的医学伦理学等社会性问题的约束,导致负载细胞或因子型支架不仅制备流程复杂烦琐,而且其实际的修复效果与非负载型支架修复再生的效果相比也无明显差异,甚至研究发现非负载细胞型支架通过支架的生物学与力学特性,为周围组织中细胞的渗透和募集来自骨髓腔的细胞提供相应的生物学线索与力学环境,最终其修复的结果更加完整,再生效果亦更加明显[26-27]。因此,在实验研究中与实际临床应用中,非负载细胞型支架修复再生骨软骨缺损已成为研究应用的热点性骨科再生医学问题。
3.2 理想的骨软骨支架材料特点
生物支架作为骨软骨缺损后修复再生的框架与暂时性替代物,在后期骨软骨修复再生的过程中,其对周围组织细胞的渗透与募集、黏附、生长与繁殖,正常细胞外基质的分泌发挥重要作用[28]。理想的骨软骨一体化仿生支架应为细胞生长提供良好的微环境,同时在组织工程骨软骨支架修复再生中主要应具备以下特点:支架材料应安全无毒,不仅材料所含成分安全且其体内修复过程中相应的降解产物也应以不引发炎症反应和毒性反应为前提;支架在体内的降解速率应与其修复再生的过程尽量保持一致;应具备良好的生物相容性与表面活性,即支架在修复过程中应与周围组织融为一体,且支架表面应有利于细胞的黏附和生长增殖,同时也不引起机体相应的免疫排斥反应;支架材料应拥有一定的力学特性,均匀的孔径及相应的孔隙率,拉伸性能、弹性模量都应与天然骨软骨结构接近,确保其在修复过程中受到复杂的力学刺激时的稳定性[29-30]。
3.3 常见的骨软骨一体化支架材料的分类
组织工程骨软骨一体化仿生支架依据层次结构与成分的不同,可以分为单相支架、双相支架、三相或多相支架,支架每层均由不同性能的材料或结构类型组成[31]。目前实验研究与临床实际应用中常见的骨软骨支架材料[30,32-34]如表 2 所示。

表2 常见的骨软骨生物支架材料
3.4 不同支架材料的生物学与力学性能
3.4.1 天然生物支架材料 各类组织工程骨软骨支架因成分及结构不同,其相应的生物学与力学性能也不同。如天然生物支架材料虽具有生物相容性好,细胞亲和力与可降解程度高,有利于后期渗透和募集的细胞黏附与增殖的优势,但其也有力学性能较差,降解速度过快,来源有限等缺点[35]。
胶原作为动物组织中含量最为丰富的蛋白质之一,其主要作用为提供和维持细胞外基质的结构完整性,而软骨与骨的细胞外基质中又富含胶原,因此胶原成为骨软骨组织工程的理想生物支架材料[43]。实验研究表明,在 3D 胶原凝胶中软骨细胞能较好地维持其正常软骨细胞表型,同时在组织修复与伤口愈合过程中胶原也发挥着重要作用。然而,由于胶原较差的力学性能也限制了其在负重区组织修复中的应用。目前,胶原与生物陶瓷的复合材料已被广泛研究用来提高胶原的力学性能,但其免疫原性、大规模生产和纯化仍然是限制胶原临床应用的主要问题。
壳聚糖是骨软骨组织工程中另外一种正在被广泛研究的天然生物材料,其化学结构类似于在软骨细胞外基质中发现的 GAGs 化学结构,这种仿生的化学结构性质使其非常有利于软骨细胞的形态发育、分化与增殖[37,44]。
3.4.2 人工合成支架材料与生物陶瓷材料 人工合成支架材料与生物陶瓷材料具有较好的力学特性,可塑性较强,降解率可控及来源广泛,不受限制等优势,而其相应的缺点即生物相容性较差,细胞亲和力低,部分支架材料缺乏亲水性,其降解产物可能存在一定的毒性等。
Shafiee 等[45]通过将亲水性的聚乙烯醇(PVA)与疏水性的 PCL 用静电纺丝技术混纺,来提高人工合成支架材料的亲水性与细胞黏附率。并且其通过体外实验和兔子的体内实验已证明 PVA 和 PCL 混纺确实可以提高间充质干细胞(MSCs)向软骨分化与增殖的能力。生物陶瓷中生物玻璃、羟基磷灰石(HA)和磷酸三钙(TCP)因其较强的力学强度,已成为骨组织工程中常见的支架材料,但其也有材料属性较脆的相应缺点。
3.4.3 复合材料 随着组织工程的发展,人们为克服各单一材料的缺点,而将两种或者两种以上的材料,依据其特性优势互补的原则,按一定比例或方式进行搭配复合,设计出能够满足骨软骨组织工程所需的理想支架。复合材料支架结合了各组成单项支架材料的优势:如降解速率可控,细胞相容性好,支架良好的亲水性,生物力学强度适宜等特点。
Lee 和 Wu[46]用纤维蛋白、PCL 与磷酸三钙(TCP)分层制造了两种双相支架,并在培养基中培养了适量的成软骨和成骨细胞,相应的种植于双相支架上下层,最后用纤维蛋白胶将两层黏合成一整体。然而由于通过黏合的方法并无法将两层紧密结合在一起,最终两层组织间出现了分离。Wang 等[47]通过液相合成扩散(LPCI)技术、改良热致相分离(TIPS)等技术,利用猪的软骨细胞外基质与 nano-HA 制得双相骨软骨支架,其中骨层由两者按比例混合构成,软骨层则由单独的取向性猪软骨细胞外基质组成。由于软骨细胞外基质富含胶原和 GAGs,且其具有取向性结构,作为软骨层非常有利于软骨细胞的生长与增殖,相应的比例混合nano-HA 作为骨层可以缩小骨层结构的孔径,增强骨层的力学结构,同时防止软骨层的钙化。
Vindas 等[48]用 3D 打印的磷酸钙作为骨层基础,由马的软骨细胞外基质构成软骨层,通过冷冻干燥与紫外线交联技术制得双相骨软骨支架,但其在修复大动物马的骨软骨缺损实验中由于观察时间较短,实验动物特殊,最终未达到预期的再生修复效果。Su 等[49]利用 Col II 与 CS 为材料制备了孔径约 100 μm 的软骨层,PLGA 作为骨层,孔径为500 μm,并在此双相支架上种植了纳米磁性粒子标记的软骨细胞,观察其在支架上的生长增殖与分布情况,从而进一步研究此方法对骨软骨修复再生的效果,实验结果显示其支架结构与新技术标记的细胞结合使用在修复再生骨软骨缺损中具有很好的应用前景。Harley 等[50]制备的骨软骨一体化支架中软骨层由 Col I 与 GAGs 混悬液构成,骨层由Col I、GAGs 与 CaP 三者混悬液构成,两混悬液之间互相渗透结合,再通过物理化学交联与冷冻干燥成型技术,形成了界面结合锚定紧密,不易分离的双相骨软骨支架。Zhang等[51]利用 3D 打印技术制备了软骨层由 PEG 组成,骨层由 β-磷酸三钙(β-TCP)构成的双相骨软骨一体化支架,由于利用了特殊的制备方法使得双相支架两层间锚定结合相当紧密,然后将其植入兔子膝关节骨软骨造模缺损处,观察52 周后发现缺损区修复再生效果明显。
采用反复冷冻干燥技术与物理化学交联法,制得多层以胶原为基础的骨软骨一体支架,其中骨层由 Col I 与 HA混合而成,钙化层由 Col I、Col II 和 HA 组成,软骨层由 Col I、Col II 和 HyA 构成,并在大动物山羊的膝关节负重区与非负重区修复再生骨软骨缺损取得令人满意的结果[52-54]。有研究用医用级的 PCL 材料通过熔融沉积成型技术(FDM)与电纺丝(ES)技术,制备了孔隙间互相连接,孔隙率为 70% 的双相骨层支架,再将 2% 的 Alg 水凝胶按压在其上方作为软骨层,最后制得一体化的多相骨软骨支架[55-56]。将 Col、HA 与 Mg 材料按不同比例混合制备了三相骨软骨一体化支架,其中软骨层由 100% 的 Col I组成,钙化层由 40% 的 Mg-HA 和 60% 的 Col I 构成,骨层则由 70% 的 Mg-HA 和 30% 的 Col I 构成,其支架已在实验中成功修复绵羊膝关节的骨软骨缺损,且相关产品已获欧盟临床认证并在 145 例的临床试验中取得很好的再生修复效果[57-58]。上述实验结果证明组织工程骨软骨一体化仿生支架具有较高的临床试验研究价值,其在骨软骨缺损修复再生领域有巨大的应用前景。
4 总结与展望
骨软骨缺损是近年来临床广泛可见且较为严重的骨关节疾病,有效的修复与再生骨软骨缺损一直是组织工程领域迫切需要解决的临床科学难题。本文系统综述了目前传统的骨软骨缺损治疗手段所面临的问题及组织工程骨软骨一体化仿生支架的研究现状。组织工程骨软骨一体化支架不仅在结构上仿生正常的骨软骨结构,同时在成分上也仿生天然的骨软骨成分,达到结构与成分的双重仿生,最终实现有效地修复与再生骨软骨缺损。但是,由于正常骨软骨的解剖结构与成分含量相当复杂,同时在其修复与再生过程中,再生区时间与空间上发生的动态变化,使得骨软骨缺损区的修复再生不仅仅是简单的新生组织的“填充”,而是需要既可再生支持透明软骨的软骨下骨,又可再生与骨紧密结合的透明关节软骨,实现软骨-骨界面一体化的形成及软骨、骨的并发性再生。
组织工程骨软骨一体化支架虽然较好地解决了目前传统治疗手段中存在的一些问题,但也有其相应的不足之处。如尚未进行较为深入的骨软骨一体化支架修复再生的机制性研究,无法从更为微观的细胞分子水平阐明缺损区的修复再生机制。并且虽然骨软骨一体化支架进行了结构与成分的双重仿生,但其无论在生物学水平还是力学水平,都无法与正常骨软骨结构相比,也无法找到类似天然骨软骨结构的特殊材料。另外,钙化层与潮线在骨软骨结构中发挥着重要作用,而一体化仿生支架尚难完全对其进行仿生,因此,目前还未能较好地解决软骨层钙化问题与双相、多相支架的两层间易分离的问题。尽管如此,相信组织工程骨软骨一体化仿生支架能够通过利用新的制备技术与方法,如 3D 打印技术与静电纺丝技术,发现或合成新的支架材料,同时结合多学科、多领域进行医工合作,综合利用材料学、生物结构学、生物力学等专业,最终解决骨软骨缺损这一临床科学难题。
[1]Madry H, van Dijk CN, Mueller-Gerbl M.The basic science of the subchondral bone.Knee Surg Sports Traumatol Arthrosc, 2010, 18(4):419-433.
[2]Vinatier C, Bouffi C, Merceron C, et al.Cartilage tissue engineering:towards a biomaterial-assisted mesenchymal stem cell therapy.Curr Stem Cell Res Ther, 2009, 4(4):318-329.
[3]Camarero-Espinosa S, Cooper-White J.Tailoring biomaterial scaffolds for osteochondral repair.Int J Pharm, 2017, 523(2):476-489.
[4]Duraine G, Hu J, Athanasoiu K.Bioengineering in the oral cavity:insights from articular cartilage tissue engineering.Int J Oral Maxillofac Implants, 2011, 26 Suppl:11-19; discussion 20-24.
[5]Grogan SP, Miyaki S, Asahara H, et al.Mesenchymal progenitor cell markers in human articular cartilage: normal distribution and changes in osteoarthritis.Arthritis Res Ther, 2009, 11(3):R85.
[6]Boushell MK, Hung CT, Hunziker EB, et al.Current strategies for integrative cartilage repair.Connect Tissue Res, 2016, 6:1-14.
[7]Kuyinu EL, Narayanan G, Nair LS, et al.Animal models of osteoarthritis: classification, update, and measurement of outcomes.J Orthop Surg Res, 2016, 11:19.
[8]Fujioka R, Aoyama T, Takakuwa T.The layered structure of the articular surface.Osteoarthritis Cartilage, 2013, 21(8):1092-1098.
[9]Hunziker EB, Michel M, Studer D.Ultrastructure of adult human articular cartilage matrix after cryotechnical processing.Microsc Res Tech, 1997, 37(4):271-284.
[10]Hoemann CD, Lafantaisie-Favreau CH, Lascau-Coman V, et al.The cartilage-bone interface.J Knee Surg, 2012, 25(2):85-97.
[11]Schinagl RM, Gurskis D, Chen AC, et al.Depth-dependent confined compression modulus of full-thickness bovine articular cartilage.J Orthop Res, 1997, 15(4):499-506.
[12]Mente PL, Lewis JL.Elastic modulus of calcified cartilage is an order of magnitude less than that of subchondral bone.J Orthop Res, 1994,12(5):637-647.
[13]Blumer MJ, Longato S, Fritsch H.Structure, formation and role of cartilage canals in the developing bone.Ann Anat, 2008, 190(4):305-315.
[14]Youn I, Choi JB, Cao L, et al.Zonal variations in the three-dimensional morphology of the chondron measured in situ using confocal microscopy.Osteoarthritis Cartilage, 2006, 14(9):889-897.
[15]Bowland P, Ingham E, Jennings L, et al.Review of the biomechanics and biotribology of osteochondral grafts used for surgical interventions in the knee.Proc Inst Mech Eng H, 2015, 229(12):879-888.
[16]Mithoefer K, McAdams T, Williams RJ, et al.Clinical efficacy of the microfracture technique for articular cartilage repair in the knee: an evidence-based systematic analysis.Am J Sports Med, 2009, 37(10):2053-2063.
[17]Hangody L, Vásárhelyi G, Hangody LR, et al.Autologous osteochondral grafting--technique and long-term results.Injury, 2008,39 Suppl 1:S32-S39.
[18]Whiteside RA, Jakob RP, Wyss UP, et al.Impact loading of articular cartilage during transplantation of osteochondral autograft.J Bone Joint Surg Br, 2005, 87(9):1285-1291.
[19]Gomoll AH, Filardo G, Almqvist FK, et al.Surgical treatment for early osteoarthritis.Part II: allografts and concurrent procedures.Knee Surg Sports Traumatol Arthrosc, 2012, 20(3):468-486.
[20]Kang RW, Friel NA, Williams JM, et al.Effect of impaction sequence on osteochondral graft damage: the role of repeated and varying loads.Am J Sports Med, 2010, 38(1):105-113.
[21]Gikas PD, Aston WJ, Briggs TW.Autologous chondrocyte implantation: where do we stand now? J Orthop Sci, 2008, 13(3):283-292.
[22]Filardo G, Kon E, Di Martino A, et al.Arthroscopic second-generation autologous chondrocyte implantation: a prospective 7-year follow-up study.Am J Sports Med, 2011, 39(10):2153-2160.
[23]Yousefi AM, Hoque ME, Prasad RG, et al.Current strategies in multiphasic scaffold design for osteochondral tissue engineering: A review.J Biomed Mater Res A, 2015, 103(7):2460-2481.
[24]Galperin A, Oldinski RA, Florczyk SJ, et al.Integrated bi-layered scaffold for osteochondral tissue engineering.Adv Healthc Mater,2013, 2(6):872-883.
[25]Sosio C, Di Giancamillo A, Deponti D, et al.Osteochondral repair by a novel interconnecting collagen-hydroxyapatite substitute: a large-animal study.Tissue Eng Part A, 2015, 21(3-4):704-715.
[26]Huang H, Zhang X, Hu X, et al.A functional biphasic biomaterial homing mesenchymal stem cells for in vivo cartilage regeneration.Biomaterials, 2014, 35(36):9608-9619.
[27]Niederauer GG, Slivka MA, Leatherbury NC, et al.Evaluation of multiphase implants for repair of focal osteochondral defects in goats.Biomaterials, 2000, 21(24):2561-2574.
[28]Izadifar Z, Chen X, Kulyk W.Strategic design and fabrication of engineered scaffolds for articular cartilage repair.J Funct Biomater,2012, 3(4):799-838.
[29]Gillette BM, Rossen NS, Das N, et al.Engineering extracellular matrix structure in 3D multiphase tissues.Biomaterials, 2011,32(32):8067-8076.
[30]Shimomura K, Moriguchi Y, Murawski CD, et al.Osteochondral tissue engineering with biphasic scaffold: current strategies and techniques.Tissue Eng Part B Rev, 2014, 20(5):468-476.
[31]Jeon JE, Vaquette C, Klein TJ, et al.Perspectives in multiphasic osteochondral tissue engineering.Anat Rec (Hoboken), 2014, 297(1):26-35.
[32]Panseri S, Russo A, Cunha C, et al.Osteochondral tissue engineering approaches for articular cartilage and subchondral bone regeneration.Knee Surg Sports Traumatol Arthrosc, 2012, 20(6):1182-1191.
[33]O'Shea TM, Miao X.Bilayered scaffolds for osteochondral tissue engineering.Tissue Eng Part B Rev, 2008, 14(4):447-464.
[34]Bentley G, Bhamra JS, Gikas PD, et al.Repair of osteochondral defects in joints--how to achieve success.Injury, 2013, 44 Suppl 1:S3-S10.
[35]Mano JF, Reis RL.Osteochondral defects: present situation and tissue engineering approaches.J Tissue Eng Regen Med, 2007, 1(4):261-273.
[36]Petrenko YA, Ivanov RV, Petrenko AY, et al.Coupling of gelatin to inner surfaces of pore walls in spongy alginate-based scaffolds facilitates the adhesion, growth and differentiation of human bone marrow mesenchymal stromal cells.J Mater Sci Mater Med, 2011,22(6):1529-1540.
[37]Xia Z, Yu X, Jiang X, et al.Fabrication and characterization of biomimetic collagen-apatite scaffolds with tunable structures for bone tissue engineering.Acta Biomater, 2013, 9(7):7308-7319.
[38]Liu X, Holzwarth JM, Ma PX.Functionalized synthetic biodegradable polymer scaffolds for tissue engineering.Macromol Biosci, 2012,12(7):911-919.
[39]Ngiam M, Liao S, Patil AJ, et al.The fabrication of nano-hydroxyapatite on PLGA and PLGA/collagen nanofibrous composite scaffolds and their effects in osteoblastic behavior for bone tissue engineering.Bone, 2009, 45(1):4-16.
[40]Hench LL.The story of Bioglass.J Mater Sci Mater Med, 2006,17(11):967-978.
[41]Minton J, Janney C, Akbarzadeh R, et al.Solvent-free polymer/bioceramic scaffolds for bone tissue engineering: fabrication,analysis, and cell growth.J Biomater Sci Polym Ed, 2014, 25(16):1856-1874.
[42]Yang Q, Peng J, Guo Q, et al.A cartilage ECM-derived 3-D porous acellular matrix scaffold for in vivo cartilage tissue engineering with PKH26-labeled chondrogenic bone marrow-derived mesenchymal stem cells.Biomaterials, 2008, 29(15):2378-2387.
[43]Galois L, Freyria AM, Grossin L, et al.Cartilage repair: surgical techniques and tissue engineering using polysaccharide- and collagen-based biomaterials.Biorheology, 2004, 41(3-4):433-443.
[44]Harley BA, Lynn AK, Wissner-Gross Z, et al.Design of a multiphase osteochondral scaffold.II.Fabrication of a mineralized collagenglycosaminoglycan scaffold.J Biomed Mater Res A, 2010, 92(3):1066-1077.
[45]Shafiee A, Soleimani M, Chamheidari GA, et al.Electrospun nanofiber-based regeneration of cartilage enhanced by mesenchymal stem cells.J Biomed Mater Res A, 2011, 99(3):467-478.
[46]Lee M, Wu BM.Recent advances in 3D printing of tissue engineering scaffolds.Methods Mol Biol, 2012, 868:257-267.
[47]Wang Y, Meng H, Yuan X, et al.Fabrication and in vitro evaluation of an articular cartilage extracellular matrix-hydroxyapatite bilayered scaffold with low permeability for interface tissue engineering.Biomed Eng Online, 2014, 13:80.
[48]Vindas Bolaños RA, Cokelaere SM, Estrada McDermott JM, et al.The use of a cartilage decellularized matrix scaffold for the repair of osteochondral defects: the importance of long-term studies in a large animal model.Osteoarthritis Cartilage, 2017, 25(3):413-420.
[49]Su JY, Chen SH, Chen YP, et al.Evaluation of magnetic nanoparticle-labeled chondrocytes cultivated on a type II collagenchitosan/poly(lactic-co-glycolic) acid biphasic scaffold.Int J Mol Sci,2017, 18(1).pii:E87.
[50]Harley BA, Lynn AK, Wissner-Gross Z, et al.Design of a multiphase osteochondral scaffold III: Fabrication of layered scaffolds with continuous interfaces.J Biomed Mater Res A, 2010, 92(3):1078-1093.
[51]Zhang W, Lian Q, Li D, et al.Cartilage repair and subchondral bone migration using 3D printing osteochondral composites: a one-year-period study in rabbit trochlea.Biomed Res Int, 2014,2014:746138.
[52]Levingstone TJ, Matsiko A, Dickson GR, et al.A biomimetic multi-layered collagen-based scaffold for osteochondral repair.Acta Biomater, 2014, 10(5):1996-2004.
[53]Levingstone TJ, Thompson E, Matsiko A, et al.Multi-layered collagen-based scaffolds for osteochondral defect repair in rabbits.Acta Biomater, 2016, 32:149-160.
[54]Levingstone TJ, Ramesh A, Brady RT, et al.Cell-free multi-layered collagen-based scaffolds demonstrate layer specific regeneration of functional osteochondral tissue in caprine joints.Biomaterials, 2016,87:69-81.
[55]Garg T, Goyal AK.Biomaterial-based scaffolds--current status and future directions.Expert Opin Drug Deliv, 2014, 11(5):767-789.
[56]Jeon JE, Vaquette C, Theodoropoulos C, et al.Multiphasic construct studied in an ectopic osteochondral defect model.J R Soc Interface,2014, 11(95):20140184.
[57]Tampieri A, Sandri M, Landi E, et al.Design of graded biomimetic osteochondral composite scaffolds.Biomaterials, 2008, 29(26):3539-3546.
[58]Kon E, Filardo G, Delcogliano M, et al.Platelet autologous growth factors decrease the osteochondral regeneration capability of a collagen-hydroxyapatite scaffold in a sheep model.BMC Musculoskelet Disord, 2010, 11:220.
科技部印发《“十三五”健康产业科技创新专项规划》
按照《中华人民共和国国民经济和社会发展第十三个五年规划纲要》、《“十三五”国家科技创新规划》、《“健康中国2030”规划纲要》等的总体部署,为加快推进健康产业科技发展,打造经济发展新动能,促进未来经济增长,引领健康服务模式变革,支撑健康中国建设,特制定《“十三五”健康产业科技创新专项规划》。详情请登录国家科学技术部网站http://www.most.gov.cn/mostinfo/xinxifenlei/fgzc/gfxwj/gfxwj2017/201706/t20170614_133528.htm 查阅。
科技部印发《生物技术研究开发安全管理办法》
为规范生物技术研究开发活动,促进和保障生物技术研究开发活动健康有序发展,有效维护国家生物安全,科技部制定了《生物技术研究开发安全管理办法》。详情请登录国家科学技术部网站 http://www.most.gov.cn/mostinfo/xinxifenlei/fgzc/gfxwj/gfxwj2017/201707/t20170725_134231.htm 查阅。
10.3969/j.issn.1673-713X.2017.04.010
国家自然科学基金(81472092);国家重点研发计划(2017YFC1104100);北京市科技专项(Z161100005016059)
100853 北京,中国人民解放军总医院骨科研究所/骨科再生医学北京市重点实验室/全军骨科战创伤重点实验室(张学亮、刘舒云、郭维民、张雨、陈明学、荆晓光、张增增、张彬、沈师、李建伟、郭全义);030012 太原,山西省中医药研究院(张学亮、李建伟)
郭全义,Email:doctorguo_301@163.com;李建伟,Email:519951700@qq.com
2017-03-29

