荧光定量法测定DNA熔解温度
陈翔,张佳琦,汪泽,许旭,朱滨
荧光定量法测定DNA熔解温度
陈翔,张佳琦,汪泽,许旭,朱滨
DNA 熔解温度(Tm)指 DNA 双链变性过程中一半双链解离为单链的温度[1],是 DNA 片段的一个重要特性。准确测定 DNA 片段 Tm值,是分子生物学实验方法(如PCR 检测技术、核酸杂交检测技术等)建立的基础,在疾病的分子诊断领域具有重要现实意义[2-4]。影响 DNA 片段Tm值的因素有很多,如 DNA 片段的长度、DNA 片段的GC% 含量[5]、盐离子浓度、pH 等[6]。传统测定 DNA 片段 Tm值的方法多用紫外分光光度法[7-9],该方法有一定的局限性,溶液需要量大,操作起来不方便。利用荧光试剂(如 SYBR Green I)与双链 DNA 结合后荧光大大增强的特点,采用荧光定量法可以较好解决这些问题。用荧光定量法测定 DNA 样品在含有 SYBR Green I 溶液中的熔解曲线,根据其导数曲线熔解峰对应的温度可以确定 DNA 样品的 Tm值。荧光定量 PCR 仪溶液需求量小,不需太多操作,能很好地控制反应的温度,进行实时自动化检测[10-11]。本文用荧光定量法测定不同大小、不同 GC% 含量 DNA片段的 Tm值并研究了其影响因素,显示该法可用于实际样品测定。
1 材料与方法
1.1 仪器与试剂
FQD-48A 型荧光定量 PCR仪、TC-XP-D 型 XP 基因扩增仪、HB-100 型恒温金属浴为杭州博日科技有限公司产品;Cary 100 型紫外可见分光光度计为美国安捷伦科技有限公司产品;OD-1000+ 超微量分光光度计为南京五义科技有限公司产品。
SYBR Green I(10 000 ×)购自厦门致善生物科技股份有限公司;lambda DNA、DMSO、Tris 盐酸盐、Tris 碱均为生工生物工程(上海)股份有限公司产品;K2HPO4·3H2O、KH2PO4均为国产分析纯试剂。
1.2 方法
1.2.1 不同大小、不同 GC% 含量 DNA 片段的制备 大片段 DNA 的 GC% 含量大多没有显著差异,选择商业化lambda DNA 产品。150~300 bp 的不同 GC% 含量 DNA片段的制备是选择人基因组中不同 GC% 含量的基因(TPMT、CY、APOE),采用体外扩增并纯化。25 bp 的不同 GC% 含量 DNA 片段(Oligo A、Oligo B、Oligo C)委托生工生物工程(上海)股份有限公司合成并纯化。不同GC% 含量的 DNA 序列见表 1。
1.2.2 溶液的配制
⑴荧光染色剂稀释液:规格为 10 000 × 的 SYBR Green I 溶液用 DMSO 稀释 10 000 倍,备用。

表1 不同 GC% 含量的 DNA 序列
⑵磷酸盐缓冲液:称取 K2HPO4·3H2O 和 KH2PO4,分别配制成 50 mmol/L 的溶液,两种磷酸盐溶液调节 pH 至7.4 左右,备用。
⑶Tris 盐缓冲液:称取 Tris 盐酸盐和 Tris 碱,分别配制成 400 mmol/L 的溶液,两种 Tris 溶液调节 pH 至7.4 左右,备用。
1.2.3 荧光测定 DNA 片段 Tm取荧光染色剂稀释液1 μl、磷酸盐溶液 4 μl(终浓度5 mmol/L)、Tris 盐溶液 6 μl(终浓度 60 mmol/L),加入适量 DNA 溶液(使定量后DNA 终浓度为 10 ng/μl),用超纯水定量至 40 μl。配制好的溶液放入荧光定量 PCR 仪中,设置程序为:30 ℃、30 s,65 个循环,每个循环增加 1 ℃。测定 DNA 片段的熔解曲线,得到熔解导数曲线,取熔解导数曲线的峰对应的温度为Tm值。
1.2.4 紫外测定 DNA 片段 Tm磷酸盐溶液(终浓度5 mmol/L)、Tris 盐溶液(终浓度 60 mmol/L),加入适量DNA 溶液(使定量后 DNA 终浓度为 10 ng/μl)。紫外分光光度计设置固定吸收波长 260 nm,升温速率 1 ℃/min,升温范围 30~95 ℃。得到 DNA片段随温度升高的紫外吸收曲线,取紫外吸收过渡曲线的中点对应的温度为 Tm值。
2 结果
2.1 不同 DNA 片段的 Tm值
不同大小、不同 GC% 含量 DNA 片段的 Tm值见表 2。本实验条件下,荧光法可测定不同 GC% 含量各种大小 DNA 片段的 Tm值,仅在寡核苷酸小片段的 GC%含量过高时(Tm大于 90 ℃,接近水的沸点),荧光定量法与紫外法一样均难以准确测定,而紫外法在测定小片段DNA 的 Tm值时还需要显著提高 DNA 浓度。荧光法与紫外法测定值基本一致,CY 片段荧光熔解曲线如图 1 所示,荧光熔解导数曲线图如图 2 所示。
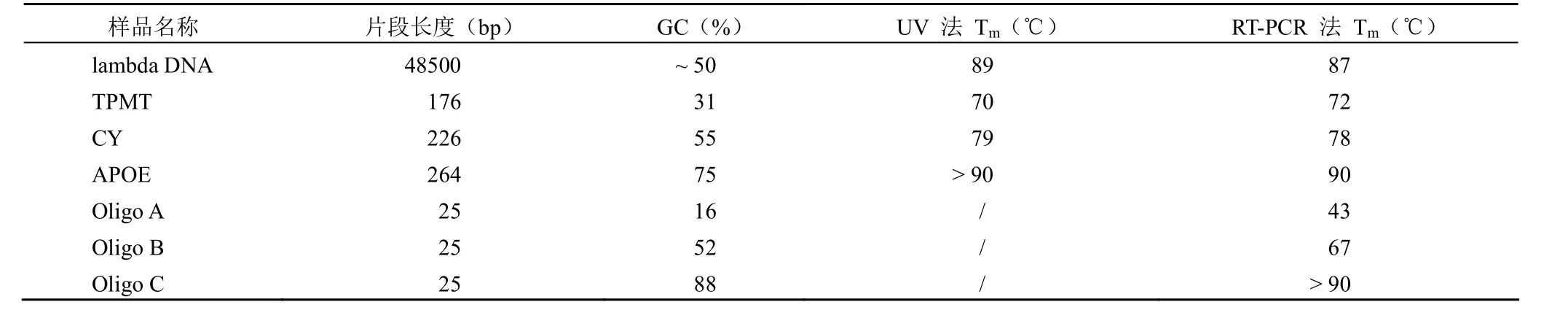
表2 不同 DNA 片段的熔解温度(Tm)值
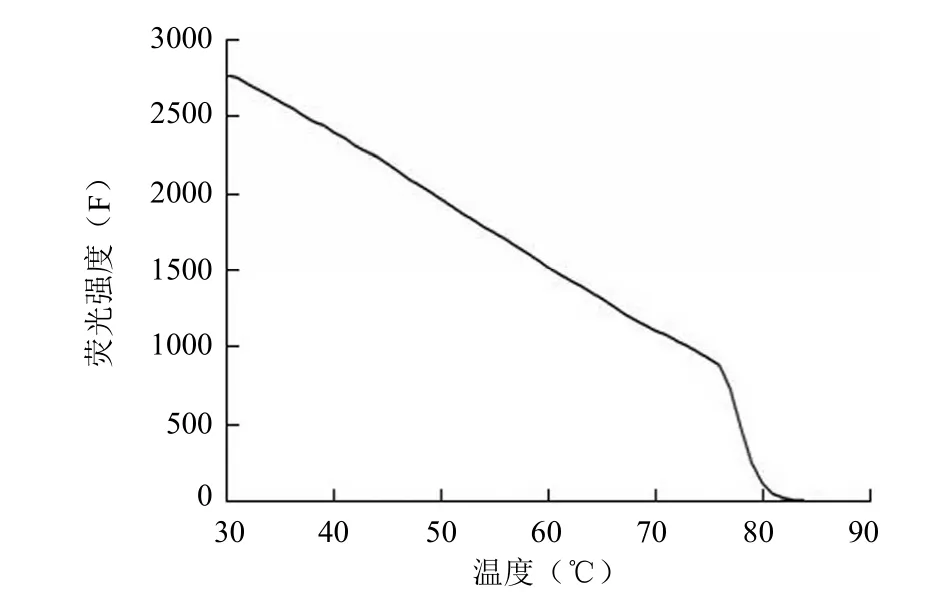
图1 CY 片段荧光熔解曲线
2.2 荧光定量法测定 Tm值时荧光染料与 DNA 的浓度配比
实验表明,对于不同大小、不同 GC% 含量的 DNA 片段,用荧光定量法测定 Tm值时,SYBR Green I 适宜的终浓度为 0.025 ×。在上述荧光染料浓度条件下,DNA 片段的适宜终浓度取决于 DNA 片段的大小,片段越小,终浓度越大。在本文建立的实验条件下,大片段 DNA(kb 级)适宜终浓度不低于 5 ng/μl,中等大小 DNA(数百 bp)适宜终浓度不低于 10 ng/μl,小片段(数十 bp)适宜终浓度不低于 20 ng/μl。同等大小的 DNA 片段,GC% 含量越高,适宜浓度也越高。例如,TPMT 片段浓度低至 1 ng/μl 时,可见明显荧光导数曲线峰,而 APOE 片段浓度为 5 ng/μl时,荧光导数曲线峰才可见。
用荧光定量法测定 DNA 片段的 Tm值时,DNA 浓度、SYBR Green I 染料量均不宜过高,否则荧光导数曲线图会出现异常峰(馒头峰或双峰),给 Tm值的确定带来困难。这可能是 DNA 解链会引起荧光信号变化产生,而解链后的 DNA 自身折叠形成局部双链(高浓度时更明显)解链也会引起荧光信号的变化,各因素叠加后使峰形复杂。
2.3 缓冲体系对测定的影响
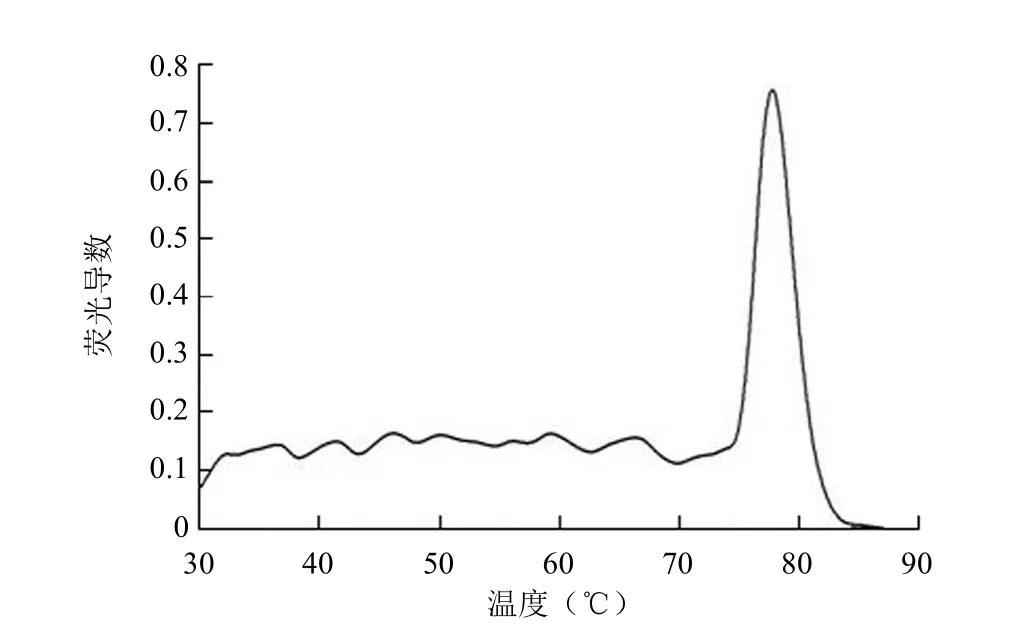
图2 CY 片段荧光熔解导数曲线
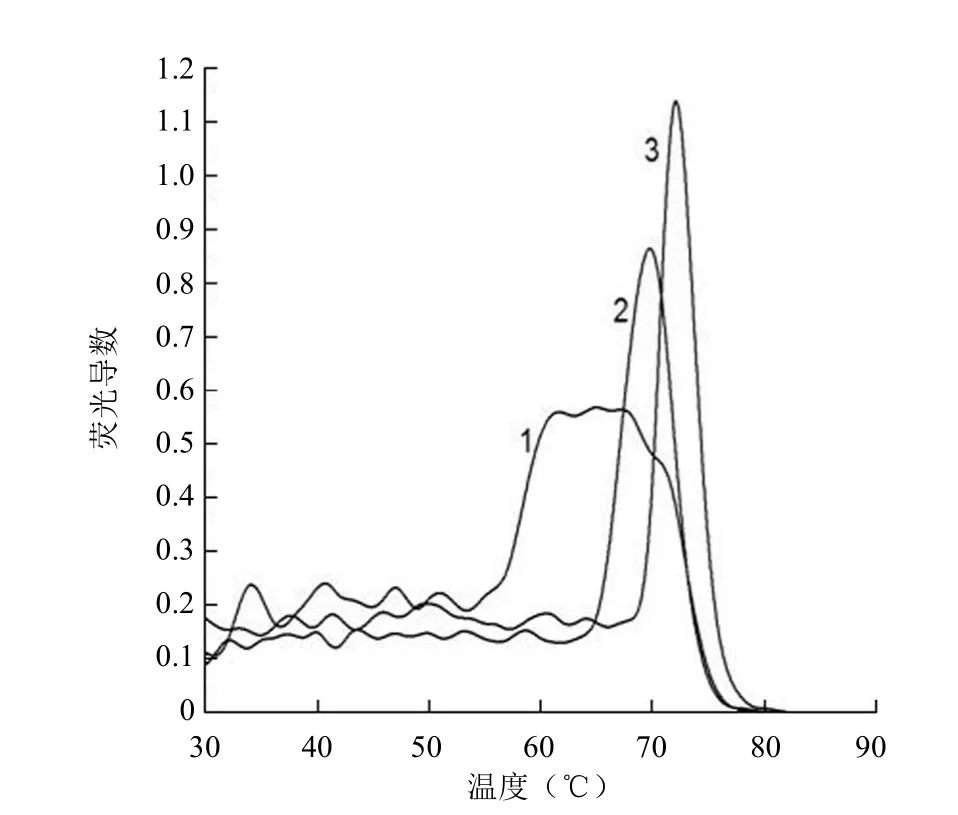
图3 TPMT 片段荧光熔解导数曲线(1:Tris 盐浓度5 mmol/L;2:Tris 盐浓度 30 mmol/L;3:Tris 盐浓度60 mmol/L)
盐浓度的变化会对 DNA 片段 Tm值产生显著影响。通常采用磷酸盐缓冲体系,以保持测定过程中盐浓度、pH的稳定。荧光导数图的峰形会受缓冲体系的影响,在缓冲体系中增加 Tris 盐浓度会明显改善低 GC% 含量 DNA 片段荧光导数曲线峰形(图 3),对 Tm值略有提高,影响不大。DNA 片段 GC% 含量越高,上述改善越不明显,但会明显提高 Tm值。
3 讨论
荧光定量 PCR 仪由于样品量小(微升级)、温控准确、功能强大、自动化程度高迅速在临床及科研领域得到普及。除了聚合酶链反应等常规用途,用于 DNA 片段 Tm值研究与传统的紫外分光光度法相比,优势明显。
紫外分光光度法测定 DNA 熔解曲线原理是单链DNA 的吸光度大于双链,根据吸光度的变化来确定 DNA熔解曲线,实际操作中,影响因素较多。DNA 溶液若不纯,其紫外吸收曲线会出现不利于判定 Tm值的情况。紫外法测定互补寡核苷酸小片段,寡核苷酸小片段原本即为两条单链,有一定的吸光度,浓度过低,熔解曲线会呈现一条逐渐升高的直线,无法判定 Tm值。
荧光定量法测定 DNA 的 Tm值是基于特殊的荧光染料分子(EB、SYBR Green I、吖啶橙等),这些染料分子可以插入双链 DNA 分子中,插入前后荧光染料分子的荧光强度有数十倍的差异。同样插入双链 DNA 中的荧光染料分子的荧光强度随 DNA 分子的解链也会产生显著变化。DNA 溶液纯度和片段大小对该法影响较小。荧光染料的用量以产生适宜的荧光强度变化为宜。目前已有专门用于此的商业试剂盒可供选择。
采用荧光定量法测定 DNA 片段 Tm值,荧光染料与DNA 的浓度配比非常重要。由于荧光染料分子插入 DNA片段后复合物本身的荧光强度会随着温度升高而下降,配比不合适会掩盖 DNA 解链引起的荧光强度下降。也因为该原因,用荧光导数图将更直观、更准确。
[1]Zhang YC, Qu WB, Lu YM, et al.A comparison of different melting temperature (Tm) prediction methods for DNAg.Milit Med Sci, 2011,35(3):231-235.(in Chinese)
张艳春, 屈武斌, 卢一鸣, 等.DNA解链温度(Tm)不同预测方法的比较.军事医学, 2011, 35(3):231-235.
[2]Steger G.Thermal denaturation of double-stranded nucleic acid:prediction of temperatures critical for gradient gel electrophoresis and polymerase chain reaction.Nucleic Acids Res, 1994, 22(14):2760-2768.
[3]Gao L, Pan SY, Chen D, et al.Investigation of methylation patterns of APC gene in lung cancer with a novel fluorescence melting curve analysis assay.J Mod Lab Med, 2012, 27(1):19-23, 27.(in Chinese)
高丽, 潘世扬, 陈丹, 等.熔解曲线法用于肺癌APC基因甲基化模式的研究.现代检验医学杂志, 2012, 27(1):19-23, 27.
[4]Li YL, Song WG, Niu ZX, et al.Extraction and determination of the G+ C mol % of DNA of pseudomonas aeruginosa.J Taishan Med Coll,2003, 24(2):109-110.(in Chinese)
李雅林, 宋文刚, 牛种相, 等.绿脓杆菌基因组DNA G+C mol%含量的测定.泰山医学院学报, 2003, 24(2):109-110.
[5]Breslauer KJ, Frank R, Blöcker H, et al.Predicting DNA duplex stability from the base sequence.Proc Natl Acad Sci U S A, 1986,83(11):3746-3750.
[6]Li JS, Zhang Q, Zhou SH.Prediction of melting temperature of DNA duplex by least squares support vector machine.Comput Eng Appl,2009, 45(5):55-58.(in Chinese)
李金松, 张强, 周士华.双链 DNA解链温度的最小二乘支持向量机预测方法.计算机工程与应用, 2009, 45(5):55-58.
[7]Rees WA, Yager TD, Korte J, et al.Betaine can eliminate the base pair composition dependence of DNA melting.Biochemistry, 1993, 32(1):137-144.
[8]Lin QY, Hu RD, Zheng XH.Studies on the interaction of metalic complex and DNA by the spectral methods.Spectroscopy Spectral Anal, 2004, 24(8):988-990.(in Chinese)
林秋月, 胡瑞定, 郑孝华.铜(II)配合物与DNA作用的光谱法研究.光谱学与光谱分析, 2004, 24(8):988-990.
[9]Wu RG, Wei ZW, Chen L, et al.The effects of divalent metal ions on the thermal stability of salmon sperm DNA.Chem J Chin Univ, 2002,23(12):2366-2368.(in Chinese)
邬瑞光, 尉志武, 陈琳, 等.二价金属离子对鲑鱼精 DNA 热稳定性的影响.高等学校化学学报, 2002, 23(12):2366-2368.
[10]Zhu YZ, Yin JD, Li DF, et al.Quantitative PCR method for detecting glyphosate- tolerant gene transfer in soybeans.J China Agric Univ,2005, 10(3):25-29.(in Chinese)
朱元招, 尹靖东, 李德发, 等.抗草甘膦转基因大豆PCR定量检测研究.中国农业大学学报, 2005, 10(3):25-29.
[11]Ding MY, Qi WQ, Chen ZY, et al.Detection of novel duck reovirus using SYBR Green II fluorescent quantitative PCR assay.Chin J Vet Parasitol, 2016, 24(1):7-14.(in Chinese)
丁明洋, 戚伟强, 陈宗艳, 等.一种新型鸭呼肠孤病毒 SYBR Green II荧光定量PCR方法的建立.中国动物传染病学报, 2016,24(1):7-14.
10.3969/j.issn.1673-713X.2017.04.014
上海张江国家自主创新示范区专项发展资金重点项目(201609-XH-CHJ-C1085-003)
201418 上海应用技术大学化学与环境工程学院(陈翔、许旭);200233 上海百傲科技股份有限公司(张佳琦、汪泽、朱滨)
朱滨,Email:zhubin@baio.com
2017-05-01

