TaqMan-MGB荧光探针法检测北京地区幽门螺杆菌gyrA基因第87位密码子和第91位密码子耐药突变
沈维祥,胡泽斌,陈春峰,张小燕,成虹,郜恒骏
TaqMan-MGB荧光探针法检测北京地区幽门螺杆菌gyrA基因第87位密码子和第91位密码子耐药突变
沈维祥*,胡泽斌*,陈春峰,张小燕,成虹,郜恒骏
目的采用 TaqMan-MGB 荧光探针法检测北京地区幽门螺杆菌喹诺酮类耐药位点 gyrA 基因第 87 位密码子和第91 位密码子突变情况,比较与药敏试验和一代测序法的一致性。
方法收集北京大学第一医院消化内科门诊尿素酶试验阳性的患者 252 例,所有患者均使用 MGB 荧光探针法和一代测序法对喹诺酮类耐药位点 gyrA 基因第 87 位密码子和第 91 位密码子进行检测。其中 158 例患者同时进行药敏试验检测,同时分析耐药位点突变发生率与耐药表型的关系。
结果158 例传统培养联合药敏法检测的标本中成功培养出 85 例,占 53.8%,其中耐药型菌株 40 例,敏感型菌株42 例。而 MGB 荧光探针法成功检出 155 例,占 98.1%,其中野生型 93 例,突变型 62 例。在药敏试验检测出的85 例阳性标本中,两种方法检出的符合率为 94.1%。252 例标本中,一代测序法成功检测出 234 例,占 92.9%,其中野生型 160 例,突变型 74 例。在 74 例突变型标本中,含 gyrA 基因第 87 位密码子突变的标本占 60.8%,含 gyrA 基因第 91 位密码子突变的标本占 39.2%。MGB荧光探针法成功检测出 250 例,占 99.2%,其中野生型161 例,突变型 89 例。在 89 例突变组标本中,含 gyrA 基因第 87 位密码子突变的标本占 64.0%,含 gyrA 基因第91 位密码子突变的标本占 36.0%。一代测序法和 MGB 荧光探针法在区分是否含有突变上的符合率为 95.3%。
结论TaqMan-MGB 荧光探针法可快速、敏感地检测患者胃黏膜标本中幽门螺杆菌喹诺酮类耐药位点 gyrA 基因第87 位密码子和第 91 位密码子的突变情况,与药敏试验和一代测序法有较高的符合性。
幽门螺杆菌; MGB 荧光探针; 喹诺酮类耐药
www.cmbp.net.cn 中国医药生物技术, 2017, 12(4):325-329
喹诺酮类是近几年应用于临床清除幽门螺杆菌的药物,Maastricht IV 共识建议在克拉霉素高耐药地区,含铋剂的四联疗法失败后可以使用含左氧氟沙星的三联方案[1-2]。中国共识也建议可以将喹诺酮类抗生素用于幽门螺杆菌感染的治疗[3]。但值得注意的是,有些地区喹诺酮类药物的滥用容易导致幽门螺杆菌对该类药物产生耐药性。另一方面,传统的幽门螺杆菌临床检验方法由于条件要求苛刻,耗时较长,不能够满足临床检验的需求[4-5]。因此,方便快速地检测幽门螺杆菌对喹诺酮类耐药情况成为临床亟待解决的问题。本文应用基于TaqMan-MGB 荧光探针的实时荧光 PCR 法(简称MGB 荧光探针法)检测幽门螺杆菌喹诺酮类耐药位点 gyrA 基因第 87 位密码子和第 91 位密码子的突变情况,并与药敏试验和一代测序法进行比较,现报道如下。
1 材料与方法
1.1 材料
1.1.1 研究对象 选取 2013年 7月至 2015年7月就诊于北京大学第一医院消化内科,胃组织活检显示尿素酶试验为阳性的患者 252 例,所有患者均签署知情同意书且在 1 个月内未服用任何抗幽门螺杆菌治疗药物。胃黏膜标本于 1 ml 的脑心浸出液液体培养基中,–80 ℃ 保存备用。
1.1.2 仪器与试剂 QIAamp DNA mini kit 和BigDye®terminator v3.1 cycle sequencing kit 购自德国 Qiagen 公司;PrimeSTAR®HS(Premix)购自Takara 公司;快速尿素酶检测试剂盒购自福建贝真生物公司;脑心浸液肉汤/干粉购自上海研生实业公司;哥伦比亚琼脂培养基购自美国 BD 公司;M-H血琼脂平板购自英国 Oxoid 公司;微需氧袋及E-test 药敏试条购自法国生物梅里埃公司;NanoDrop 2000 超微量生物检测仪、ABI 7500 实时荧光 PCR 仪、3730 基因分析仪和 MGB 荧光探针及合成引物购自美国 ThermoFisher 公司;台式低温离心机购自德国 Sigma 公司;Taq 酶、dNTPs 等购自大连宝生物工程有限公司。
1.1.3 标准菌株H.pyloriNCTC11637 来自英国伦敦国家标准培养物收藏中心,保存于北京大学第一医院消化实验室。
1.2 方法
1.2.1 幽门螺杆菌 DNA 提取 以 QIAamp DNA mini kit 抽提 252 例胃黏膜组织的幽门螺杆菌基因组 DNA。
1.2.2 MGB 荧光探针法检测 设计合成 gyrA基因第 87 位密码子和第 91 位密码子相应的野生型和突变型 MGB 探针,并采用 HPLC 纯化方式进行制备。所用 MGB 探针序列如表 1 所示。
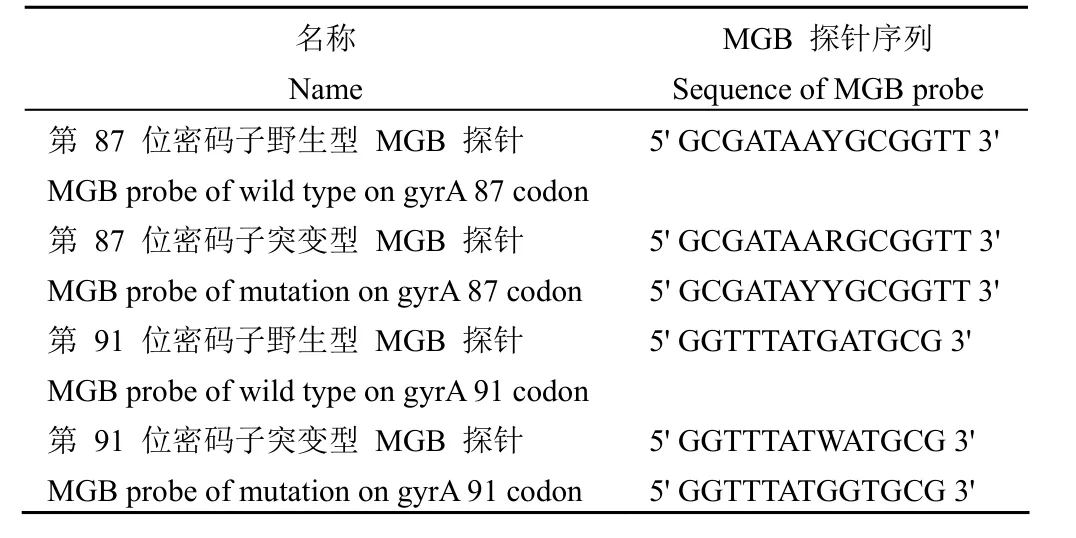
表1 MGB 探针序列信息Table 1 Sequence information of MGB probe
PCR 体系含 10 × PCR buffer、2 mmol/L MgCl2、0.2 mmol/L dNTPs、2 U Taq 酶、0.3 μmol/L上游引物和 0.03 μmol/L 下游引物。将上述组分混匀后,分别加入 0.1 μmol/L gyrA 基因第 87 位密码子和第 91 位密码子相应的野生型和突变型MGB 探针。每小管最终体积 25 μl,使得每条MGB 探针分别对 4 种基因型进行 PCR 扩增与结果分析。反应条件:94 ℃ 预变性 5 min;94 ℃ 变性 15 s,62 ℃ 延伸 30 s,扩增 40 个循环;在每一循环的退火温度时收集荧光信号。
1.2.3 一代测序验证 为验证 MGB 荧光 PCR检测结果的准确性,gyrA 基因第 87 位密码子和第 91 位密码子均经表 2 中的测序引物扩增后进行双向测序。首先采用 PrimeSTAR®HS(Premix)进行 PCR 扩增。反应体系:PrimeSTAR®HS(Premix)20 μl,测序引物 F 10 pmol,测序引物 R 10 pmol,DNA 模板 100 ng,总体积 50 μl。反应条件:94 ℃ 预变性 15 s;98 ℃ 变性 10 s,55 ℃延伸 15 s,72 ℃ 延伸 1 min,扩增 30 个循环。之后使用 QIAquick PCR purification kit 纯化 PCR产物,再使用 BigDye®terminator v3.1 cycle sequencing kit 和 3730 基因分析仪,测序引物进行双向测序。同时使用幽门螺杆菌标准菌株作为阳性质控对照进行测序试验。
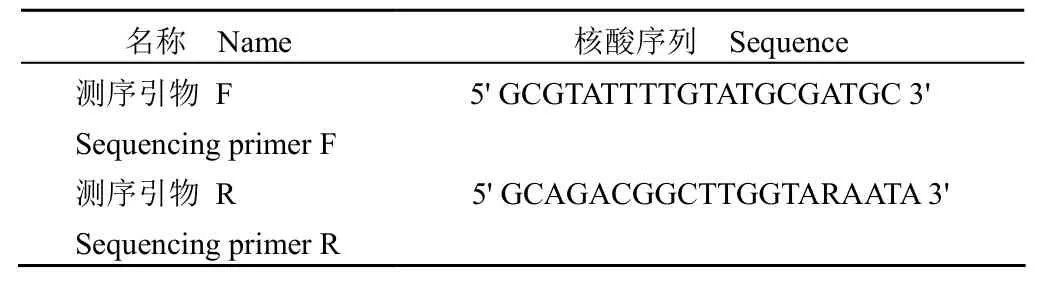
表2 一代测序法所用测序引物序列信息Table 2 Sequence information of sequencing primers
1.2.4 细菌培养与药敏试验 对符合入选标准的患者,在内镜下距幽门 5 cm 的大弯或小弯处,额外钳取 1 块或 2 块胃黏膜组织置于脑心浸液肉汤中保存,取材后 4 h 内接种于哥伦比亚琼脂培养基并放入微需氧袋中,置 37 ℃ 培养 3~21 d。挑取培养基上的无色透明菌落,依据全国临床检验操作规程(第 3 版)进行鉴定。药敏试验采用 E-test试验检测 MIC 值确定幽门螺杆菌菌株对左氧氟沙星的耐药性。收集哥伦比亚琼脂培养基上新鲜培养的幽门螺杆菌菌落,调整浓度至 3 × 108cfu/ml,接种于 9 cm 平板琼脂培养基上,L 棒均匀涂开,晾干后放置一条含药液的 E-test 试纸条,试纸条标有 MIC,刻度面朝上,浓度最大端靠近平板边缘。37 ℃、微需氧条件下培养 72 h 后读取结果。幽门螺杆菌对左氧氟沙星耐药的判断标准为 MIC 值> 1 μg/ml[6-7]。
1.3 统计学处理
两种方法的比较采用四格表分析和配对卡方检验。P< 0.05 表示两种方法的差异有统计学意义。
2 结果
2.1 MGB 荧光探针法检测结果与药敏试验的结果比较
158 例尿素酶试验阳性患者的胃黏膜标本应用药敏试验培养出 85 例,培养阳性率为 53.8%(85/158),其中耐药型菌株 40 例,敏感型菌株45 例。MGB 荧光探针法成功检测出 155 例,占98.1%(155/158),其中野生型 93 例,突变型62 例,3 例未见扩增信号。在药敏试验培养出的85 例标本中,两种方法检测符合率为 94.1%(80/85)。其中,药敏试验检测为敏感的 45 例标本中,有 5 例 MGB 荧光探针法检测出突变位点;药敏试验检测为耐药的 40 例标本中均检测出突变位点,见表 3。
2.2 MGB 荧光探针法检测结果与一代测序法的结果比较
252 例胃黏膜标本中一代测序法成功检测出234 例,占 92.9%(234/252),18 例未见信号。该18 例胃黏膜标本经过测序法重复检测,仍未出现信号,表明尿素酶试验可能存在一定的假阳性情况。
234 例成功检测出的标本中包括野生型(即不包含 gyrA 第 87 位密码子或第 91 位密码子突变)160 例,占 68.4%(160/234);突变型(即包含 gyrA 第 87 位密码子或第 91 位密码子突变)74 例,占 31.6%(74/234)。在 74 例突变型标本中,含 gyrA 第 87 位密码子突变的标本占 60.8%(45/74),含 gyrA 第 91 位密码子突变的标本占39.2%(29/74)。
252 例胃黏膜标本中 MGB 荧光探针法成功检测出 250 例,占 99.2%(250/252),2 例未见信号。250例成功检测出标本中包括野生型 161 例,占 64.4%(161/250),突变型 89 例,占 35.6%(89/250)。在 89 例突变组标本中,含 gyrA 第87 位密码子突变的标本占 64.0%(57/89),含 gyrA第 91 位密码子突变的标本占 36.0%(32/89)。在两种方法均成功检测出的 234 例标本中,符合率为 95.3%(223/234),见表 4。
3 讨论
幽门螺杆菌对喹诺酮类的耐药主要与 gyrA基因中的喹诺酮类药物耐药决定区(QRDR)发生点突变有关,在喹诺酮耐药菌株中也有学者检测到gyrB 基因突变,但往往与 gyrA 基因突变同时出现[8-9]。因此,本研究主要检测 gyrA 基因的突变情况,同时将耐药突变位点的检测集中在该基因第87 位密码子位点突变(Asn 突变为 Lys 和 Ile)和第 91 位密码子位点突变(Asp 突变为 Gly、Asn和 Tyr)。MGB 荧光探针法是基于 PCR 反应过程的动态检测方法,已有相关报道将该方法应用于幽门螺杆菌其他耐药位点的突变检测[10]。
由于患者意愿的原因,在本次研究中同时进行MGB 荧光探针法与药敏试验检测的只有 158 例。药敏试验检测结果为敏感型的 45 例标本中,MGB荧光探针法检测 40 例为野生型,3 例为 gyrA基因第 87 位密码子突变,2 例为 gyrA 基因第91 位密码子突变。造成个别标本检测结果不一致的原因可能是 gyrA 基因发生突变与喹诺酮类耐药不存在必然关系,某些菌株虽然发生了 gyrA 基因突变,但是菌株药敏表型仍为敏感。在上述不一致的 5 例患者中有 4 例成功进行了随访,之后检测均显示传统方法为敏感型,同时这 5 位患者均应用了包含左氧氟沙星的三联方案进行治疗,且均根除失败。进一步说明 MGB 荧光探针法在检测幽门螺杆菌喹诺酮类耐药菌株混合感染时要优于传统方法。
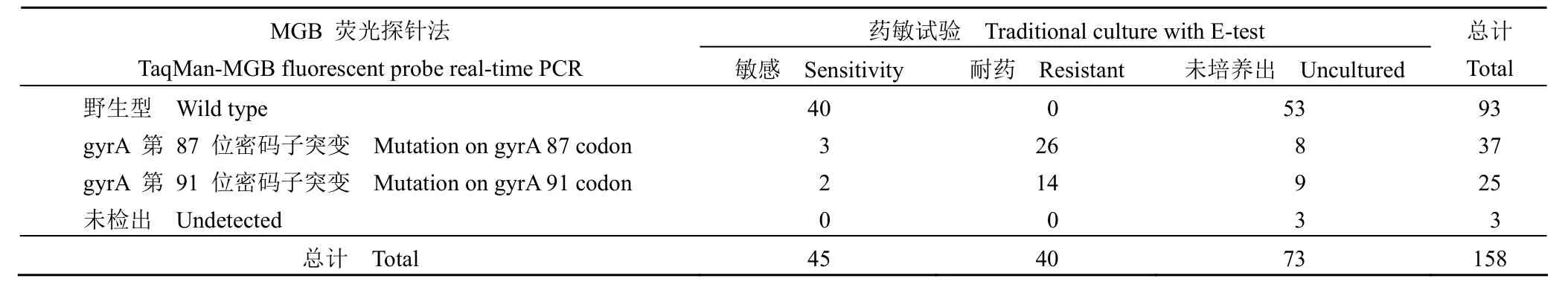
表3 MGB 荧光探针法与药敏试验的比较Table 3 Results of both traditional culture with E-test and TaqMan-MGB fluorescent probe real-time PCR
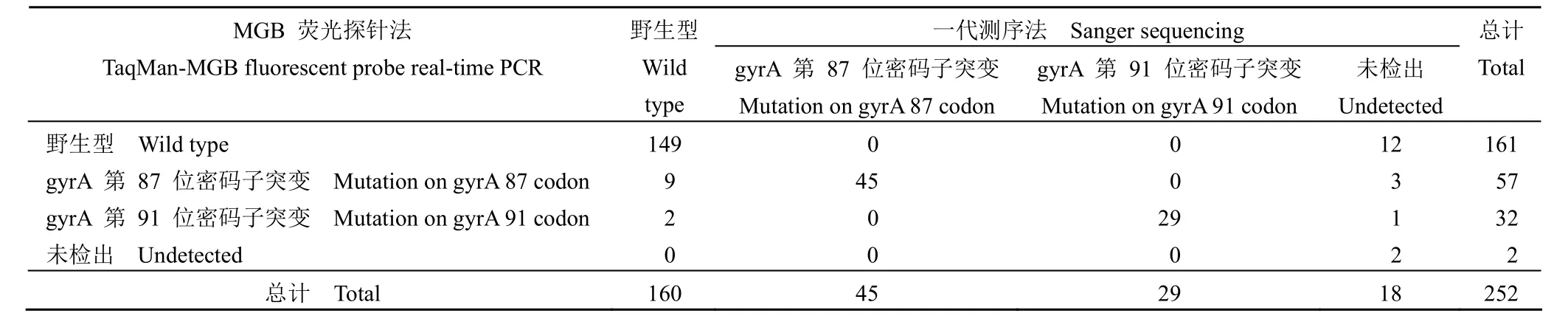
表4 MGB 荧光探针法与一代测序法的结果比较Table 4 Results of both TaqMan-MGB fluorescent probe real-time PCR and Sanger sequencing
在本研究中,MGB 荧光探针法和一代测序法同时成功检出的标本共 234 例,2 种方法检测结果完全一致的共 223 例,不一致共 11 例,不一致主要集中在一代测序法检测为野生型而 MGB荧光探针法检测为 gyrA 基因第 87 位密码子突变的 9 例,检测为 gyrA 基因第 91 位密码子突变的 2 例。造成这种不一致的原因可能为 MGB荧光探针法的灵敏度远高于一代测序法。另一方面,18 例使用一代测序法无法检出的标本中,MGB荧光探针法可检出 12 例野生型,4 例突变型。因此,采用 MGB 荧光探针法可以检出标本中含量更低的野生或突变菌。这两种方法的符合率为95.3%,表明 MGB 荧光探针法可以应用于临床上幽门螺杆菌喹诺酮类耐药位点的快速检测。
综上所述,本文应用 MGB 荧光探针法检测幽门螺杆菌 gyrA 基因第 87 位密码子和第 91 位密码子的突变,操作简便,敏感性高,与药敏试验和一代测序法的一致性较好,为幽门螺杆菌喹诺酮类耐药位点的快速检测提供了应用思路。
[1]Sasaki M, Ogasawara N, Utsumi K, et al.Changes in 12-year first-line eradication rate of Helicobacter pylori based on triple therapy with proton pump inhibitor, Amoxicillin and Clarithromycin.J Clin Biochem Nutr, 2010, 47(1):53-58.
[2]Malfertheiner P, Megraud F, O'Morain CA, et al.Management of Helicobacter pylori infection--the Maastricht IV/ Florence Consensus Report.Gut, 2012, 61(5):646-664.
[3]Liu WZ, Xie Y, Cheng H, et al.Report on the fourth national consensus on Helicobacter pylori infection.Chin J Gastroenterol,2012, 17(10):618-625.(in Chinese)
刘文忠, 谢勇, 成虹, 等.第四次全国幽门螺杆菌感染处理共识报告.胃肠病学, 2012, 17(10):618-625.
[4]Gao ZQ, Yue BF, He ZM.Detection of Helicobacter pylori by real -time fluorescence quantitative PCR with TaqMan MGB probe.Chin J Clin Lab Sci, 2012, 30(7):500-502.(in Chinese)
高正琴, 岳秉飞, 贺争鸣.TaqMan MGB探针实时荧光定量PCR法检测幽门螺杆菌.临床检验杂志, 2012, 30(7):500-502.
[5]Wang JT, Liu YL.The quadruple regimen including Nexium and furazolidone on a choice to treat helicobacter pylori eradication failure.Chin J Gastroenterol Hepatol, 2006, 15(5):519-521.(in Chinese)
王晶桐, 刘玉兰.以耐信、呋喃唑酮为核心的四联疗法治疗一线、二线根治失败的幽门螺杆菌感染.胃肠病学和肝病学杂志, 2006,15(5):519-521.
[6]Liou JM, Lin JT, Chang CY, et al.Levofloxacin-based and clarithromycin-based triple therapies as first-line and second-line treatments for Helicobacter pylori infection: a randomised comparative trial with crossover design.Gut, 2010, 59(5):572-578.
[7]Cianci R, Montalto M, Pandolfi F, et al.Third-line rescue therapy for Helicobacter pylori infection.World J Gastroenterol, 2006, 12(15):2313-2319.
[8]Miyachi H, Miki I, Aoyama N, et al.Primary levofloxacin resistance and gyrA/B mutations among Helicobacter pylori in Japan.Helicobacter, 2006, 11(4):243-249.
[9]Wang LH, Cheng H, Hu FL, et al.Distribution of gyrA mutations in fluoroquinolone-resistant Helicobacter pylori strains.World J Gastroenterol, 2010, 16(18):2272-2277.
[10]Xian HP, Sun YJ, Liu C, et al.Employment of TaqMan MGB fluorescent probe real-time PCR in detecting current resistant mutation of H.pylori A2142G/A2143G in Beijing area.Chin J Clin Lab Sci, 2016, 34(6):401-406.(in Chinese)
线海鹏, 孙宇晶, 刘畅, 等.用TaqMan-MGB荧光探针法检测北京地区幽门螺杆菌A2142G/A2143G耐药突变.临床检验杂志, 2016,34(6):401-406.
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(4):325-329
科技部发布2016年生物和医学领域国家重点实验室评估结果
根据《国家重点实验室建设与运行管理办法》和《国家重点实验室评估规则》,2016年,科技部委托中国生物技术发展中心会同中国科协生命科学学会联合体,对生物和医学领域共 75 个国家重点实验室进行了独立评估。根据评估情况,经科技部部务会会议审定,评估结果予以发布。
详情请登录国家科学技术部网站 http://www.most.gov.cn/mostinfo/xinxifenlei/fgzc/gfxwj/gfxwj2017/201706/t20170629_13 3829.htm 查阅。
Employment of TaqMan-MGB fluorescent probe real-time PCR for detection of the quinolones resistant mutations of Helicobacter pylori in Beijing area
SHEN Wei-xiang, HU Ze-bin, CHEN Chun-feng, ZHANG Xiao-yan, CHENG Hong, GAO Heng-jun
ObjectiveTo use the method based on TaqMan-MGB fluorescent probe real-time PCR for detection of the prevalence of primary quinolones-resistance and the distribution involvedHelicobacter pylorimutations in Beijing area.
MethodsA total of 252Helicobacter pylori-positive patients undergoing gastroscope in the First Hospital of Beijing University was enrolled.Helicobacter pyloriinfection was identified by histology and rapid urease test.The quinolones resistant status ofgastric mucosa tissues from 158 patients was detected by traditional culture with E-test, TaqMan-MGB fluorescent probe real-time PCR and Sanger sequencing.The detection for the rest of 94 patients was performed by only TaqMan-MGB fluorescent probe real-time PCR and Sanger sequencing.
ResultsAmong the 158 cases using both traditional culture with E-test and TaqMan-MGB fluorescent probe real-time PCR, 53.8%and 98.1% ofHelicobacter pyloripositive cases were detected by traditional assay and TaqMan-MGB method, respectively.Total of 94.1% consistency were showed in both assays in 85 positive case with traditional culture.In the 252 cases, 99.2% and 92.9%Helicobacter pyloripositive cases was detected using TaqMan-MGB fluorescent probe real-time PCR and Sanger sequencing,respectively.Coincidence rate of 95.3% was found in both assays to distinguish mutations.For the 234 positive cases tested by Sanger sequencing, the mutations were detected in 74 cases (including 60.8% mutations with gyrA 87 codon or 39.2% mutations with gyrA 91 codon), while wild type was detected in 160 cases.For the 250 positive cases tested by TaqMan-MGB fluorescent probe real-time PCR, mutations were detected in 89 cases (including 64.0% mutations with gyrA 87 codon or 36.0% mutations with gyrA 91 codon), while wild type (without gyrA 87 codon mutation or gyrA 91 codon mutation) was detectable in 161 cases.
ConclusionThe method based on TaqMan-MGB fluorescent probe real-time PCR could be applied for rapid and sensitive clinical detection of quinolones resistance toHelicobacter pylori.
Helicobacter pylori; TaqMan-MGB probe; Quinolones resistance
s:CHENG Hong, Email: chenghong1969@163.com; GAO Heng-jun, Email: xiaoyan_zhang@shbiochip.com
10.3969/j.issn.1673-713X.2017.04.006
2015年浦东新区科技发展基金(PKJ2015-S26)
201203 上海,生物芯片上海国家工程研究中心(沈维祥、陈春峰、张小燕、郜恒骏);100050 北京,中国食品药品检定研究院体外诊断试剂检定所(胡泽斌);200438 上海,复旦大学生命科学学院(张小燕);100034 北京大学第一医院消化内科(成虹);200092 上海,同济大学医学院消化疾病研究所(郜恒骏)
成虹,Email:chenghong1969@163.com;郜恒骏,Email:xiaoyan_zhang@shbiochip.com
2017-03-14
*同为第一作者
Author Affiliations:National Engineering Center for Biochip, Shanghai 201203, China (SHEN Wei-xiang, CHEN Chun-feng,ZHANG Xiao-yan, GAO Heng-jun); Institute for in Vitro Diagnostic Reagents of National Institutes for Food and Drug Control,Beijing 100050, China (HU Ze-bin); School of Life Sciences, Fudan University, Shanghai 200438, China (ZHANG Xiao-yan);Department of Gastroenterology, the First Hospital of Beijing University, Beijing 100034, China (CHENG Hong); Institute of Digestive Diseases, Tongji University School of Medicine, Shanghai 200092, China (GAO Heng-jun)

