JNK1基因在金鱼性腺不同发育时期的表达分析
邹立军, 黄 文, 庄远红, 廖海艳, 吉 璐
(湖南第一师范学院 基础生物学实验室, 长沙 410205)
JNK1基因在金鱼性腺不同发育时期的表达分析
邹立军, 黄 文, 庄远红, 廖海艳, 吉 璐
(湖南第一师范学院 基础生物学实验室, 长沙 410205)

请扫二维码,关注本文及作者更多信息
为探明JNK1(c-JunN-terminalkinase1)在鱼类性腺发育过程中的相关性,以模式动物金鱼为实验对象,采用实时荧光定量PCR(qPCR)和蛋白免疫印迹(Western blotting)技术检测JNK1基因及其蛋白在金鱼精巢和卵巢不同发育时期的表达水平。结果表明:金鱼雄鱼和雌鱼的性腺指数(GSI)显示性腺在发育过程中呈明显的季节变化规律,其中在性腺成熟期GSI最高(P<0.05)。qPCR检测结果显示JNK1在卵巢发育时期的表达量表现为先升高后降低的趋势,其在卵巢成熟期的表达量最高(P<0.05),为成熟前期、退化吸收期和修整恢复期表达量的4.0、1.4和2.1倍;JNK1在精巢不同发育时期的表达量总体呈现出微量变化的趋势;在精巢成熟前期表达最低,成熟期、退化吸收期和修整恢复期表达量较成熟期有微量升高,且精巢发育全过程中的表达变化均无显著性差异。Western blotting检测结果显示其蛋白水平表达模式与mRNA的表达水平吻合。研究表明,JNK1在一定程度上与鱼类卵巢发育相关,可能在促进卵细胞的成熟方面具有重要作用。
金鱼;JNK1;性腺发育;性腺指数
JNKs(c-Jun N-terminal kinases)蛋白激酶是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族中的成员,属于进化上保守的Serine/Threonine蛋白激酶[1-2]。它包含了双磷酸化功能区Thr-Pro-Tyr,与c-Jun N端的活化区结合并使其第63、73位丝氨酸残基磷酸化[3-4]。JNKs由JNK1、JNK2和JNK3 3个基因编码,它们可选择性地拼接成10种JNK的亚型,都能编码46 ku和55 ku的蛋白产物[5-6]。JNK1和JNK2在体内的各种组织中广泛表达,而JNK3基因的表达形式具有组织特异性,通常只在大脑、心脏和睾丸中表达,且三者作用也不尽相同[7]。研究发现,细胞因子TNF-α和IL-1、生长因子EGF、放射线、热休克、渗透压及蛋白合成抑制剂等外界条件均能通过不同的信号通路激活JNK,进而参与调控多种生理病理过程,如细胞增殖、分化、迁移、凋亡、自噬和应激反应等[8-13]。
金鱼(Carassiusauratus),隶属于鲤形目(Cypriniformes),鲤科(Cyprinidae),鲫属(Carassius)。由于具备养殖方便,体外受精,胚胎发育速度快等方面的优势, 已被广泛用作模式动物[14],但迄今为止,关于JNK1在鱼类发育中的研究还很有限。本实验室通过分子克隆技术获得了JNK1全长并发现其在金鱼的性腺中表达存在性别二态性,即卵巢的表达量要显著高于精巢[15]。为了探索JNK1与鱼类性腺发育周期的相关性,本研究检测并分析了JNK1在金鱼性腺不同发育时期的mRNA和蛋白表达模式,以期找出不同时期的表达差异,为进一步研究JNKs 家族在鱼类性腺分化与发育中的功能提供基础依据。
1 材料与方法
1.1 材料
1.1.1 实验材料
用于本实验的金鱼购自长沙市花鸟市场,雌雄均为40尾,1~2年龄,其中雌鱼体长9.9~15.1 cm,体重96.3~107.2 g;雄鱼体长9.7~14.5 cm,体重85.4~96.4 g。水温控制在25℃~28℃左右,每天定时(早晚各1次)投喂固体饵料,流水充氧,满足自然光照。
1.1.2 实验样品采集
于2015年3月至2016年2月分别按月份采集样本,在性腺成熟期(3月—5月)、性腺退化吸收期(6月—8月)、性腺修整恢复期(9月—11月)和性腺成熟前期(12月至翌年2月)4个时期各取健康雌、雄金鱼各10尾,测量金鱼的主要生物学指标并迅速解剖其性腺,生物学指标包括体长(Body length, BL),体重(Body weight, BW),性腺重(Gonad weight, GW),去内脏重(Visceral weight, VW)后得净重(BW-VW);计算性腺成熟系数(GSI)=[GW/(BW-VW)]×100。将卵巢、精巢两种组织用液氮速冻后置于-80℃冰箱保存。
1.1.3 主要仪器和试剂
NanoDrop 2000核酸蛋白测定仪(Thermo Scientific);Centrifuge 5904R 离心机(Eppendorf);MyCy-clerTM Thermal Cycler PCR 仪(BioRad);凝胶电泳槽(北京六一);GDS7500 凝胶成像系统(UVP);ABI 7500 HT platform实时定量PCR仪(Applied Biosystems);蛋白电泳Mini-PROTEAN Tetra系统(BioRad);Primer 5.0引物设计软件;Gel-Pro图像分析软件和SPSS 19.0软件。
总RNA提取TRIzol Reagent (Invitrogen-Life Technologies);反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser,DNA Ladder和SYBR Premix ExTaqTM(TaKaRa);蛋白酶抑制剂Cocktail,Protein Ladder和NBT/BICP 显色剂 (Thermo Scientific);JNK1抗体,β-actin抗体和IgG-AP二抗(Santa Cruz);RIPA裂解液和BCA蛋白浓度测定试剂盒(碧云天)。
1.1.4 引物的设计与合成
根据GenBank 中金鱼的JNK1和β-actin基因序列,在各自的编码区序列(CDS)设计特异引物。引物由上海生工生物工程有限公司合成;引物序列及产物大小见表1。

表 1 本研究所用到引物
1.2 方法
1.2.1 总RNA提取及cDNA 第一条链合成
将得到的性腺样本参照Trizol Reagent说明书提取总RNA,将总RNA沉淀溶解于DEPC水中。用1% 琼脂糖凝胶电泳验证RNA片段的完整性。分光光度计测定RNA的浓度及纯度,且保证D260 nm/D280 nm值在1.8~2.0之间。取1 μg总RNA样品进行反转录合成cDNA第一链,产物保存于-20℃冰箱。
1.2.2 实时荧光定量PCR(Quantitative Real-time PCR)
采用Quantitative Real-time PCR(qPCR)检测JNK1(β-actin作内参) 在金鱼性腺发育过程中的mRNA表达水平。反应条件为50℃预变性2 min;95℃变性10 min,95℃退火15 s,60℃延伸45 s,40 个循环。熔解曲线程序:95℃,60 s;60℃,60 s,从60℃开始上升至95℃获得熔解曲线。根据不同样本的扩增曲线,确定扩增循环数(Ct值),参照Livak等[16]提出的相对标准曲线法2(-ΔΔCt),对相对定量的结果进行分析,得到性腺不同发育时期JNK1 mRNA的相对表达量图谱。为确保qPCR反应的准确性和可重复性,每个样品均重复测定3次。
1.2.3 蛋白免疫印迹(Western blotting)
取金鱼不同发育时期性腺组织用少量液氮研磨至粉末状,再加入含蛋白酶抑制剂Cocktail的RIPA裂解液,12 000 r/min 4℃离心20 min,取上清, 取4 μL用BCA法测定总蛋白浓度,其余分装保存于-80℃。采用Western blotting标准步骤[17]进行操作。一抗稀释浓度分别为:兔抗JNK1抗体(1∶1000),鼠抗β-actin抗体(1∶2000)。二抗稀释浓度为:抗兔或抗鼠IgG-AP(1∶30 000)。显影结果通过Gel-Pro软件分析计算JNK1/β-actin的灰度值, 最终得到JNK1 蛋白丰度的相对表达图。
1.2.4 数据处理
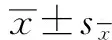
2 结果
2.1 性腺成熟系数的周年变化
数据统计结果显示雌鱼和雄鱼的性腺成熟系数(GSI)变化趋势基本一致,且性腺发育不同时期的GSI呈现出明显的季节变化规律,但是卵巢GSI均值要显著高于精巢。如图1所示,GSI 在性腺成熟期(3月—5月)数值最高,此时卵巢发育至Ⅳ期或Ⅴ期,雌鱼的GSI高达20.2348±3.0160;随后进入卵巢退化吸收期(6月—8月),此时GSI 均值显著降低(P<0.05),至休整恢复期(9月—11月)降到最低(P<0.05),卵巢成熟前期GSI显著增加(P<0.05)。金鱼精巢GSI值较低;虽然在性腺成熟期(3月—5月)出现高峰,但值仅为7.0751±1.7332;此时的精巢一般处于Ⅴ期,繁殖结束后进入精巢退化吸收期,此时GSI显著降低(P<0.05),随后的修整恢复期GSI水平较退化期无显著性差异,进入精巢成熟前期GSI又显著升高(P<0.05)。
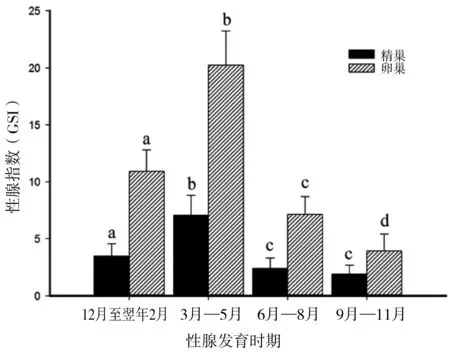
图1 金鱼雄鱼和雌鱼性腺成熟系数(GSI)的周年变化Fig 1 Profiles of gonadosomatic index (GSI) in male and famale goldfish
数据均表示为平均数±标准差(n=10),图中标有不同的字母表示存在显著性差异(P<0.05);下同
2.2JNK1 mRNA在金鱼性腺发育不同时期的表达水平
通过分析熔解曲线(图2)来判断引物的特异性,横坐标代表反应温度,纵坐标代表反应过程中生成的产物量。如图2 所示,金鱼JNK1和β-actin引物熔解曲线分别在78.89℃和82.42℃时表现为特异性单峰,表明没有引物二聚体的产生,产物为目的产物,因此引物适用于本次实验。
JNK1在卵巢不同发育时期的表达量表现为先升高后降低的趋势(图3)。在性腺成熟前期(12月至翌年2月)JNK1表达最低,随后进入繁殖期,卵巢发育成熟(3月—5月),JNK1的相对表达量显著升高(P<0.05)且达到峰值,为3.985±0.380,进入卵巢退化吸收期(6月—8月)后JNK1表达显著降低(P<0.05)到2.856±0.426,到卵巢修整恢复期(9月—11月)JNK1表达进一步降低(P<0.05)为1.901±0.101,最后逐渐恢复到性腺成熟前期水平。
JNK1在精巢发育不同时期的表达量总体呈现出微量变化的趋势(图3);在精巢成熟前期(12月至翌年2月)JNK1表达最低,在精巢成熟期(3月—5月)表达量微量升高,为1.3363±0.2343;随后精巢进入退化吸收期(6月—8月)和修整恢复期(9月—11月),而这期间JNK1的表达量无明显变化,分别为1.2103±0.1239和1.2345±0.1997;最后逐渐恢复到精巢成熟前期水平;JNK1在精巢发育全过程中的表达变化均无显著性差异。

图2 引物熔解曲线
A:JNK1引物熔解曲线; B:β-actin引物熔解曲线
2.3 JNK1蛋白在金鱼不同性腺发育时期的表达水平
通过Western blotting技术检测了JNK1 蛋白在金鱼性腺发育周年的表达模式,结果显示JNK1蛋白在雌性金鱼卵巢不同发育时期表现出较大的波动(图4-A),Gel-Pro软件分析显示其表达的总体趋势与mRNA的表达模式吻合(图4-C),即卵巢成熟前期表达量最低,到达卵巢成熟期JNK1蛋白表达量升到较高水平(P<0.05),随着进入卵巢退化吸收期和修整恢复期,JNK1蛋白表达逐渐降低。
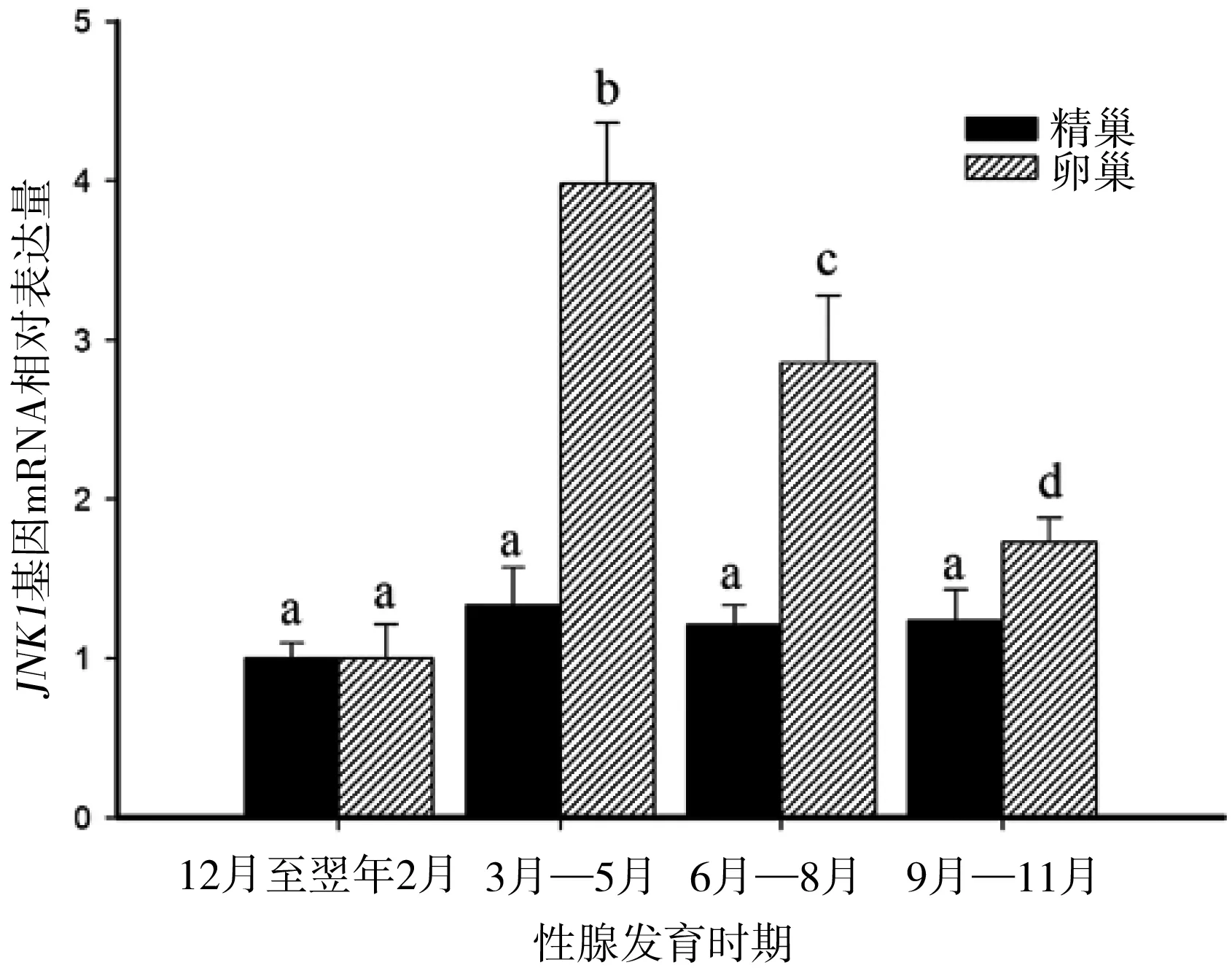
图3 JNK1在金鱼性腺不同发育时期的表达水平
注:数据均表示为平均数±标准差(n=6),图中标有不同的字母表示存在显著性差异(P<0.05)
JNK1蛋白在精巢在发育过程中的总体表达量较低(图4-B),其中在精巢成熟前期(12月至翌年2月)表达量最低,在进入成熟期后(3月—5月)微量升高,随后在精巢退化吸收期和修整恢复期的表达量均维持在较低水平;且JNK1蛋白表达水平在精巢各发育过程中无显著性差异(图4-C)。
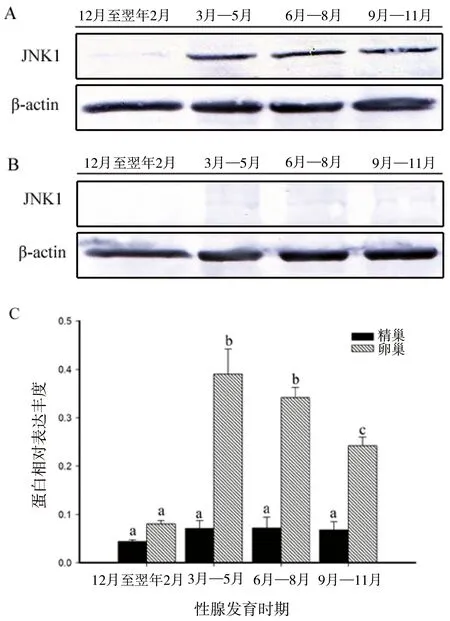
图4 JNK1在金鱼卵巢(A)和精巢(B)不同发育时期的蛋白表达水平以及蛋白丰度柱形图(C)Fig 4 Protein expression level of JNK1 in different developmental phases of ovary (A) and testis (B) in goldfish and protein abundance column chart (C)
3 讨论
JNK 信号通路是真核细胞中高度保守的一条重要信号通路。研究证实,JNK信号通过蛋白激酶间的酶促磷酸化级联反应参与了生物体组织器官的分化及发育调控[18-19]。通常情况下,JNK的活性是由其磷酸化水平决定的;因此,外源信号主要按照MAPK kinase kinase(MAPKKK)-MAPK kinase(MAPKK)-JNK的方式进行调控和传递[20]。一系列研究表明,JNK在细胞凋亡过程中扮演了重要角色。在海鞘(Ascidian) 蝌蚪幼体的尾巴退化时伴随了细胞凋亡的发生,研究发现JNK信号的激活是引起尾部细胞发生凋亡的重要因素;随后用JNK活性抑制剂SP600125处理早期蝌蚪幼体,发现其尾部细胞凋亡受到严重抑制,从而阻碍尾部退化及变态过程[21]。在Kuan等[22]的研究中,条件性敲除JNK1或JNK2的小鼠均可以正常存活,但是同时敲除JNK1和JNK2 的小鼠神经管发育出现严重缺陷,脑细胞凋亡速率增加,从而导致其在胚胎期死亡。新近报道了哺乳动物生殖细胞发育调控蛋白SPAG9 (Novel human sperm-associate antigen 9) 在人类的精巢特异性表达,且SPAG9蛋白结构与JNK相互作用蛋白JIP(JNK interacting protein)同源,进一步研究显示SPAG9功能与JNK密切相关,表明JNK可能参与生殖细胞的分化调控[23-24]。随后研究发现JNK信号负调控果蝇性腺的形态结构发育,JNK信号增强导致性腺正常功能出现缺陷[25]。
在对鱼类JNK的研究中,已在黄鳝Monopterusalbus[26],斑马鱼Daniorerio[27],鲤鱼CyprinuscarpioL.[28],金鱼[15]等鱼类中获得JNK1全长并开展了相关研究。Huang等[29]通过显微注射将JNK基因的显性突变体(DNM-JNK)转染至金鱼的受精卵进而抑制JNK活性,结果导致金鱼胚胎死亡率显著增加,同时引起多种器官(眼睛、神经管以及肌肉)出现畸形。Xiao等[26]在黄鳝性逆转研究中亦发现JNK1 在卵巢组织中的表达量要远高于精巢组织中的表达量, 推测JNK1可能在调控黄鳝卵巢组织退化过程中发挥了重要作用。采用SP600125 抑制剂处理斑马鱼早期胚胎,引起JNK 信号下调,除引起部分器官畸形外,还抑制了卵巢分化及性别决定,暗示了JNK信号通路参与了鱼类性腺分化的调节[17, 27]。在非洲爪蟾卵母细胞中激活MEKK1能够诱导JNK异位表达,从而加快减数分裂进程[30]。因此,JNK1可能在调控鱼类性腺分化及发育过程中发挥了重要作用。
已有研究证实,金鱼JNK1在各组织中广泛表达,但是在卵巢中的表达量远高于精巢[15],由此推断,JNK1可能在调控金鱼性腺发育过程中发挥作用。在本研究中,通过qPCR检测发现,JNK1精巢发育各时期的表达量无显著性差异,而在卵巢的发育过程中表达变量较大,且在成熟期的表达量要显著高于其他时期(P<0.05)。进一步检测了JNK1蛋白在性腺发育过程中的表达模式;结果显示JNK1在性腺发育不同时期均有表达,但是在卵巢的表达量要远高于精巢,且在卵巢成熟期的表达量最高(P<0.05)。值得引起我们关注的是,无论是mRNA水平还是蛋白水平的表达,卵巢的表达量都要显著高于精巢,表明JNK1在调控金鱼卵巢发育及卵细胞成熟过程中发挥了重要作用。
综上所述,本研究初步证实JNK1参与了金鱼性腺发育调节,尤其在雌性金鱼卵巢发育及卵细胞成熟过程中可能具有重要的调控作用,这为进一步确定JNK1在鱼类性别决定,性腺分化和发育中的功能提供了新的理论依据。但是对于JNK信号通路在如何调控卵巢发育方面的功能还有待今后进一步研究。
[1]DAVIS R J. Signal transduction by the JNK group of MAP kinases [J]. Cell, 2000, 103(2): 239-252.
[2]CHIMNARONK S, SITTHIROONGRUANG J, SRISUCHARITPANIT K, et al. The crystal structure of JNK fromDrosophilamelanogasterreveals an evolutionarily conserved topology with that of mammalian JNK proteins [J]. BMC Struct Biol, 2015, 15(17):17.
[3]WESTON C R,DAVIS R J. The JNK signal transduction pathway [J]. Curr Opin Cell Biol, 2007, 19(2): 142-149.
[4]PULVERER B J, KYRIAKIS J M, AVRUCH J, et al. Phosphorylation of c-jun mediated by MAP kinases [J]. Nature, 1991, 353(6345): 670-674.
[5]JOHNSON G L, NAKAMURA K. The c-jun kinase/stress-activated pathway: regulation, function and role in human disease [J]. Biochim Biophys Acta, 2007, 1773(8): 1341-1348.
[6]GUPTA S, BARRETT T, WHITMARSH A J, et al. Selective interaction of JNK protein kinase isoforms with transcription factors [J]. EMBO J, 1996, 15(11): 2760-2770.
[7]陈丽莉, 邹立军, 熊 振, 等.jnk3基因在金鱼和斑马鱼不同发育时期胚胎与成体不同组织中的分化表达 [J].水产学报, 2011,35(2): 161-169.
[8]CARGNELLO M, ROUX P P. Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases [J]. Microbiol Mol Biol Rev, 2011, 75(1): 50-83.
[9]DHANASEKARAN D N, REDDY E P. JNK signaling in apoptosis [J]. Oncogene, 2008, 27(48): 6245-6251.
[10]LEE I T, LIN C C, CHENG S E, et al. TNF-alpha induces cytosolic phospholipase A2 expression in human lung epithelial cells via JNK1/2- and p38 MAPK-dependent AP-1 activation [J]. PLoS One, 2013, 8(9): e72783.
[11]BROWN M, STRUDWICK N, SUWARA M, et al. An initial phase of JNK activation inhibits cell death early in the endoplasmic reticulum stress response [J]. J Cell Sci, 2016, 129(12): 2317-2328.
[12]ZHOU Y Y, LI Y, JIANG W Q, et al. MAPK/JNK signalling: a potential autophagy regulation pathway [J]. Biosci Rep, 2015, 35(3): e00199.
[13]YOU H, LEI P, ANDREADIS S T. JNK is a novel regulator of intercellular adhesion [J]. Tissue Barriers, 2013, 1(5): e26845.
[14]KATZENBACK B A, KATAKURA F, BELOSEVIC M. Goldfish (CarassiusauratusL.) as a model system to study the growth factors, receptors and transcription factors that govern myelopoiesis in fish [J]. Dev Comp Immunol, 2016, 58(1): 68-85.
[15]邹立军, 陈丽莉, 龚 婧, 等. 金鱼JNK1基因的克隆及表达研究[J].生命科学研究, 2013, 17(4): 292-297.
[16]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method [J]. Methods, 2001, 25(4): 402-408.
[17]邹立军. JNKs在斑马鱼胚胎发育过程中的分化表达及功能研究[D].长沙:湖南师范大学, 2011.
[18]WESTON C R,DAVIS R J. The JNK signal transduction pathway [J]. Curr Opin Genet Dev, 2002, 12(1): 14-21.
[19]TEJADA-ROMERO B, CARTER J M, MIHAYLOVA Y, et al. JNK signalling is necessary for a Wnt- and stem cell-dependent regeneration programme [J]. Development, 2015, 142(14): 2413-2424.
[20]ROBINSON M J, COBB M H. Mitogen-activated protein kinase pathways [J]. Curr Opin Cell Biol, 1997, 9(2): 180-186.
[21]CHAMBON J P, NAKAYAMA A, TAKAMURA K, et al. ERK- and JNK-signalling regulate gene networks that stimulate metamorphosis and apoptosis in tail tissues of ascidian tadpoles [J]. Development, 2007, 134(6): 1203-1219.
[22]KUAN C Y, YANG D D, SAMANTA ROY D R, et al. The Jnk1 and Jnk2 protein kinases are required for regional specific apoptosis during early brain development [J]. Neuron, 1999, 22(4): 667-676.
[23]JAGADISH N, RANA R, MISHRA D, et al. Sperm associated antigen 9 (SPAG9): a new member of c-Jun NH2 -terminal kinase (JNK) interacting protein exclusively expressed in testis [J]. Keio J Med, 2005, 54(2): 66-71.
[24]JAGADISH N, RANA R, SELVI R, et al. Characterization of a novel human sperm-associated antigen 9 (SPAG9) having structural homology with c-jun N-terminal kinase-interacting protein [J]. Biochem J, 2005, 389(Pt 1): 73-82.
[25]JEMC J C, MILUTINOVICH A B, WEYERS J J, et al. Raw functions through JNK signaling and cadherin-based adhesion to regulateDrosophilagonad morphogenesis [J]. Dev Biol, 2012, 367(2): 114-125.
[26]XIAO Y M, CHEN L, LIU J, et al. Contrast expression patterns of JNK1 during sex reversal of the rice-field eel [J]. J Exp Zool B Mol Dev Evol, 2010, 314(3): 242-256.
[27]XIAO Y, ZHOU Y, XIONG Z, et al. Involvement of JNK in the embryonic development and organogenesis in zebrafish [J]. Mar Biotechnol (NY), 2013, 15(6): 716-725.
[28]XIAO Y M, JIANG M G, LUO Z W, et al. Identification and analysis of the jnk1 gene in polyploid hybrids of red crucian carp (Carassiusauratusred var.) and common carp (CyprinuscarpioL.) [J]. Genet Mol Res, 2014, 13(1): 906-919.
[29]HUANG X Q, HUANG Z X, LI Z L, et al. C-jun terminal kinases play an important role in regulating embryonic survival and eye development in vertebrates [J]. Curr Mol Med, 2013, 13(1): 228-237.
Expression analysis ofJNK1 in different developmental phases of gonad in goldfishCarassiusauratus
ZOU Li-jun, HUANG Wen, ZHUANG Yuan-hong, LIAO Hai-yan, JI Lu
(Laboratory of Basic Biology, Hunan First Normal University, Changsha 410205, China)
The objective of this study was to explore the correlation ofJNK1 gene in the process of gonad development of Goldfish (Carassiusauratus). The expression ofJNK1 was studied and analyzed in different developmental phases of gonad by using quantitative real-time PCR and Western blotting. It was found that gonadosomatic index (GSI) of males and females showed significant seasonal variation with the development process of gonad and was the maximium during the breeding period (P<0.05). The qPCR analysis revealed that the expression ofJNK1 firstly increased and then decreased at the development phases of ovary, reached the peak level at maturity phase (P<0.05),4.0 times higher before sexual maturity, 1.4 times higher degradation phase and 2.1 times higher at the rest phase compared with that at maturity phase.In the testis, the expression ofJNK1 was found to be trace enhanced compared with before sexual maturity phase, however, the expression changes had no significant difference in the whole development process. Western blotting analysis showed that expression tendency of JNK1 protein was in line with that ofJNK1 mRNA. Together, these results suggest thatJNK1 plays an important role in the processes of the development of ovary and promoting the maturation of oocytes in fish.
Carassiusauratus;JNK1 gene; gonadal development; gonadosomatic index
2016-07-25;
2016-08-10
湖南省科技计划项目(2014FJ4261);湖南省教育厅科学研究项目(14C0252)
邹立军,博士,讲师,研究方向为发育生物学, E-mail: zoulijun123@163.com
Q78
A
2095-1736(2017)04-0006-05
doi∶10.3969/j.issn.2095-1736.2017.04.006

