高效液相色谱法测定剑麻叶片中的可溶性糖含量
鹿志伟,杨子平,张燕梅,李俊峰,侯晓婉,赵艳龙,陆军迎,周文钊*
(1.中国热带农业科学院南亚热带作物研究所,广东湛江524091;2.湛江市热带作物遗传改良重点实验室,广东湛江524091)
高效液相色谱法测定剑麻叶片中的可溶性糖含量
鹿志伟1,2,杨子平1,2,张燕梅1,2,李俊峰1,2,侯晓婉1,赵艳龙1,陆军迎1,2,周文钊1,2*
(1.中国热带农业科学院南亚热带作物研究所,广东湛江524091;2.湛江市热带作物遗传改良重点实验室,广东湛江524091)
采用不同体积百分比浓度下的乙醇提取液对剑麻叶片中葡萄糖、果糖和蔗糖的提取效率进行研究,并建立能够同时测定剑麻叶片中三种糖分的高效液相色谱方法。结果表明:60%的乙醇为最佳提取液,该方法的相对标准偏差为1.0%~4.6%,相关系数在0.999以上,加标回收率为98.5%~99.4%;剑麻叶片(干重)中3种糖的总含量达167 mg/g,其中葡萄糖含量最高为74 mg/g(干重)。
高效液相色谱;剑麻;可溶性糖;叶片
剑麻(Agave sisalana Perrine)属于龙舌兰科龙舌兰属多年生草本植物,是一种重要的热带经济作物[1]。其作为硬质纤维的主要来源之一,具有重要的商业应用潜力,在世界范围内广泛种植[2-3]。目前,我国剑麻主要在广东、广西、海南等热带亚热带地区大面积种植[4-5],对其利用主要为提取剑麻叶片中纤维,用于缆绳、麻布、地毯等,而纤维加工后剩下的麻渣则得不到有效的利用,被大量丢弃[6-7]。据前人[8-10]报道,剑麻麻渣中主要含有大量的多糖、黄酮、皂素、果胶、可溶性糖、纤维素等,而目前对其成分测定的研究主要为黄酮、皂素等成分,对剑麻叶片可溶性糖含量的研究尚未发现[11-13]。可溶性糖主要包括果糖、葡萄糖、蔗糖,其为植物成分测定的重要指标之一,为植物生理生化特征研究及副产品综合利用提供了重要数据支撑[14-16]。高效液相色谱法为可溶性糖含量测定较为准确的方法之一,该方法具有灵敏、高效、快捷等优点[14,18]。
因此,本试验以剑麻叶片作为研究对象,采用高效液相色谱法对其可溶性糖含量进行测定,以期建立一种能够同时测定果糖、葡萄糖、蔗糖三种可溶性糖含量的快速、高效、准确的方法,为剑麻相关生理生化指标分析以及副产品综合开发利用提供依据。
1 材料与方法
1.1 材料与试剂
葡萄糖、果糖和蔗糖均为进口色谱纯,水为超纯水,无水乙醇(分析纯),色谱纯乙腈。“金边毛里求斯”剑麻品种取自中国热带农业科学院南亚热带作物研究所剑麻种植圃。
1.2 主要仪器设备
高效液相色谱仪(LC-20A,日本岛津公司),Inertsil胺基柱,恒温水浴锅,离心机(Eppendorf)。
1.3 样品处理及提取方法
选取三株剑麻植株,每个植株选取一张叶片(叶片与茎干夹角为45°)。将每个叶片平均分成若干小份,均等挑取一半叶片作为试验材料。称取叶片鲜重后置于烘箱内70℃过夜烘干。待剑麻叶片重量不再发生变化时,记录最终叶片干重。将每个品种的剑麻叶片混合打碎,置于保鲜盒内干燥保存,备用。
剑麻叶片可溶性糖提取方法参考刘胜辉、张秀梅等[17-18],稍作修改,具体如下:剑麻叶片粉末采用体积百分浓度分别为双蒸水、20%、40%、60%、80%乙醇及无水乙醇6种提取液提取,探索最佳提取液。精确称取经粉碎机混匀的剑麻叶片1.00 g,同时添加0.1 g葡萄糖、0.1 g蔗糖和0.1 g果糖的混合样作为阳性对照以及空白提取液对照,每个样品重复4次。用4 mL提取液充分研磨,10000 r/min,室温离心10 min,残渣加入2 mL提取液继续提取,收集所有上清液,96℃水浴蒸干,随后定容至5 mL,漩涡混合,再使用一次性注射器抽取样液,经0.45μm滤膜过滤后上机分析。
1.4 绘制标准曲线
精确称取葡萄糖、蔗糖、果糖各20 g,置于500 mL烧杯中溶解,将溶解液置于1 L容量瓶中,用ddH2O定容至刻度,获得各自浓度均为20 mg/mL的混标溶液,然后将混标溶液依次稀释至10、5、2.5、1.25、0.625 mg/mL。最后使用一次性注射器抽取标样,经0.45μm滤膜过滤后上机分析。每个样品平行4次。根据每个标样的峰面积大小进行标准曲线绘制。
1.5 色谱分析条件
Inertsil胺基柱150 mm×4.6 mm,5μm;柱温:35℃;流动相:乙腈:水=75:25(V/V);真空泵脱气;流速:1 mL/min;进样量:10.0μL。
1.6 加标回收率
运用加标样回收法,每个测试样品取2份,1份加入蔗糖、果糖、葡萄糖的标准溶液,1份不加,重复测定4次,最后计算平均回收率。
1.7 统计分析
使用SPSS19.0软件对所得数据进行统计学分析。
2 结果与分析
2.1 标准曲线绘制
取蔗糖、果糖、葡萄糖各级标准溶液(20、10、5、2.5、1.25、0.625 mg/mL),进样量为10μL,进行上样分析,所得色谱图见图1,图2同。以标样质量浓度作为纵坐标,标样峰面积作为横坐标,制作标准曲线,得出回归方程,结果见表1,蔗糖、果糖、葡萄糖的质量浓度与峰面积相关性均在0.999以上,其线性范围为0.625~20 mg/mL。
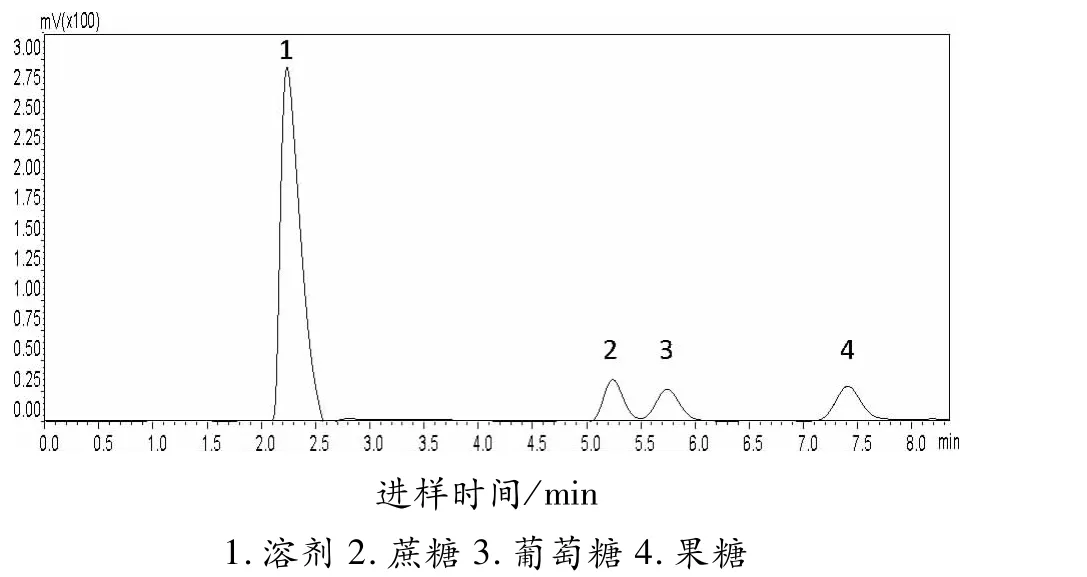
图1 标样色谱图Fig.1 Chromatophy of standards

表1 回归方程、相关系数和线性范围Tab.1 Regression equationswith correlation coefficients and linearity ranges
2.2 提取条件优化
经上述提取方法及色谱条件对剑麻叶片提取液进行上机分析,各试验组色谱叠加图以及分析结果见图2和表2、3。由图2可知,各试验组色谱叠加图出峰时间及峰形完全保持一致。由表3可知,60%乙醇提取出来的果糖含量为73.28 mg/g,显著高于其它试验组结果;60%和80%的乙醇提取液提取葡萄糖的效果差异不显著,但明显大于其它试验组结果;而在蔗糖的提取中,20%、40%、60%乙醇的提取效果差异不显著,但蔗糖含量明显大于其它试验组结果;在总糖含量的提取效果中,60%乙醇提取效果最佳,明显高于其它试验组,达166.99 mg/g的干重含量。结果表明,60%乙醇提取液对果糖、葡萄糖以及蔗糖的单糖和总糖提取效果均最佳,且各重复组结果在统计学上差异较小,结果比较稳定可靠。

图2 各试验组色谱叠加图Fig.2 Overlapping chromatophic of each experiment

表2 不同提取液所提取糖浓度Tab.2 The extraction sugar concentration by different solutions

表3 不同提取液所提取糖浓度邓肯分析Tab.3 The Duncanmultiple comparison analysis for extraction sugar concentration by different solutions
2.3 精密度及回收率试验
准备待测的剑麻叶片提取液,每个样品平行进样4次,计算峰面积,分析相应的相对标准偏差(RSD)对测定结果的精密度进行检测,结果显示,3种可溶性糖的RSD分别为:葡萄糖4.18%、果糖2.71%、蔗糖0.71%。结果见表4。
准备两份剑麻叶片提取样品,其中一份加入果糖、葡萄糖、蔗糖标样,另外一份加入空白提取液对照,重复测定4次,统计回收率,测定结果见表4。蔗糖、葡萄糖、果糖的加标样回收率分别为98.43%、99.41%、99.80%,说明本试验测定方法具有较高的精确性。

表4 方法的精密度和回收率试验Tab.4 Precision and recovery of themethod
3 结果与讨论
可溶性糖含量测定时样品处理常用方法有水提法和醇提法两种[18-19],两种方法各有优劣。本文采用了6个体积百分比浓度的乙醇提取液对剑麻叶片中可溶性糖进行提取,充分对比水提法和醇提法两种方法的优势。结果表明,水提法即0%的乙醇处理时,样品溶解速率明显大于其它试验组,但是后期样品蒸干处理时,蒸干速率较慢。而样品处理采用醇提法时,样品溶解速率随着乙醇体积百分比浓度的增加而逐渐降低,但是后期样品蒸干处理时,蒸干速率则明显大于水提法试验组,且随着乙醇浓度的增加蒸干速率逐渐增加。另外,从表3可以看出,随着乙醇浓度的增加,提取得到的可溶性总糖含量也随之增加,在60%乙醇时达到最大,继续增加时,总糖含量则出现下降的趋势,且用无水乙醇提取时总糖含量出现明显的下降,这可能是由于随着乙醇体积百分比浓度的增加,可溶性糖的溶解度逐渐降低的原因。这与李映志[14]的研究结果相似。经综合对比分析后,60%的乙醇溶液为最佳的可溶性糖提取液。
本研究对可溶性糖含量测定时样品处理方法进行研究,发现最佳的样品处理方法为使用60%乙醇作为提取液,采用Inertsil胺基柱作为分析柱,乙腈:水=75∶25(V/V)作为流动相,柱温35℃,分析剑麻叶片中果糖、葡萄糖、蔗糖,保留时间的重现性比较好,三者的色谱峰面积与含量之间呈现较好的线性关系,相对标准偏差为0.71%~4.18%,加标回收率为98.43%~99.80%,结果证明高效液相色谱法可作为一种高效、便捷、准确的剑麻叶片可溶性糖含量检测方法。
[1]熊和平.麻类作物育种学[M].北京:中国农业科学技术出版社,2008:2-3.
[2]Mishra S,Mohanty A K,Drzal L T,etal.A Review on Pineapple Leaf Fibers,Sisal Fibers and Their Biocomposites[J].Macromolecular Materials and Engineering,2004,289(11):955-974.
[3]Ramzy A,Beermann D,Steuernagel L,et al.Developing a new generation of sisal composite fibres for use in industrial applications[J].Composites:Part B,2014,66(4):287-298.
[4]陈冰,李开成,陈碧练,等.二十七种龙舌兰麻超氧化物歧化酶的分析[J].食品工业技,2011,32(12):123-125.
[5]Bing C,Liang C,Gao L J,etal.Purification and partial properties of a superoxide dismutase from Agave hybrid No.11648.[J]. Journal of the Chinese Chemical Society,2012,59(4):520-524.
[6]杨就锦,陈冰,李嘉亮,等.金边龙舌兰超氧化物岐化酶的提取与特性研究[J].化学研究与应用,2014,26(4):497-500.
[7]陈冰.剑麻超氧化物歧化酶的提取方法[P].中国:CN201010522632.6,2013-01-09.
[8]Sharma S,Varshney V K.Chemical analysis of Agave sisalana juice for its possible utilization[J].Acta Chim Pharm Indica,2012,2(1):60-66.
[9]Zhang X,Liu L,Lin C.Isolation,structural characterization and antioxidant activity of a neutral polysaccharide from Sisalwaste[J].Food Hydrocolloids,2014,39(5):10-18.
[10]Ding Y,Tian R H,Yang CR,etal.Two new steroidal saponins from dried fermented residues of leaf-juices of Agave sisalanaforma Dong No.1[J].Chemical&Pharmaceutical Bulletin,1993,41(3):557.
[11]Rizwan K,Zubair M,Rasool N,etal.Phytochemical and Biological Studies of Agave attenuata[J].International Journal ofMolecular Sciences,2012,13(5):6440-6451.
[12]Santos JD G,Vieira IJC,Braz-Filho R,etal.Chemicals from Agave sisalana Biomass:,Isolation and Identification[J].International Journal of Molecular Sciences,2015,16(4):8761-8771.
[13]黄尚顺,廖青,李华锋,等.剑麻皂素提取工艺研究[J].化工技术与开发,2015,44(12):1-3.
[14]李映志,刘胜辉,朱祝英,等.高效液相色谱法测定菠萝蜜果实中的葡萄糖、果糖和蔗糖[J].食品科学,2014,35(12):84-87.
[15]林艳,郭伟珍,徐振华,等.大叶女贞抗寒性及冬季叶片丙二醛和可溶性糖含量的变化[J].中国农学通报,2012,28(25):68-72.
[16]吉增宝,王进鑫,李继文,等.不同季节干旱及复水对刺槐幼苗可溶性糖含量的影响[J].西北植物学报,2009,29(7):1358-1363.
[17]刘胜辉,魏长宾,孙光明,等.高效液相色谱法测定台农6号菠萝果实中的糖分[J].食品科学,2009,30(12):162-164.
[18]张秀梅,杜丽清,谢江辉,等.高效液相色谱法测定菠萝果实中的糖分[J].食品科学,2007,28(11):450-452.
[19]赵仁邦,刘孟军.高效液相色谱法测定枣果实中的糖分[J].食品科学,2004,25(8):138-141.
Determ ination of Soluble Sugar in Sisal Leaf by HPLC
LU Zhiwei1,2,YANG Ziping1,2,ZHANG Yanmei1,2,LIJunfeng1,2,HOU Xiaowan1,ZHAO Yanlong1,LU Junying1,2,ZHOUWenzhao1,2*
(1.South Subtropical Crops institute,Chinese Academy of Tropical Agricultural Sciences,Zhanjiang,Guangdong 524091,China;2.Tropical Crop Genetic Improvement Key Laboratory of Zhanjiang,Zhanjiang,Guangdong 524091,China)
Different concentration ethanol extracting solutionswere selected to study the extraction efficiency for glucose,fructose and sucrose.The high efficiency HPLC way ofmeasuring the three soluble sugars simultaneously was expected to be constructed.The results showed that60%ethanolwas the optimal extraction solution,with relative standard deviations of1.0%~4.6%,association coefficients above 0.999 and the adding standard recoveries of 98.5%~99.4%.The total soluble sugar contentswere up to 167 mg/g,in which the glucose contentswere the highestwith the dry weight of 74 mg/g.
HPLC;sisal;soluble sugar;leaf
S563.8
A
1671-3532(2017)04-0189-06
2017-03-30
现代农业产业技术体系建设专项(CARS-19);湛江市热带作物遗传改良重点实验室建设项目(2015A06005);中国热带农业科学院南亚热带作物研究所基本科研业务费专项(1630062016019);国家自然科学基金(31401427)
鹿志伟(1990-),男,硕士,主要从事作物育种研究。E-mail:luzhiweihn@126.com
*通讯作者:周文钊(1965-),男,研究员,主要从事剑麻育种研究。E-mail:zwenzhao@163.com

