基于聚对苯二甲酸乙二醇酯薄膜的石墨烯/金纳米粒子/葡萄糖氧化酶柔性电极的制备及检测葡萄糖
徐杰+孙文+贺路影+张芹+苏文金
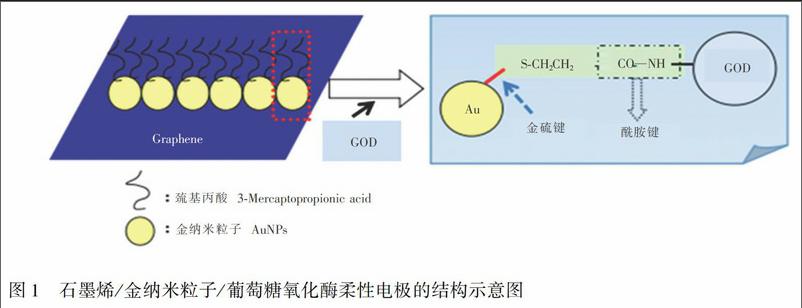

摘 要 采用化学气相沉积法生长多晶石墨烯(Graphene, G),转移至聚对苯二甲酸乙二醇酯(PET)薄膜表面,通过控制金溶胶蒸发速率,在多晶石墨烯表面组装均匀分布的亚单层金纳米粒子(AuNPs);然后修饰巯基乙酸,通过共价交联反应将葡萄糖氧化酶固定于AuNPs表面,构建基于PET膜的石墨烯/金纳米粒子/葡萄糖氧化酶(G/AuNPs/GOD)柔性电极。此电极在工作电位0.6 V(vs.SCE电极)、pH 7.0磷酸盐缓冲溶液、室温25℃条件下,差分脉冲伏安法响应电流与被测葡萄糖浓度在0.05~10.55 mmol/L范围内呈线性关系,线性方程为I(108A)=0.2629 C(mmol/L)+1.4149,线性相关系数 r=0.9955,检出限1 μmol/L (3σ)。 G/AuNPs/GOD柔性电极的制备可为特定环境和可穿戴设备的葡萄糖检测提供了新的途径和方法,拓展了葡萄糖检测的应用范围。
关键词 葡萄糖; 柔性电极; 葡萄糖氧化酶; 石墨烯; 金纳米粒子
1 引 言
葡萄糖的检测在医学、工业生产、食品、环境等领域均有广泛的应用 [1]。其中,基于葡萄糖氧化酶(Glucose oxidase, GOD)的电化学检测方法是应用最广泛的方法之一,例如长期使用的生化分析仪或植入式的血糖传感器等设备均采用了此方法。葡萄糖氧化酶电极主要利用酶对底物的专一选择性和催化反应的高效性,可在复杂样品(如血液)中直接、高灵敏地检测葡萄糖的催化氧化产物,而不易受其它成分干扰;同时具有较高的稳定性,可多次或长期使用。与所有的生物酶电极类似,葡萄糖氧化酶电极制备的关键是如何将酶长期稳定固定在电极表面,保持酶的活性。目前已经发展了许多酶的固定方法,如电化学法[2,3]、层层自组装法[4],共价交联法[5]、溶胶-凝胶法[6~8]等。新的纳米材料的出现,如金纳米粒子[9]、碳纳米管[10]、石墨烯[11~13]、石墨烯/金纳米粒子复合物[14~16]等,不但具有高的比表面以固定更多的酶,还可以增强电子传递的能力。在已报道的石墨烯相关研究中,主要使用其微纳米颗粒或悬浮液形式进行加工,如Hui等[11]将石墨烯粉末悬浮液滴涂在金盘电极上,滴加葡萄糖氧化酶和Nafion溶液成膜,制备葡萄糖检测电极;Wang等[14]在玻碳电极上滴加石墨烯悬浮液,干燥后再浸入氯金酸溶液,利用电化学法共合成石墨烯/金纳米粒子复合物,再滴加葡萄糖氧化酶形成葡萄糖检测电极。这些研究充分利用了石墨烯纳米结构(片或卷)大的比表面积和良好的电子传递能力,显著改善了葡萄糖酶电极的性能。但石墨烯作为可大面积制备的二维纳米材料,在柔性电极和可穿戴装备方面的应用仍较少。
本研究将化学气相沉积法生长于铜箔上的多晶石墨烯转移至聚对苯二甲酸乙二醇酯(PET)薄膜表面,通过控制金溶胶蒸发速率,在多晶石墨烯表面组装均匀分布的亚单层金纳米粒子,修饰巯基乙酸,然后将葡萄糖氧化酶共价固定于金粒子表面,构建了基于PET薄膜的石墨烯/金纳米粒子/葡萄糖氧化酶G/AuNPs/GOD柔性电极,利用电镜、傅立叶变换红外(FTIR)光谱、电子能谱对电极进行表征,考察了柔性电极对葡萄糖检测的线性范围、检出限、稳定性、重复性、选择性等性能。
2 实验部分
2.1 仪器与试剂
Hitachi S-4800扫描电子显微镜(日本日立公司);CHI 760 D电化学工作站(上海辰华仪器公司);Rigaku Ultima IV型 X-射线衍射仪(日本理学公司);NicoletAvatar 330傅里叶变换红外光谱仪 (美国热电公司);Mill-Q超纯水机(美国Millipore公司)。
葡萄糖氧化酶(GOD, 100~250 U/mg,厦门慧嘉生物科技有限公司);氯金酸(HAuCl4·4H2O)、H2O2(30%);、柠檬酸钠(C6H5Na3O7·2H2O);Na2HPO4、NaH2PO4(国药集团化学试剂有限公司);所用试剂均为分析纯;实验用水均为超纯水(>18.2 MΩ·cm)。
2.2 G/AuNPs电极的制备
多晶石墨烯/PET薄膜电极由厦门大学物理系蔡伟伟课题组提供,制备方法为在铜箔上采用化学气相沉积法生长石墨烯,然后通过PMMA转移至PET薄膜表面制备[17]。
Au纳米粒子(AuNPs)按照文献[8]方法用柠檬酸还原氯金酸制备合成:在沸腾条件下,向200 mL 0.01% (m/V) HAuCl4溶液中快速加入1.4 mL 1% (m/V)柠檬酸三钠,反应30 min,得到55 nm AuNPs。取100 mL AuNPs原液, 6000 r/min离心,移去上层清液,得到2 mL浓缩液。再加5 mL超纯水离心清洗两次,移去上层清液,制得2 mL备用AuNPs浓缩液。取20 μL滴加到5 mm × 10 mm的石墨烯基电极的一侧,将其置于加盖的培养皿中蒸发直至完全干燥,AuNPs形成0.3 cm半径的圆形图案,即制得面积为0.28 cm2的G/AuNPs电极。
2.3 G/AuNPs/GOD电极的制备
将G/AuNPs电极置于含1%(V/V) 巯基乙酸(TGA)溶液中浸泡12 h,用超纯水淋洗后将G/AuNPs-TGA电极浸入含0.01 mol/L 4-二甲氨基吡啶(DMAP)的碳二亚胺(EDC,0.05 mol/L)与N-羟基丁二酰亚胺(NHS,0.05 mol/L)[19,20]混合溶液中浸泡1 h,取出后用超纯水淋洗,再將其放入10 mg/mL GOD溶液中浸泡2 h,用pH 7.0 的PBS溶液淋洗,即制得G/AuNPs/GOD电极(图1)。于4℃保存备用。
2.4 葡萄糖浓度检测
采用三电极体系,以制备的G/AuNPs/GOD电极为工作电极, 饱和甘汞电极为参比电极,铂片电极为对电极进行实验。在室温条件下,于20 mL 0.1 mol/L pH 7.0 的PBS中在0~1.2 V电压下进行循环伏安测试、控制电位为0.6 V条件下进行计时电流测试, 控制扫速50 mV/s, 在0~1.1 V电压范围单向扫描进行示差脉冲伏安测试,分别记录G/AuNPs/GOD电极对葡萄糖的电流响应。
3 结果与讨论
3.1 G/AuNPs/GOD电极的表征
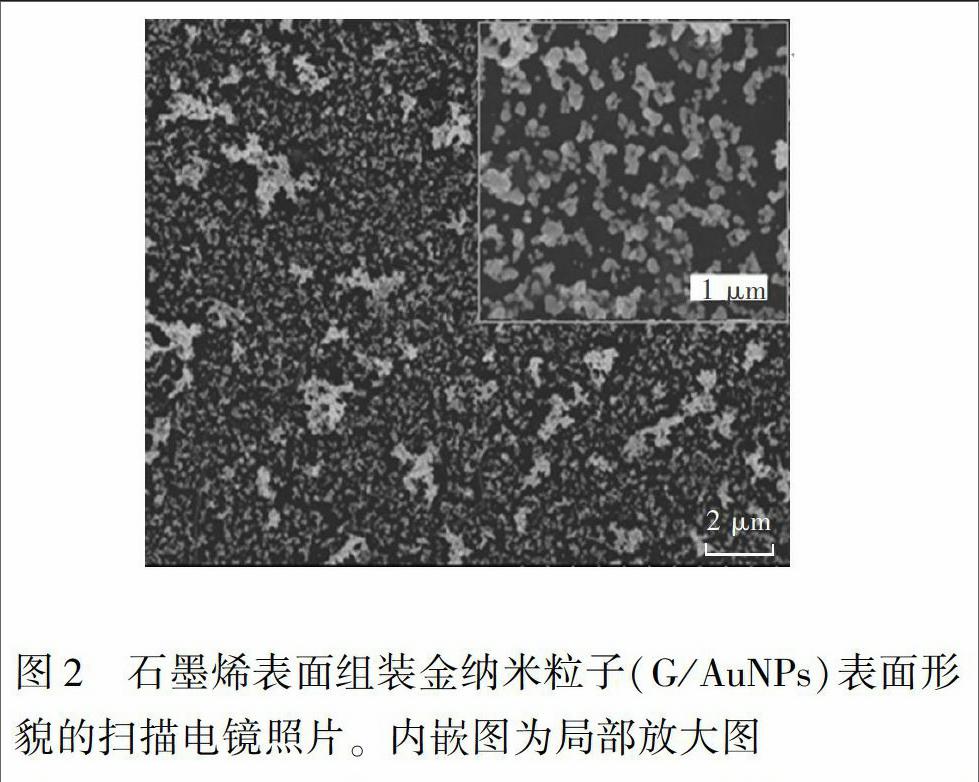
从电镜结果(图2)可见,在室温条件下,于加盖的表面皿中蒸发干燥的方法可制备得到较大面积、分布比较规整均一的AuNPs亚单层结构。溶液在固体表面蒸干后,会形成明显边缘堆积而中央稀薄的现象,即咖啡环效应。通过控制固体表面的亲疏水性和蒸发速度,可显著抑制咖啡环效应,获得较均匀的沉积效果。由于石墨烯表面富含苯环结构,具有较强的疏水性,本研究使用加盖的蒸发皿,使其蒸发速率较慢,因而显著减轻了咖啡环效应,获得较均匀的亚单层结构。
采用傅立叶变换红外(FTIR) 光谱对电极修饰过程进行表征。图3是 AuNPs上修饰巯基乙酸的 FTIR 光谱,在 637 cm1处有一微弱的振动峰,归属于CS键的对称振动,说明巯基乙酸在金纳米粒子表面成功修饰。图3c是AuNPs-TGA电极偶联GOD后的 FTIR 光谱曲线[21],与修饰前相比,637 cm1处的小峰消失, 而1644 cm1处出现一个新峰,主要归属为GOD上CO的伸缩振动,而1095 cm1峰更加明显,其归属于CO单键的伸缩振动,这表明葡萄糖氧化酶通过酰胺键偶联到金纳米粒子表面。
通过X射线能谱(EDS)对制备的各个电极进行了表面元素分析,结果见表1,石墨烯表面分布均匀的金纳米粒子主要含有C、O和Au 3种元素;当金纳米粒子修饰电极浸入到巯基乙酸溶液中反应一段时间后,其表面新增加了S元素,表明巯基乙酸通过AuS键修饰到AuNPs表面;偶联葡萄糖氧化酶后,电极表面新增加了N元素,其来源只可能是葡萄糖氧化酶,说明葡萄糖氧化酶修饰到柔性电极表面。金纳米粒子与PET基底上的石墨烯表面之间主要是较强的物理吸附作用,制备完成后, 即使长时间浸泡在缓冲溶液中,石墨烯表面的金纳米粒子也不会脱落。
3.2 G/AuNPs/GOD电极的电化学性能
采用循环伏安法表征了G/AuNPs电极、G/AuNPs/TGA电极及G/AuNPs/GOD 3种电极的电化学性能(图4)。这3种电极施加相同电压时,响应电流依次减小,而氧化还原电势差依次增大,表明在制备过程中,TGA和酶的修饰使电极表面导电性下降,电子交换速率变慢,电极表面电化学反应的不可逆性增加。这些电极在0.9和0.4 V出现氧化还原峰,是金纳米粒子吸附O或者OH而产生的氧化还原吸附峰[22]。
图5A是G/AuNPs/GOD电极对不同浓度的葡萄糖溶液的循环伏安图。随溶液中葡萄糖浓度增加,氧化峰电流增大,电流强度与葡萄糖浓度成正相关。由于葡萄糖不具有电化学活性,电流的增加与酶催化葡萄糖氧化生成葡萄糖酸和过氧化氢相关。酶反应过程与通常的氧化酶类似,如式(1)与式(2)所示。
FAD以黄素腺嘌呤二核苷酸辅基氧化酶的形式存在。式(3)是电化学反应步骤,主要由葡萄糖过氧化酶中辅酶与葡萄糖反应生成过氧化氢失去电子发生氧化而产生电流[23]。
扫描速度在 5~200 mV/s范围内变化时,随着扫速增加,氧化还原电流逐步增大(图5B),峰电流与扫速的平方根成正比(图5B内插图),说明此电极对葡萄糖的电化学氧化还原过程受扩散控制。
3.3 G/AuNPs/GOD柔性电极葡萄糖检测
图6A是不同浓度葡萄糖溶液的差分脉冲伏安(DPV)曲线。葡萄糖浓度较低时,浓度增加引起响应电流变化较大;葡萄糖浓度较大时,由于受溶液氧分压的限制,其浓度的增加引起的电流增量很小。从葡萄糖溶液的计时电流曲线(图6B)可见,最大响应时间小于10 s,说明此电极对葡萄糖有快速灵敏的响应。定量曲线如图6B插图所示,响应电流值随葡萄糖浓度升高而增大, 在0.05~10.55 mmol/L范围内呈线性关系,线性方程为I (108A) =0.2629C (mmol/L)+1.4149, 检出限为 1 μmol/L(3σ),低于文献[11,14]报道的采用粉末石墨烯悬浮液在玻碳电极和金电极上制备的GOD电极(表2)。
考察了G/AuNPs/GOD电极对葡萄糖响应的稳定性和重现性,对G/AuNPs/GOD电极进行了100次循环扫描结果表明,随着循环次数的增加, 电流先降低, 随后趋于稳定,第100次测试得到电流为首次测试电流的65%。电流的衰减可能与循环过程中产生的过氧化氢使酶活性部分丧失有关[27]。采用相同方法制备10支G/AuNPs/GOD电极测定0.2 mmol/L葡萄糖溶液,10电极电流的相对标准偏差为 4.7% (n=10),表明此方法制备的葡萄糖生物传感器具有良好的重现性。
G/AuNPs/GOD柔性电极在 4℃ 下 pH 6.5 的缓冲溶液中放置20 天后进行测试,对 0.1 mmol/L葡萄糖溶液的响应仍保持初始响应的78%。
为了考察G/AuNPs/GOD电极的对葡萄糖测定的选择性,测定食品中其它糖类存在时葡萄糖的响应(图7)。结果表明,制备的酶电极仅对葡萄糖有明显的电流响应,而对同等浓度的果糖、核糖和半乳糖几乎均无响应,说明此电极对葡萄糖的检测具有较好的专一性。
4 结 论
通过在PET薄膜转移的多晶石墨烯表面组装AuNPs和GOD,构建了G/AuNPs/GOD柔性電极。在工作电位0.6 V (vs.SCE)、pH 7.0磷酸盐缓冲溶液、室温25℃条件下,构建的生物传感器具有宽的线性范围, 检出限为1 μmol/L。此柔性电极的制备可为特定环境和可穿戴设备的葡萄糖检测提供新的途径和方法。
References
1 Clark L C, Lyons C. Ann. NY Acad. Sci., 1962, 102(1): 29-32
2 Liu X, Neoh K G, Cen L. Biosens. Bioelectron., 2004, 19(8): 823-834
3 Turkmen E, Bas S Z, Gulce H, Yildiz S. Electrochim. Acta, 2014, 123: 93-102
4 Salimi A, Noorbakhsh A. Electrochim. Acta, 2011, 56: 6097-6105
5 Unnikrishnan B, Palanisamy S, Chen S M. Biosens. Bioelectron., 2013, 39: 70-75
6 Chen X J, Zhu J W, Tian R, Yao C. Sens. Actuators B, 2012, 163(1): 272-280
7 Qu F L, Sun H Y, Zhang Y, Lu H M, Yang M H. Sens. Actuators B, 2012, 166: 837-841
8 Huang H M, Huang P K, Kuo W H. J. Sol-Gel Sci. Technol., 2013, 67: 492-500
9 Wang H H, Ohnukia H, Endo H, Izumi M. Sens. Actuators B, 2012, 168: 249-255
10 Fu G L, Yue X L, Dai Z F. Biosens. Bioelectron., 2011, 26: 3973-3976
11 Hui J N, Cui J W, Xu G Q, Adeloju S B, Wu Y C. Mater. Lett., 2013, 108: 88-91
12 Al-Sagur H, Komathi S. Biosensor. Bioelectron., 2017, 92: 638-645
13 Li S, Zhang Q, Lu Y L, Chen X, Liu Q. Sens. Actuators B: Chem., 2017, 244: 290-298
14 Wang X L, Zhang X L. Electrochim. Acta, 2013, 112: 774-782
15 Shumba M, Nyokong T. Electrochim. Acta, 2017, 236: 212-220
16 Mashayekhi M F, Mandi A, Ahmad M. Process Biochemistry, 2017, 56: 71-80
17 Li X S, Cai W W, An J, Kim S, Nah J, Yang D X, Piner R, Velamakanni A, Jung I, Tutuc E, Banerjee S K, Colombo L, Ruoff R S. Science, 2009, 324: 1312-1314
18 Frens G. Nat. Phys. Sci., 1973, 241: 20-22
19 Liu Y, Yu D, Zeng C, Miao Z C, Dai L M. Langmuir, 2010, 26(9): 6158-6160
20 Claussen J C, Wickner M M, Fisher T S, Porterfield D M. ACS Appl. Mater. Inter., 2011, 3: 1765-1770
21 Unnikrishnan B, Palanisamy S, Chen S M. Biosensor. Bioelectron., 2013, 39: 70-75
22 Conway B E. Prog. Surf. Sci., 1995, 49(4): 331-452
23 Dixon B M, Lowry J P, ONeill R D. J. Neurosci. Meth., 2002, 119(2): 135-142
24 Jiang X Y, Wu Y H, Mao X Y, Cui X J, Zhu L D. Sens. Actuators B, 2011, 153(1): 158-163
25 Yang L Q, Ren X L, Tang F Q, Zhang L. Biosens. Bioelectron., 2009, 25(4): 889-895
26 Kang X H, Wang J, Wu H, Aksay I A, Liu J, Lin Y H. Biosens. Bioelectron., 2009, 25(4) 901-905
27 Uang Y M, Chou T C. Biosens. Bioelectron., 2003, 19(3): 141-147

