转录共激活子TAZ对肝癌细胞株MHCC97H增殖能力的影响
张 雷 王 林 耿智敏 万 永 孟凡迪 孟宪魁
·基础研究·
转录共激活子TAZ对肝癌细胞株MHCC97H增殖能力的影响
张 雷 王 林 耿智敏 万 永 孟凡迪 孟宪魁
目的 观察转录共激活子TAZ对肝癌细胞株MHCC97H的增殖能力的影响,以期对阐明原发性肝细胞癌(HCC)的发生发展机制提供1个新的研究思路。方法 应用细胞转染、RNA干扰(RNAi)以及过表达技术,在肝癌细胞株MHCC97H中干预TAZ的表达。在转染后提取细胞RNA和总蛋白,应用qRT-PCR和Western blot等方法检测TAZ、Nek7的表达。选用细胞计数kit-8(CCK-8)法检测细胞活性和增殖能力。结果 与NC组相比,转染了TAZ特异性靶向干扰片段之后,TAZ的mRNA与蛋白表达水平均出现下调,差异具有统计学意义(P<0.0001);Nek7表达也出现下降,差异具有统计学意义(P<0.0001);功能实验(CKK8)发现MHCC97H细胞活性和增殖能力也降低,差异具有统计学意义(P<0.001)。另一方面,过表达了TAZ之后,Nek7表达水平也相应上调了,差异具有统计学意义(P<0.0001);MHCC97H细胞活性和增殖能力也提高,差异具有统计学意义(P<0.001)。结论 转录共激活子TAZ能通过调控Nek7的表达对肝癌细胞MHCC97H的增殖能力产生影响,该发现对于阐明TAZ在肝癌发生发展过程中的作用提供一定的实验基础。
TAZ;Nek7;肝癌;MHCC97H细胞;增殖
(ThePracticalJournalofCancer,2017,32:1219~1223)
原发性肝细胞癌(hepatocellular carcinoma,HCC)是全球五大高发肿瘤之一[1]。在我国,与肿瘤相关的死亡人数中肝癌导致的死亡人数高居第二位[2],目前治疗肝癌还是以手术切除为主,辅以放、化疗或者生物治疗等[3],但由于肝癌发病隐秘,早期症状不典型,很多患者发现时既已经到中晚期,所以治疗效果不理想,五年生存率很低[4]。研究肝癌的发生发展对更好地预防和治疗肝癌有重大意义,对临床治疗也能提供新的思路和策略。转录共激活子TAZ首次报道是于2000年Kanai等[5]发现其能够与14-3-3蛋白结合。近期的研究证明TAZ是Hippo信号通路中的重要效应分子[6],通过转录共激活作用调控下游靶基因的表达[7]。国内外的研究表明TAZ是1个癌基因,在乳腺癌、结肠癌、甲状腺癌、骨肉瘤等[8-11]肿瘤中都呈现高表达并与临床预后相关。分子机制方面,Wang等[12]发现在成神经细胞瘤中TAZ呈表达,并通过上调CTGF 和 PDGF-β的表达促进细胞增殖和肿瘤形成。Nek7(NIMA-related kinase-7)是1个能参与细胞周期调控的丝氨酸/苏氨酸激酶,Zhou等[13]研究发现Nek7在肝癌组织中高表达且能促进肝癌细胞的增殖,可作为肝癌的1个生物标记。依据以上证据,我们推测TAZ通过调控Nek7的表达在肝癌细胞的增殖中发挥着重要的调节作用。本研究以肝癌细胞株MHCC97H为研究对象,探讨TAZ对肝癌细胞增殖能力的影响,为阐明肝癌的发生发展提供分子机制理论基础。
1 材料与方法
1.1 主要试剂和材料
MHCC97H(人肝癌细胞株)购自中国科学院上海生命科学研究院。细胞计数kit-8(CCK-8)试剂盒购自上海碧云天生物技术公司。RIPA裂解液购自北京普利莱基因技术有限公司。LipofectaminTM2000购自Invitrogen公司(USA)。逆转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)、实时荧光定量(SYBR®Premix Ex TaqTM(Tli RNaseH Plus))试剂盒、限制性内切酶BamHⅠ、RcoRⅠ、T4DNA连接酶、pyrobest DNA聚合酶、DpnI酶、质粒提取试剂盒、DNA凝胶回收试剂盒等均购自宝大连生物工程有限公司(TaKaRa)。兔抗人TAZ、Nek7、GAPDH多克隆抗体购自美国Proteintech。山羊抗兔IgG(二抗)购自北京中杉金桥生物技术有限公司。TRIzol 试剂、化学发光检测试剂盒、大肠杆菌DH5α感受态细胞等购自北京天根生物科技有限公司。设计的TAZ靶向siRNA由上海吉玛制药技术有限公司合成。TAZ过表达质粒构建引物和TAZ、Nek7、GAPDH的qRT-PCR引物等均由生工生物工程(上海)有限公司合成。pCMV5-HA载体购自promega(USA)。BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所。
1.2 细胞培养及转染
人肝癌细胞株MHCC97H置于37 ℃、CO2含100 U/ml双抗、10%胎牛血清的DMEM(Gibco,USA) 全培养液换液传代培养。转染前24 h接种细胞于6 cm培养皿中,当细胞融合度约70%时饥饿培养4 h,然后用LipofectaminTM2000按照说明书的操作步骤将TAZ靶向siRNA(序列:CCGUUUCCCUGAUUUCCUUTT)以及阴性对照(序列:ACUCUGGACUGAAUCGACGAU)转染入细胞中。于转染4~6 h 后更换含有10%胎牛血清的DMEM培养液继续培养。
1.3 qRT-PCR检测MHCC97H细胞中TAZ、Nek7、GAPDH的mRNA水平
收集经处理的MHCC97H细胞,应用TRIzol试剂法提取各组细胞的总RNA,用逆转录试剂盒将其反转录成cDNA,反应条件如下:37 ℃ 15 min,85 ℃ 5 s,随后以此cDNA为模板进行qRT-PCR。PCR反应条件:95 ℃ 30 s;95 ℃ 5 s、60 ℃ 30 s,共40 个循环。以2-ΔΔCt值表示各基因 mRNA 的相对表达水平。TAZ、Nek7、GAPDH的qRT-PCR引物见表1。

表1 qRT-PCR引物序列
1.4 Western blot检测TAZ、Nek7、GAPDH蛋白表达水平
收集经处理的MHCC97H细胞,提取细胞总蛋白。采用Western blot检测TAZ、Nek7、GAPDH蛋白表达水平,Image Lab软件分析蛋白条带灰度值。蛋白的表达情况以TAZ或Nek7条带的灰度值与GAPDH条带灰度值的比值表示。
1.5 设计引物及构建pCMV5-HA-TAZ过表达质粒
根据Genbank的基因序列设计引物,其中限制性内切酶BamH I序列:GTTGGATCCATGAATCCGGCCTCGGCGCC,RcoRⅠ序列:GACGAATTCTTACAGCCAGGTTAGAAAGG。提取总RNA,将其反转录为cDNA进行PCR扩增反应,利用T4 DNA连接酶连接TAZ全长片段与pCMV5-HA空载体,然后将连接产物转化到DH5α感受态大肠杆菌,扩增后抽提质粒DNA,酶切及测序验证。
1.6 细胞计数kit-8(CCK-8)实验检测细胞活力
肝癌细胞MHCC97H经转染siRNA或者过表达质粒之后,接种到96孔板中分别培养24、48、72及96 h,实验终止前2 h按照CCK-8试剂盒说明要求加入20 μl试剂,37°孵育2 h,应用酶标仪检测在450 nm处的吸光值,根据各组所得数据制作OD值曲线。
1.7 统计学方法
应用SPSS 17.0统计软件,数据以均数±标准差表示;t检验被用于两组间数据的比较;方差分析用于多组间数据的比较,而Tukey 法或Dunnett’s T3 法用于组间两两比较分析,P<0.05 为差异有统计学意义。本研究中的所有实验均重复3次。
2 结果
2.1 转染TAZ靶向siRNA后TAZ、Nek7、GAPDH的mRNA和蛋白表达情况
取生长状态良好的MHCC97H细胞,按如下分组:siTAZ组、阴性对照组(siNC组)、空白对照组(Blank组),转染相应的siRNA,24 h后提取RNA,进行qRT-PCR;48 h后提取细胞总蛋白,进行Western blot,实验结果见图1。结果显示:与阴性对照组(TAZ mRNA的相对表达水平为3.48±0.43,蛋白的相对表达水平2.28±0.31)相比,siTAZ(TAZ mRNA 的相对表达水平为1.07±0.15,蛋白的相对表达水平0.81±0.21)有明显靶向干扰效果,能使TAZ的mRNA水平下降70%,差异具有统计学意义(P<0.0001);蛋白表达水平下降65%,差异具有统计学意义(P<0.0001)。进一步检测Nek7的表达变化发现,其mRNA水平从相对表达量1.08下降至0.31,下降70%,差异具有统计学意义(P<0.0001);蛋白从相对表达量0.98下降至0.25水平下降75%,差异具有统计学意义(P<0.0001)。实验结果说明TAZ与Nek7之间存在关联,TAZ可以调控Nek7的表达。
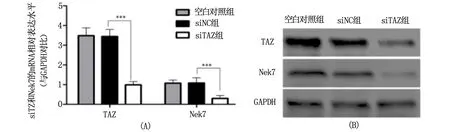
A为qRT-PCR量化数据柱状图,B为Western blot成像图。
2.2 TAZ表达水平降低对肝癌细胞MHCC97H增殖能力的影响
CCK-8实验结果发现:与siNC组相比,siTAZ组MHCCC97H细胞活性明显下降,差异具有统计学意义(P<0.001),实验结果见图2。

图2 MHCC97H细胞CKK-8实验数据量化图
2.3 TAZ过表达质粒的构建
提取人肝癌细胞株MHCC97H细胞中的总RNA,以总RNA为模板反转录为cDNA,以得到的cDNA为模板进行PCR扩增反应。将得到的PCR产物进行琼脂糖凝胶电泳验证:成功扩增出TAZ基因编码区的外显子序列,结果见图3。为排除PCR产物为非特异性扩增所得,我们以GAPDH为对照,确保所得的PCR产物准确可靠。以得到的产物为基础成功构建了TAZ的过表达质粒,用HA-TAZ表示。

图3 TAZ PCR产物琼脂糖凝胶电泳成像图
2.4 过表达TAZ后TAZ、Nek7、GAPDH mRNA和蛋白表达情况
将得到的HATAZ质粒转染入MHCC97H细胞中,24 h后提取RNA,进行qRT-PCR;48 h后提取细胞总蛋白,进行Western blot,实验结果见图4。结果显示:与转染了HA-Vector质粒组相比,转染了HA-TAZ质粒组细胞的TAZ mRNA表达水平从(3.25±0.37)上升至(6.74±0.56),蛋白水平从(2.65±0.45)上升至(5.89±0.51);Nek7的mRNA和蛋白表达水平也分别增高200%和150%,差异具有统计学意义(P<0.0001),见图4。

A为qRT-PCR量化数据柱状图,B为Western blot成像图。
2.5 TAZ表达增强使MHCC97H细胞增殖能力提高
将转染了HA-Vector或者HA-TAZ质粒的MHCC97H细胞接种到96孔板中,CKK-8检测细胞活力,结果如图5所示:与HA-Vector组相比,转染了HA-TAZ组的细胞活力明显提高,差异具有统计学意义(P<0.001)。

图5 MHCC97H细胞CKK-8实验数据量化图
3 讨论
肝癌是我国高发的恶性肿瘤,与国外相比,我国肝癌具有年轻化、发病率高、死亡率高等特点[14]。虽然,近十几年的部分研究成果已经开始应用于临床检测和治疗[3,15-16],但是肝癌术后的恢复情况仍然不乐观,因此,我们有必要深入了解肝癌发生发展的分子机制,这将有助于临床制定出更有利的治疗策略。肿瘤的发生是1个多基因参与、多步骤的复杂的慢性过程,现代观点认为肿瘤发生最主要是由于细胞内蛋白平衡紊乱,抑癌基因失活,促癌基因表达增加。肿瘤细胞1个最主要的特点就是永生性,它能摆脱细胞死亡的过程,进而发展成不受限制的增殖,最终导致向其他细胞或组织侵袭[17]。结合以上这两点,我们选择肝癌的增殖领域来研究,以经典的肝癌细胞株MHCC97H为研究对象,以期发现更多的治疗肝癌的分子靶点。
转录共激活子TAZ/WWTR1是新近发现的、具有转录调节作用的蛋白,它包含1个保守的WW区域、1个14-3-3结合位点以及C端的PDZ结合模体[18]。做为Hippo信号通路中的重要效应分子,在哺乳动物中,TAZ能起到控制器官大小的作用[19];另外还有研究表明,TAZ可以控制细胞的增殖[20]。众多的研究表明TAZ为1个癌基因,它参与了肿瘤的形成,并能促进肿瘤的侵袭转移[21]。在肝癌中,TAZ的表达比癌旁高[22],提示TAZ在肝癌的发生发展中扮演着重要的角色。在本研究中我们发现,TAZ基因的表达发生改变时,肝癌细胞MHCC97H的细胞活性和增殖能力也会发生改变,两者的改变是正相关的。这说明TAZ能够控制肝癌细胞的增殖,可以作为1个新的生物治疗的靶点。
尽管很多基因和通路已经被证明可以作为肝癌的早期检测、诊断和生物治疗靶点,但是更多可能的、新的生物标记仍然需要被发掘。最近的1项研究表明Nek7在肝癌中高表达,且能控制细胞周期进而促进细胞增殖[13]。基于上述发现,我们推测TAZ可以通过调控Nek7的表达来影响肝癌细胞的增殖。为了验证我们的设想,我们应用RNA干扰和质粒过表达技术改变TAZ的表达,结果我们发现,Nek7同样随着TAZ的变化而变化,而且还能影响肝癌细胞的增殖。这些结果验证了我们之前的推测,为将Nek7定义为肝癌的生物治疗靶点提供了更多的证据。
本文实验结果表明转录共激活子TAZ可以调控Nek7的表达进而促进肝癌细胞MHCC97H的增殖,为揭示原发性肝癌初始发生启动机制提供1个崭新思路。
[1] 杨尚君,罗治彬,张 波,等.斑蝥酸钠对肝癌细胞HepG2增殖抑制作用的研究〔J〕.西部医学,2011,23(6):1007-1009.
[2] Xiao H,Jiang N,Zhou B,et al.TAZ regulates cell proliferation and epithelial-mesenchymal transition of human hepatocellular carcinoma〔J〕.Cancer science,2015,106(2):151-159.
[3] 赵雅琴,奚维东.索拉非尼对肝癌患者的生存率、AFP-L3、ALT和AST的影响〔J〕.西部医学,2015,27(7):1016-1018.
[4] 李宗芳,王志东.中晚期肝癌的综合治疗现状〔J〕.西部医学,2013,25(10):1441-1443.
[5] Kanai F,Marignani PA,Sarbassova D,Yagi R,Hall RA,et al.TAZ:a novel transcriptional co-activator regulated by interactions with 14-3-3 and PDZ domain proteins〔J〕.The EMBO Journal,2000,19(24):6778-6791.
[6] Hong W,Guan KL.The YAP and TAZ transcription co-activators:Key downstream effectors of the mammalian Hippo pathway〔J〕.Semin Cell Dev Biol,2012,23(7):785-793.
[7] Valenciasama I,Zhao Y,Lai D,et al.Hippo Component T- AZ Functions as a Co-repressor and Negatively Regulates ΔNp63 Transcription through TEA Domain(TEAD) Transcription Factor〔J〕.J Biol Chem,2015,290(27):16906-16917.
[8] De CT,Di PT,Ferraro A,et al.TAZ/WWTR1 is overexpressed in papillary thyroid carcinoma〔J〕.Eur J Cancer,2011,47(6):926-933.
[9] Yuen HF,McCrudden CM,Huang YH,et al.TAZ Expression as a Prognostic Indicator in Colorectal Cancer〔J〕.PLoS ONE,2013,8(1):e54211.
[10] 贾 楠,张迎龙,刘 涛,等.YAP和TAZ在骨肉瘤组织中的表达及临床意义〔J〕.现代肿瘤医学,2015,25(22):3330-3333.
[11] Wang J,Rouse C,Jasper JS,et al.ABL kinases promote breast cancer osteolytic metastasis by modulating tumor-bone interactions through TAZ and STAT5 signaling〔J〕.Sci Signal,2015,9(413):ra12.
[12] Wang M,Liu Y,Zou J,et al.Transcriptional co-activator TAZ sustains proliferation and tumorigenicity of neuroblastoma by targeting CTGF and PDGF-β〔J〕.Oncotarget,2015,6(11):9517-9530.
[13] Zhou L,Wang Z,Xu X,et al.Nek7 is overexpressed in hepatocellular carcinoma and promotes hepatocellular carcinoma cell proliferation in vitro and in vivo〔J〕.Oncotarget,2016,7(14):18620-18630.
[14] 杨学刚.青年人原发性肝癌诊断的研究进展〔J〕.西部医学,2012,24(7):1412-1414.
[15] 杨红春,李 永,马 海.TP、VEGF在原发性肝细胞癌中的表达及与肝癌血管生成的相关性研究〔J〕.西部医学,2012,24(7):1265-1267.
[16] 张 健,吴友伟,吕飒美,等.血清IP-10 MIG IL-8及RANTES水平变化与肝癌进展关系分析〔J〕.西部医学,2015,27(9):1328-1331.
[17] Narayanan KB,Ali M,Barclay BJ,et al.Disruptive environmental chemicals and cellular mechanisms that confer resistance to cell death〔J〕.Carcinogenesis,2015,36(Suppl 1):S89-S110.
[18] Liu C,Huang W,Lei Q.Regulation and function of the TAZ transcription co-activator〔J〕.Int J Biochem Mol Biol,2011,2(3):247-256.
[19] Pan D.The hippo signaling pathway in development and cancer〔J〕.Dev Cell,2010,19(4):491-505.
[20] Huang JB,Wu S,Barrera J,et al.The Hippo signaling pathway coordinately regulates cell proliferation and apoptosis by inactivating Yorkie,the Drosophila homolog of YAP〔J〕.Cell,2005,122(3):421-434.
[21] Zhou Z,Hao Y,Liu N,et al.TAZ is a novel oncogene in non-small cell lung cancer〔J〕.Oncogene,2011,30(18):2181-2186.
[22] 陈俊任,杨定华,孙艳花,等.TAZ和KLF5在肝细胞癌组织中的表达及其临床意义〔J〕.中国免疫学杂志,2015,31(3):380-383.
(编辑:吴小红)
Effect of Transcriptional Coactivator TAZ on Proliferation of Human Hepatocellular Carcinoma Cell Line MHCC97H
ZHANG Lei,WANG Lin,GENG Zhimin,et al.
The First Affiliated Hospital,Xi'an Jiaotong University,Xi’an,710061
Objective To study the effect of transcriptional co-activator TAZ(transcriptional coactivator with PDZ binding motif)on the proliferation of hepatocellular carcinoma cell line MHCC97H,to provide a new research idea for clarifying the occurrence and development mechanism of hepatocellular carcinoma(HCC).Methods Change the expression of TAZ in hepatocellular carcinoma cell line MHCC97H by using cell transfection,RNA interference(RNAi)and over expression.After transfection,the RNA and total proteins were extracted,and then the expression of TAZ and Nek7 were detected by qRT-PCR and western blot.Cell counting kit-8(CCK-8)assay was performed to detect the cell viability and proliferation.Results Compared with the non-control(NC)group,the TAZ’s mRNA and protein expression were down regulated after transfected the TAZ specific targeting interfere fragments,the difference was statistically significant(P<0.0001)correspondingly,the expression of Nek7 were decreased;meanwhile the functional tests(CKK8)showed that the viability and proliferation of MHCC97H cells were also decreased.On the other hand,the expression of Nek7 was increased after up-regulating the TAZ’s expression;as a result,the viability and proliferation ability of MHCC97H cells was also increased.Conclusion The transcriptional co-activator TAZ can affect the proliferation of HCC cell line MHCC97H by regulating the expression of Nek7,which can provide some experimental basis for elucidating the role of TAZ in the progression of hepatocellular carcinoma.
TAZ;Nek7;Hepatocellular carcinoma;MHCC97H cells;Proliferation
710061 西安交通大学第一附属医院
孟宪魁
10.3969/j.issn.1001-5930.2017.08.001
R735.7
A
1001-5930(2017)08-1219-05
2016-08-24
2017-06-12)

