FHL1A在胶质瘤组织中的表达及其与胶质瘤患者预后的关系
韦喜生 郑晓君 曾弼良 刘英香 范元平
FHL1A在胶质瘤组织中的表达及其与胶质瘤患者预后的关系
韦喜生 郑晓君 曾弼良 刘英香 范元平
目的 探讨FHL1A在胶质瘤组织中的表达及其与胶质瘤患者预后的关系。方法 采用免疫组化法检测FHL1A在89例胶质瘤组织中的表达,同时采用该方法与western blot法对38例配对样本(同一患者的肿瘤组织及其周围正常组织)FHL1A表达差异进行检测,并对各病例的预后影响与FHL1A表达差异间关系进行分析比较。结果 FHL1A 在胶质瘤中表达明显低于其在周围正常组织中表达,且差异具有统计学意义(P<0.05)。同时FHL1A 的表达与胶质瘤级别呈负相关,FHL1A表达低的患者预后效果差。结论 FHL1A的表达与胶质瘤的预后及恶性程度密切相关,对临床诊断及预后判断有参考价值。
胶质瘤;FHL1A;预后
(ThePracticalJournalofCancer,2017,32:1229~1232)
胶质瘤是一种中枢神经系统的恶性肿瘤,具有对放化疗不敏感、易体外成瘤以及多向分化的特点,而对于胶质瘤干细胞信号通路以及调控分子的研究成为目前诊断及治疗胶质瘤的关键科学问题[1]。不少研究表明,Notch 信号通路与胶质瘤对于化疗的耐受有着密切关系,即该通路参与胶质瘤细胞的维持、增殖、自我更新以及分化活动[2-4],而FHL1主要通过参与Notch 信号通路、Cas 信号通路及Src信号通路的信号传导,为其中的重要蛋白质家族[5],而其中亚型FHL1A与该类通路的关系,即与胶质瘤的关系尚少有报道。因此研究FHL1A与胶质瘤的预后关系不仅能够阐明以上信号通路与胶质瘤预后的关系,更能够评价其对胶质瘤发生发展以及预后的作用。故本研究通过对不同类型胶质瘤患者肿瘤组织及其周围正常组织中FHL1A表达水平的测定,探讨其与胶质瘤的预后及恶性程度的相关性。
1 材料与方法
1.1 样本来源
胶质瘤标本主要来源于我们所在医院的胶质瘤治疗中心。样本例数为89例,搜集时间为2013年至2015年。样本中胶质瘤类型主要包括:8 例WHOⅠ级,18 例WHOⅡ级(6 例少突胶质细胞瘤和12 例星形细胞瘤),15 例WHO Ⅲ级(6例间变型少突胶质细胞瘤、9 例间变型星形胶质细胞瘤),48 例WHOⅣ级;搜集样本中来源于男性的样本44 例,女性样本 45 例,样本来源的年龄范围为19~ 77 岁,平均年龄(33.7±22.1) 岁。 此外,采用IHC以及 western blot进行配对样本(来源于同一患者的肿瘤组织及其自身的周围正常脑组织)分析,样本例数为38例,搜集时间为2013年-2015年。38例配对样本中有7 例WHOⅡ级,21 例WHOⅢ级,10 例WHOⅣ级。所有肿瘤样本的检验均由我们所在医院病理科的2位以上副高医师进行确诊及病理分级后进行。本研究所有程序均经医院的医学伦理委员审核、批准。
1.2 主要试剂及仪器
1.2.1 试剂 苏木精、画圈笔、DAB 显色试剂盒、抗体封闭液(凯基生物有限公司);即用型 Dako 二抗(羊抗兔)、鼠抗人β-actin(sigma)、兔抗人 FHL1 抗体(proteintech)、HRP-羊抗鼠 IgG、HRP-羊抗兔 IgG(凯基生物有限公司)。Tris-Hcl、SDS、甘油、甘氨酸、甲醇、柠檬酸、NaCl、KCl、Na2HPO4、KH2PO4(南京化学试剂有限公司);伊利脱脂奶粉。
1.2.2 仪器 生物组织包埋机(KL)(湖北康龙电子仪器有限公司),自动恒温摊烤烘片机(苏州奥德机械设备有限公司),生物组织自动脱水机(湖北慧达仪器有限公司),石蜡组织切片机(RM2235GTK-2002)(德国Leica 公司)。
1.3 方法
1.3.1 实验试剂配置 ①上样缓冲液:1 g SDS(10%),5 ml甘油,50 mg BPB(0.5%),2.5 ml 1M Tris-Hcl(pH6.8),蒸馏水溶解并定容至10 ml,分装为每份 500 μl,室温保存待用。使用前加入2-ME稀释。②蛋白电泳缓冲液:94 g甘氨酸,15.1 g Tris 碱,5 g SDS混合后用蒸馏水定容至 1 L,室温保存待用。使用前采用蒸馏水稀释5倍。③膜转移缓冲液:3.035 g Tris 碱和14.41 g Glycine中加入200 ml甲醇后用蒸馏水定容到1 L,现配现用。⑤封闭缓冲液:用100 ml PBST将脱脂奶粉溶解为5%的浓度,现配现用。
1.3.2 免疫组化 采用多聚甲醛将样本固定,并用石蜡包埋,冷冻切片后进行免疫组化染色。使用二甲苯将待测标本进行脱蜡,脱蜡3次,每次做好标记,并采用酒精梯度水化(梯度为100%,100%,95%,95%,90%,85%,80%,75%),采用0.3%的过氧化氢避光封闭条件下孵育12 min,用抗原修复液将样本修复,PBS清洗载玻片3次并用抗体封闭半小时后,加入FHL1一抗(1∶150稀释)75 ml,4 ℃过夜,PBS洗涤3次,采用DAB显色10 min,自来水终止显色,苏木精复染3 min,盐酸酒精酚化,梯度酒精脱水干燥5 min,二甲苯透明3次,中性树胶封片。
1.3.3 Western Blot 采用PBS将100 g组织样本上血液洗净,匀浆、离心后取上清进行蛋白定量,并于-80 ℃保存待用。采用12%分离胶及5%的浓缩胶,将预先准备好的总蛋白上样,利用恒压进行蛋白电泳,用缓冲液封闭室温孵育后加入抗体,其中FHL1抗体(1∶1 000稀释),其他二抗(1∶2 000稀释),进行37 ℃孵育,1 h后采用显色液显影(显影液A∶B=1∶1)。
1.3.4 预后评价 在患者接受30天治疗后采用随访方式对患者进行改良 Rankin’s 评分[6],其中按照患者日常生活是否可以自理分为6级评分,0分为生活可以完全自理,5分为生活不能自理、完全依赖他人、且量便失禁。得分在0~2分的患者说明其预后良好,得分在3~5分者预后不良。
1.4 统计学方法
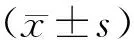
2 结果
2.1 FHL1 A在胶质瘤和相应瘤周正常脑组织中的表达
通过对38例患者的胶质瘤及肿瘤组织周围的正常组织标本进行western blot以及免疫组化检测,结果发现,FHL1A在肿瘤组织周围的正常组织中表达(125.3±10.3)高于在胶质瘤中的表达(12.3±2.0),且差异具有统计学意义(t=4.303,P=0.0311)。
2.2 不同胶质瘤级别患者的预后评价
经改良Rankin’s法评分后,WHO Ⅳ级组得分(4.9±1.8)最高,WHOⅠ级组得分(2.2±0.7)最低,WHO Ⅱ级得分(3.8±0.8),WHO Ⅲ级得分(4.1±1.0),不同级别患者得分具有统计学差异(F=11.35,P<0.05)。
2.3 FHL1A表达与胶质瘤临床病理特征的关系
对所搜集的89 例患者的胶质瘤石蜡标本进行免疫组化分析,根据患者预后评价结果,对 FHL1A的表达与患者的预后以及临床特点进行相关性分析,结果发现 FHL1A表达与胶质瘤级别具有负相关性,见表1。
3 讨论
脑部肿瘤占人类全身肿瘤发生率的2%,而胶质瘤是人体脑部肿瘤中最为常见的一种肿瘤,其致死率极高,预后较差[7]。且该类肿瘤在体内弥散性较快,对化疗及常规放射性疗法具有抵抗作用。而仅通过手术切除法治疗的患者,其生命也只能延续6~9个月。因此,对于胶质瘤的治疗以及预后探讨成为目前研究的热点及难点[8]。
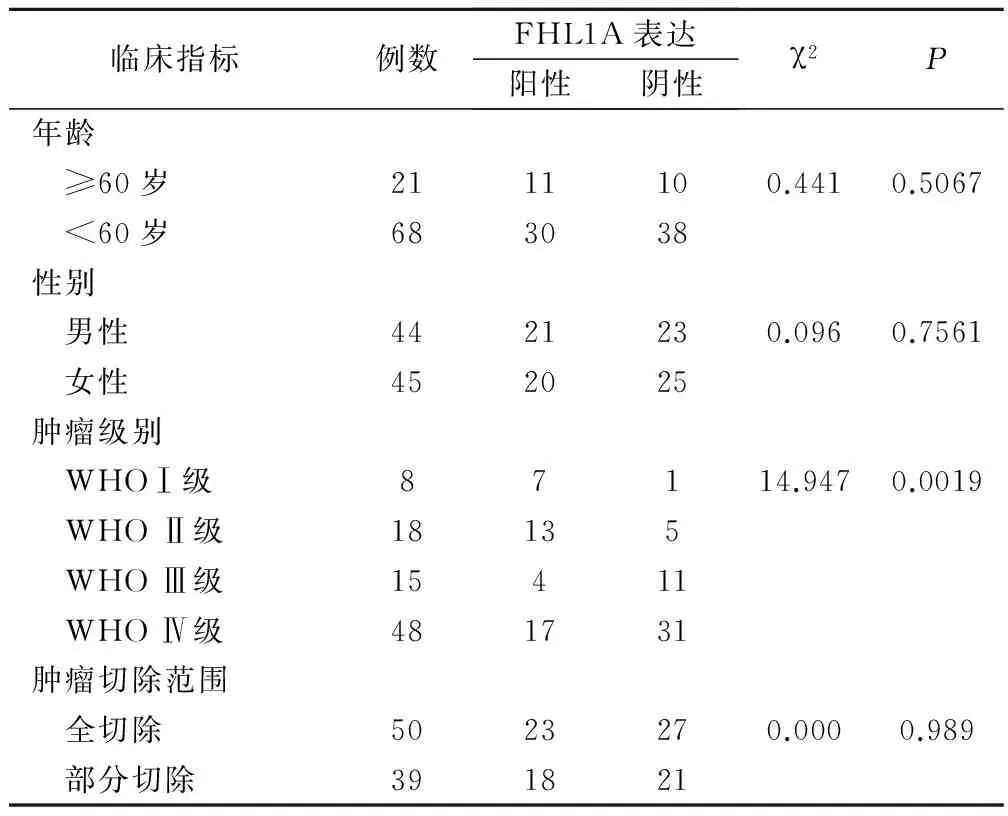
表1 FHL1A表达与胶质瘤临床病理特征的关系/例
通常情况下,肿瘤的发生、发展与转移都与细胞之间黏着有密切的关系[9],Notch 信号通路中的FHL 家族蛋白是参与黏着斑激酶的重要信号传导蛋白[10]。该类家族蛋白主要由4个半 LIM 结构域组成,包括FHL5(ACT)、FHL4、FHL3、FHL2以及FHL1蛋白[11]。FHL1为1种肿瘤抑制因子,在肺癌、乳腺癌、前列腺癌、肝癌以及胶质瘤中的表达呈明显降低,且参与有关Notch 信号通路、Cas 信号通路及Src信号通路,影响细胞正常的生长、分化以及骨架的重塑,对肿瘤细胞的发展以及转移具有一定的抑制作用[12]。而有关FHL1A是否参与胶质瘤的发生、发展,以及该指标与胶质瘤的预后关系少有报道。
本研究通过采用western blot 以及免疫组化检测对胶质瘤患者肿瘤组织以及其肿瘤组织周围的正常组织中FHL1A的表达量进行检测,结果发现,FHL1A在胶质瘤组织中的表达明显低于其在肿瘤组织周围的正常组织,且具有统计学差异(P<0.05)。说明该项指标与胶质瘤的发生有着密切的关系。根据文献调研我们发现,FHL1A 主要通过抑制 AKT 的磷酸化,进而干涉PI3K/AKT 信号通路的正常功能,对肿瘤细胞的细胞周期具有一定的影响,促进参与抑制细胞周期蛋白的依赖性激酶P21的表达,进而通过影响胶质瘤细胞的周期来控制胶质瘤细胞的增殖,起到抑制肿瘤细胞增殖的作用[13-14]。同时,FHL为Notch信号通路中重要的蛋白家族,而Notch信号通路与胶质瘤对于化疗药物的敏感性有密切关系,可以调节胶质瘤细胞对于化疗的耐受程度,对胶质瘤的预后有着极大的影响。而FHL1A可以有效地阻断Notch信号通路中磷酸化过程[15],进而阻断该通路的信号传导,可以耗竭胶质瘤干细胞,并且增加胶质瘤细胞对于化疗药物以及放射性治疗的敏感性,提高治愈率,改善胶质瘤的预后。
此外,本研究还通过对不同肿瘤级别的样本中FHL1A表达进行检测后发现,胶质瘤肿瘤级别越高,其中FHL1A表达量越低,说明胶质瘤肿瘤级别与FHL1A表达水平存在负性相关性,经统计学分析发现P值小于0.05。改良的Rankin’s法评分中分数越高说明患者预后效果越差,其自理能力恢复越差。本研究中采用改良Rankin’s法评分法对各入选患者的预后进行评价,结果发现,肿瘤级别越高的患者术后预后结果越差,也进一步证实了FHL1A表达水平与患者预后的相关性,两者也存在负性相关性。实验中还考察了FHL1A与患者年龄、性别以及做肿瘤切除手术的范围之间的关系,结果发现,FHL1A与上述一些临床指标间并不存在相关性,经统计学分析P值大于0.05。而FHL1A却与患者肿瘤级别类型密切相关,从侧面反映出FHL1A与胶质瘤发生发展的关系。
本研究探讨了FHL1A表达水平的高低与胶质瘤患者病情的严重程度的关系,结果表明该项指标可以作为胶质瘤病情演化严重程度的一项参照指标,FHL1A表达较高的患者,其胶质瘤级别较高,且预后不良,该项指标的表达与患者预后呈现负性相关性。因此,该项指标对于临床检测及预后判断具有一定借鉴价值。
[1] van Loon EM,Heijenbrok-Kal MH,van Loon WS,et al.Assessment methods and prevalence of cognitive dysfunction in patients with low-grade glioma:A systematic review〔J〕.J Rehabil Med,2015,47(6):481-488.
[2] Liu P,Man Y,Wang Y,et al.Mechanism of BMP9 promotes growth of osteosarcoma mediated by the Notch signaling pathway〔J〕.Oncol Lett,2016,11(2):1367-1370.
[3] Vitale MA,Brogan DM,Shin AY,et al.Intra-articular fractures of the sigmoid notch of the distal radius:analysis of progression to distal radial ulnar joint arthritis and impact on upper extremity function in surgically treated fractures〔J〕.J Wrist Surg,2016,5(1):52-58.
[4] Deford P,Brown K,Richards RL,et al.MAGP2 controls N- otch via interactions with RGD binding integrins:Identification of a novel ECM-integrin-Notch signaling axis〔J〕.Exp Cell Res,2016,341(1):84-91.
[5] Brangulis K,Petrovskis I,Kazaks A,et al.Structural characterization of CspZ,a complement regulator factor H and FHL-1 binding protein from Borrelia burgdorferi〔J〕.FEBS J,2014,281(11):2613-2622.
[6] Gutierrez V1,Kassim S,Bibi O,et al.Alternative for carpal tunnel injection:palmar injection site(Rankin's zone)〔J〕.J Surg Orthop Adv,2015,24(1):1-4.
[7] Westphal M,Lamszus K.Circulating biomarkers for gliomas〔J〕.Nat Rev Neurol,2015,11(10):556-566.
[8] Ganau L,Paris M,Ligarotti GK,et al.Management of gliomas:overview of the latest technological advancements and related behavioral drawbacks〔J〕.Behav Neurol,2015,2015:862634.
[9] Chandra V,Kim JJ,Mittal B,et al.MicroRNA aberrations:An emerging field for gallbladder cancer management〔J〕.World J Gastroenterol,2016,22(5):1787-1799.
[10] Lin J,Qin X,Zhu Z,et al.FHL family members suppress vascular endothelial growth factor expression through blockade of dimerization of HIF1α and HIF1β〔J〕.IUBMB Life,2012,64(11):921-930.
[11] Castiblanco-Valencia MM,Fraga TR,Silva LB,et al.Leptospiral immunoglobulin-like proteins interact with human complement regulators factor H,FHL-1,FHR-1,and C4BP〔J〕.J Infect Dis,2012,205(6):995-1004.
[12] Yue J,Guan J,Wang X,et al.MicroRNA-206 is involved in hypoxia-induced pulmonary hypertension through targeting of the HIF-1α/Fhl-1 pathway〔J〕.Lab Invest,2013,93(7):748-759.
[13] Schessl J1,Feldkirchner S,Kubny C,et al.Reducing body myopathy and other FHL1-related muscular disorders〔J〕.Semin Pediatr Neurol,2011,18(4):257-263.
[14] Christodoulou DC,Wakimoto H,Onoue K,et al.5'RNA-Seq identifies Fhl1 as a genetic modifier in cardiomyopathy〔J〕.J Clin Invest,2014,124(3):1364-1370.
[15] Liang L,Zhang HW,Liang J,et al.KyoT3,an isoform of murine FHL1,associates with the transcription factor RBP-J and represses the RBP-J-mediated transactivation〔J〕.Biochim Biophys Acta,2008,1779(12):805-810.
(编辑:甘 艳)
Expression of FHL1A in Gliomas Tissues and Its Correlations with Prognosis
WEI Xisheng,ZHENG Xiaojun,ZENG Biliang,et al.
The 421 Hospital of PLA,Guangzhou,510318
Objective To investigate the expressions of FHL1A in gliomas tissue and the relationship between their expressions and prognosis of patients with gliomas.Methods Immunohistochemistry SP methods were applied to detect the expression of FHL1A in 89 cases of gliomas organization and western blot also applied to analyze the expression levels differences of FHL1A of 38 matched samples(normal tumor tissue and surrounding normal tissue of the same patients).The relationship between the expression levels and the glioma prognosis were analyzed.Results The expression of FHL1A in gliomas was significantly lower than the corresponding peritumoral normal brain tissue,and the difference had statistical significance(P<0.05);The expression of FHL1A was inversely correlated with tumor grade of gliomas and the lower expression of the FHL1A of patients,the worse prognosis appeared in patients.Conclusion The expression of FHL1A is closely related to the prognosis and malignancy of glioma,and has reference values for clinical diagnosis and prognosis.
Gliomas;FHL1A;Prognosis
510318 解放军第四二一医院
10.3969/j.issn.1001-5930.2017.08.003
R730.264
A
1001-5930(2017)08-1229-04
2017-04-06
2017-05-25)

