老年2型糖尿病颈动脉粥样硬化斑块与纤维蛋白原的关系
何英鸾
[摘要] 目的 探讨老年2型糖尿病颈动脉粥样硬化斑块与纤维蛋白原的关系。方法 采用回顾性分析法,选取该院2016年1月—2017年1月期间收治的90例老年2型糖尿病颈动脉粥样硬化斑块患者,依据患者斑块类型将患者分为3组,无斑块组(30例)、稳定斑块组(30例)、不稳定斑块组(30例)。观察组3组患者血纤维蛋白原水平。结果 无斑块组和稳定板块组相比血FG差异无统计学意义(P>0.05);不稳定斑块组血FG明显高于稳定斑块组和无斑块组血FG水平,差异有统计学意义(P<0.05);纤维蛋白原与斑块性质呈中度相关。结论 血纤维蛋白原与颈动脉粥样硬化斑块性质有关,血纤维蛋白原决定着颈动脉粥样硬化斑块稳定性。
[关键词] 老年;2型糖尿病;颈动脉粥样硬化斑块;纤维蛋白原
[中图分类号] R59 [文献标识码] A [文章编号] 1672-4062(2017)04(a)-0050-02
颈动脉粥样硬化斑块(AS)主要是颈动脉狭窄和斑块脱落造成的一种疾病,2型糖尿病患者纤溶、血脂絮乱、凝血等,对内皮细胞损坏比较大;血液凝血系统活性增强,进而导致动脉粥样硬化,这样就加大了糖尿病患者缺血性脑卒中发生概率[1-2]。有关研究发现血液纤维蛋白原(FG)是凝血因子之一,同时也是脑卒中、周围动脉粥样硬化疾病重要危险因素之一。该次研究在此基础上分析老年2型糖尿病颈动脉粥样硬化斑块与纤维蛋白原的关系,现报道如下。
1 资料与方法
1.1 一般资料
随机选取该院2016年1月—2017年1月期间收治的90例老年2型糖尿病颈动脉粥样硬化斑块患者进行研究,所有患者均符合WHO糖尿病相关诊断标准。依据斑块类型将患者分为3组,无斑块组(30例)、稳定斑块组(30例)、不稳定斑块组(30例)。无斑块组:男16例,女14例;年龄45~85岁,平均年龄(62.24±4.26)岁;病程:7个月~6年,平均病程(3.45±1.24)年;稳定斑块组:男18例,女12例;年龄49~89岁,平均年龄(65.18±4.52)岁;病程:6个月~8年,平均病程(3.47±2.35)年;不稳定斑块组:男19例,女11例;年龄50~89岁,平均年龄(65.85±5.24)岁;病程:5个月~9年,平均病程(4.12±1.89)年。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。纳入标准:①年龄40岁以上;②经超声诊断确定双侧颈动脉中至少1条动脉内膜中层厚度在1.2 mm以上;③所有患者均签书知情同意书。排除标准:①有出血倾向者;②由感染性心内膜炎、肺静脉血栓引发的脑栓塞者;③肝胆肾严重疾病者;④需要长期服用抗凝药物者
1.2 方法
1.2.1 纤维蛋白原检测方法 患者入院后,于第2天早晨抽取空腹静脉血液3 mL,并注入含有枸缘酸钠抗凝剂玻璃管内。检测仪器采用背景赛科希德AS-6000自动血流变学测试仪,并采用先进的椎板测量方法测试FG含量。
1.2.2 颈动脉斑块检测 利用HP5500彩色多普勒超声诊断仪检测颈动脉,首先嘱咐患者取仰卧位,颈后枕薄枕头,头略微偏向对侧,并充分暴露患者颈部,并利用751 MHz探头放置于患者胸锁乳突肌或前缘、后缘,从患者颈总动脉起始处开始滑行到颈内动脉入颅段血流显示不清为止。所有被检者均要实施颈动脉超声检查。
1.3 诊断标准
斑块超声诊断标准:患者血管内中膜突出于表面或厚度均在1.3 mm以上,回声较均匀、明显增强,后方伴声影者为硬斑;后方无声影者为软斑,两种回声同时称为混合型斑块。稳定斑块:硬斑为;不稳定性斑块:混合型斑和软斑。
1.4 统计方法
该次研究所有数据分析均利用SPSS 20.0统计学软件进行处理,组间数据比较采用±标准差(x±s)表示,行t检验,P<0.05为差异有统计学意义。
2 结果
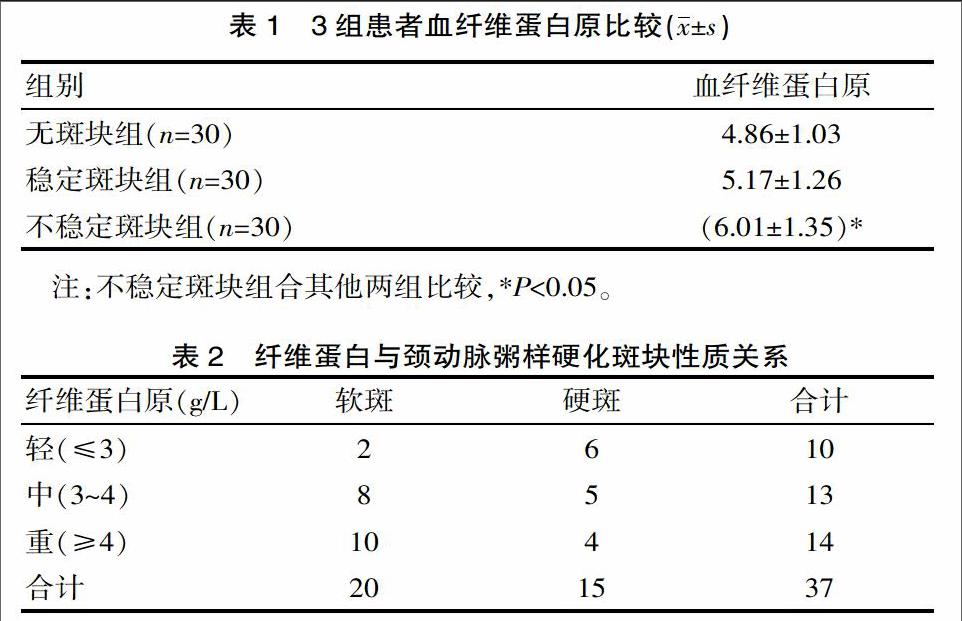
2.1 3组患者血纤维蛋白原比较
经过检测发现,无斑块组和稳定板块组血FG相比,差异无统计学意义(P>0.05);不稳定斑块组血FG明显高于稳定斑块组和无斑块组血FG水平,差异有统计学意义(P<0.05),详见表1。
2.2 FG与颈动脉粥样硬化斑块性质关系
经过观察发现,纤维蛋白原水平和颈动脉粥样硬化斑块性质有一定的关系,纤维蛋白原水平越高,患者颈动脉粥样硬化斑块越严重;FG与斑块性质呈中度相关,见表2。
3 讨论
脑梗死发病的主要原因是由于AS引起,而AS是人体血液内脂质成分沉积于动脉壁内膜,导致动脉壁内膜出现灶状纤维化,并形成局部粥样斑块,进而导致血管壁变硬,患者出现血管腔狭窄。该病主要累及大中动脉,常见于主动脉、颈动脉以及冠状动脉等等[3]。Temel[4]等专家研究发现平均血糖水平与颈动脉粥样硬化斑块有密切的关联性,颈动脉增加与餐后血糖有加大的关联性,餐后2 h血糖是颈动脉粥样硬化的主要危险因素,颈动脉斑块与心血管疾病有较大的关联性。
同时AS与患者FG之间也有一定的关联性,FG属于凝血银族,正常情况下人体血浆中的FG含量在2~4 g/L[5]范围内。人体内FG水平升高可能会使人体内血管中血液粘度升高,从而增加血栓的出现概率,这种情况下就会导致血管内平滑肌细胞和FG纤维蛋白结合物粘附作用在血栓形成过程中起着重要的作用[6]。其作用机制可以理解为:首先在凝血酶作用下可以讲FG能转变为纤维蛋白,而且FG会沉积在人體受损伤的动脉内膜上,这种情况下会增强其或者血管通透性,此时血液中的低密度脂蛋白比较容易沉积于血管内膜下,这种环境为AS的形成提供有利的条件;FG实际上是人体内肝细胞合成,肝细胞受到外界刺激后产生刺激因子,同时刺激增至血管中的平滑肌细胞,进而形成斑块。目前很多专家认为血管内皮功能不全主要是AS早期症状,其能够有效促进人体内血液弄得上升,进而刺激内皮细胞,分泌出纤溶酶原激活物的抑制剂,进而人体血管内会产生血栓,这时如果血栓不能及时清除,就会增加血管内部损伤,进而增加人体你饿胆固醇,最终形成AS;FG是大分子蛋白质,在人体内具有较高的东都,聚合性比较强,决定着血液黏度,血小板膜上含有上万的FG黏附受体,FG通过血小板促使血小板聚集,促进血栓形成,进而AS斑块形成。
FG与动脉硬化斑块性质也有一定的关联性,AS斑块的形成从病理方面来看可以分两种:粥样斑块、纤维斑块。利用数字化技术和高分辨彩色多普勒超声技术检测斑块能够比较直观的发现斑块状态;在超声环境下能够观察到低回声区的病灶症状,则提示斑块内出血,超声检查有火山口样影像,提示斑块已经破裂。AS斑块在超声图像上而已分为软斑和硬斑,软斑为不稳定斑块,比较容易脱落造成脑梗塞。该次研究结果显示不稳定斑块组血FG明显高于稳定斑块组和无斑块组血FG水平;纤维蛋白原水平越高,患者颈动脉粥样硬化斑块越严重;提示AS和FG之间有一定的关联性,FG水平高低直接影响着颈AS斑块的稳定性。这可能是由于FG使黏附分子的白细胞黏附增加,刺激患者平滑肌,增加血浆中的脂质纤维,促进斑块形成。
综上所述,血纤维蛋白原与2型糖尿病颈动脉粥样硬化斑块性质有关,血纤维蛋白原决定着颈动脉粥样硬化斑块稳定性。所以在治疗的过程中必须要降低患者脑血管并发症,关注患者颈动脉粥样斑块因素,从而预防患者心血管疾病的发生。
[参考文献]
[1] 王曼曼,舒冏,穆攀伟,等.2型糖尿病颈动脉粥样硬化斑块与尿微量白蛋白肌酐比值的关系[J].中国民康医学,2013, 25(9):28-29.
[2] 王曼曼,穆攀伟,曾龙驿,等.老年2型糖尿病颈动脉粥样硬化斑块与血纤维蛋白原的关系[J].内蒙古中医药,2013,32(17):2-3.
[3] 王曼曼,穆攀伟,曾龙驿,等.2型糖尿病颈动脉粥样硬化斑块与血白细胞的关系[J].中国现代药物应用,2013,7(7):5-6.
[4] Temelkova-kurktschievTS,KoehlerC,HenkelE,et al.Postchallengeplasma glucose and glycemic spikes aremorestronglyassociated with atherosclerosisthanfas tingglucoseorHbA1c level[J].Diabetes Care, 2000,23(12):1830-1834.
[5] 夏明武,賀军.脑梗死合并2型糖尿病的发生与颈动脉粥样硬化的相关性[J].中华神经医学杂志,2012,11(8):832-834.
[6] 邵红,谢立凯,吕丹,等.2型糖尿病患者血糖波动与颈动脉粥样硬化斑块的相关性[J].中国老年学杂志,2011,31(23):4518-4520.
(收稿日期:2017-03-08)

