雷公藤内酯醇联用甘草次酸的药代动力学研究
邓艳平, 戴雅彬, 陈开杰, 黄秀旺
雷公藤内酯醇联用甘草次酸的药代动力学研究
邓艳平1, 戴雅彬1, 陈开杰2, 黄秀旺1
目的 探讨甘草次酸对雷公藤内酯醇在大鼠体内的药代动力学行为的影响。 方法 将SD大鼠随机分为雷公藤内酯醇单独给药组和雷公藤内酯醇与甘草次酸联合给药组,分别通过尾静脉注射雷公藤内酯醇0.2 mg/kg,采用液相色谱-质谱法(LC-MS),选择离子检测(SIM)的方式测定2组大鼠不同时间血浆中的雷公藤内酯醇浓度,比较2组在大鼠体内的药代动力学行为。 结果 在0.2~250 ng/mL质量浓度范围内,血浆中雷公藤内酯醇线性良好。定量下限为0.2 ng/mL,日内和日间精密度RSD均<12.0%,准确度为90%~105%,绝对回收率>80%,基质效应>90%,血浆样品的稳定性良好。药代动力学数据显示,联合给药组的最大血药浓度(cmax)、消除半衰期(t1/2)、平均滞留时间(MRT0~180 min)、血药浓度-时间曲线下面积(AUC0~180 min)分别是单独给药组的0.75,2.51,1.15及1.39倍,其中t1/2、MRT0~180 min在2组间的差别有统计学意义(P<0.05)。 结论 甘草次酸与雷公藤内酯醇联用可降低雷公藤内酯醇的峰浓度,延长其体内滞留时间,从而提高其大鼠体内的生物利用度;该测定方法简便、效率高、重复性好,符合生物样品分析的基本要求。
雷公藤内酯醇; 甘草次酸; 药代动力学
雷公藤内酯醇(triptolide, TPL)是从卫矛科雷公藤属植物雷公藤中分离到的二萜内酯化合物,其药理活性广泛,具有显著的抗肿瘤、抗炎、抗生育及免疫抑制等作用,在临床上被用于治疗肾病综合症、自身免疫性疾病及癌症等,效果显著。但因其治疗窗窄以及肝、肾毒性,限制了其在临床的广泛应用[1]。为降低其毒性,许多学者做了大量的相关研究,如甘草与雷公藤配伍能显著降低雷公藤的毒性[2-3];中成药复方甘草酸铵与雷公藤同时使用可起到保肝作用,减轻对肝脏的影响[4]。其机制可能与甘草加速雷公藤甲素及雷公藤内酯酮的体内代谢与排泄,使药物浓度在各组织中平缓分布有关[5-6]。甘草的主要成分有黄酮类和三萜类等,甘草次酸(glycyrrhetinic acid,GA)就是三萜类活性成分的一种。为探讨TPL联用GA的静脉给药代谢动力学,本研究建立TPL的液相色谱-质谱(liquid chromatography-tandemmass spectrometry, LC-MS)测定方法,通过大鼠尾静脉给药,比较单独给药组和联合给药组的药代动力学行为,报道如下。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 TPL(批号:091001,纯度98.6%,福建汉堂生物制药股份有限公司);GA(批号:C10038704,纯度98%,上海麦克林公司);泼尼松龙(批号:T20J7H9291,HPLC>98%,上海源叶生物科技有限公司);乙酸乙酯(色谱纯,天津康科德科技有限公司);其余均为市售分析纯试剂。
1.1.2 仪器 高效液相色谱-质谱联用仪(Agilent 1260-6410,安捷伦科技有限公司);台式超声仪(KQ5200B,昆山市超声仪器有限公司);电子天平(XS105DΜ,瑞士Mettler-Toledo公司);离心浓缩仪(RVC 2-33 IR,德国Christ公司)。
1.1.3 动物 健康雄性SD大鼠12只,体质量192 g(180~220 g)[动物合格证号:SCXK(闽)2012-0001,福建医科大学动物试验中心]。
1.2 方法
1.2.1 血浆样品分析 采用LC-MS测定方法:(1)配制溶液。精密称取泼尼松龙对照品10.0 mg,于10 mL量瓶中用甲醇溶解定容,配成1.0 mg/mL的贮备液;精密称取TPL对照品10.0 mg,于10 mL量瓶中用甲醇溶解定容,配成1.0 mg/mL的贮备液;2种溶液均置于4 ℃冰箱保存待用。(2)液相色谱条件。色谱柱为Agilent Eclipse Plus C18 (2.1 mm×50 mm,3.5 μm);柱温30 ℃;流动相:水-甲醇梯度洗脱(45%的甲醇0~0.5 min;100%的甲醇0.5~1.00 min;100%的甲醇1.00~3.00 min;100%的甲醇3.10~4.80 min);流速0.2 mL/min;进样量5 μL。(3)质谱检测条件。电离方式:电喷雾离子源(ESI);正离子检测;扫描方式:选择性离子检测(SIM);检测的离子:TPL(m/z,383.1),内标泼尼松龙(m/z,383.2);离子源温度350 ℃;雾化气压25 psi;干燥气流速10 L/min;毛细管电压:正负电压分别为3 500和4 000 V。
1.2.2 血浆样品处理 精密吸取血浆100 μL,加入10 μL的内标溶液(1 μg/mL),再加入乙酸乙酯400 μL进行液-液萃取,涡旋混匀3 min,14 000 r/min离心5 min,取上清液于1.5 mL的EP管,置于60 ℃离心浓缩仪挥干,用100 μL流动相溶解残渣,涡旋混匀2 min,15 000 r/min离心5 min,取上清液于进样瓶中,进样5 μL。
1.2.3 方法学考察
1.2.3.1 专属性考察 取空白SD大鼠的血浆,按1.2.2操作,得到空白血浆样品色谱图。另取空白SD大鼠的血浆95 μL,加入TPL对照品溶液5 μL,涡旋混合后加入10 μL的内标溶液(1 μg/mL),按1.2.2操作,得到空白血浆添加对照品溶液色谱图。取给药后SD大鼠的血浆100 μL,按1.2.2操作,得到实测血浆样品色谱图。
1.2.3.2 标准曲线与线性范围 精密吸取2,4,10,20,50,100,250,500,1 250,2 500 ng/mL的TPL对照品溶液各5 μL,分别加入空白SD大鼠的血浆95 μL,配制成0.2,0.4,1,2,5,10,25,50,125,250 ng/mL的对照品血浆样品,混匀后加入10 μL的内标溶液(1 μg/mL),按1.2.2操作后进样分析。
1.2.3.3 定量下限 取空白血浆,制备5个独立的标准样品,其浓度应使信噪比(S/N)>10,在一定的准确度和精密度下(变异系数CV),该准确度和精密度的接受标准为CV<20%,偏差±20%。
1.2.3.4 精密度试验 取空白血浆95 μL,分别加入不同浓度TPL对照品溶液5 μL,涡旋混合,制备成0.4,10,125 ng/mL的QC样品(n=5)。按1.2.2操作,于1 d内连续测定,计算日内精密度;于5 d内分别取高、中、低3个浓度的QC样品同法操作,计算日间精密度。
1.2.3.5 回收率试验 各取5份浓度为0.4,10,125 ng/mL的QC样品,按1.2.2操作,以QC样品的TPL峰面积与相应对照品溶液的TPL峰面积之比为绝对回收率。以血浆样品标准曲线中TPL的测得量与TPL的加入量之比为相对回收率。
1.2.3.6 基质效应 取6只不同个体的大鼠空白血浆,按1.2.2操作,将有机溶剂挥发后,加入低、中、高浓度的对照品溶液,以所得峰面积与对应浓度的对照品溶液的峰面积之比计算基质效应。
1.2.3.7 样品稳定性 制备低、中、高浓度(0.4,10,125 ng/mL)的QC样品各5份,分别将样品于4 ℃和室温下放置24 h、-20 ℃冷冻24 h后取出,在室温下解冻,反复冻融3次。上述样品按1.2.2操作,并将测定结果代入标准曲线方程,得出样品中药物的浓度,考察其稳定性。
1.2.4 GA联合TPL或TPL单独给药的药代动力学研究
1.2.4.1 注射溶液的配制 精密称取一定量的TPL,用适量的丙二醇超声振荡至药物完全溶解,注射生理盐水稀释定容,充分混匀,配制成200 μg/mL的TPL注射液。精密称取一定量的TPL和GA(w/w为1∶1),用适量的丙二醇超声溶解至完全溶解,注射生理盐水稀释定容,充分混匀,配制成200 μg/mL的TPL联合GA注射液。
1.2.4.2 SD大鼠尾静脉给药 雄性SD大鼠12只,实验前禁食12 h,自由饮水。实验时固定在专用固定器,做好标记,然后按单独给药组(TPL:0.2 mg/kg)、联合给药组(GA:0.2 mg/kg,TPL:0.2 mg/kg),每组6只,尾静脉注射。给药后于2.5,5,10,15,20,30,45,60,120,240,360 min分别取血0.3 mL于肝素化的EP管,8 000 r/min离心10 min,取上层血浆冻存于-80 ℃冰箱。
1.3 统计学处理 采用DAS 3.2.3药代动力学智能分析软件进行数据分析,采用非房室模型法估算SD大鼠给药后的药代动力学参数。
2 结 果
2.1 血浆样品分析方法的建立与验证
2.1.1 专属性考察 TPL和泼尼松龙全扫描如图1所示。在本实验条件下,血浆中内源性物质不干扰动物体内TPL和泼尼松龙含量的测定,TPL的保留时间约为2.86 min,峰形对称无拖尾,具有较好的分离度(图2)。
2.1.2 标准曲线与线性范围 以TPL的血浆药物浓度(x)为横坐标,TPL与内标的峰面积比(y)为纵坐标,得到标准曲线方程为:
y=8.95×10-2x-1.07×10-2(r=0.999 1,n=5)
线性范围为0.2~250 ng/mL。
2.1.3 定量下限 定量下限为0.2 ng/mL,在该水平浓度时,相对标准偏差(RSD)和CV均<20%。表明此浓度范围达到分析要求。
2.1.4 精密度和准确度 低、中、高3种浓度的日间和日内CV均<12%,准确度95%~105%,符合血浆样品分析要求(表1)。
2.1.5 回收率 低、中、高3种浓度的样品在SD大鼠血浆样品中的绝对回收率均>85%,回收率较高,同时各样品的批内及批间精密度RSD均<15%,符合生物样品的分析要求(表2)。低、中、高3种浓度的样品在SD大鼠血浆样品中的绝对回收率为99%~102%,回收率较高,同时各样品的批内及批间精密度RSD均<15%,符合生物样品的分析要求(表2)。

A:雷公藤内酯醇;B:泼尼松龙.图1 雷公藤内酯醇和泼尼松龙全扫描质谱图Fig 1 Negative ion mass spectra of triptolide and prednisolone(I.S)
Tab 1 Precision of the determination method in SD rat plasma samples

ρTPL/(ng·mL-1)日内精密度日间精密度0.46.4711.93100.915.341250.752.92
n=5,表中数据为%. TPL:雷公藤内酯醇.
表2 SD大鼠血浆样品中TPL的绝对回收率和相对回收率试验结果
Tab 2 Extraction and relative recoveries of triptolide in SD rat plasma samples

回收率ρTPL/(ng·mL-1)0.410125绝对回收率92.85±5.7188.35±1.3186.26±0.50相对回收率99.14±2.73100.3±2.23101.2±2.11
n=5,表中数据为%. TPL:雷公藤内酯醇.
2.1.6 样品稳定性 低、中、高3种浓度的样品在自动进样器放置24 h、室温下放置4 h或冻融循环3次的条件下,样品基本稳定(表3)。
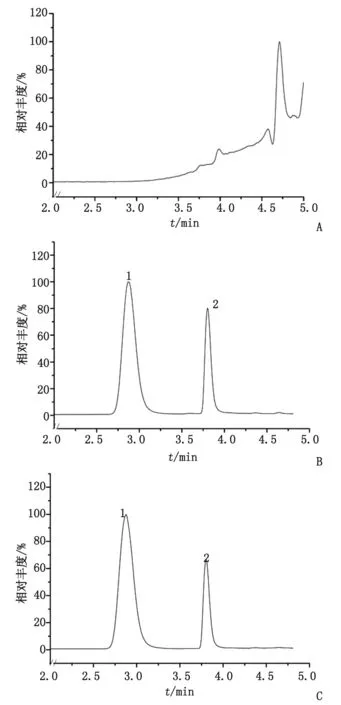
A:空白SD大鼠血浆;B:空白SD大鼠血浆添加对照品溶液;C:实际血浆样品. 1:雷公藤内酯醇;2:泼尼松龙.图2 大鼠血浆样品色谱图Fig 2 The LC chromatograms of SD rat plasma samples
2.1.7 基质效应 低、中、高浓度的基质效应SD大鼠血浆中均>90%,符合生物样品的分析要求。
2.2 联合给药及单独给药的大鼠药代动力学研究
2.2.1 药-时曲线 SD大鼠尾静脉注射,平均血药浓度与时间曲线如图3所示。给药后体内不同时间点联合给药组、单独给药组的消除过程基本呈线性动力学特征。
2.2.2 体内药代动力学参数估算 如表4所示,联合给药组在血浆中最大血药浓度(cmax)、消除半衰期(t1/2)、平均滞留时间(MRT0~180 min)、血药浓度-时间曲线下面积(AUC0~180 min)分别是单独给药组的0.75,2.51,1.15,1.39倍,且2组的t1/2及MRT0~180 min差别有统计学意义(P<0.05)。

表3 SD大鼠血浆样品中TPL的短期稳定性考察结果
n=5,表中数据为%. TPL:雷公藤内酯醇.

图3 单独给药组和联合给药组的药-时曲线Fig 3 The average plasma concentration-time curve after intravenous injecting glycyrrhetinic acid compatibility with TPL and TPL solvents
Tab 4 Pharmacokinetic parameters in rats after intravenous injection of TPL compatibility with glycyrrhetinic acid and TPL solvents

参 数 单独给药组联合用药组cmax/(μg·L-1)56±342±16t1/2/min27.1±2.368±25☆MRT0~180min/min46.3±0.953.2±2.9☆Vz(L/kg)5.1±0.810±6CLz(L/min/kg)0.05±0.000.09±0.03AUC0~180min(min·μg/L)1548±1192153±585AUC0-∞min(min·μg/L)1615±432196±574
n=6.cmax:最大血药浓度;t1/2:消除半衰期; MRT:平均滞留时间; Vz:表观分布容积; CLz:清除率; AUC:血药浓度-时曲线下面积. 与单独给药组比较,☆:P<0.05.
3 讨 论
近几年来,TPL的应用引起了国内外医药界的广泛关注,但大量研究表明,TPL具有很强的毒性,阻碍了其广泛的临床应用。甘草能够降低雷公藤的毒性,如30 mg/kg的甘草灌胃给药后,可以加速TPL在体内的代谢[6];GA与雷公藤配伍使用可明显降低肝损伤的发生率,如GA与TPL联用能降低TPL的毒性[7];GA受体不仅具有肝细胞亲和能力,还可以增加纳米粒子对肝癌细胞的摄取[8-10]。但目前临床上甘草或GA的给药途径均是口服,而TPL主要是静脉给药。本研究通过静脉给药方式,研究GA与TPL在大鼠体内的药代动力学,在给药方式和剂量上均有所不同。本研究给药剂量仅为200 μg/kg,体内TPL浓度低,需要筛选一种高灵敏度的测定方法。本实验在选择质谱的离子源、检测和扫描方式检测离子时,综合了较多参考文献[11-16],发现采用ESI源后,电离效率显著提高,响应值增大,离子化效果更佳。对1 μg/mL的TPL进行正负离子全扫描,结果如下:[M-H]-=5.0×104,[M+H]+=4.8×104,[M+K]+=5.0×104,[M+Na]+=3.0×105,因此最终选择ESI源,[M+Na]+(m/z,383.1)的响应信号相对较高且稳定。选用水和甲醇作为流动相,流速为0.2 mL/min。在本研究的条件下,TPL与内源性的杂质分离较好,峰形较佳,检测灵敏度与效率高,方法简便、可靠。定量下限为0.2 ng/mL。预实验过程中,通过摸索GA与TPL不同比例的组合,发现当GA∶TPL的质量比为1∶1联合给药时,在SD大鼠的血浆中有较低的cmax及较大的AUC0~180 min,且平均滞留时间延长。药代动力学参数分析结果中,对于峰浓度,联合给药组较单独给药组有所下降,这可能与GA改变了TPL在体内的代谢过程有关。一方面使其血药浓度降低,避免了由于血药浓度达到中毒剂量而产生毒性;另一方面又延长了作用时间,提高疗效,可能与GA的加入使TPL在肝脏内的滞留时间延长有关。推测TPL与GA联合给药可延长TPL在体内的滞留时间,从而提高其生物利用度,与文献报道的GA及其代谢物能竞争性抑制TPL的体外代谢相吻合[7]。
总之,GA联合TPL可影响TPL在体内的药代动力学过程,深入研究二者联用的机制有助于将来对抗肝癌靶向药物的开发。
[1] 刘 良, 王战勇, 黄光照, 等. 雷公藤甲素亚慢性中毒对昆明种小鼠肾脏及睾丸的影响[J]. 华中科技大学学报(医学版), 2001,30(3):214-217.
[2] 刘星雨. 甘草水提物对细胞色素P450酶主要亚型的表达影响及其对雷公藤内酯醇的减毒增效作用[D]. 镇江:江苏大学, 2014.
[3] 李志华, 颜 苗, 张毕奎, 等. 基于药动学的甘草配伍减毒机制研究进展[J]. 中草药, 2015,46(23):3611-3616.
[4] 陈晓峰. 复方甘草酸铵联合雷公藤多苷治疗泛发性湿疹90例[J].中国中西医结合皮肤性病学杂志, 2010,9(4):231.
[5] 刘建群, 李 青, 张 锐, 等. LC-MS/MS法研究甘草对雷公藤甲素药代动力学及组织分布与排泄的影响[J]. 药物分析杂志, 2010,30(9):1664-1671.
[6] 张 锐, 李 青, 刘 芳, 等. LC-MS/MS法研究甘草对雷公藤内酯酮药代动力学及组织分布与排泄的影响 [J]. 中国实验方剂学杂志, 2010,16(7):151-156.
[7] Han F M, Peng Z H, Wang J J,etal.Invivoeffect of triptolide combined with glycyrrhetinic acid on rat cytochrome P450 enzymes [J].ActaPharmaceuticaSinica, 2013,48(7):1136.
[8] 黄 微, 王 平, 王 蔚, 等. 甘草次酸修饰PEG-PLGA纳米粒的制备及与肝癌细胞的亲和性[J]. 高等学校化学学报, 2011,32(2):416-420.
[9] 周长升, 芶 欣, 王效民, 等. 18β-甘草次酸抑制肝癌细胞生长的实验研究[J]. 中国普通外科杂志, 2016,25(8):1168-1174.
[10] Chen J, Jiang H, Wu Y,etal. A novel glycyrrhetinic acid-modified oxaliplatin liposome for liver-targeting andinvitro/vivoevaluation [J].DrugDesignDevelopmentandTherapy, 2015,9(4):2265-2275.
[11] 邵 凤, 王广基, 孙建国, 等. 雷公藤内酯醇在Beagle犬体内的药代动力学[J]. 药学学报, 2007,42(1):61-65.
[12] 余 炜, 黄秀旺, 许建华, 等. HPLC法测定大鼠血浆中雷公藤内酯醇及其药代动力学研究[J]. 中药药理与临床, 2007,23(2):15-17.
[13] 刘萍霞, 刘频健, 庄笑梅, 等. 抗肿瘤化合物MC002的活性代谢产物雷公藤内酯醇在大鼠体内药代动力学与组织分布[J].中国药理学与毒理学杂志, 2011,25(2):206-210.
[14] 柏小辉, 潘荣华, 芮国华, 等. UHPLC-MS/MS法测定雷公藤甲素人血浆蛋白结合率[J]. 中国医药导报, 2016,13(21):46-49.
[15] 刘萍霞, 庄笑梅, 王 娟, 等. 雷公藤内酯醇前药MC002在大鼠体内药代性别差异研究[J]. 解放军药学学报, 2012,28(5):389-391.
[16] 秦春雨, 周 滔, 宫雯雯, 等. UPLC-MS/MS法测定大鼠血浆中雷公藤内酯醇及其药代动力学[J]. 首都医科大学学报, 2015,36(1):121-126.
(编辑:何佳凤)
Pharmacokinetics of Glycyrrhetinic Acid Combined with Triptolide in Ratsinvivo
DENG Yanping1, DAI Yabin1, CHEN Kaijie2, HUANG Xiuwang1
1. Department of Pharmaceutics, School of Pharmacy, Fujian Medical University, Fuzhou 350122, China; 2.Department of Pharmacy, The 175th Hospital of PLA, Zhangzhou 363020, China
Objective To investigate the pharmacokinetics of glycyrrhetinic acid combined with triptolide (TPL) in SD rats. Methods The SD rats were divided into single and combined administration groups. The combined group was injected with triptolide and glycyrrhetinic acid (w/w=1∶1) at the dose of 0.2 mg/kg, while the single group was injected only with triptolide at the dose of 0.2 mg/kg. The concentration of triptolide in plasmainvivowas determined by LC-MS method. Results The determination methods with good precision and stability were suitable for the assay of triptolide in biological samples. The linear range of 0.2~200 ng/mL and quantification of 0.2 ng/mL were established. The mean absolute recovery was more than 85%. The relative standard deviation (RSD) of intra-day and inter-day were all less than 12%. The results showed that thecmax,t1/2, MRT0~180 min, AUC0~180 minof combined administration group were 0.75, 2.51, 1.15, 1.39 times of that of the single administration group in the plasma respectively. Between the two groups, thet1/2, MRT0~180 minwere statistically significant. Conclusion The method was proved to be convenient, sensitive, rapid and suitable for pharmacokinetics study. Glycyrrhetinic acid can extend the residence time of TPLinvivoand prolong the circulation time of TPLinvivoremarkable.
Triptolide; glycyrrhetinic acid; pharmacokinetics
2017-03-01
福建省自然科学基金(2016J01370)
1. 福建医科大学 药学院药剂学系,福州 350122; 2. 中国人民解放军第一七五医院 药学科,漳州 363020
邓艳平,女,讲师,医学博士
黄秀旺. Email: xhw705@126.com
R332; R284.1
A
1672-4194(2017)03-0150-05

