大豆矮化突变体苗期表型观察及对外源激素的响应
李元龙 ,王中华 ,冯献忠
(1.西北农林科技大学 农学院,陕西杨凌 712100;2.中国科学院 东北地理与农业生态研究所,长春 130000)
大豆矮化突变体苗期表型观察及对外源激素的响应
李元龙1,王中华1,冯献忠2
(1.西北农林科技大学 农学院,陕西杨凌 712100;2.中国科学院 东北地理与农业生态研究所,长春 130000)
以‘菏豆12’及其60CO-γ射线诱导矮化突变体为材料,研究突变体的第一复叶叶柄长度、苗期株高、叶柄显微结构,利用4种外源激素处理根系,初步探查突变基因的类型。结果表明:该突变体叶柄比野生型短,株高矮,整体紧凑。叶柄横切观察发现,该突变体木质部细胞及髓细胞直径变小。根系对6-苄氨基嘌呤(6-BA)、赤霉素(GA3)、吲哚乙酸(IAA)非常敏感,对油菜素内酯(BR)无应答,表明该突变体可能是BR信号转导出现障碍,后续目标基因发掘应围绕BR信号转导途径的相关基因展开。矮化短叶柄突变体在大豆理想株型改造与大豆分子育种中可能具有潜在利用价值。
大豆;矮化突变体;短叶柄;根系;植物外源激素;显微结构
高产是大豆育种的重要目标,受谷物的“绿色革命”启示,通过适度降低大豆株高,高密度种植可提高植株的水分利用效率,从而增加大豆的单位面积产量[1]。研究表明,大豆矮杆、短叶柄可以改变大豆冠层结构,形成紧凑的株型,可以在高密度种植的前提下,最大限度地提高群体光能利用率而增加产量[2]。对于大豆矮杆、短叶柄的研究最早始于1983年,Kilen发现1个大豆矮杆、短叶柄突变体‘D76-1609’,其与长叶柄大豆‘Lee68’杂交,遗传分析表明该短叶柄性状受1对隐性基因控制, 命名为lps[3]。1998年,南京农业大学大豆研究所发现新型大豆短叶柄突变体‘NJ90L-1SP’,表现为短叶柄且叶枕异常。遗传研究发现这两个性状受2对隐性重叠基因 lps1和 lps2控制[4]。2009年,Jun等发现1个大豆短叶柄突变体——‘SS98206’,经过遗传分析后发现其基因与‘D76-1609’短叶柄基因lps不是等位基因。且其表型与‘NJ90L-1SP’的表型明显不同,故命名该基因为 lps3[5]。由此可见,培育和研究矮化、短叶柄大豆突变体一方面丰富了大豆的遗传资源;另一方面对于培育大豆理想株型、高密种植来提高产量具有重要意义。
许多研究表明植物矮化多是由某一植物激素无法合成或某一植物激素作用通路受阻所致[6-7]。在豌豆矮化突变体1 kb中存在GA信号转导异常和IAA合成缺陷[8]。在番茄中与BR合成相关的dwarf基因突变造成植株矮化[9]。Sasaki等[10]对1个GA不敏感水稻矮化突变体研究发现,GID1和GID2与GA信号转导相关。张达对矮化大豆突变体‘东泽11号’的激素处理研究和李葳对矮杆及半矮杆大豆突变体的激素处理研究都证明GA3与大豆矮化存在正相关联系[11-12]。矮化植株的细胞学研究发现,矮化表型主要由于细胞数目减少或细胞间隙变小,细胞长度变短所致。多种激素间存在复杂的相互作用且均会影响植物发育。GA可以影响细胞分裂的某个阶段促进细胞分裂的进程和细胞壁长轴以及微管的伸长[13],IAA可促进GA1的生物合成,抑制GA1向无活性的GA29转化[14]。BR在促进植株生长的过程中具有纵向伸长和横向扩展的双重作用,作用机制既不同于IAA,也不同于GA[15]。由此可见,激素与矮化、短叶柄性状有紧密的关系。
本研究对60CO-γ射线诱变‘菏豆12’产生的1个矮化短柄突变体的株高、叶柄长度进行动态观测,对叶柄进行显微观察。为了研究该突变体与激素的关系,采用4种激素处理来检测突变体与野生型‘菏豆12’的表型差异,为进一步研究该大豆矮化、短叶柄性状的调控基因功能奠定基础。
1 材料与方法
1.1 材料与试剂
大豆突变体由‘菏豆12’经60CO-γ诱变而来,由中国科学院东北地理与农业生态研究所提供。野生型大豆‘荷豆12’由山东省菏泽市农科所选育。
所用植物激素有6-苄氨基嘌呤(6-BA),赤霉素(GA3),吲哚乙酸(IAA),油菜素内酯(BR)。使用1/2 MS培养液(MS 2.165 g,蔗糖15 g,调节pH=5.8)配制4种植物激素的所需浓度。
1.2 试验方法
1.2.1 大豆幼苗株高和叶柄长度测量 挑选饱满、大小一致的突变体和‘菏豆12’种子,进行温室盆栽,从出苗后第10天开始,即第1片三出复叶完全展开,每隔3 d测量1次株高与第1片三出复叶叶柄长度,各取3株重复,共测量6次,每次测量3次取平均值,绘制生长曲线。
1.2.2 大豆突变体叶柄横切观察 材料取自成熟突变体和野生型‘菏豆12’植株上第4片复叶叶柄中间部位。各3个重复,置于FAA固定液中48 h,冲洗后备用,采用常规石蜡制片方法,切片厚度10 μm。番红固绿染色。阿拉伯树胶封片,在光学显微镜下观察拍照。各项数据测量取3个重复的“平均值±标准差”。
1.2.3 大豆突变体根系在不同激素处理反应 试验材料种植与管理:挑选饱满、大小一致的突变体和‘菏豆12’种子,用氯气(200 mL次氯酸钠+40 mL浓盐酸)熏蒸一夜,取出敞口放在超净工作台上吹0.5 h,封口放置2 d后分别放于无菌培养皿中,加适量无菌水,将培养皿封口放于37 ℃培养箱中,进行浸种处理(约60 h);将露出胚根的大豆,胚根向下依次放入Phytotc培养袋(北京启维益成科技有限公司)中,每个培养袋加入10 mL相应浓度的植物激素营养液。放于空气相对湿度为60%的培养室,设置温度(26 ℃光/24 ℃暗)和光照(13 h光/11 h暗)条件。每天向培养袋添加5 mL相应浓度的植物激素营养液,保持生长袋湿润。培养6 d后,观察根系生长情况。
外源激素浓度设置:对突变体和‘菏豆12’的种子同时设置4种外源植物激素处理,分别为IAA、6-BA、GA3、BR,每种植物激素设置3个浓度梯度处理,0.1、1、5 μmol/L,每个处理设3个重复。野生型与突变体对照组只用1/2 MS营养液处理。
2 结果与分析
2.1 突变体株高与叶柄长度的变化
从图1可以看出,突变体第一片叶叶柄长度明显短于野生型,且长度变化并不明显,平均只增长0.70 cm,而野生型的叶柄的伸长非常明显,大约是突变体的4倍,平均增长2.733 cm。突变体植株株高在出苗10~13 d增长显著,之后增长缓慢。野生型株高在全时期增长明显,在出苗后19~21 d增幅最大。以上结果表明,突变体的生长速度要弱于野生型。
2.2 叶柄显微结构观察
大豆叶柄横切从外到内依次是表皮、皮层、维管束、髓。具有多个维管束列,以大型维管束和小型维管束交替相间的方式环形排列,维管束类型为外韧维管束。通过显微观察发现,突变体叶柄表皮细胞,皮层细胞的大小形态与野生型差异不大,维管束个数与野生型类似,大致为13个。突变体叶柄中大型维管束管孔链数为3~4列,野生型中为3~5列(图2)。在细胞直径大小方面,突变体叶柄木质部导管细胞和髓细胞直径都显著小于野生型(P<0.05),野生型木质部导管平均直径为23.88 μm,而突变体木质部导管细胞平均直径只有19.26 μm。野生型髓细胞较突变体发达,细胞直径普遍较大,其中大于100 μm的有10个左右,而突变体中只有4个左右(表1)。综上所述,突变体大豆叶柄在整体的显微组成结构上相比于野生型无变化,但木质部细胞及髓细胞直径较野生型小,这可能由于突变体中细胞的横向发育能力下降所致。
2.3 外源激素处理对突变体根部的影响
早前研究表明,植物矮化与多种植物激素如GA、BR、IAA、6-BA有关[16]。主根长是评价根系生长发育的重要指标。本研究用4种植物激素处理该突变体根系,用主根长的变化判断突变是否与某种激素有关。
从图3得出,突变体主根长在应对不同浓度GA3、6-BA、IAA处理时的变化趋势与野生型类似。这表明突变体在应答模式上与野生型相同。不同的是,在0.1 μmol/L的GA3、6-BA、IAA低浓度处理下均会对突变体主根长产生显著影响,而对野生型影响不大。这可能是突变体在各激素旁系通路或激素平衡机制上出现异常,导致对低浓度激素敏感。在1和5 μmol/L的6-BA、IAA处理下,对突变体的促进率明显大于野生型。GA3与此相反(图3-Ⅱ)。
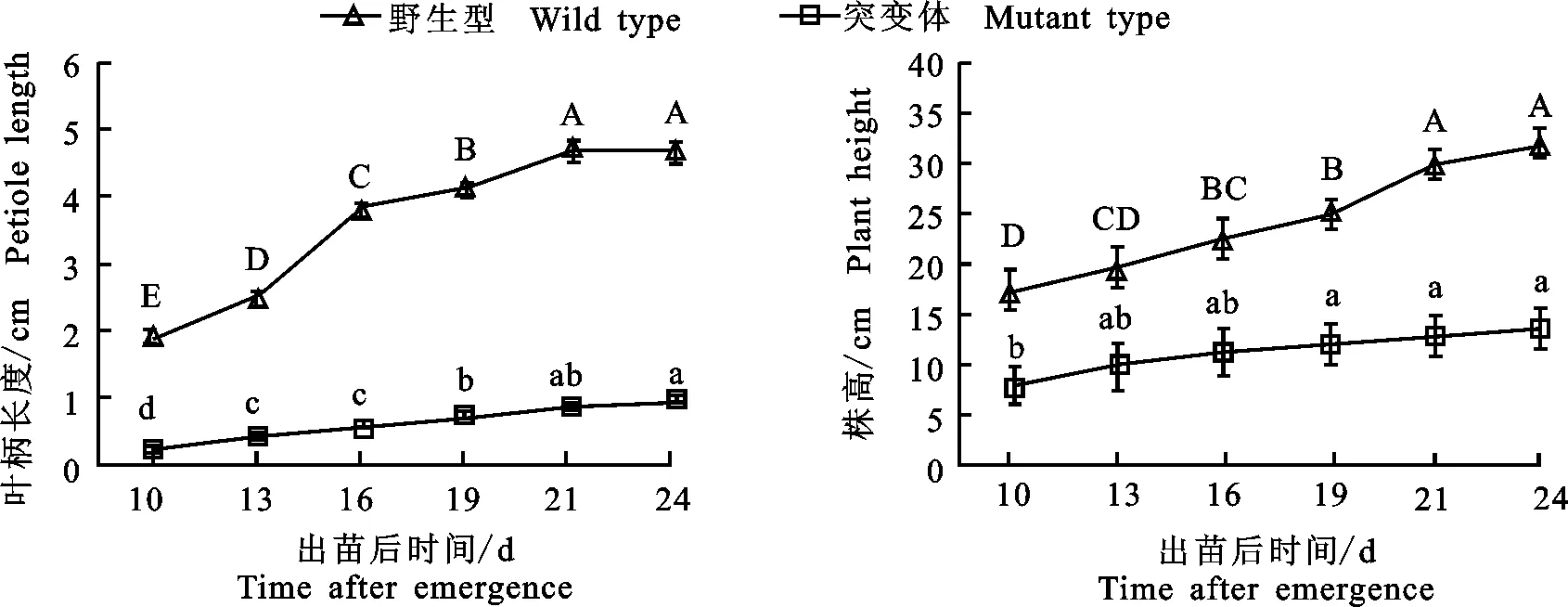
误差线为标准偏差;多重比较采用Duncan’s新复极差法,不同的大写字母为野生型内差异显著(P<0.05),不同的小写字母为突变体内差异显著(P<0.05),下同 The error bar is the standard deviation;based on Duncan ’s multiple comparison test, different capital letters mean significant difference among various periods in wild type(P<0.05), different small letters mean significant difference among various periods in mutant type(P<0.05),the same below
图1 野生型与突变体大豆株高和叶柄长度动态比较
Fig.1 Dynamic comparison of plant height and petiole length between wild type and mutant type
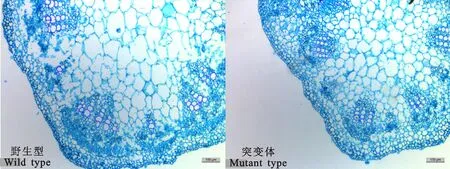
左图为野生型叶柄横切(10×),右图为突变体叶柄横切(10×) The wild type petiole crosscutting on the left, The mutant type petiole crosscutting on the right
图2 野生型与突变体大豆叶柄横切(10×)
Fig.2 Soybean petiole crosscutting between wild type and mutant type

表1 野生型与突变体叶柄横切显微结构Table 1 Petiole crosscutting microstructure between wild type and mutant type
注:多重比较采用Duncan’s新复极差法,*和**分别表示差异显著(P<0.05)和差异极显著(P<0.01)。
Note:Based on Duncan’s multiple comparison test, * and ** means significantly different at theP<0.05 andP<0.01respectively.
从BR处理结果可以看到,突变体大豆主根长的变化与野生型大豆主根长的变化有明显差别(图3-Ⅳ)。0.1 μm的BR处理对主根长的促进作用还并不明显,但在1 μm的BR处理下,野生型大豆主根长长度有明显增加,且对主根长伸长的促进效果是所有激素处理中最大的。随着外源BR浓度的升高,促进作用有所下降,但仍具有显著性差异。这表明正常大豆主根长长度是会随着外源BR浓度的变化而变化的,并会受到外源BR的强烈促进。但与此不同的是,在突变体中,无论何种浓度的BR处理都不会对主根长产生影响,突变体根系丧失对外源BR浓度变化的响应,这表明该大豆突变体根系存在应答BR信号通路上的缺陷,这种缺陷是造成该大豆突变体表型的主要原因。
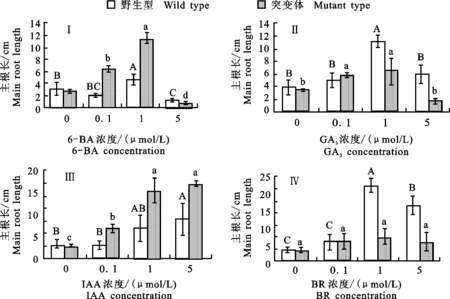
Ⅰ.6-BA处理 6-BA hormone treatment;Ⅱ.GA3处理 GA3hormone treatment;Ⅲ.IAA处理 IAA hormone treatment;Ⅳ.BR处理 BR hormone treatment
图3 不同激素处理对突变体大豆与野生型大豆根系的影响
Fig.3 Effects of different phytohormones on soybean root growth between wild type and mutant type
3 讨 论
新育大豆突变体株高变矮,叶柄缩短,整体呈现紧凑株型特征,叶柄木质部导管细胞和髓细胞直径明显小于野生型。该突变体与表现为株高和节间缩短、叶柄长短不变的矮化突变体‘东泽11号’是不同类型的突变体;与大豆短叶柄突变体‘D76-1609’‘NJ90L-1SP’和‘SS98206’的关系还需进一步确认。
该突变体对外源激素BR响应异常,说明该大豆矮化短柄突变体存在BR信号转导途径上的缺陷。BR信号转导受阻将导致细胞横向生长能力和分裂能力下降[17],这与叶柄切片的观察结果相符。对BR信号转导的研究表明,同一受体蛋白会存在于多种植物激素信号转导通路中,形成特殊的植物激素平衡机制,维持彼此含量平衡[18]。该突变体对低浓度6-BA、IAA、GA3敏感,这可能是该突变体中某些激素平衡被打破,激素间互作异常所致。
目前,与BR信号转导相关研究已有报道。在拟南芥中DWF1蛋白是一种Ca2+/CAM结合蛋白,当DWF1蛋白与CAM不能正常结合时,就会表现为矮化表型[19-20]。并且已发现多个编码BR信号转导蛋白的基因,如 bri1、 cbb2等和多个参与BR信号转导的蛋白如bri1,V-ATPase等,其中 bri1基因编码的bri1蛋白是BR信号转导途径中最主要的成分,这种蛋白是膜受体蛋白,具有ser/thr激酶活性,参与下游信号的传递[21]。而在单子叶模式植物水稻中,与BR合成相关基因有 brd1、brd2等[22-23],参与BR信号转导的基因有 d10、 d10等[24-25], BR信号转导受体蛋白有3个,分别是Osbri1、OsBRLl、OsBRL3,其中OsBRI1的功能缺失会导致对BR的不敏感[26],另外在水稻BR不敏感型突变体‘d10-4’[27]的研究中发现,有一种名为PCAM的蛋白表达上调,这表明PCAM在BR的信号转导途径中起负调控作用[28]。本研究鉴定的突变体到底是哪个基因发生突变,还有待进一步研究。
本矮化短柄大豆突变体作为矮化大豆遗传资源,对于挖掘与株型性状相关基因功能、大豆理想株型构建和大豆分子育种中都具有潜在价值。
Reference:
[1] INAMULLAH E A.Adaptive responses of soybean and cotton to diurnal changes in solar radiation and leaf movement[J].AsianJournalofPlantSciences,2006,5(6):1007-1011.
[2] YOU M G.Genetic analysis of short petiole and abnormal pulvinus in soybean[J].Euphytica,1998,102(3):329-333.
[3] KHUSH G S.Rice Research in Asia[M].New York:Oxford University Press,1996:59-71.
[4] KILEN T C.Inheritance of a short petiole trait in soybean[J].CropScience,1983,23(6):1208-1209.
[5] YOU M G,ZHAO T J,GAI J Y,etal.Genetic analysis of short petiole and abnormal pulvinus in soybean[J].Euphytica,1998,102(3):329-333.
[6] 虞慧芳,曹家树,王永勤.植物矮化突变体的激素调控[J].生命科学,2002,14(2):85-88.
YU H F,CAO J SH,WANG Y Q,etal.Hormones regulation in plant dwarfing mutants[J].ChineseBulletinofLifeSciences,2002,14(2):85-88(in Chinese with English abstract).
[7] CHOE S,SCHMITZ R J,FUJIOKA S,etal.Arabidopsisbrassinosteroid-insensitive dwarf12 mutants are semidominant and defective in a glycogen synthase kinase 3beta-like kinase[J].PlantPhysiology,2002,130(3):1506-1515.
[8] SCHULTZ L,HUUB L,KERCKHOFFS J,etal.Molecular characterization on the brassinosteroid-deficient 1 kb mutant of pea[J].PlantMolecularBiology,2001,47(4):491-498.
[9] BISHOP G J,HARRISON K,JONES J.The tomato dwarf gene isolated by heterologous transposon tagging encodes the first member of a new cytochrome P450 family[J].PlantCell,1996,8(6):959-969.
[10] SASAKI A,ITOH H,GOMIK,etal.Accumulation of phosphorylated repressor for gibberellin signaling in an F-box mutant[J].Science,2003,299(5614):1896-1898.
[11] 李 葳,朱保葛,徐民新,等.矮杆和半矮杆大豆突变体植株生长对外源GA3的响应[J].作物学报,2008(7):1240-1246.
LI W,ZHU B G,XU M X,etal.Responses of plant growth of dwarf and semi-dwarf soybean mutants to exogenous GA3[J].ActaAgronomicaSinica,2008(7):1240-1246(in Chinese with English abstract).
[12] 张 达,王军虹,王豫颖,等.矮化大豆突变体的GA3调控[J].大豆科学,2008,27(3):456-460.
ZHANG D,WANG J H,WANG Y Y,etal.GA3 regulation in the dwarfing mutant soybean[J].SoybeanScience,2008,27(3):456-460(in Chinese with English abstract).
[13] AESCHBACHER R A,HAUSER M T,FELDMANN K A,etal.TheSABREgene is required for normal cell expansion inArabidopsis[J].Genes&Development,1995,9(3):330-340.
[14] WOLBANG C M,ROSS J J.Auxin promotes gibberellin biosynthesis in decapitated tobacco plants[J].Planta,2001,214(1):153-157.
[15] 侯雷平,李梅兰.油菜素内酯(BR)促进植物生长机理研究进展[J].植物学通报,2001,18(5):560-566.
HOU L P,LI M L.Progress of studies on the plant growth promoting mechanism of brassinolide (BR)[J].ChineseBulletinofBotany,2001,18(5):560-566(in Chinese with English abstract).
[16] 马良勇.水稻株高相关基因的遗传分析和QTL定位[D].杭州:浙江大学,2007.
MA L Y.Genetical analysis and QTL mapping for plant height related traits in rice(OryzasativaL.) [D].Hangzhou:Zhejiang University,2007(in Chinese with English abstract).
[17] BEST N B,HARTWIG T,BUDKA J,etal.Nana plant2 encodes a maize ortholog of theArabidopsisbrassinosteroid biosynthesis gene DWARF1,identifying developmental interactions between brassinosteroids and gibberellins[J].PlantPhysiology,2016,171(4):2633-2647.
[18] YANG T,DAVIES P J,REID J B.Genetic dissection of the relative roles of auxin and gibberellin in the regulation of stem elongation in intact light-grown peas[J].PlantPhysiology,1996,110(3):1029-1034.
[19] KLAHRE U,NOGUCHI T,FUJIOKA S,etal,TheArabidopsisDIMINUTO/DWARF1 gene encodes a protein involved in steroid synthesis[J].PlantCell,1998,10(10):1677-1690.
[20] DU L,POOVAIAH B W.Ca2+/calmodulin is critical for brassinosteroid biosynthesis and plant growth[J].Nature,2005,437(7059):741-750.
[21] CLOUSE S D,LANGFORD M,McMORRIS T C.A brassinosteroid-insensitive mutant inArabidopsisthalianaexhibits multiple defects in growth and development[J].PlantPhysiology,1996,111(3):671-678.
[22] HONG Z,UEGUCHI-TANAKA M,SHIMIZU-SATO S,etal.Loss-of-function of a rice brassinosteroid biosynthetic enzyme,C-6 oxidase,prevents the organized arrangement and polar elongation of cells in the leaves and stem[J].PlantJournal,2002,32(4):495-508.
[23] HONG Z,UEGUCHI-TANAKA M,FUJIOKA S,etal.The rice brassinosteroid-deficient dwarf mutant,defective in the rice homolog ofArabidopsisDIMINUTO/DWARF1, is rescued by the endogenously accumulated alternative bioactive brassinosteroid,dolichosterone[J].PlantCell,2005,17(8):2243-2254.
[24] YAMAMURO C,IHARA Y,WU X,etal.Loss of function of a rice brassinosteroid insensitive1 homolog prevents internode elongation and bending of the lamina joint[J].PlantCell,2000,12(9):1591-1606.
[25] ARITE T,IWATA H,OHSHIMA K,etal.DWARF10,an RMS1/MAX4/DAD1 ortholog,controls lateral bud outgrowth in rice[J].PlantJournal,2007,51(6):1019-1029.
[26] YIN Y,WANG Z Y,MORA-GARCIA S,etal.BES1 accumulates in the nucleus in response to brassinosteroids to regulate gene expression and promote stem elongation[J].Cell,2002,109(2):181-191.
[27] HONG Z,UEGUCHI-TANAKA M,SHIMIZU-SATO S,etal.Loss-of-function of a rice brassinosteroid biosynthetic enzyme,C-6 oxidase,prevents the organized arrangement and polar elongation of cells in the leaves and stem[J].PlantJournal,2002,32(4):495-508.
[28] 黄 新,王凤茹.PCAM 蛋白功能分析及其与油菜素内酯(BR)信号转导关系[J].农业生物技术学报,2012,20(12):1407-1413.
HUANG X,WANG F R.Function analysis of putative calmodulin (PCAM) and the relationship between PCAM and brassinosteroid(BR) signal transductionin[J].JournalofAgriculturalBiotechnology,2012,20(12):1407-1413(in Chinese with English abstract).
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
Phynotypic Observation and Response to Exogenous Hormones in a Soybean Dwarf-mutant at Seedlings Stage.
LI Yuanlong1,WANG Zhonghua1and FENG Xianzhong2.
(1.College of Agronomy, Northwest A&F University,Yangling Shaanxi 712100, China; 2.Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Changchun 130000, China)
We adopted the mutant soybean which was generated by the60CO-γ ray induce ‘Hedou 12’. Comparative study on the first compound leaf petiole length, seedling plant height and petiole microstructure between wild type and mutant type. In order to explore preliminarily the type of mutation gene, four different hormone treatments were carried out on roots. Result shows that the mutant type has shorter petiole length and lower plant height compared with the wild type, as well as, present a compact phenotype. Petiole crosscutting observation reveal that the mutant cells of xylem and pith become smaller. The mutant roots were very sensitive to 6-BA, GA3, IAA, However, had no response to BR, indicating that the mutant might be BR signal transduction disorder, subsequent target gene discovery should be based on the related genes of BR signal transduction pathway. Soybean dwarf short petiole mutant may have potential application value in the soybean ideotype transformation and soybean molecular breeding.
Soybean; Dwarf mutant; Short petiole; Roots; Plant exogenous hormones; Microstructure
2016-09-04 Returned 2016-09-13
The National Natural Science Foundation of China(No.31571692):Northwest Agriculture and Forestry University Tang Zhongying Breeding Fund Project.
LI Yuanlong, male,master student. Research area:crop genetics and breeding.E-mail:845686931@qq.com.
WANG Zhonghua, male,Ph.D,doctoral supervisor,professor.Research area:crop genetics and breeding. E-mail: zhonghuawang@nwsuaf.edu.cn
日期:2017-06-29
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170629.1107.006.html
2016-09-04
2016-09-13
国家自然科学基金(31571692);西北农林科技大学唐仲英育种基金。
李元龙,男,硕士研究生,研究方向为作物遗传育种。E-mail:845686931@qq.com 通信作者:王中华,男,博士,博导,教授,研究方向为作物遗传育种。E-mail:zhonghuawang@nwsuaf.edu.cn 冯献忠,男,博士,博导,研究员,研究方向为大豆功能基因组学、系统生物学、分子设计。E-mail:fengxianzhong@neigae.ac.cn
S529
A
1004-1389(2017)07-1014-06
FENG Xianzhong, male,Ph.D,doctoral supervisor,research fellow.Research area:functional genomics of soybean, systems biology. E-mail:fengxianzhong@neigae.ac.cn

