牦牛 DKK1基因多态性及其与生长性状的相关性
郭 琳,柴志欣,钟金城,陈智华
(1.西南民族大学 动物遗传育种学国家民委-教育部重点实验室,成都 610041;2.西南民族大学 青藏高原研究院,成都 610041)
牦牛 DKK1基因多态性及其与生长性状的相关性
郭 琳1,2,柴志欣1,2,钟金城1,2,陈智华1
(1.西南民族大学 动物遗传育种学国家民委-教育部重点实验室,成都 610041;2.西南民族大学 青藏高原研究院,成都 610041)
选取麦洼牦牛、类乌齐牦牛、申扎牦牛、帕里牦牛和斯布牦牛5个群体共287头个体,采用直接测序法检测牦牛 DKK1基因的SNP位点,分析其与生长性状的相关性。结果表明,牦牛 DKK1基因存在2个突变位点, g.983A→G位点和g.1075C→G位点;位点g.983A→G在斯布牦牛中处于Hardy-Weinberg不平衡状态,其余位点处于平衡状态。在遗传多态性研究中,2个SNP位点均为中度多态。2个位点不同基因型与体高、体斜长、胸围、管围和体质量的相关分析结果显示,位点g.983A→G与体高、体斜长、胸围和体质量均具有相关性;位点g.1075C→G与生长性状不相关。
牦牛; DKK1基因;单核苷酸多态性(SNP);相关性
牦牛是中国青藏高原的特有物种,生活在海拔3 000 m以上的高寒地区,昼夜温差大,辐射强,牦牛具有耐寒、抗低氧等特征,对高山草地生态环境具有极强的适应性,是经长期自然选择而形成的优势群体,具有独特的体质形态结构和生理特征,在遗传上是一个优质的基因库[1]。牦牛作为一个全能型的优势资源,其肉质性状和生长性状是选育工作的重要方面,由于粗放式经营和不健全的良种体系影响牦牛群体生产力,具体表现为体格小、体质量降低等。1998年Glinka等[2]首次在非洲爪蟾胚胎细胞中发现Dickkopf-1 ( DKK1)基因,是Dickkopf(DKKs)家族成员之一,Wnt/β-catenin信号是调节骨代谢及维持骨质稳态的主要信号途径,DKK1作为一种可溶性Wnt抑制剂,可通过阻断骨细胞分化并调节成骨细胞Wnt经典途径的正性及负性调节因子即OPG与RANKL的平衡参与破骨的发生[3]。抗DKK1抗体可增加成骨细胞数量、降低破骨细胞数量而促进骨质形成[4]。牦牛肉质性状和生长性状是选育工作的参考指标, DKK1基因在骨骼发育和骨平衡中起重要作用,是骨再塑的重要调控因子。因此,本研究利用分子生物学和生物信息学技术研究牦牛 DKK1基因的遗传多态性及其与体尺、体质量等生长性状的关联性,寻找与生产性能相关的多态位点,以期在育种实践中提高牦牛的生产性能。
Dickkopf蛋白家族是一个保守的基因家族,也是构成Wnt拮抗剂的重要成分之一,包括DKK1、DKK2、DKK3和DKK4 4个成员[5]。 DKK1蛋白是一种外泌型的糖蛋白,可作为抑制剂参与调控Wnt信号[6]。DKK1作为Wnt抗结剂参与Wnt/β-catenin信号通路转导[7],Reya等[8]研究表明DKK1拮抗Wnt/β-catenin信号的主要原因是LRP5/6(Lowdensity lipoprotein receptor-related protein5/6)具有专门为Wnt/β-catenin信号通路转导的特异性,结合特定的Wnt抑制,触发某些特定的Wnt信号分子,从而调控骨骼发育和脂肪分化[9]。kremen1/2(krm1/2)作为DKK1的另一个高亲和性受体,在 krm2 存在的情况下,DKK1可与 LRP6 、 Krm2 形成三元复合内吞小体,Mao等[10]研究表明,由于这种内吞现象的存在,可清除膜表面的 LRP6,从而抑制 Wnt/β-catenin 信号,影响胚胎发育及生长。Kazaskoya[11]研究显示,DKK1 在非洲爪蟾胚胎发育过程中阻断 Wnt信号,是头部发育和脊索前板形成的必要条件。目前,对 DKK1基因多态性的研究主要集中在人、猪和秦川牛上,对于牦牛 DKK1基因的研究尚少, DKK1基因与牦牛体型密切相关,是选育工作的重要方面。本研究通过直接测序方式,对牦牛 DKK1基因全序列进行SNPs位点的筛选,寻找与其生长性状相关的多态性位点,为提高牦牛生产性能提供理论依据和数据支持。
1 材料与方法
1.1 试验动物
选取麦洼牦牛(MW)、类乌齐牦牛(LWQ)、申扎牦牛(SZ)、帕里牦牛(PL)和斯布牦牛(SB)5个品种共287头个体,其中MW 97头选于四川省阿坝藏族羌族自治州红原县龙日种畜场,LWQ 49头选于西藏自治区类乌齐县,SZ 70头选于那曲地区申扎县,PL 31头选于亚东县帕里地区,SB 40头选于墨竹工卡县斯布村。采集牦牛耳组织样品,φ=75%乙醇保存带回实验室,-80 ℃保存,备用,在样品采集的同时测定其体高、体斜长、胸围、管围、体质量等生长指标。数据用“平均数±标准差”表示。
1.2 主要试剂
DNA提取试剂盒和凝胶回收试剂盒(Axygen公司);胰蛋白胨、琼脂粉、酵母浸出粉(Oxoid公司),DL2000 Marker购自大连宝生物工程有限公司,琼脂糖为成都科龙化工试剂厂产品。
1.3 基因组DNA提取
利用组织基因组DNA提取试剂盒(TIANGEN)提取基因组DNA[12],采用10 g/L的琼脂糖凝胶电泳检测DNA的纯度,置于-20 ℃保存,备用。
1.4 构建DNA池
DNA混合池是把多个DNA样本溶液等质量浓度等体积混合,进行PCR扩增,主要用于基因分型,并用统计学方法对数据进行分析。这种方法有效地减少工作量,降低研究成本[13]。随机选取80 个DNA样品于4 ℃保存,使其单个样品混匀,利用紫外分光光度计对DNA样品质量浓度(上层、中层、下层)依次测定,取平均值。将每个样品稀释至50 ng/μL,各取5 μL混合,4 ℃环境下静置24~48 h使其充分混匀,置于-20 ℃保存,备用。按照以上方法构建牦牛群体DNA池。
1.5 引物设计与合成
参考NCBI数据库GenBank中牛(AC_000183) DKK1基因序列,采用交叉重叠原理,用Primer Premier 6.0软件设计2对引物(表1),引物由上海伯津生物技术有限公司合成。
1.6 PCR扩增
PCR反应体系(50 μL):DNA模板2 μL,上下游引物各2 μL, dd H2O 19 μL、Premix ExTaq聚合酶25 μL。DKK1-1 PCR反应条件:94 ℃预变性4 min;94 ℃ 变性30 s,62.9 ℃退火30 s,72 ℃延伸2 min 40 s,共30个循环;72 ℃延伸5 min,4 ℃保存。DKK1-2 PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s,60.4 ℃退火30 s,72 ℃延伸2 min 10 s,30个循环;72 ℃延伸5 min,4 ℃保存。PCR产物用10 g/L的琼脂糖凝胶电泳检测。
2 结果与分析
2.1 牦牛 DKK1基因的PCR扩增
DKK1-1扩增产物为大于2 000 bp的DNA片段,与预期的2 389 bp DNA片段长度一致。DKK1-2扩增产物长1 000~2 000 bp,靠近2 000 bp,与预期扩增的1 746 bp片段长度基本一致(图1)。将扩增产物送英潍捷基(上海)生物技术有限公司测序,利用DNAMAN将测序结果与NCBI牛 DKK1基因序列进行比对,一致性为99.64%,确定为目的基因。利用BioEdit 7.0.5生物软件查找双峰位点,预测多态位点。
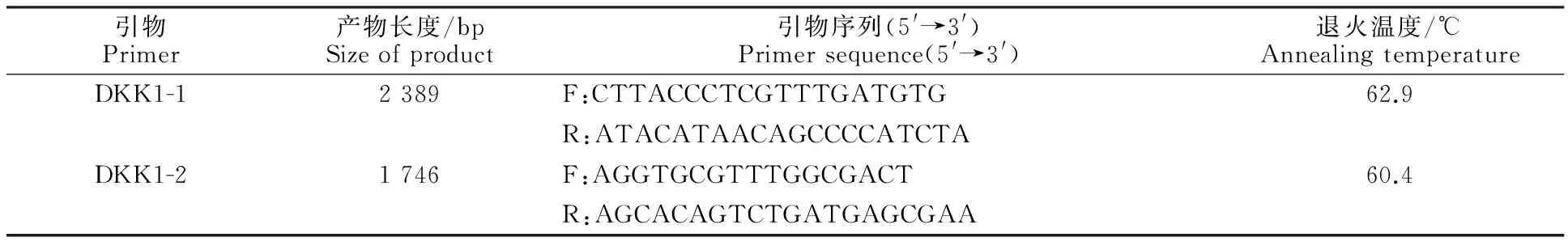
表1 扩增牦牛 DKK1基因序列所用引物信息Table 1 Information of primer to amplify complete yak DKK1 gene
2.2 牦牛 DKK1基因测序
DNA池PCR扩增产物测序结果显示,牦牛 DKK1基因存在2个单核苷酸突变位点(图2),均位于内含子中(g.983A→G、g.1075C→G)。
2.3 DKK1基因SNPs位点的筛查和检测
2个SNP位点PCR扩增测序结果表明,均含有3种不同的基因型,g.983A→G位点包括AA、AC、CC 3种基因型,g.1075C→G位点基因型为CC、CG和GG(图3)。

图1 牦牛 DKK1基因的PCR扩增产物琼脂糖凝胶电泳Fig.1 Agarose gel electrophpresis of PCR amplified DKK1 gene in yak
2.4 牦牛 DKK1基因的遗传多态性
2.4.1 基因型频率、基因频率及χ2适合性检验 由表2可知,在g.983A→G位点中,杂合基因型AC在MW、PL和SB群体中的分布频率为0.42、0.48和0.63,为优势基因型;CC基因型在LWQ和SZ中的分布频率为均为0.49,为优势基因型。在g.1075C→G位点中,CC基因型在MW、SZ和SB中的分布频率为0.56、0.60和0.65,为优势基因型;杂合基因型CG在LWQ和PL中分布频率为0.41和0.55,为优势基因型。g.983A→G位点中,等位基因C基因频率在5个群体中分别为0.6、0.68 、0.71、0.47和0.66,除在PL中不是优势等位基因外,在其余4个群体中均为优势等位基因;g.1075C→G位点中,等位基因C分布频率为0.73、0.55、0.76、0.63和0.79,为优势等位基因。
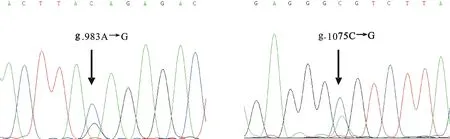
图2 牦牛 DKK1基因DNA池部分测序Fig.2 The results of sequencing of DKK1 fragment in yak
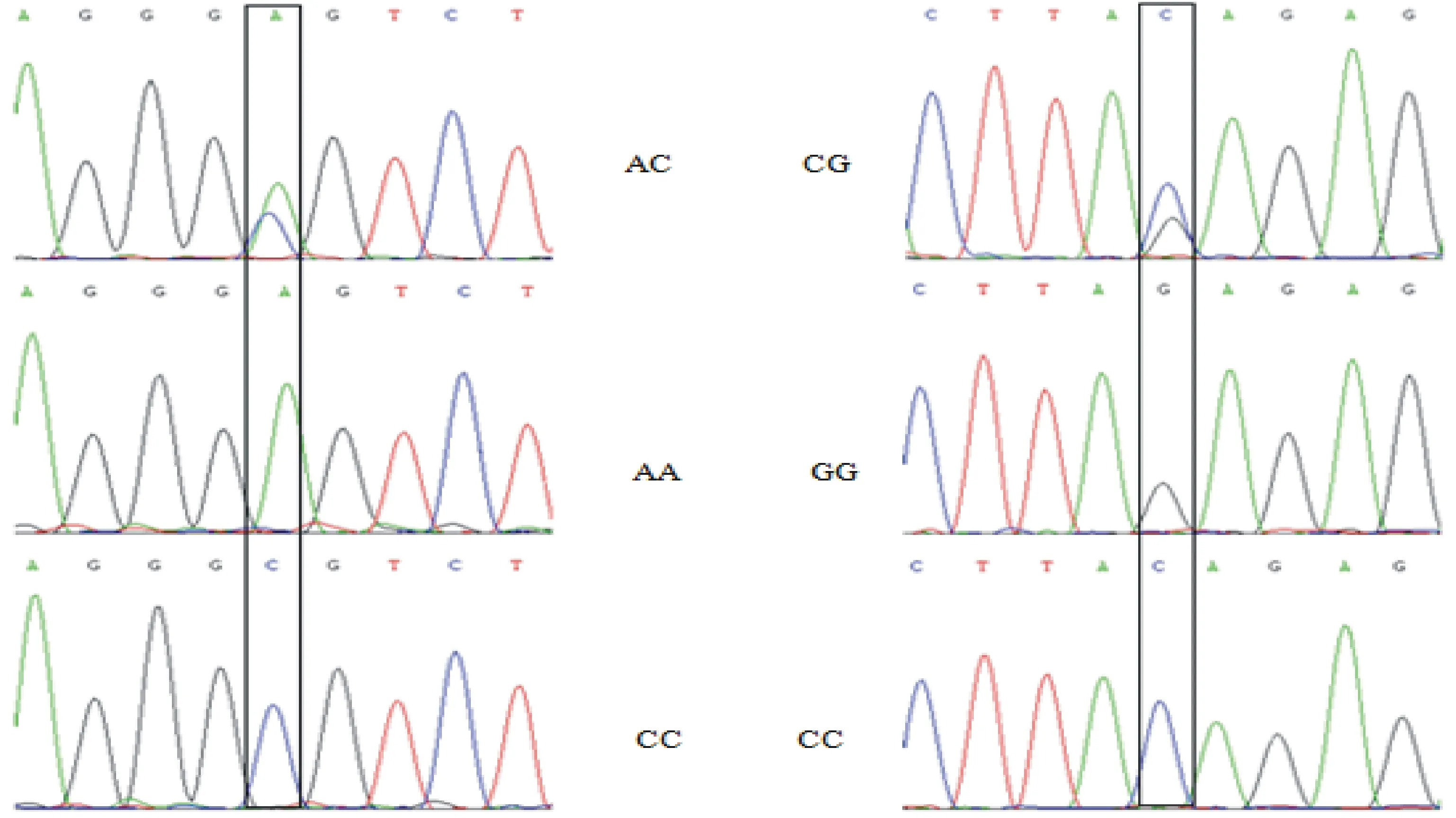
图3 牦牛 DKK1基因2个SNP位点测序Fig.3 Sequencing of 2 SNP sites in DKK1 fragment of yak
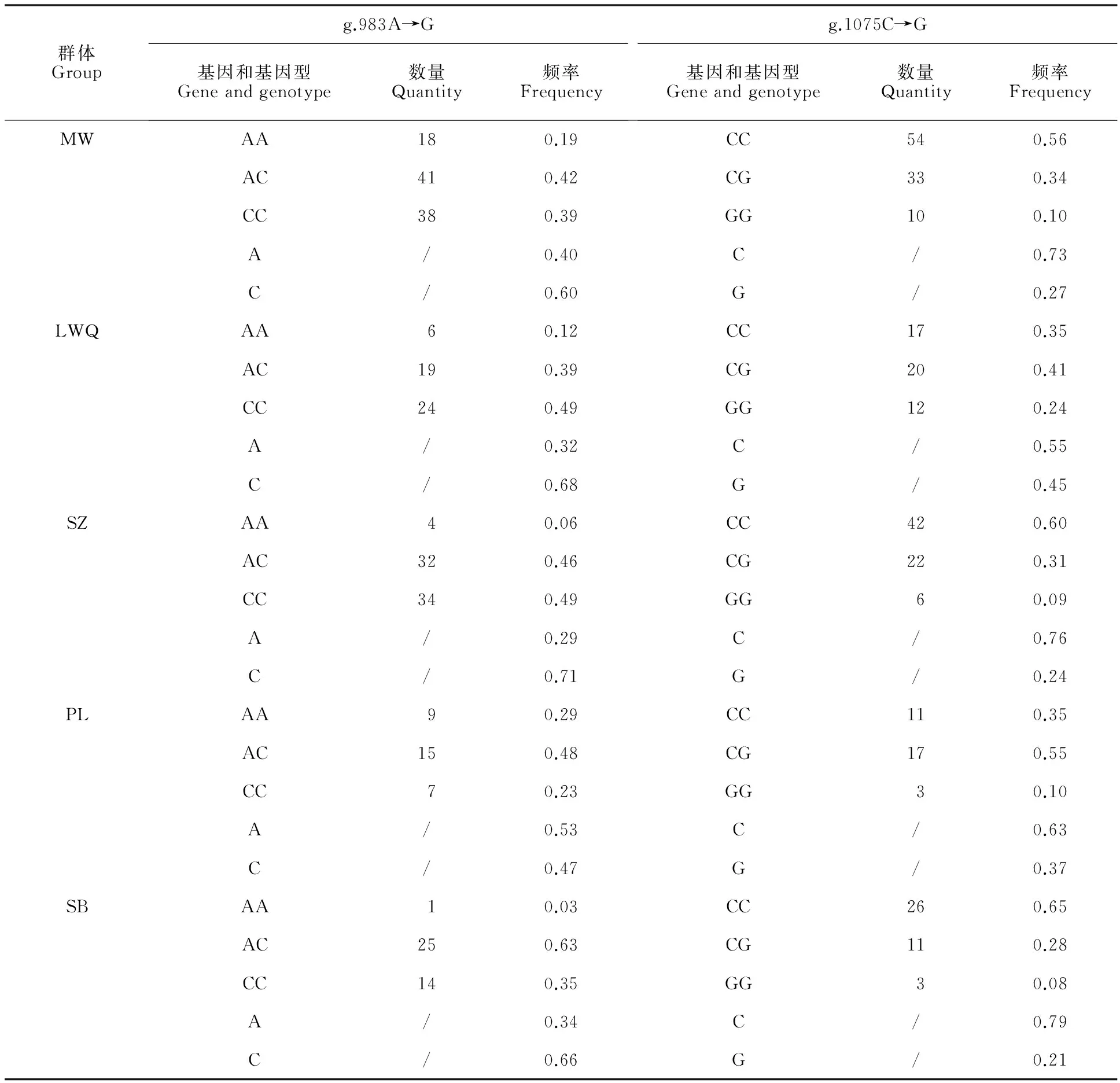
表2 牦牛 DKK1基因2个SNP位点基因型频率和基因频率Table 2 Genotype allele and frequencies of 2 SNP sites in DKK1gene of yak
对牦牛 DKK1基因2个SNP位点进行卡方适合性检验(表3),位点g.983A→G在SB中χ2值为6.324 2,达到显著水平(P<0.05),不符合Hardy-Weinberg平衡,群体遗传不平衡,可能研究选取的牦牛个体数量较少,或是受到基因突变、人为选育等多种因素影响导致[14]。其余位点χ2值均未达到显著水平(P>0.05),符合Hardy-Weinberg平衡,在其长期进化过程中达到群体基因遗传平衡。
2.4.2 群体遗传多态性 运用PIC_CALC软件计算多态信息含量,其中PIC>0.5高度多态,0.25
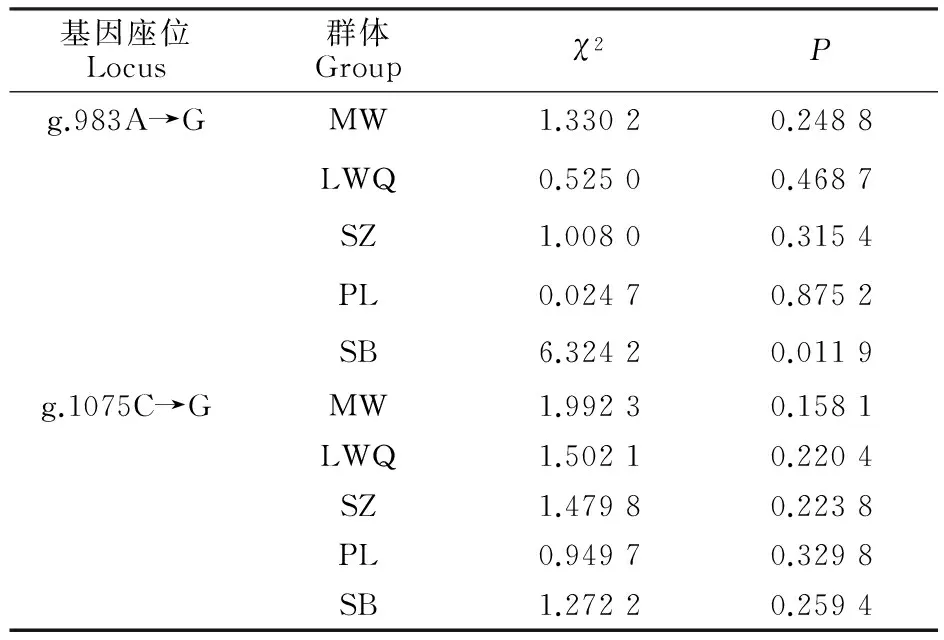
表3 牦牛 DKK1基因2个SNP位点的Hardy-Weinberg平衡性检测Table 3 Equilibrium analysis of Hardy-Weinberg for 2 SNP sites in DKK1 gene of yak
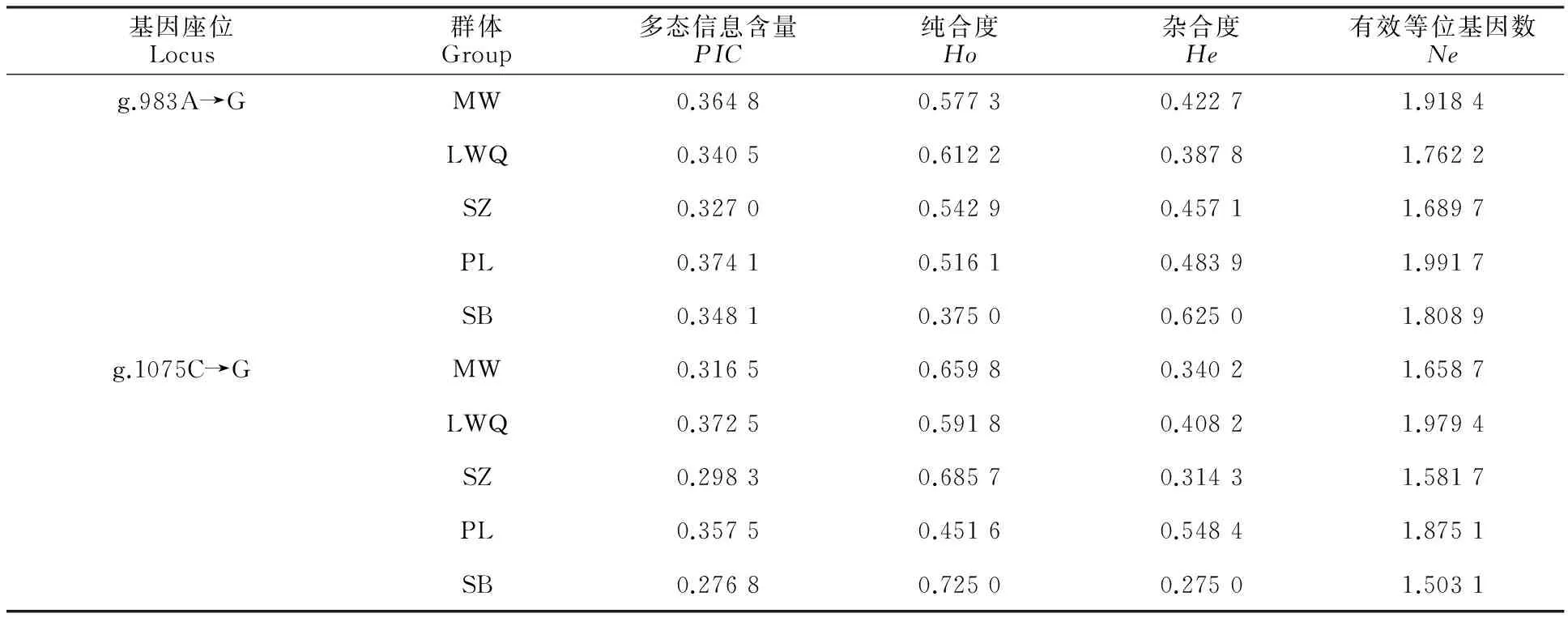
表4 麦洼牦牛 DKK1基因2个SNP位点的遗传多态性Table 4 Genetic polymorphism of 2 SNP sites of DKK1 gene in yak
2.4.3 DKK1基因多态性与牦牛生长性状的关联性分析
运用SPSS 17.0分析软件中的单因素方差分析对276头牦牛个体 DKK1基因的2个SNP位点不同基因型与体高、体斜长、胸围、管围和体质量等生长性状进行相关性分析(表5~表6)。分析结果显示,位点g.983A→G与体高、体斜长、胸围和体质量均具有相关性(P<0.05)。AA基因型个体体高、体斜长、胸围和体质量显著高于AC基因型和CC基因型。位点g.1075C→G与生长性状不相关,无统计学差异(P>0.05)。

表5 DKK1基因g.983A→G位点与牦牛生长性状的相关性Table 5 Correlation analysis between the g.983A→G site and growth traits of yak
注:同列不同字母表示差异显著(P<0.05)。
Note:The different scripts mean significant difference(P<0.05).

表6 DKK1基因g.1075C→G位点与牦牛生长性状的相关性Table 6 Correlation analysis between the g.1075C→G site and growth traits of yak
3 讨 论
在非洲爪蟾胚胎早期发育的研究中发现 DKK1能够诱导头部发育和脊索前板形成[2],在斑马鱼[16]胚胎发育过程中尤其是感应区头部的表达中 DKK1起关键作用,去除 DKK1基因的小鼠表现出严重的肢体发育异常,从而证实 DKK1在肢体发育和骨平衡中起着重要作用[17-19]。高建斌等[20]对秦川牛 DKK1基因进行SNPs筛查,发现存在5个突变位点,分别为第1内含子G523A突变,第2内含子A999G 和A1169G突变,第3内含子C1858T突变和第4外显子A2355G突变,其中G523A、A999G、A1169G和C1858T位点均位于内含子区域,均不编码蛋白质序列,但其功能机制尚不清楚。曹贵玲[21]对白绒山羊群体 DKK1基因序列进行多态位点扫描,发现33处单核苷酸替代,内含子2中存在1处4碱基插入,启动子区T593C-C603A位点,T-C颠换和C-A转换,二者间距9 bp,单位体表面积产绒量、产绒量、出生质量、断奶增质量等性状在T593C位点不同基因型之间差异不显著。栾新[22]对兔 DKK1基因进行相关研究,结果显示 DKK1基因与毛囊发育有着密切关联,并通过银染技术和酰胺凝胶电泳相结合的试验方法,发现2种基因型,但这2种基因型与毛长、皮张面积、光泽度、平整度和毛密度5个兔被毛性状的相关上均差异不显著(P>0.05)。
本研究采用DNA直接测序技术对麦洼牦牛、类乌齐牦牛、申扎牦牛、帕里牦牛和斯布牦牛 DKK1基因进行SNPs筛选,结果发现2个SNP位点,g.983A→G位点包括AA、AC、CC 3种基因型,g.1075C→G位点基因型为CC、CG和GG,具有较丰富的遗传变异。2个SNP位点中,CC为优势基因型, g.983A→G位点中等位基因C基因频率在5个群体中分别为0.60、0.68 、0.71、0.47和0.66,除在帕里牦牛中不是优势等位基因外,在其余4个类群中均为优势等位基因;g.1075C→G位点中等位基因C为优势等位基因。基因频率的差异在各群体间较为显著,群体间的遗传距离相对较大。位点g.983A→G在斯布牦牛中χ2值为6.324 2,达到显著水平(P<0.05),不符合Hardy-Weinberg平衡,群体遗传不平衡,可能受到基因突变、人为选育等多种因素影响导致,说明其在自然选择和人工选育过程中可能会被逐渐淘汰[23],也可能与品种本身有关或是由于样本量过小导致群体的等位基因频率和基因型频率改变;其余位点χ2值均未达到显著水平(P>0.05),符合Hardy-Weinberg平衡,在其长期进化过程中达到群体基因遗传平衡。2个SNP位点分布均为中度多态,PIC越高,杂合度越大,遗传变异也较为丰富,在以往的选择中受到的压力较小,选择空间大,在育种实践中,可加大人工选择的强度。运用SPSS17.0分析软件对牦牛 DKK1基因的2个SNP位点不同基因型与牦牛体高、体斜长、胸围、管围和体质量等生长性状进行相关性分析,分析结果显示位点g.983A→G与体高、体斜长、胸围和体质量均具有相关性(P<0.05),AA基因型个体体高、体斜长、胸围和体质量显著高于AC基因型和CC基因型,由此表明,g.983A→G位点的等位基因A可能影响牦牛体尺性状;位点g.1075C→G与生长性状不相关,无统计学差异(P>0.05)。与高建斌等[20]对秦川牛 DKK1基因研究结果一致,其研究结果表明 DKK1基因可能对秦川牛体斜长、体高、腰高、尻长和坐骨端宽的体尺性状有显著影响。牦牛 DKK1基因g.983A→G位点可作为影响体高、体斜长、胸围和体质量的遗传标记,可以通过对优势基因型的选择,加快牦牛育种的遗传改良[24]。 DKK1影响骨骼的形成和发育,相关性状已经在小鼠身上得到证实。目前该基因在大型家畜的研究较少,在高建斌[20]对秦川牛的研究中证明该基因不但对部分体尺性状有影响,在肉质性状方面也存在显著差异。因此未来对 DKK1基因相关性状的研究应扩大到更多的大型家畜上,获得更多经济效益。
4 结 论
牦牛 DKK1基因存在一定的遗传多态性,在其内含子区域处筛选出2个SNP位点,分别为g.983A→G和g.1075C→G位点,且位点g.983A→G对牦牛的体高、体斜长、胸围和体质量有较为显著的影响,可以用来作为优化选育体系的一种遗传标记。
Reference:
[1] 钟金城,赵素君,陈智华,等.牦牛品种的遗传多样性及其分类研究[J].中国农业科学,2006,39(2):389-397.
ZHONG J CH,ZHAO S J,CHEN ZH H,etal.Study on genetic diversity and classification of the Yak[J].ScientiaAgriculturaSinica,2006,39(2):389-397(in Chinese with English abstract).
[2] GLINKA A,WU W,DELIUS H,etal.Dickkopf-1 is a member of a new family of secreted proteins and functions in head induction[J].Nature,1998,391(6665):357-362.
[3] LOGAN C,NUSSE R.The wnt signaling pathway in development and disease[J].AnnualReviewofCellandDevelopmentalBiology,2004,20(20):781-810.
[4] 李 波,郝云良,孙道萍,等. DKK1在多发性骨髓瘤中的表达及临床意义[J].中国医药指南,2010,8(13):181-184.
LI B,HAO Y L,SUN D P,etal.The expression and significance of Dickkopf-1 in multiple myeloma[J].GuideofChinaMedicine,2010,8(13):181-184 (in Chinese with English abstract).
[5] 蔡恬恬.DKK1抑制经典 Wnt 信号通路的分子机制的研究[D].北京:清华大学,2008.
CAI T T.Study of the molecular mechanism of Dkk1-Mediated in hibition of canonical wnt pathway[D].Beijing:Tsinghua University,2008(in Chinese with English abstract).
[6] NIEHRS C.Function and biological roles of the Dickkopf family of Wnt modulators[J].Oncogene,2006,25(57):7468-7481.
[7] CLEVERS H.Wnt/beta-catenin signaling in development and disease[J].Cell,2006,127(3):469-480.
[8] REYA T,CLEVERS H,CLEVERS H.Wnt signaling in stem cells and cancer[J].Nature,2005,434(7035):843-850.
[9] KAWANO Y,KYPTA R.Secreted antagonists of the Wnt signaling pathway[J].JournalofCellScience,2003,116(13):2627-2634.
[10] MAO B,WU W,DAVIDSON G,etal.Kremen proteins are Dickkopf receptors that regulate Wnt/β-catenin signaling[J].Nature,2002,417(6889):664-667.
[11] KAZASKAYA O.The role ofXenopusdickkopf 1 in prechordal plate specification and neural patterning[J].Devepment,2000,127(22):4981-4992.
[12] SAMBROOK J.The Condensed Protocols from Molecular Cloning:A Laboratory Manua[M].Beijing:Science Press,2002.
[13] 何 柳,唐 迅,胡永华.DNA混合分析技术的单体型频率估计方法[J].中南大学学报(医学版),2011,36(5):457-461.
HE L,TANG X,HU Y H.Estimation of haplotypes based on DNA pooling[J].JournalofCentralSouthUniversity(MedicalScienceEdition),2011,36(5):457-461(in Chinese with English abstract).
[14] 姬秋梅,唐懿挺,张成福,等.西藏牦牛mtDNAcytb基因的序列多态性及其系统进化分析[J].畜牧兽医学报,2012,43(11):1723-1732.
JI Q M,TANG Y T,ZHANG CH F,etal.Genetic diversity and evolution relationship of Tibet yaks inferred from mtDNAcyt[J].ActaVeterinariaetZootechnicaSinica,2012,43(11):1723-1732(in Chinese with English abstract).
[15] 柴志欣,罗晓林,赵上娟,等.西藏牦牛 ADD1基因第2外显子的PCR-SSCP检测及序列分析[J].生物技术通报,2012(1):124-129.
CHAI ZH X,LUO X L,ZHAO SH J,etal.PCR-SSCP detection and sequence analysis on exon2 of ADD1 gene in tibetan yak[J].BiotechnologyBulletin,2012(1):124-129(in Chinese with English abstract).
[16] HASIMTO H,ITOH M,YAMANAKA Y,etal.Zebrafish DKK1 functions in forebrain specification and axial mesendoderm formation[J].DevelopmentalBiology,2000,217(1):138-152.
[17] MORGAN F,BOULUKOS K,CIEMENT LP,etal.Deletion of a single allele of the DKK1 gene leads to an increase in bone formation and bone mass[J].JournalofBoneandMineralResearch,2006,21(6):934-945.
[18] MACDONALD B T,JOINER D M,OYSERMAN S M,etal.Bone mass is inversely proportional to DKK1 levels in mice[J].Bone,2007,41(3):331-339.
[19] LI J,SAROSI I,CATTLEY R C,etal.DKK1-mediated inhibition of Wnt signaling in bone results in osteopenia[J].Bone,2006,39(4):754-766.
[20] 高建斌,昝林森,杨 宁,等.秦川牛 DKK1基因SNPs检测及其与体尺、肉质性状的关联分析[J].畜牧兽医学报,2013,44(3):376-386.
GAO J B,ZAN L S,YANG N,etal.Polymorphisms of DKK1 gene and its association with body measurement and meat quality traits in qinchuan[J].ActaVeterinariaetZootechnicaSinica,2013,44(3):376-386(in Chinese with English abstract).
[21] 曹贵玲.山羊印记基因 H19、Dlk1、CLPG和毛囊发育相关基因 DKK1的研究[D].山东泰安:山东农业大学,2008.
CAO G L.Studies on imprinted gen H19,Dlkl,CLPG and hair follicle development related gene DKK1 in goats[D].Tai’an Shandong:Shandong Agricultural University,2008(in Chinese with English abstract).
[22] 栾 新.兔 MC4R和 DKK1基因的多态性及其与经济性状的关系研究[D].山东泰安:山东农业大学,2012.
LUAN X.The association of polymorphisms of MC4R gene and DKK1 gene with economic traits in rabbits[D].Tai’an Shandong:Shandong Agricultural University,2012(in Chinese with English abstract).
[23] 牛富彪,王丽君,杨 菁,等.秦川牛PYGM基因的表达及其遗传变异对胴体和体尺性状的影响[J].西北农林科技大学学报(自然科学版),2013,41(9):1-7.
NIU F B,WANG L J,YANG J.etal.Expression ofPYGMgene and relationship between polymorphism of PYGM gene and carcass[J].JournalofNorthwestA&FUniversity(NatureScienceEdition),2013,41(9):1-7(in Chinese with English abstract).
[24] 柴志欣,王 永,罗晓林,等.麦洼牦牛H-FABP、HSL 基因多态性及与生长性状的相关分析[J].中国农业科学,2013,46(14):3022-3031.
CHAI ZH X,WANG Y,LUO X L,etal.Association of single nucleotide polymorphism of H-FABP and HSL genes with growth traits in maiwa yak[J].ScientiaAgriculturaSinica,2013,46(14):3022-3031(in Chinese with English abstract).
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Association of Single Nucleotide Polymorphism of DKK1 Gene with Growth Traits in Yak.
GUO Lin1,2,CHAI Zhixin1,2,ZHONG Jincheng1,2and CHEN Zhihua1.
(1.Key Laboratory of Animal Genetics and Breeding of State Ethnic Affairs Commission and Ministry ofEducation,Southwest University for Nationalities,Chengdu 610041,China; 2.Institute of Tibetan Plateau Research,Southwest University for Nationalities,Chengdu 610041,China)
To investigate the genetic polymorphism of Dickkopf-1 ( DKK1) gene in yak and reveal the association between SNPs detected and growth traits,and looking for alternative auxiliary marker. This study selected 287 individuals which include five yak breeds named Maiwa,Leiwuqi ,Shenzha ,Pali and Sibu,to detect the SNPs of the DKK1 gene in yaks and its correlation with the growth traits of yak. The results showed that:there are two mutations in the DKK1 gene,each of them has three different genotypes. The χ2value of g.983A→G site in SB yak was 6.324 2,which meant the site was out-off-balance of the Hardy-Weinberg equilibrium (HWE),but the rest of sites matched the balance of the HWE;the distribution of both SNPs were moderate polymorphic;the correlation analysis between different genotypes of two SNPs of DKK1 gene and body height,body length,chest bust,cannon circumference,body mass and other growth traits showed that g.983A→G site was associated with body height,body length,chest bust,and body mass,but no significant difference was detected between g.1075C→G and growth traits.
Yak; DKK1 gene; Single nucleotide polymorphism (SNP); Correlation Analysis
2015-11-16 Returned 2016-03-06
The National Science and Technology Support Program Topic(No.2012BAD03B02);Southwest University for Nationalities Construction Graduate Student Enrollments Projects (No.20152XWD-S071007).
GUO Lin,female,master student. Research area:molecular ecology.E-mail:guolin20151@163.com
CHEN Zhihua,male,professor,Ph.D.Research area:bio-diversity.E-mail:Chenzhihua_czh@sohu.com
日期:2017-06-29
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170629.1107.014.html
2015-11-16
2016-03-06
国家科技支撑计划(2012BAD03B02);西南民族大学研究生学位点建设项目(20152XWD-S071007)。
郭 琳,女,硕士研究生,研究方向为分子生态学。E-mail:guolin20151@163.com 通信作者:陈智华,男,教授,博士,研究方向为生物多样性。E-mail:Chenzhihua_czh@sohu.com 钟金城,男,教授,研究方向为动物遗传学。E-mail:zhongjincheng518@163.com
S823;Q78
A
1004-1389(2017)07-0975-08
ZHANG Jincheng,male,professor.Research area:animal genetics.E-mail:zhongjincheng518@163.com

