外源亚精胺和乙烯利对干旱胁迫下小麦籽粒灌浆的影响及其生理机制
陈 庆,吕晓康,李 佳,廖允成,刘 杨,温晓霞
(西北农林科技大学 农学院,陕西杨凌 712100)
外源亚精胺和乙烯利对干旱胁迫下小麦籽粒灌浆的影响及其生理机制
陈 庆,吕晓康,李 佳,廖允成,刘 杨,温晓霞
(西北农林科技大学 农学院,陕西杨凌 712100)
以‘西农979’为材料,采用盆栽试验在小麦灌浆期模拟干旱胁迫,通过对干旱胁迫下小麦进行喷施亚精胺(Spd)和乙烯利处理,测定小麦籽粒灌浆动态、旗叶抗氧化酶(SOD、POD、CAT)活性、丙二醛(MDA)质量摩尔浓度、叶绿素质量分数以及旗叶温度等指标,分析外源Spd和乙烯利对干旱胁迫下小麦籽粒灌浆的影响及其生理机制。结果表明:干旱胁迫显著抑制小麦籽粒灌浆,外源Spd显著促进干旱胁迫下小麦籽粒灌浆,外源乙烯利则显著抑制干旱胁迫下小麦籽粒灌浆;外源Spd在灌浆进程中能够提高干旱胁迫下小麦旗叶抗氧化酶活性和叶绿素质量分数,同时显著降低旗叶MDA质量摩尔浓度以及旗叶温度,而外源乙烯利则作用相反。说明外源Spd和乙烯利均能显著调控干旱胁迫下小麦籽粒灌浆,其调控作用与叶片抗氧化酶活性、MDA质量摩尔浓度、叶绿素质量分数以及气孔开闭密切相关。
亚精胺;乙烯利;干旱胁迫;小麦;籽粒灌浆
小麦(TriticumaestivumL.)产量由单位面积穗数、穗粒数和粒质量3个因素构成。灌浆期是决定小麦最终籽粒产量的关键时期,但中国北方冬小麦在该时期经常遭受干旱胁迫,导致小麦体内生理代谢紊乱、植株早衰[1],使得小麦灌浆期缩短,灌浆速率降低,并最终导致小麦粒质量和产量的下降[2]。因此,采用有效的调控措施缓解干旱胁迫对小麦籽粒灌浆的抑制作用,对于北方旱区小麦的高产稳产具有重要意义。
多胺是一类广泛存在于生物体内的具有生物活性的低分子量脂肪族含氮碱,被认为是生长调节物质或激素的第二信使[3-4],不仅能促进植物正常的生长发育[5-6],而且在植物抗逆性方面发挥着重要作用[7-8]。前人研究表明,多胺显著影响小麦[5]和水稻[9]籽粒灌浆;Yang等[10]和Liu[11]等研究认为,外源亚精胺(Spd,多胺的一类)能显著提高小麦粒质量。除多胺外,乙烯作为一种重要的植物激素,也参与了植物对逆境胁迫的响应[12],同时参与调控作物籽粒灌浆[13-14]。前人研究表明,乙烯大量释放降低了小麦[15]和水稻[16]粒质量,喷施乙烯抑制剂能够增加小麦粒质量[13],提高水稻基部籽粒的干物质分配和籽粒灌浆[17],然而喷施乙烯释放促进剂-乙烯利则作用相反[13,17]。
这些研究结果表明多胺和乙烯均参与了植物对干旱胁迫的响应,同时二者对小麦籽粒灌浆均起着重要的调节作用。多胺和乙烯拥有共同的生物合成前体S-腺苷蛋氨酸(SAM)[18],它们可能在调控小麦籽粒灌浆方面互相影响,但是关于干旱胁迫下多胺和乙烯对小麦籽粒灌浆的调控及其生理机制还缺乏相关研究。因此,本研究采用外源喷施Spd和乙烯利处理,重点研究外源Spd和乙烯利对干旱胁迫下小麦籽粒灌浆动态、旗叶抗氧化酶活性、丙二醛(MDA)质量摩尔浓度、叶绿素质量分数及旗叶温度等指标的影响,旨在探讨外源Spd和乙烯利在干旱胁迫下调控小麦籽粒灌浆的相关机制,以期为旱区小麦灌浆期调控措施提供理论依据。
1 材料与方法
1.1 试验地概况
试验于2015年10月至2016年6月在陕西省西北农林科技大学农作物标本区(34°20′N,108°04′E,海拔521 m)防雨棚进行。该地区属暖温带半湿润易旱区,年均降雨量500~700 mm,年均气温11~13 ℃,年均日照时数2 196 h,无霜天数为210 d。试验区土壤属土娄土,耕层(0~20 cm)土壤有机质质量分数为12.34 g·kg-1,碱解氮57.45 mg·kg-1,速效磷17.33 mg·kg-1,速效钾118.57 mg·kg-1,pH 7.35。
1.2 试验设计
本试验供试小麦品种为‘西农979’,于2015-11-01种植于盆钵内,每个盆钵(上口径28 cm,下口径20.5 cm,高26.4 cm)装过筛土娄土25 kg,所用土壤均取自大田耕层(0~20 cm)土壤。播种前每盆施尿素约3.89 g,磷酸二铵约1.29 g。每盆播种25粒,3叶期定苗,每盆留苗15株。
小麦开花前土壤水势保持在-20~-30 kPa,从开花期至成熟期,进行2种水分处理:正常水分(WW,土壤水势保持在-20~-30 kPa)和干旱胁迫(DS,土壤水势保持在-50~-60 kPa)。土壤水势采用SWP-100型便携式土壤水势测定仪(中国科学院南京土壤研究所)监测,水势测定探头埋入深度为15~20 cm。每天10:30-11:30记录土壤水势测定仪读数,当土壤水势低于设定值时,分别补充一定量的水,使水势恢复至设定范围。小麦生长期管理同常规大田管理。
共设4个处理:(1)CK1:WW+喷施清水;(2)CK2:DS+喷施清水;(3)T1:DS+喷施1 mmol·L-1Spd;(4)T2:DS+喷施50 mmol·L-1乙烯利。喷施液均在开花期喷施于小麦穗部,每日17:00-18:00喷施,连续喷施4 d,喷施量为每株5 mL,所有喷施液中均含有φ=0.1%无水乙醇和φ=0.01% Tween-20,Spd、乙烯利和Tween-20均购买自美国Sigma公司。每个处理30盆,分为3组,作为3次重复。在开花期,各处理选择长势一致且同日开花的植株进行挂牌标记,从开花至成熟收获,每4 d取样1次。各处理每组取10株,穗部用于测定籽粒灌浆动态,旗叶用液氮速冻后存放于-70 ℃保存。
1.3 测定项目与方法
1.3.1 籽粒灌浆动态 取小麦中部小穗(从穗基部数第4~12小穗)的籽粒,籽粒样品经105 ℃杀青和70 ℃烘干称量。参照朱庆森等[19]的方法,用Richards方程[20]拟合。
W=A/(1+Be-kt)1/N
(1)
式中,W为粒质量(mg),A为最终粒质量 (mg),t为开花后的时间(d),B、k和N为回归方程所确定的参数。对方程(1)求导,得到灌浆速率(G)。
G=AkBe-kt/N(1+Be-kt)(N+1)/N
(2)
活跃灌浆期D(d)定义为粒质量W由最终粒质量A的5% (t1)增加到95% (t2)所经历的时间。这段时间内籽粒增加的质量除以灌浆时间(t2-t1)为平均灌浆速率Gmean。
1.3.2 抗氧化酶活性 取冷冻的小麦旗叶,采用氮蓝四唑(NBT)光化还原法测定超氧化物歧化酶(SOD)活性,以抑制NBT 光化还原的 50%为一个酶活性单位;采用愈创木酚法测定过氧化物酶(POD)活性, 以每分钟变化 0.01为一个酶活性单位;采用 240 mm 光密度比色法测定过氧化氢酶(CAT)活性,以每分钟变化 0.043 6为一个活性单位。具体测定方法参照张蜀秋[21]方法。
1.3.3 丙二醛质量摩尔浓度及叶绿素质量分数 取冷冻的小麦旗叶,采用硫代巴比妥酸(TBA)显色反应测定MDA 质量摩尔浓度[21];采用丙酮乙醇混合液[V(丙酮)∶V(乙醇)=2∶1]浸提比色法测定叶绿素质量分数[22]。
1.3.4 小麦旗叶远红外热成像图的获取 采用Fluke Ti100型红外热像仪(Fluke,America)采集小麦旗叶红外图像。该仪器配备160×120 焦平面阵列(FPA)非制冷微量热型探测器,能够探测的光谱范围为7.5~14 μm,镜头视场角为22.5°×31°,热灵敏度≤0.1 ℃(目标温度为30 ℃时),发射率设定为0.95。远红外热图像采集时间为花后12 d 10:00-10:30,获取的远红外图像用Smart View软件分析。
1.4 数据处理与分析
采用 Microsoft Excel 2010软件进行数据整理及绘制图表,SPSS 20.0软件进行统计分析。
2 结果与分析
2.1 外源Spd和乙烯利对干旱胁迫下籽粒灌浆的影响
干旱胁迫、外源Spd和乙烯利均显著影响小麦籽粒灌浆。由图1可知,干旱胁迫对小麦籽粒灌浆有显著抑制作用,从花后12 d开始,CK2处理的粒质量显著低于CK1;T1处理的粒质量从花后12 d开始显著高于CK2,但显著低于CK1,而T2处理粒质量在灌浆期显著低于CK2,这表明外源Spd显著缓解干旱胁迫对小麦籽粒灌浆的抑制作用,但是外源乙烯利则加重干旱胁迫对小麦籽粒灌浆的抑制作用。从籽粒灌浆速率拟合曲线可以看出,各处理籽粒灌浆速率均随灌浆进程呈现先增大后降低的单峰变化趋势,在花后16 d左右达到峰值,在整个灌浆进程中,籽粒灌浆速率均表现为CK1>T1>CK2>T2。
由表1可以看出,CK2处理下小麦籽粒的最终粒质量、最大灌浆速率、平均灌浆速率和活跃灌浆期均显著低于CK1,T1处理显著提高干旱胁迫下小麦的最终粒质量、最大灌浆速率和平均灌浆速率,对活跃灌浆期无显著影响,表明干旱胁迫下喷施Spd主要通过影响籽粒灌浆速率进而影响粒质量;T2处理则显著降低干旱胁迫下小麦的最终粒质量、最大灌浆速率、平均灌浆速率和活跃灌浆期。
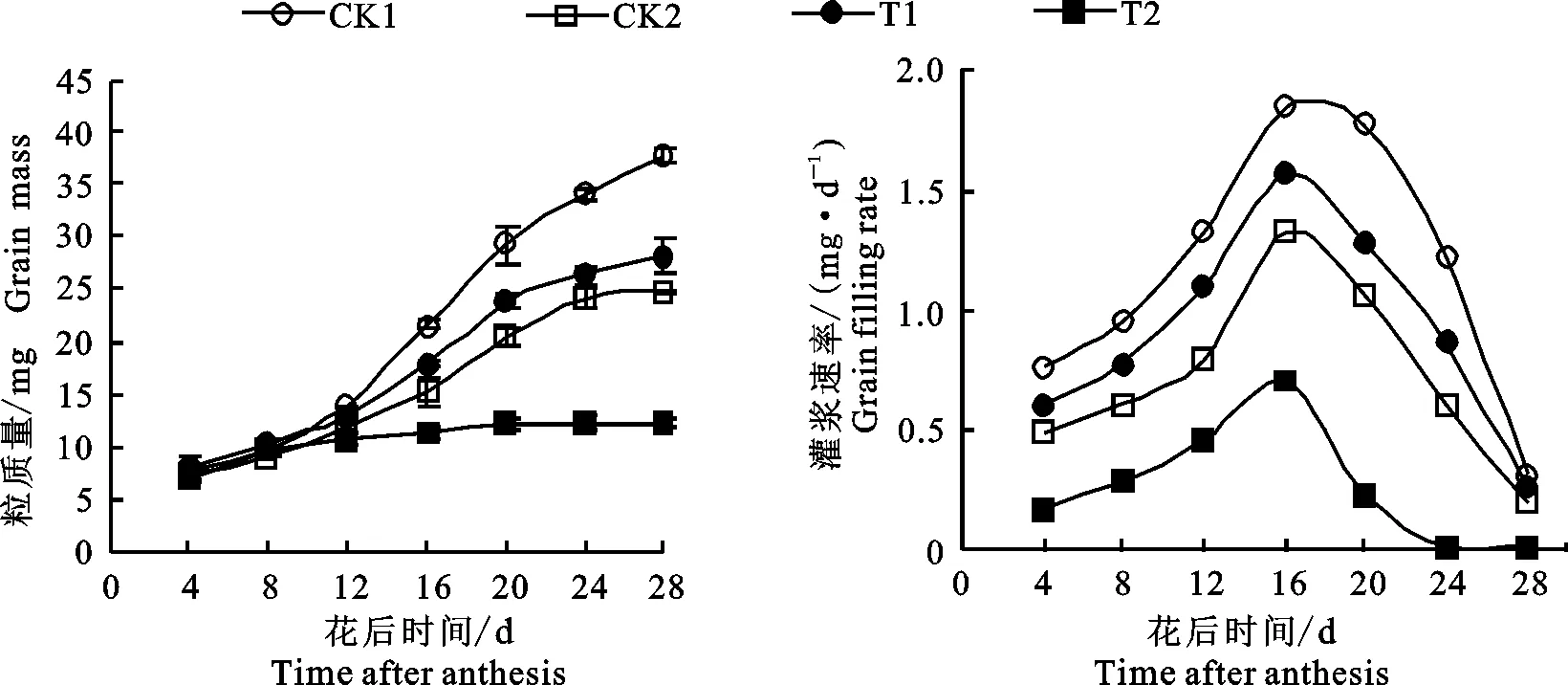
图1 不同处理下小麦的粒质量和籽粒灌浆速率Fig.1 Grain mass and grain filling rates of wheat under different treatments

表1 不同处理下小麦的籽粒灌浆参数Table 1 Grain filling parameters of wheat under different treatments
注: 同列数据后不同字母表示处理间差异显著(P<0.05)。
Note:Values within a column with different letters are significantly different between treatments(P<0.05).
2.2 外源Spd和乙烯利对干旱胁迫下小麦叶片抗氧化酶活性的影响
如图2所示,花后28 d内,小麦旗叶SOD活性除CK1呈先升后降趋势外,其余各处理均表现为下降趋势;在灌浆初期,CK2、T1、T2处理的SOD活性均高于CK1,在花后16~28 d,CK2处理的SOD活性显著低于CK1,T1处理显著提高干旱胁迫下小麦旗叶SOD活性,而外源乙烯利则作用相反。
不同处理下小麦旗叶POD活性总体表现为先升后降趋势,CK1和T1处理在花后12 d达到最大值,CK2和T2处理在花后8 d达到峰值;在花后16~24 d, CK2处理显著降低旗叶POD活性,T1处理显著提高干旱胁迫下旗叶的POD活性,T2处理显则著降低旗叶POD活性。
小麦旗叶中CAT活性除CK1呈先升后降趋势外,其余处理均呈下降趋势;在灌浆初期,不同处理之间CAT活性差异不显著,在花后12~20 d,CK2处理显著降低旗叶CAT活性,T1处理显著提高干旱胁迫下旗叶的CAT活性,而T2处理则使干旱胁迫下旗叶CAT活性进一步降低。
2.3 外源Spd和乙烯利对干旱胁迫下小麦叶片丙二醛质量摩尔浓度及叶绿素质量分数的影响
由图3可知,花后4~28 d,不同处理旗叶中 MDA 质量摩尔浓度均呈上升趋势。CK2处理在花后12~28 d显著增加旗叶MDA质量摩尔浓度,增幅为22.7%~60.2%,T1处理显著降低干旱胁迫下旗叶MDA质量摩尔浓度,较CK2下降4.6%~18.3%,但仍高于CK1;在花后4~28 d,T2处理显著增加干旱胁迫下小麦旗叶MDA质量摩尔浓度,较CK2上升15.3%~44.3%。
花后28 d内,各处理旗叶中叶绿素质量分数均呈下降趋势。灌浆初期,CK1、CK2和T1处理旗叶叶绿素质量分数变化不大,且各处理间差异不显著;从花后12 d开始,CK2处理显著降低旗叶叶绿素质量分数,较CK1下降13.0%~75.0%;T1处理显著增加干旱胁迫下旗叶叶绿素质量分数,较CK2上升8.9%~54.8%,但仍低于CK1;T2处理在花后8~20 d均显著降低干旱胁迫下旗叶叶绿素质量分数,较CK2下降10.8%~61.7%。
2.4 外源Spd和乙烯利对干旱胁迫下小麦旗叶温度的影响
从图4可以看出,小麦旗叶的温度对干旱胁迫的响应较为敏感,外源物质对干旱胁迫下小麦旗叶的温度有显著影响。本研究结果表明,CK2处理显著提高旗叶温度,相比CK1增加1.08 ℃,增幅为4.03%;T1处理显著降低干旱胁迫下小麦旗叶的温度,相比CK2降低0.58 ℃,降幅为2.05%,但相比CK1仍高0.51 ℃,T2处理则使干旱胁迫下小麦旗叶温度进一步升高,与CK1和CK2相比,分别增加1.90 ℃和0.81 ℃,增幅分别为7.03%和2.88%。
3 讨 论
3.1 外源Spd和乙烯利对干旱胁迫下小麦籽粒灌浆的影响
籽粒灌浆过程决定小麦粒质量,而粒质量是最后形成的产量构成因素,对最终产量的高低有显著影响。干旱胁迫显著影响禾谷类作物籽粒灌浆,在干旱胁迫下,小麦[23]、水稻[24]和玉米[25]等作物籽粒灌浆过程均受到显著抑制。本研究表明,干旱胁迫显著降低小麦籽粒的最大灌浆速率、平均灌浆速率和活跃灌浆期,进而降低粒质量,与前人研究结果一致。多胺和乙烯被认为是两类重要的植物激素或生长调节剂,均参与对植物生长发育及其对环境胁迫响应的调节[3,5,7,13]。前人研究表明,多胺和乙烯均参与对小麦等禾谷类作物籽粒灌浆的调控[5,11,23],但其机理尚不明确。本研究发现,外源Spd能够显著提高干旱胁迫下小麦的最大灌浆速率、平均灌浆速率及粒质量,显著缓解干旱胁迫对小麦籽粒灌浆的抑制作用,而外源乙烯利则作用相反,且显著降低活跃灌浆期,说明外源Spd和乙烯利对干旱胁迫小麦籽粒灌浆有显著的调控作用,并且表现相互拮抗作用。张伟杨等[23]和刘凯等[24]在水稻研究中发现,干旱胁迫下,喷施Spd和乙烯合成抑制剂氨基-乙氧基乙烯基甘氨酸(AVG)显著提高籽粒灌浆速率和粒质量,而喷施多胺合成抑制剂甲基已二醛-双(脒基腙)(MGBG)和乙烯利的结果则相反,与本研究结果一致。多胺和乙烯在生物合成过程中共用一个生物合成前体SAM,且前人研究表明施用外源Spd能显著降低小麦[5,10]和水稻[9,26]籽粒中乙烯释放速率,而施用外源乙烯利则显著增加籽粒中乙烯释放速率,籽粒中较高的乙烯水平会增加细胞分裂素的分解,进而抑制胚乳细胞分裂,导致较低的籽粒灌浆速率和粒质量[23],这可能是外源Spd促进干旱胁迫下籽粒灌浆而外源乙烯利抑制干旱胁迫下小麦籽粒灌浆重要原因。此外,也有研究指出在灌浆初期喷施Spd可以增加水稻籽粒蔗糖-淀粉代谢途径关键酶活性,进而实现对籽粒灌浆的调节[27],而外源乙烯利对籽粒中蔗糖-淀粉代谢途径关键酶活性的研究还鲜见报道。关于Spd和乙烯对干旱胁迫下小麦籽粒灌浆调控机制的研究有待进一步深入。

图2 不同处理下小麦旗叶的抗氧化酶活性Fig.2 Antioxidant enzyme activities of wheat flag leaves under different treatments

图3 不同处理下小麦旗叶的MDA质量摩尔浓度和叶绿素质量分数Fig.3 MDA molality and chlorophyll mass fraction of wheat flag leaves under different treatments
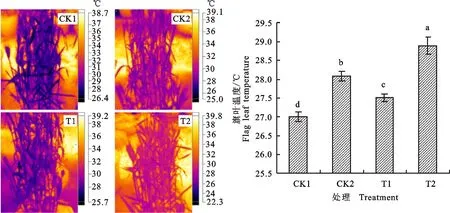
不同小写字母表示处理间差异显著(P<0.05) Different lowercase letters mean significant difference(P<0.05)
3.2 外源Spd和乙烯利对干旱胁迫下小麦籽粒灌浆的调控与植株衰老代谢的关系
干旱胁迫会改变植物一系列的代谢平衡,影响植物的生理生化功能。干旱胁迫造成植物体内的活性氧大量积累,进而破坏质膜结构、氧化蛋白质和核酸,导致细胞的氧化损伤,加速细胞的衰老和解体[28]。植物体内存在活性氧自由基清除系统,对维持细胞结构完整性和防御活性氧自由基对膜脂的攻击伤害有重要作用,其中SOD、POD、CAT等抗氧化酶起着重要作用;MDA是膜脂过氧化的最终产物,其质量摩尔浓度的大小可以反映植物遭受逆境伤害的程度。本研究发现干旱胁迫初期,小麦旗叶抗氧化酶都具有较高的活性,使植株能够有效清除胞内各种活性氧自由基,阻止干旱胁迫对植物机体产生显著损伤,这是植物对胁迫环境的适应性反应。随着干旱胁迫时间的延续,小麦旗叶中SOD、CAT、POD等抗氧化酶活性显著降低,MDA的质量摩尔浓度显著增加,与前人研究结果一致[29],这一结果表明干旱胁迫在籽粒灌浆进程中破坏小麦植株体内的抗氧化酶系统,诱导小麦植株体内活性氧的产生。对于多胺和乙烯调控干旱胁迫下小麦灌浆的作用机制,目前还不清楚。本研究观察到,在灌浆初期喷施Spd可以提高干旱胁迫下小麦旗叶的SOD、POD、CAT活性,同时对干旱胁迫下小麦MDA质量摩尔浓度的升高具有明显的缓解作用,喷施乙烯利作用则相反,表明干旱胁迫下外源Spd可通过提高植株体内抗氧化酶活性,降低MDA质量摩尔浓度,减缓小麦在干旱胁迫下受到的氧化伤害,增强对干旱逆境的适应性,而外源乙烯利处理加重干旱胁迫下小麦旗叶受到的氧化伤害。
叶绿素是植物体内重要的光合色素,对植物进行正常的光合作用具有重要的意义。本研究结果表明,干旱胁迫造成小麦旗叶叶绿素质量分数下降,外源Spd缓解干旱胁迫下小麦叶绿素质量分数的下降幅度,喷施乙烯利则使干旱胁迫下小麦叶绿素质量分数进一步下降,这可能是因为Spd可以通过抑制乙烯的生物合成而延缓植物衰老[30],而外源乙烯利通过促进乙烯释放,则可加速植株衰老。外源Spd使干旱胁迫小麦旗叶的持绿性得到提高,乙烯利作用相反,而持绿性是作物抗旱的重要性状,与小麦灌浆进程以及产量形成关系密切。
以上这些结果表明,外源Spd可以提高干旱胁迫下旗叶SOD、POD、CAT等抗氧化酶活性,降低MDA质量摩尔浓度,增加叶绿素质量分数,进而延缓小麦植株的衰老,提高小麦在灌浆期的抗旱性,而外源乙烯利则作用相反,加速小麦植株的衰老。这可能是外源Spd能够促进干旱下小麦籽粒灌浆而外源乙烯利抑制干旱胁迫下籽粒灌浆的另一个重要原因。
3.3 外源Spd和乙烯利对干旱胁迫下小麦籽粒灌浆的调控与旗叶温度的关系
在正常情况下,植物的叶片温度通过蒸腾失水来维持相对的稳定性,一旦受到逆境胁迫的影响,叶片温度则会发生变化,叶温的变化可以被用来监测诊断植株的受胁迫情况[31]。一般气孔行为的改变会直接反映在一些生理指标的改变上,如气孔导度和蒸腾强度等,而蒸腾强度的改变通常会改变叶片表面热量损失程度的大小,进而反应在叶温的改变上。远红外成像技术可以快速精确的检测植株叶片因气孔开度变化而导致的微小温度差异,并且能把这种通过传统手段很难量化的指标以可视化图像呈现出来,且具有非接触、无损、高通量等特点,目前已成功的应用于对植物突变体的筛选[32]以及植株抗旱性检测与筛选[33]。本试验利用远红外成像技术研究外源Spd和乙烯利对干旱胁迫下小麦旗叶温度的影响,发现在干旱胁迫下,小麦旗叶温度显著增加,主要是因为在干旱胁迫下,小麦水分吸收跟不上水分的蒸腾,因此气孔为了维持植物体内的水分平衡将会趋于关闭,导致蒸腾强度的降低,进而导致叶温的升高;外源Spd处理显著降低干旱胁迫下小麦旗叶温度,而外源乙烯利处理作用则相反,这表明喷施Spd能够在一定程度缓解小麦植株受到的干旱胁迫,使小麦旗叶温度接近正常植物的温度,究其原因,可能是外源Spd能缓解干旱胁迫下叶片气孔的关闭,与张春梅等[34]研究结果一致;而喷施乙烯利则加重小麦的干旱程度,导致干旱胁迫下小麦旗叶温度进一步升高,可能是因为乙烯具有诱导气孔关闭的作用[35]。气孔的开闭不仅控制着蒸腾作用水分的散失,而且控制着光合作用所需CO2的摄取,气孔开闭的调节显著影响作物的最终产量。外源Spd通过缓解干旱胁迫下小麦旗叶气孔的关闭,能够促进植株对CO2的吸收,从而提高植株的光合能力,而外源乙烯则作用相反,这与外源Spd促进干旱胁迫下籽粒灌浆而外源乙烯利抑制干旱胁迫下小麦籽粒灌浆的结果相符合。
4 结 论
干旱胁迫显著抑制小麦籽粒灌浆,外源Spd能够显著促进干旱胁迫下小麦籽粒灌浆,而外源乙烯利显著抑制干旱胁迫下小麦籽粒灌浆。外源Spd能够在灌浆进程中显著提高干旱胁迫下小麦旗叶的抗氧化酶活性,抑制活性氧的产生,降低MDA质量摩尔浓度,提高叶绿素质量分数,降低旗叶温度,而外源乙烯利则作用相反,外源Spd和乙烯利对干旱胁迫下籽粒灌浆的影响可能与植株体内抗氧化酶活性、MDA质量摩尔浓度、叶绿素质量分数和气孔开闭有关。
Reference:
[1] CHAVES M M,OLIVEIRA M M.Mechanisms underlying plant resilience to water deficits:prospects for water-saving agriculture[J].JournalofExperimentalBotany,2004,55(407):2365-2384.
[2] MADANI A,RAD A S,PAZOKI A,etal.Wheat (TriticumaestivumL.) grain filling and dry matter partitioning responses to source:sink modifications under postanthesis water and nitrogen deficiency[J].ActaScientiarumAgronomy,2010,32(1):145-151.
[3] ALCAZAR R,MARCO F,CUEVAS J C,etal.Involvement of polyamines in plant response to abiotic stress[J].BiotechnologyLetters,2006,28(23):1867-1876.
[4] LIU H P,DONG B H,ZHANG Y Y,etal.Relationship between osmotic stress and the levels of free,conjugated and bound polyamines in leaves of wheat seedlings[J].PlantScience,2004,166(5):1261-1267.
[5] 刘 杨,温晓霞,顾丹丹,等.多胺对冬小麦籽粒灌浆的影响及其生理机制[J].作物学报,2013,39(4):712-719.
LIU Y,WEN X X,GU D D,etal.Effect of polyamine on grain filling of winter wheat and its physiological mechanism[J].ActaAgronomicaSinica,2013,39(4):712-719 (in Chinese with English abstract).
[6] 徐 璐,邢树堂,孙宪芝,等.多胺对菊花激素含量与花芽分化的影响[J].植物生理学报,2014,50(8):1195-1202.
XU L,XING SH T,SUN X ZH,etal.Effects of polyamines on hormones contents and the relationship with the flower bud differentiation in chrysanthemum[J].PlantPhysiologyJournal,2014,50(8):1195-1202 (in Chinese with English abstract).
[7] YIN Z P,LI S,REN J,etal.Role of spermidine and spermine in alleviation of drought-induced oxidative stress and photosynthetic inhibition in Chinese dwarf cherry(Cerasushumilis) seedlings[J].PlantGrowthRegulation,2014,74(3):209-218.
[8] 刘 冰,周新国,李彩霞,等.叶面喷施外源多胺提高夏玉米灌浆前期抗涝性[J].农业工程学报,2016,32(12):122-128.
LIU B,ZHOU X G,LI C X,etal.Foliar spraying polyamine improving waterlogging resistance of summer maize in early grain filling stage[J].TransactionsoftheChineseSocietyofAgriculturalEngineering,2016,32(12):122-128 (in Chinese with English abstract).
[9] WANG Z,XU Y,WANG J,etal.Polyamine and ethylene interactions in grain filling of superior and inferior spikelets of rice[J].PlantGrowthRegulation,2012,66(66):215-228.
[10] YANG W,YIN Y,LI Y,etal.Interactions between polyamines and ethylene during grain filling in wheat grown under water deficit conditions[J].PlantGrowthRegulation,2014,72(2):189-201.
[11] LIU Y,LIANG H,LV X,etal.Effect of polyamines on the grain filling of wheat under drought stress[J].PlantPhysiologyandBiochemistry,2016(100):113-129.
[12] 王 忠.植物生理学[M].北京:中国农业出版社,2002:267-273.
WANG ZH.Plant Physiology[M].Beijing:China Agriculture Press,2002:267-273(in Chinese).
[13] YANG J,ZHANG J,LIU K,etal.Abscisic acid and ethylene interact in wheat grains in response to soil drying during grain filling[J].NewPhytologist,2006,171(2):293-303.
[14] YANG J,ZHANG J,LIU K,etal.Abscisic acid and ethylene interact in rice spikelets in response to water stress during meiosis[J].JournalofPlantGrowthRegulation,2007,26(4):318-328.
[15] BELTRANO J,RONCO M G,MONTALDI E R.Drought stress syndrome in wheat is provoked by ethylene evolution imbalance and reversed by rewatering,aminoethoxyvinylglycine,or sodium benzoate[J].JournalofPlantGrowthRegulation,1999,18(2):59-64.
[16] YANG J C,ZHANG J H,X.Y Y,etal.Involvement of abscisic acid and ethylene in the responses of rice grains to water stress during filling[J].PlantCell&Environment,2004,27(8):1055-1064.
[17] NAIK P K,MOHAPATRA P K.Ethylene inhibitors enhanced sucrose synthase activity and promoted grain filling of basal rice kernels[J].AustralianJournalofPlantPhysiology,2000,27(27):997-1008.
[18] RAVANEL S,GAKIERE B,JOB D,etal.The specific features of methionine biosynthesis and metabolism in plants[J].ProceedingsoftheNationalAcademyofScience,1998,95(13):7805-7812.
[19] 朱庆森,曹显祖,骆亦其.水稻籽粒灌浆的生长分析[J].作物学报,1988,14(3):182-193.
ZHU Q S,CAO X Z,LUO Y Q.Growth analysis on the process of grain filling in rice[J].ActaAgronomicaSinica,1988,14(3):182-193(in Chinese with English abstract).
[20] RICHARDS F J.A flexible growth function for empirical use[J].JournalofExperimentalBotany,1959,10(2):290-301.
[21] 张蜀秋.植物生理学实验技术教程[M].北京:科学出版社,2011:191-196.
ZHANG SH Q.Techniques for Plant Physiology Experiment[M].Beijing:Science Press,2011:191-196(in Chinese).
[22] 明 华,胡春胜,张玉铭,等.浸提法测定玉米叶绿素含量的改进[J].玉米科学,2007,15(4):93-95.
MING H,HU CH SH,ZHANG Y M,etal.Improved extraction methods of chlorophyll from maize[J].JournalofMaizeSciences,2007,15(4):93-95(in Chinese with English abstract).
[23] 张伟杨,徐云姬,钱希旸,等.小麦籽粒游离多胺对土壤干旱的响应及其与籽粒灌浆的关系[J].作物学报,2016,42(6):860-872.
ZHANG W Y,XU Y J,QIAN X Y,etal.Free polyamines in grains in response to soil drought and their relationship with grain filling of wheat[J].ActaAgronomicaSinica,2016,42(6):860-872(in Chinese with English abstract).
[24] 刘 凯,叶玉秀,唐 成,等.水稻籽粒中乙烯和ACC对土壤水分的反应及其与籽粒灌浆的关系[J].作物学报,2007,33(4):539-546.
LIU K,YE Y X,TANG CH,etal.Responses of ethylene and ACC in rice grains to soil moisture and their relation to grain filling[J].ActaAgronomicaSinica,2007,33(4):539-546(in Chinese with English abstract).
[25] 王永平,刘 杨,卢海军,等.水分胁迫对夏玉米籽粒灌浆的影响及其与内源激素的关系[J].西北农业学报,2014,23(4):28-32.
WANG Y P,LIU Y,LU H J,etal.Effect of water stress on grain filling and hormone changes in grains of summer corn[J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(4):28-32(in Chinese with English abstract).
[26] CHEN T,XU Y,WANG J,etal.Polyamines and ethylene interact in rice grains in response to soil drying during grain filling[J].JournalofExperimentalBotany,2013,64(8):2523-2538.
[27] 谈桂露,张 耗,付 景,等.超级稻花后强、弱势粒多胺浓度变化及其与籽粒灌浆的关系[J].作物学报,2009,35(12):2225-2233.
TAN G L,ZHANG H,FU J,etal.Post-anthesis changes in concentrations of polyamines in superior and inferior spikelets and their relation with grain filling of super rice[J].ActaAgronomicaSinica,2009,35(12):2225-2233 (in Chinese with English abstract).
[28] REDDY A R,CHAITANYA K V,VIVEKANANDAN M.Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants[J].JournalofPlantPhysiology,2004,161(11):1189-1202.
[29] 张仁和,郭东伟,张兴华,等.吐丝期干旱胁迫对玉米生理特性和物质生产的影响[J].作物学报,2012,38(10):1884-1890.
ZHANG R H,GUO D W,ZHANG X H,etal.Effects of drought stress on physiological characteristics and dry matter production in maize silking stage[J].ActaAgronomicaSinica,2012,38(10):1884-1890 (in Chinese with English abstract).
[30] QUINET M,NDAYIRAGIJE A,LEFEVRE I,etal.Putrescine differently influences the effect of salt stress on polyamine metabolism and ethylene synthesis in rice cultivars differing in salt resistance[J].JournalofExperimentalBotany,2010,61(10):2719-2733.
[31] CHAERLE L,VAN D S D.Imaging techniques and the early detection of plant stress[J].TrendsinPlantScience,2000,5(11):495-501.
[32] 宋玉伟,宋纯鹏.拟南芥H2O2突变体的筛选及特性分析[J].西北植物学报,2009,29(5):888-893.
SONG Y W,SONG CH P.Isolation and characteraction of H2O2mutants in arabidopsis thaliana[J].ActaBotanicaBoreali-occidentaliaSinica,2009,29(5):888-893 (in Chinese with English abstract).
[33] 刘 亚,丁俊强,苏巴钱德,等.基于远红外热成像的叶温变化与玉米苗期耐旱性的研究[J].中国农业科学,2009,42(6):2192-2201.
LIU Y,DING J Q,SUBHASH CHANDER,etal.Identification of maize drought-tolerance at seedling stage based on leaf temperature using infrared thermography[J].ScientiaAgriculturaSinica,2009,42(6):2192-2201(in Chinese with English abstract).
[34] 张春梅,邹志荣,黄 志,等.外源亚精胺对干旱胁迫下不同品种番茄幼苗光合作用的影响[J].干旱地区农业研究,2010,28(3):182-187.
ZHANG CH M,ZOU ZH R,HUANG ZH,etal.Effects of exogenous spermidine on photosynthesis of tomato seedlings under drought stress[J].AgriculturalResearchintheAridAreas,2010,28(3):182-187(in Chinese with English abstract).
[35] 刘国华,侯丽霞,刘 菁,等.H2O2介导的NO合成参与乙烯诱导的拟南芥叶片气孔关闭[J].自然科学进展,2009,19(8):841-851.
LIU G H,HOU L X,LIU J,etal.H2O2-mediated NO synthesis in ethylene-induced stomatal closure[J].ProgressinNaturalScience,2009,19(8):841-851(in Chinese).
(责任编辑:成 敏 Responsible editor:CHENG Min)
Effect of Exogenous Spermidine and Ethephon on Grain Filling of Wheat under Drought Stress and Its Physiological Mechanism.
CHEN Qing,LÜ Xiaokang,LI Jia,LIAO Yuncheng,LIU Yang and WEN Xiaoxia.
(College of Agronomy,Northwest A&F University,Yangling Shaanxi 712100,China)
Wheat grain filling is influenced by drough, and it is of an important agronomic traits to affect grain mass. Spermidine(Spd) and ethephon are regulators of plant growth that is proved to participate in regulation of grain filling in cereal crop. In the study,wheat cultivar ‘Xinong 979’ was used to investigate the effect of exogenous Spd and ethephon on grain mass during grain filling stage under drought stress; besides, the activities of antioxidant enzymes (SOD, POD, and CAT), malondialdehyde (MDA) molality , chlorophyll mass fraction and temperature in flag leaves were also measured for explaining the mechanism of such effects. The results showed that drought stress significantly inhibited grain filling, exogenous Spd significantly promoted the grain filling under drought stress,while exogenous ethephon significantly inhibited the grain filling under drought stress. Exogenous Spd increased activities of antioxidant enzymes and chlorophyll mass fraction and decreased MDA molality and temperature in flag leaves during filling process under drought stress, while exogenous ethephon had the opposite effect on those indexes.Therefore, exogenous Spd and ethephon had notable effect on grain filling under drought stress, it may relate to the activities of antioxidant enzymes, chlorophyll mass fraction , MDA molality and the degree of stomatal closure in leaves.
Spermidine;Ethephon;Drought stress;Wheat;Grain filling
2016-10-10 Returned 2016-10-21
National Natural Science Foundation of China(No.31301260); National Key Technology Support Program(No.2015BAD22B03-05); General Program of China Science Foundation for Postdoc(No.2015M572604);Association for Science and Technology Youth Talent Lifting Project of Shaanxi province(No.20150109);Science and Technology Co-ordination Innovation Project of Shaanxi province(No.2015KTZDNY01-02).
CHEN Qing,male,master student.Research area:crop physiology and ecology.E-mail:chenqing6011@163.com
LIU Yang,male,associate professor.Research area:physiology and ecology.E-mail:liuyang0328@126.com
日期:2017-06-29
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170629.1107.002.html
2016-10-10
2016-10-21
国家自然科学基金(31301260);国家科技支撑计划项目(2015BAD22B03-05);中国博士后科学基金面上项目(2015M572604);陕西省高校科协青年人才托举计划项目(20150109);陕西省科技统筹创新工程计划项目(2015KTZDNY01-02)。
陈 庆,男,硕士研究生,研究方向为作物生态生理。E-mail:chenqing6011@163.com
刘 杨,男,副教授,研究方向为农业生理生态。E-mail:liuyang0328@126.com 温晓霞,女,教授,研究方向为农业生态和高效农作制度。E-mail:wenxiaoxia6811@163.com
S311
A
1004-1389(2017)07-0998-09
WEN Xiaoxia,female,professor.Research area:agro-ecology and efficient farming system.E-mail:wenxiaoxia6811@163.com

