血必净注射液对脓毒症大鼠心功能及内皮功能的影响
何健卓,尹 鑫,马世玉,郭力恒,张敏州
·基础医学论著/研究·
血必净注射液对脓毒症大鼠心功能及内皮功能的影响
何健卓,尹 鑫,马世玉,郭力恒,张敏州
目的 探讨血必净注射液(XBJ)对脓毒症大鼠心肌及血清核转录因子-κB(NF-κB)表达;血清内皮素-1(ET-1)、血管性血友病因子(vWF)、内皮型一氧化氮合酶(eNOS)等内皮功能指标的影响及对心功能障碍的保护作用。方法 将42只SD大鼠按随机数字表法分为假手术组(Sham,n=6)、模型组(CLP,n=18)、中药组(XBJ,n=18),通过盲肠结扎穿孔(CLP)法制作脓毒症大鼠模型。中药组腹腔注射血必净注射液(浓度为1 mg/mL,10 mg/kg);假手术组、模型组则灌胃生理盐水,每12 h予1次。应用小动物超声、ELISA、免疫组化及病理学等方法观察XBJ对脓毒症大鼠模型的心率、左室射血分数(LVEF)、左室收缩末内径(LVISD)、左室舒张末内径(LVIDD)、室间隔厚度(IVS),内皮功能(ET-1、vWF、eNOS)及外周血、心脏的NF-κB等指标变化。结果 造模24 h后心脏彩超提示与Sham组比较, CLP组HR上升(P<0.05);LVEF及IVS活动度(P<0.05)下降;LVISD及LVIDD上升(P<0.05)。与Sham组比较,XBJ组HR上升(P<0.05),LVEF下降(P<0.05)。CLP组48 h后HR较24 h下降(P<0.05)。XBJ组24 h及48 h与CLP组同时点比较心率下降(P<0.05),LVISD减少(P<0.05),LVEF及IVS升高(P<0.05)。造模后24 h,CLP组ET-1及vWF较Sham组升高(P<0.05),eNOS较Sham组降低(P<0.05)。XBJ组ET-1(P<0.05)及vWF较Sham组升高(P<0.05),eNOS较Sham组降低(P<0.05)。XBJ组24 h ET-1、vWF水平低于CLP组(P<0.05)、eNOS高于CLP组(P<0.05),48 h ET-1水平低于CLP组(P<0.05)。造模后24 h,血清NF-κB水平CLP组、XBJ组较Sham组升高(P<0.05),XBJ组低于CLP组(P<0.05)。Sham组偶见NF-κB表达阳性细胞,细胞质浅黄色且阳性率较低,显著低于CLP组。CLP组可见大量阳性细胞,多数为棕黄色,阳性率高。XBJ组阳性细胞减少,多数为浅黄色或黄色,且阳性率较模型组明显降低(P<0.05)。结论 血必净可改善CLP大鼠心功能及内皮功能,降低内皮细胞标志物浓度,其机制可能是干预NF-κB信号通路,降低NF-κB表达,增加eNOS表达,减少内皮损伤,内皮功能障碍可能是脓毒症心功能障碍的其中一个重要机制。
脓毒症;血必净注射液;大鼠;心肌;核转录因子-κB;内皮功能
脓毒症(sepsis)是宿主对侵袭性感染反应的一个复杂综合征,成为人类健康的重要威胁。脓毒症、脓毒症休克及多器官功能障碍综合征(MODS)的死亡率从25%~70%,是非冠心病重症监护病房(ICU)的主要死亡原因[1]。脓毒症的发病机制复杂,传统研究主要集中在白细胞介导的炎症反应。新近研究表明,内皮细胞在脓毒症发展至严重脓毒症及脓毒症休克进程中至关重要[2]。内皮细胞在脓毒症病人血管渗漏及休克过程中起重要作用。微血管改变是导致脓毒症诱导心功能障碍(SIMD)的主因,而进展的血流动力学紊乱和心血管不稳定是导致死亡的重要原因[3]。
核转录因子-κB(NF-κB)诱导表达的靶基因中多种物质是炎性反应、内皮激活的关键介质,在脓毒症/脓毒性休克的发生、发展中作用重要[4]。血必净注射液(XBJ)已被广泛用于治疗脓毒症及保护器官、稳定血管内皮细胞,改善凝血功能障碍并调节炎症反应和氧化应激。目前对血必净注射液干预NF-κB通路从而影响脓毒症和感染性休克的研究甚少。本研究采用盲肠结扎穿孔(cecal ligation and puncture,CLP)复制脓毒症大鼠模型,观察血必净注射液对脓毒症大鼠NF-κB信号通路的活化调控,探讨其对脓毒症诱导心功能及内皮功能的保护作用。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠42只,体重为210 g±10 g,南方医科大学实验动物中心提供,实验动物合格证号:44002100001869;动物实验环境设施合格证号:SYXK(粤)2008-0094。
1.2 试剂与药品 BIOPAC SYSTEMS(MP150型)16道生理系统记录仪(美国),超高分辨率小动物彩色多普勒(Visualsonics,Canada),Anke TDL-5-A低温离心机(上海),UV-754分光光度计(上海),LIBROR AEU-210型电子分析天平(上海),DT-1TB电子体温计(上海医用仪表厂),玻璃匀浆器、眼科手术剪、手术刀、镊子、离心管、EP管、试管等。
血必净注射液(国药准字 Z20040033;天津红日药业股份有限公司生产)。组分:红花、赤芍、川芎、丹参、当归等中药材提取物,主要成分为红花黄色素A等。性状:棕黄色至棕红色澄明液体;规格:每支10 mL;包装:玻璃安瓿包装,每盒5支。实验用血清内皮素-1(ET-1)、血管性血友病因子(vWF)、内皮型一氧化氮合酶(eNOS)、NF-κB试剂盒:上海拜沃生物科技公司提供;NF-κB p65免疫组化抗原:BIOSS公司生产;以上试剂置于4 ℃冰箱保存。碘、75%酒精棉球、4%无菌水合氯醛、生理盐水由广东省中医院提供。
1.3 动物分组与模型 将42只SD大鼠按随机数字表法分为假手术组(Sham,n=6)、模型组(CLP,n=18)、中药组(XBJ,n=18),CLP组、XBJ组均在24 h、48 h两个时间点取样。参照Rittirsch等[5]描述方法,复制CLP脓毒症模型,其优点是该模型较其他方法更符合临床脓毒症病人发病过程。大鼠称重后标记,假手术组打开腹腔,拉出盲肠后轻轻翻动盲肠,再还纳腹腔后缝合腹腔。术后以生理盐水灌胃,以后每12 h同上以生理盐水灌胃一次。模型组及中药组皆使用盲肠结扎穿刺法造模,模型组造模后10 min腹腔注射生理盐水10 mL/kg;中药组造模后10 min腹腔注射血必净注射液(浓度1 mg/mL,10 mg/kg),每12 h给药。CLP方法如下:以水合氯醛(0.3 mL/100 g)麻醉后,于腹前正中作长约2 cm切口,游离肠系膜和盲肠,以30号丝线环形结扎盲肠根部,结扎完毕应仔细检查,保持肠道通路正常。在与肠系膜相对的盲肠肠壁浆膜面用18号针头穿刺2处。针孔之间相距约1 cm。轻轻挤压肠管使粪便自穿刺点溢出,还纳肠管,逐层缝合关腹。假手术组6只大鼠统一于24 h活杀取标本,CLP组及XBJ组分别于24 h、48 h观察死亡率及活杀取标本。实验过程中动物处置方法符合动物伦理学标准。
1.4 观察项目和检验指标 在常温下用DT-1TB电子体温计行大鼠肛管内测定肛温及记录,通过BIOPAC SYSTEM16道生理系统记录仪记录大鼠的心电图、呼吸波并计算次数。肉眼观察大鼠粪便次数及性状,大鼠死亡率等情况。动物麻醉开腹活杀后立即取心、肺及肝脏组织标本行苏木精伊红(HE)染色,在光镜下观察脏器组织学改变。Vevo 2100超高分辨率小动物彩色多普勒监测各时点大鼠左室射血分数(LVEF)、缩短分数(FS)、左室舒张末期内径(LVIDD)、左室收缩末期内径(LVISD)、室间隔厚度(IVS)等动态变化规律。经腹主动脉采血2 mL,分别用台式离心机3 000 r/min离心15 min后,取上清液-80 ℃保存。采用酶联免疫吸附法(ELISA)测定血清ET-1、vWF、eNOS、NF-κB浓度;免疫组化组织染色法检测大鼠心脏组织中的NF-κB p65表达活性,着色强度按未着色、淡黄、粽黄及黄褐色分为(-)、(+)、(++)、(+++)。阳性比率:随机观察5个中倍视野(10×20),计算呈黄色的阳性细胞占细胞数的比例。具体步骤按试剂盒说明进行。

2 结 果
2.1 3组大鼠心功能比较 造模24 h后,与Sham组比较,CLP组大鼠明显上升,LVEF及IVS活动度下降,LVISD及LVIDD上升,差异有统计学意义(P<0.05);XBJ组与Sham组比较心率上升,LVEF下降,差异有统计学意义(P<0.05)。CLP组给予生理盐水腹腔注射,48 h后HR较24 h下降,差异有统计学意义,提示炎症反应减轻及液体复苏可有效降低心率。XBJ组腹腔注射XBJ后,24 h及48 h与CLP组比较心率下降、LVISD减少、LVEF及IVS活动度升高,差异有统计学意义(P<0.05),提示XBJ可有效改善CLP组大鼠心脏心肌活动从而改善心功能。详见表1、图1。
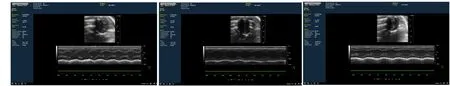
Shan组 CLP组 XBJ组
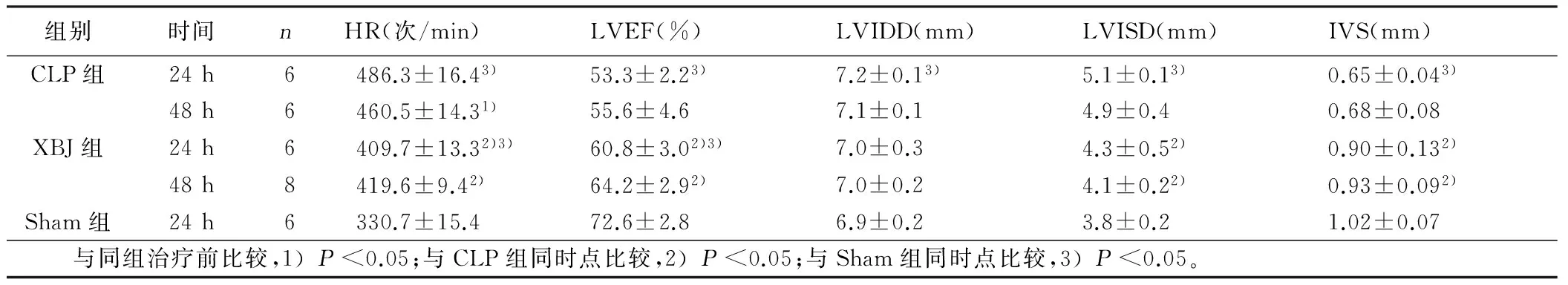
组别时间nHR(次/min)LVEF(%)LVIDD(mm)LVISD(mm)IVS(mm)CLP组24h6486.3±16.43)53.3±2.23)7.2±0.13)5.1±0.13)0.65±0.043)48h6460.5±14.31)55.6±4.67.1±0.14.9±0.40.68±0.08XBJ组24h6409.7±13.32)3)60.8±3.02)3)7.0±0.34.3±0.52)0.90±0.132)48h8419.6±9.42) 64.2±2.92)7.0±0.24.1±0.22)0.93±0.092)Sham组24h6330.7±15.4 72.6±2.86.9±0.23.8±0.21.02±0.07 与同组治疗前比较,1)P<0.05;与CLP组同时点比较,2)P<0.05;与Sham组同时点比较,3)P<0.05。
2.2 3组大鼠不同时点内皮功能标志物比较 造模后24 h,CLP组及XBJ组ET-1及vWF较Sham组升高,eNOS较Sham组降低,差异有统计学意义(P<0.05),提示CLP大鼠存在内皮功能损伤;48 h与24 h比较ET-1、vWF已有较明显的降低趋势,eNOS有升高趋势,提示内皮功能改变发生在脓毒症早期,中后期逐步抑制。XBJ组24 hET-1、vWF水平低于CLP组,eNOS高于CLP组,差异有统计学意义(P<0.05);48 h ET-1低于CLP组差异有统计学意义(P<0.05),提示XBJ对CLP大鼠内皮功能有一定改善作用。详见表2。
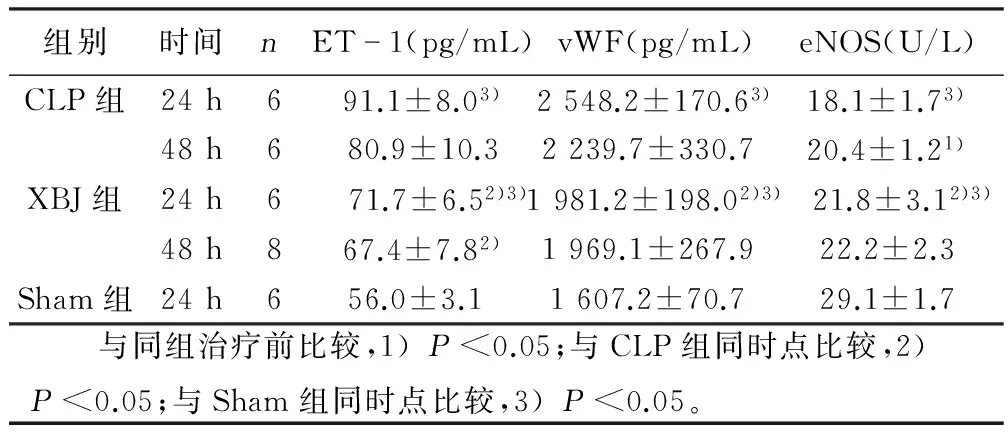
组别时间nET1(pg/mL)vWF(pg/mL)eNOS(U/L)CLP组24h691.1±8.03)2548.2±170.63)18.1±1.73)48h680.9±10.32239.7±330.7 20.4±1.21)XBJ组24h6 71.7±6.52)3)1981.2±198.02)3) 21.8±3.12)3)48h867.4±7.82)1969.1±267.9 22.2±2.3Sham组24h656.0±3.1 1607.2±70.7 29.1±1.7 与同组治疗前比较,1)P<0.05;与CLP组同时点比较,2)P<0.05;与Sham组同时点比较,3)P<0.05。
2.3 3组大鼠不同时点血清NF-κB水平比较 造模后24 h,CLP组及XBJ组大鼠血清NF-κB水平较Sham组明显升高,差异有统计学意义(P<0.05),提示CLP大鼠循环中NF-κB被激活,表达升高;48 h出现下降,提示其激活多在脓毒症早期出现,中晚期水平会有下降趋势;XBJ组24 h血清NF-κB水平低于CLP组,提示血必净能在一定程度上降低NF-κB水平。详见表3。
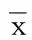
表3 3组大鼠血清NF-κB水平比较(±s) pg/mL
2.4 心肌组织病理改变 光镜:Sham组心肌未见明显组织病理学改变,心肌横纹清晰,未见水肿变性、萎缩;CLP组可见肌束浆较多炎细胞浸润,炎细胞呈单核及中性粒细胞改变,小血管瘀血、部分心肌空泡变性;XBJ组可见肌束浆少量炎细胞浸润,为单核及中性粒细胞。详见图2。
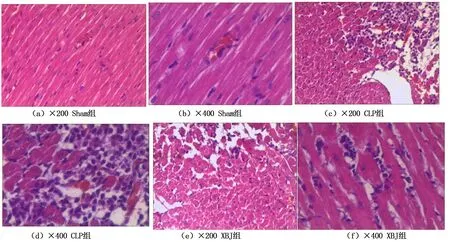
图2 光镜下心肌病理组织表现
2.5 3组大鼠心脏组织NF-κB p65阳性细胞数比较 Sham组偶见NF-κB表达阳性细胞,细胞质浅黄色且阳性率较低,显著低于CLP组。CLP组可见大量阳性细胞,多数为棕黄色,阳性率高。XBJ组阳性细胞减少,多数为浅黄色或黄色,且阳性率较模型组明显降低,详见图3。CLP组与Sham组、XBJ组比较,差异有统计学意义(P<0.05)。详见表4、表5。

表4 3组大鼠心脏组织NF-κB p65阳性细胞数比较 个
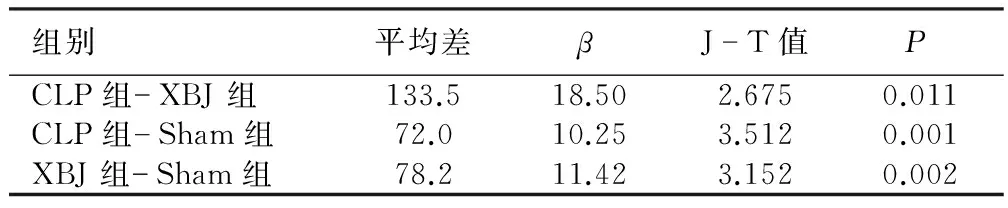
表5 3组大鼠心脏组织NF-κB p65阳性细胞数组间比较
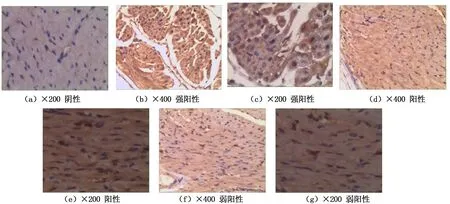
图3 大鼠心肌组织NF-κBp65免疫组化表达
3 讨 论
人们对脓毒症诱导心功能障碍认识起源于重要的临床观察。Park等[6]首先根据肺动脉导管的血流动力学数据,描述感染性休克病人可逆性心肌顿抑,在实验中发现右心室扩张和右心室射血分数明显减低,但在脓毒症发病后7 d~14 d恢复正常。因此,心肌抑制同时影响左右心室。有学者建议SIMD可定义为脓毒症引起的心脏左右两侧内源性心肌收缩及舒张功能障碍[7]。本实验得出类似结果,实验大鼠中CLP组与Sham组相比HR增加,LVEF下降,LVIDD与LVISD增加,IVS活动幅度下降,提示大鼠经过CLP后,心脏超声表现出心脏扩大、室间隔活动减弱,舒张末期及收缩末期左心室内径(尤其是收缩末)增加,心脏射血分数下降,提示心脏收缩功能受到明显抑制;而XBJ组与CLP组比较,心率和心功能改善。有研究表明,预后较好病人,左心室扩张伴随着双侧心室射血分数下降、每搏量(SV)及心输出量(CO)改善,这可能是脓毒症时心脏的一个代偿机制。目前对SIMD缺少临床有效的药物,已明确合并SIMD明显加重脓毒症病人病情,增加其死亡率,血必净注射液在临床上显示出一定改善心功能及血流动力学的作用,并对内皮功能有一定改善[8]。
20世纪90年代以前,细胞机制如冠状动脉的血流量减少、循环因子及微循环的变化,认为是SIMD的主导机制。之后有证据明确评估细胞机制在脓毒症心脏中主要作用。细胞机制包括钙离子和心肌肌丝、β-肾上腺素能受体、一氧化氮和过氧化亚硝基通路、细胞凋亡、基质金属蛋白酶与线粒体功能障碍[9]。较多证据表明,内皮功能障碍在SIMD中起重要作用[10]。微循环在脓毒症时发生重大变化,认为是流量分布改变导致局部缺血,如冠状动脉血流量分布不均可能是由微血管内皮肿胀和非闭塞血管内纤维蛋白沉积造成的。脓毒症引起很多内皮功能异常,并导致器官功能障碍。脓毒症诱导的内皮细胞活化作用是在炎性细胞因子作用时,血管内皮细胞黏附分子表达增加,并导致有害的中性粒细胞向心肌细胞浸润的恶性循环。脓毒症诱导血管内皮细胞的物理破坏,使炎性细胞和液体渗入组织间隙,同时诱导促凝状态,导致组织微血栓形成及缺血。内皮细胞损伤的标志物,如细胞间黏附分子-1(ICAM-1)、E-选择素、vWF和前肽及血栓调节蛋白(TM),在脓毒症时水平升高[11]。
脓毒症诱导的内皮功能障碍反映血管张力,eNOS表达及活性的下降,导致血管舒张障碍。因此血管内皮功能障碍的标志物与脓毒症死亡率和心脏收缩和舒张功能障碍存在相关。以往研究表明血必净能明显缓解血管内皮功能障碍,有研究指出,血必净注射液能明显改善脓毒症病人病情,降低严重脓毒症病人28 d病死率,血必净组血清ICAM-1和细胞黏附分子-1(VCAM-1)水平显著降低,而血清一氧化氮(NO)、抗凝血酶-Ⅲ(AT-Ⅲ)、血栓调节蛋白、组织型纤维酶原激活物(TPA)浓度、vWF和组织纤维溶酶原激活(PAI-1)均显著高于对照组[12]。大鼠腹腔注射脂多糖(LPS)后,血必净能提高主动脉内皮细胞的血管内皮细胞蛋白C受体(EPCR)和蛋白酶激活受体(PAR1)mRNA和蛋白的表达,这可能与保护发生凋亡的内皮细胞相关[13]。本实验结果显示ET-1、vWF水平明显降低,而内皮型一氧化氮合酶在XBJ组高于CLP组。说明血必净能可能通过减轻血管内皮功能障碍缓解CLP大鼠模型的SIMD。
NF-κB是细胞内重要的核转录因子,在多种基因转录过程中参与调控。它一般以二聚体形式存在于细胞质内,其中最重要的是P50/P65二聚体。当细胞受到细胞因子、LPS、NO等多种因素刺激后,由信号诱导激活核因子抑制蛋白(IκB)激酶,引起IκBα迅速磷酸化,使NF-κB通过核孔复合体上的受体快速进入细胞核内,结合于靶基因的启动子上,诱导靶基因mRNA的合成。NF-κB诱导表达的靶基因中多种物质是炎性反应、内皮激活的关键介质,在严重脓毒症/脓毒性休克的发生、发展中作用重要。LPS和细胞因子(如TNF-α)下调eNOS的表达,认为是血管内皮依赖性舒张功能受损的一个重要分子机制。动物实验研究表明,抑制NF-κB活化可抑制多种炎性基因的表达,逆转全身性低血压,纠正心肌功能障碍并防止内皮依赖性血管舒张功能受损[14]。有研究表明,选择性阻断内皮细胞内NF-κB通路导致脓毒症休克和感染性血管功能障碍的分子级联反应[14]。NF-κB活化在脓毒症休克及感染性血管功能障碍中的致病作用重要。基于NF-κB通路在脓毒症中作用机制研究较多,许多涉及失调炎症反应复杂网络的基因,包括促炎和抗炎方面,在转录水平均被NF-κB调节。本研究显示CLP大鼠血清NF-κB水平上升,同时心脏NF-κB表达增加,证明NF-κB在脓毒症时出现激活,且其升高趋势与内皮标志物升高趋势相一致,提示NF-κB可能参与脓毒症内皮功能损伤过程,且实验发现CLP大鼠NF-κB升高时伴随心功能障碍,提示NF-κB信号通路在脓毒症心功能障碍中可能起重要作用,并可能通过内皮损伤起作用。
虽已证明心肌纤维损伤、自主神经功能紊乱及细胞凋亡在SIMD中发挥作用,但潜在机制尚不清楚。这些因素皆与NF-κB关联,在脓毒症相关信号通路中起主要作用。动物实验表明,脓毒症时LPS诱导的TNF-α在心肌细胞中表达,NF-κB被激活,通过去甲肾上腺素激活α1受体抑制LPS诱导的心肌细胞TNF-α表达并改善心功能,此过程通过促进心肌细胞外调节蛋白激酶(ERK)磷酸化和抑制NF-κB的激活[15]。其他研究表明,唐松草坡芬碱通过增加“良性”正磷脂酰肌醇-3-激酶/蛋白激酶B/哺乳动物西罗莫司蛋白(PI3K/Akt/mTOR)及降低“恶性”p38和NF-κB通路避免SIMD,这与降低TNF-α水平和caspase-3依赖的细胞凋亡相关[16]。本实验免疫组化分析显示CLP大鼠心肌NF-κB表达增高,并伴随心脏功能减退及内皮功能受损。LPS小鼠实验表明三七皂苷受体1保护脓毒症休克时的心脏功能。这可能通过激活雌激素受体α(ERα)和PI3K/Akt信号,产生NF-κB阻滞剂并减轻心肌促炎及凋亡应激状态。
血必净注射液是一种植物源性中药,应用于治疗炎症相关疾病,如败血症和重症肺炎[17]。一些研究显示血必清注射液具有稳定血管内皮细胞,改善严重的炎症反应和凝血功能障碍[18]。LPS可刺激大鼠肾脏微血管内皮细胞产生大量活性氧,通过激活NF-κB导致细胞形态损伤并和影响其功能。血必净注射液能减少ROS的表达和NF-κB的激活,从而保护内皮细胞。动物实验发现[19],在血必净对百草枯致急性肺损伤保护作用,抑制p38 MAPK和NF-κB p65的表达至关重要。本研究证明血必净注射液降低CLP大鼠心肌组织和血浆的NF-κB表达,能有效减轻心肌损伤及心脏功能受损。同时,在XBJ组大鼠内皮细胞标志物表达低于CLP组,表明CLP大鼠存在明显的内皮细胞损伤。由于NF-κB在许多免疫相关细胞过程重要作用,血必净注射液的心脏保护作用可能是调整NF-κB的表达。
综上所述,血必净注射液可改善CLP大鼠心脏功能及内皮功能,心脏功能和血管内皮功能之间存在相关性,内皮功能障碍可能是SIMD的重要机制。血必净注射液可减少内皮细胞标记物的浓度,其机制可能通过NF-κB通路干预,降低NF-κB的表达,从而增加eNOS的表达,减轻血管内皮损伤。
[1] Martin GS,Mannino DM, Eaton S,et al.The epidemiology of sepsis in the United States from 1979 through 2000[J].The New England Journal of Medicine,2003,348(16):1546-1554.
[2] Lee WL,Slutsky AS.Sepsis and endothelial permeability[J].The New England Journal of Medicine,2010,363(7):689-691.
[3] Rabuel C,Mebazaa A.Septic shock: a heart story since the 1960s[J].Intensive Care Medicine,2006,32(6):799-807.
[4] Ding J,Song D,Ye X,et al.A pivotal role of endothelial-specific NF-kappa B signaling in the pathogenesis of septic shock and septic vascular dysfunction[J].Journal of Immunology,2009,183(6):4031-4038.
[5] Rittirsch D,Huber-Lang MS,Flierl MA,et al.Immunodesign of experimental sepsis by cecal ligation and puncture[J].Nat Protoc,2009,4(1):31-36.
[6] Parker MM, Shelhamer JH, Bacharach SL,et al.Profound but reversible myocardial depression in patients with septic shock[J].Annals of Internal Medicine,1984,100(4):483-490.
[7] Antonucci E,Fiaccadori E,Donadello K,et al.Myocardial depression in sepsis: from pathogenesis to clinical manifestations and treatment[J].J Crit Care,2014,29:500-511.
[8] 何健卓,谭展鹏,张敏州,等.血必净注射液对严重脓毒症患者血流动力学及内皮功能影响的前瞻性研究[J].中华危重病急救医学,2015,27(2):127-132.
[9] Romero-Bermejo FJ, Ruiz-Bailen M, Gil-Cebrian J,et al.Sepsis-induced cardiomyopathy[J].Current Cardiology Reviews,2011,7(3):163-183.
[10] Chagnon F, Bentourkia M, Lecomte R,et al.Endotoxin-induced heart dysfunction in rats: assessment of myocardial perfusion and permeability and the role of fluid resuscitation[J].Critical Care Medicine,2006,34(1):127-133.
[11] Schuetz P,Jones AE,Aird WC,et al.Endothelial cell activation in emergency department patients with sepsis-related and non-sepsis-related hypotension[J].Shock,2011,36(2):104-108.
[12] 李春盛,金铭,武军元,等.血必净对严重脓毒症患者血管内皮细胞相关促炎因子和凝血因子的影响[J].中华医学杂志,2009,89(39):2744-2747.
[13] 李银平,乔佑杰,武子霞,等.血必净注射液对脓毒症大鼠血栓调节蛋白及内皮蛋白C受体基因表达的影响[J].中华危重病急救医学,2007,19(6):365-368.
[14] Liu SF,Malik AB.NF-kappa B activation as a pathological mechanism of septic shock and inflammation[J].American Journal of Physiology Lung Cellular and Molecular Physiology,2006,290(4):L622-L645.
[15] Yu X,Jia B,Wang F,et al.Alpha(1) adrenoceptor activation by norepinephrine inhibits LPS-induced cardiomyocyte TNF-alpha production via modulating ERK1/2 and NF-kappa B pathway[J].Journal of Cellular and Molecular Medicine,2014,18(2):263-273.
[16] Lee AS, Chen WP, Kuo YL,et al.Thaliporphine preserves cardiac function of endotoxemic rabbits by both directly and indirectly attenuating NF-kappa B signaling pathway[J].PloS One,2012,7(6): e39174.
[17] He XD,Wang Y,Wu Q,et al.Xuebijing protects rats from sepsis challenged with acinetobacter baumannii by promoting annexin A1 expression and inhibiting proinflammatory cytokines secretion[J].Evidence-based Complementary and Alternative Medicine:eCAM,2013,2013:804-940.
[18] 李鑫,马晓春.血必净注射液对肾脏微血管内皮细胞发挥保护作用的机制探讨[J].中国中西医结合急救杂志,2012,19(2):94-97.
[19] Liu MW,Su MX,Zhang W,et al.Protective effect of Xuebijing injection on paraquat-induced pulmonary injury via down-regulating the expression of p38 MAPK in rats[J].BMC,2014,14(1):498.
(本文编辑薛妮)
The Effects of Xuebijing Injection on Cardiac Function and Endothelial Function in Rats with Sepsis
He Jianzhuo,Yin Xin,Ma Shiyu,Guo Liheng,Zhang Minzhou
Comesponding Author:Zhang MinzhouGuangdong Provincial Hospital of Chinese Medicine,Guangzhou 510120,Guangdong,China
Objective To observe the protective effects of Xuebijing injection (XBJ) on the myocardium and serum nuclear factor-κB (NF-κB) expressions, endothelin-1 (ET-1), von Willebrand factor (vWF) and endothelial nitric oxide synthase (eNOS) in rats with sepsis,and to investigate the protection of cardiac dysfunction. Methods Forty-two male Sprage-Dawely (SD) rats were divided randomLy into sham group (n=6),CLP group (n=18) and XBJ group (n=18). The animal models of sepsis were induced by cecal ligation and puncture (CLP) and XBJ was given by intraperitoneal injection. Heart rate, cardiac function such as left ventricular ejection fraction (LVEF), left ventricular end-diastolic diameter (LVESD), left ventricular end diastolic diameter (LVEDD), intact ventricular septum (IVS) activity were observed. The histopathological changes were observed by Hematoxylin-Eosin (HE) staining. The levels of serum ET-1, vWF, eNOS and NF-κB were measured by enzyme-linked immunosorbent assay (ELISA). The expression of NF-κB in cardiac tissue was detected by immunohistochemical staining. Results After 24 hours of modeling, compared with sham group, the heart rate,LVESD and LVEDD increased while IVS activities degree decreased in CLP group (P<0.05).The heart rate increased while LVEF decreased in XBJ group (P<0.05). Compared with 24 hours,the heart rate decreased in 48 hours in CLP group (P<0.05). Compared with CLP group, the heart rate,LVESD decreased while LVEF and IVS activity increased in XBJ group in 24 hours and 48 hours (P<0.05). After 24 hours of modeling, compared with sham group,the levels of serum ET-1 and vWF increased while eNOS level decreased in CLP group(P<0.05).The levels of serum ET-1 and vWF in XBJ group were lower than that in CLP group(P<0.05) while eNOS level in XBJ group was higher than that in CLP group(P<0.05) .After 48 hours of modeling, ET-1 level in XBJ group was lower than that in CLP group(P<0.05) . After 24 hours of modeling, compared with sham group, serum NF-κB level increased in CLP and XBJ group (P<0.05) ,which was lower in XBJ group than that in CLP group(P<0.05) . The rate of NF-κB positive cells in CLP group was higher than that in sham group(P<0.05),whilewas lower in XBJ group than that in CLP group (P<0.05) . Conclusion XBJ could improve cardiac and endothelial function in CLP rats,which might be through the intervention of NF-κB pathway,decreasing the expression of NF-κB,thereby increasing the expression of eNOS,reducing the endothelial damage.
sepsis;Xuebijing injection;rats;myocardium;nuclear factor-κB;endothelium function
2014年广东省中医药管理局建设中医药强省科研课题(No.20141125)
广东省中医院(广州 510120)
张敏州,E-mail:minzhouzhang@aliyun.com
信息:何健卓,尹鑫,马世玉,等.血必净注射液对脓毒症大鼠心功能及内皮功能的影响[J].中西医结合心脑血管病杂志,2017,15(14):1710-1715.
R631 R289.5
A
10.3969/j.issn.1672-1349.2017.14.009
1672-1349(2017)14-1710-06
2017-03-28)

