lncRNA_HOTAIR在宫颈癌组织及HeLa细胞中的表达及其生物学功能研究
叶岭,吴涛
(简阳市人民医院肿瘤科二1、病理科2,四川简阳641400)
lncRNA_HOTAIR在宫颈癌组织及HeLa细胞中的表达及其生物学功能研究
叶岭1,吴涛2
(简阳市人民医院肿瘤科二1、病理科2,四川简阳641400)
目的探讨长链非编码RNA HOTAIR在宫颈癌组织中的表达及其生物学功能。方法选取简阳市人民医院2014年8月至2016年7月收治并手术治疗的宫颈癌患者47例,采用实时荧光定量PCR检测患者癌组织及癌旁正常宫颈组织中HOTAIR RNA的相对表达量;以人宫颈癌Hela细胞为研究材料,应用小RNA干扰技术下调宫颈癌Hela癌细胞HOTAIR RNA表达,分别应用CCK-8实验、Wound Healing实验检测小干扰RNA下调HOTAIR表达前后Hela细胞增殖和迁移能力变化情况。结果HOTAIR在宫颈癌患者癌组织与癌旁正常宫颈组织中的相对表达量分别为(6.89±2.12)与(4.02±1.89),癌组织显著高于癌旁组织,差异有统计学意义(P<0.05);与对照组细胞相比,外源性小干扰RNA可显著敲低Hela细胞中HOTAIR的表达并影响其增殖和迁移(P<0.05)。结论宫颈癌患者癌组织中HOTAIR表达水平高于癌旁正常宫颈上皮;HOTAIR可能参与了宫颈癌细胞增殖和迁移等生物学功能。
宫颈癌;长链非编码RAN;增殖;迁移;干扰RNA
宫颈癌是妇科常见的实体恶性肿瘤之一,其好发年龄为35~55岁[1]。流行病学研究证实,宫颈癌的发生与高危型乳头瘤病毒(HPV)感染存在明显的相关性[2]。其他危险因素还包括多性伴侣、初次性生活较为年轻及早育等。早期非浸润性宫颈癌预后较好,远期生存率较高,但晚期患者发生淋巴转移者预后不良。目前,关于宫颈癌的发生发展、侵袭转移的确切机制并未完全阐明。随着分子生物学研究的不断深入,越来越多的研究发现表观遗传调控在宫颈癌的发生发展方面发挥重要作用。已有研究显示,HOTAIR在多种实体肿瘤包括乳腺癌、肺癌及肠癌中呈现异常高表达,并与患者预后存在相关性[3-4]。然而,HOTAIR与人宫颈癌细胞生物学行为关系的研究鲜有报道。
1 资料与方法
1.1 一般资料收集2014年8月至2016年6月简阳市人民医院47例手术切除宫颈癌标本(癌组织及癌旁组织)。纳入标准:(1)病理学明确诊断为宫颈癌;(2)患者术前未接受过新辅助放化疗;(3)年龄大于18周岁;(4)组织学标本获取经家属签字,并经简阳市人民医院伦理委员会讨论通过。排除标准:(1)宫颈癌诊断不明确者;(2)术前接受新辅助放化疗者;(3)合并其他恶性肿瘤者;(4)HIV阳性患者。术中切除患者宫颈癌组织标本即可放入预先准备好的液氮中迅速冷冻,防治RNA降解,然后置入-80°C冰箱保存待检。
1.2 主要试剂Trizol试剂,购自Life Technologies公司;DMEM细胞培养基,购自Gibco公司;10%胎牛血清,购自Gibco公司;RNA提取试剂盒,购自Ta-KaRa公司;荧光定量PCR试剂盒,购自TaKaRa公司,CCK-8试剂盒,购自上海碧云天生物技术公司;转染试剂Lipofectamine2000,购自Life Technologies公司。Transwell试剂盒,购自美国BD公司。针对HOTAIR的小干扰RNAshRNA_HOTAIR由吉玛公司合成。
1.3 细胞培养及转染人宫颈癌Hela细胞,购自中科院上海细胞库,在5%CO2的水套式培养箱中进行培养。Hela细胞密度在80%~90%时,用0.05%的胰酶进行消化传代,应用吉玛公司合成的shRNA_HOTAIR及对照shRNA_control进行转染,转染过程根据转染试剂操作说明进行。
1.4 qPCR检测HOTAIR表达提取癌组织、癌旁组织及宫颈癌Hela细胞中的总RNA,采用反转录试剂盒将RNA反转录成cDNA,应用实时荧光定量PCR仪进行HOTAIR表达水平检测。对所得待测基因的Ct值进行校正,分别用待测基因HOTAIR的Ct值减去内参基因GAPDH的Ct值,代表待测基因的相对拷贝数,ΔΔCt=Ct待测基因-CtGAPDH;算出每组ΔΔCt的平均值。
1.5 CCK-8实验将转染shRNA_HOTAIR及shRNA_Control的Hela细胞按5 000个/孔接种于96孔板,每组设置6个复孔,于接种后24 h、48 h、72 h和96 h,按照CCK-8试剂盒说明,检测细胞增殖。于450 nm波长处测定每组细胞的吸光度值。取6孔平均值为结果(A值),以时间为横轴,A值为纵轴绘制细胞增殖曲线。
1.6 Transwell实验应用无血清培养基重悬5× 104左右Hela细胞置入Transwell上室内,下室加入600 μL的含10%胎牛血清的培养基。37℃培养箱培养48 h后,100倍镜下观察穿过Transwell小室的细胞数目,随机取3个视野,计算平均细胞数。
1.7 统计学方法应用STATA12.0统计软件分析相关数据,RNA表达水平等计量资料符合正态分布,以均数±标准差(x-±s)表示,组间比较采用两样本均数t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 HOTAIR在宫颈癌组织中表达HOTAIR在宫颈癌患者癌组织和癌旁正常宫颈组织中的相对表达量分别为(6.89±2.12)和(4.02±1.89),癌组织显著高于癌旁组织,差异具有统计学意义(t=2.66,P<0.05),见图1。
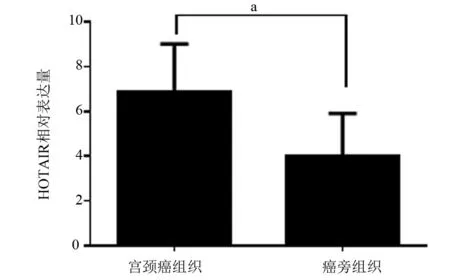
图1 癌组织与癌旁组织中HOTAIR相对表达量比较
2.2 HOTAIR与宫颈癌细胞增殖侵袭能力与对照组细胞比较,小干扰RNA可显著下调HOTAIR在Hela细胞中的表达水平,差异有统计学意义(P<0.05),见图2A;下调后宫颈癌Hela细胞中HOTAIR表达后,细胞增殖能力明显降低,见图2B;细胞迁移能力也下降,差异有统计学意义(P<0.05),见图2C。

图2 下调宫颈癌Hela癌细胞HOTAIR后细胞增殖及迁移能力
3 讨论
长链非编码RNA是一类长度大于200 nt的RNA分子,由于此类RNA分子不具备开放阅读框,从而不能作为模板被进一步翻译成蛋白质而行使生物学功能[5]。因此,在相当长的一段时间内,生物学界普遍认为此类RNA分子不具备任何生物学功能,只是DNA在转录过程中产生的“噪音”或“垃圾”。但近年来随着生物学技术及研究的不断深入和发展,越来越多的证据表明此类RNA分子不但不是“噪音”反而在细胞的分裂增殖、凋亡、转录激活及染色质修饰等多方面发挥着重要作用。HOTAIR为HOX基因转录反义RNA,是近年来发现的非编码RNA分子,其全长为2.2 kb,其转录本位于人12号染色体长臂13带13区[6]。HOTAIR可作为骨架分子起到脚手架作用,导致不同靶基因特异性组蛋白修饰改变,从而导致如干基因沉默、促进乳腺癌转移[7]。同时,在多种实体肿瘤中发现HOTAIR存在癌与正常组织的差异表达且这种差异与患者预后存在一定的关系。崔玲等[8]采用实时荧光定量PCR方法检测了44例卵巢癌组织及14例癌旁组织中HOTAIR的表达情况,结果发现其表达与肿瘤类型、分化程度存在相关性。Nakagawa等[9]探讨了HOTAIR在肺癌转移中的作用,证实HOTAIR在晚期肺癌及肺癌转移患者中呈高表达。
关于HOTAIR在人宫颈癌中的表达情况及与宫颈癌Hela细胞增殖、侵袭能力关系的研究报道较少。郑婷华等[10]探讨了HOTAIR与人宫颈癌Hela细胞凋亡的关系,研究结果认为下调Hela细胞中HOTAIR的表达,将导致Hela细胞凋亡比例增加细胞停滞于G0/G1期。而该研究未对HOTAIR与宫颈癌细胞侵袭能力进行研究。本研究中,HOTAIR在宫颈癌患者癌组织与癌旁组织中的相对表达量为(6.89±2.12)与(4.02±1.89),癌组织显著高于癌旁组织,这与张艳梅等[11]的研究结果一致。癌组织与正常宫颈组织的差异表达提示HOTAIR在宫颈癌的发生发展中可能发挥着重要作用。shRNA下调HOTAIR,可影响Hela细胞增殖及迁移能力,说明HOTAIR在宫颈癌细胞的转移过程中发挥重要的表观遗传调控作用,但其作用机制是否与在乳腺癌细胞中相同,有待进一步研究证实。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.
[2]乌恩奇,赵焕虎,刘微,等.中国不同地区宫颈癌中HPV型别分布数据横向比较分析[J].中华肿瘤防治杂志,2013,20(23):1845-1851.
[3]王昌亮,王礼泉,林明臻,等.长链非编码RNA-HOTAIR与乳腺癌腋窝淋巴结转移相关性研究[J].中国医学创新,2015,12(2):38-41.
[4]薛世民,贾娟,沈华.非小细胞肺癌组织中lncRNA HOTAIR的表达及临床意义[J].临床肿瘤学杂志,2016,21(9):780-784.
[5]Zhang H,Chen Z,Wang X,et al.Long non-coding RNA:a new player in cancer[J].J Hematol Oncol,2013,6(3):37-44.
[6]Yu X,Li Z.Long non-coding RNA HOTAIR:a novel oncogene(Review)[J].Mol Med Rep,2015,12(8):5611-5618.
[7]Woo CJ,Kingston RE.HOTAIR lifts noncoding RNAs to new levels [J].Cell,129(7):1257-1257.
[8]崔玲,谢晓砚,王和,等.长链非编码RNA HOTAIR mRNA在卵巢癌中的表达[J].四川大学学报(医学版),2013,15(1):57-59.
[9]Nakagawa T,Endo H,Yokoyama M,et al.Large noncoding RNA HOTAIR enhances aggressive biological behavior and is associated with short disease-free survival in human non-small cell lung cancer [J].Biochem Biophys Res Commun,2013,436(2):319-324.
[10]郑婷华,王茜,杨小杰,等.长链非编码RNA HOTAIR在宫颈癌患者组织及HeLa细胞中的表达和影响[J].基础医学与临床,2016,36 (1):94-98.
[11]张艳梅,陈晓忠.长链非编码RNA HOTAIR在宫颈癌中的表达及其对宫颈癌HeLa细胞增殖和凋亡的影响[J].肿瘤,2015,17(4):446-452.
Long non-coding RNA HOTAIR expression in cervical cancer tissue and HeLa cells and its biology function.
YE Ling1,WU Tao2.Second Department of Oncology1,Department of Pathology2,People's Hospital of Jianyang City,Jianyang 641400,Sichuan,CHINA
ObjectiveTo discuss the long non-coding RNA HOTAIR expression in cervical cancer tissue,corresponding normal tissue and its biology function.MethodsForty-seven cervical cancer patients who
operation for cervical cancer were included in this study from Aug.2014 to Jul.2016.HOTAIR relative expression was tested by real-time PCR in the cancer tissue and corresponding normal tissue.HOTAIR was knock down in HeLa cells by small interfering RNA(shRNA).CCK-8 assay was used to detect the cell proliferation ability,and the wound healing assay was used to detect the migration ability after inhibiting HOTAIR expression in HeLa cells.ResultsThe relative HOTAIR expression in cervical cancer and normal tissue were(6.89±2.12)and(4.02±1.89),with statistically significant difference(P<0.05).shRNA_HOTAIR could successfully decrease HOTAIR expression in HeLa cells,and the proliferation and migration ability were inhibited by knocking down HOTAIR in HeLa cells compared to shRNA_control cell(P<0.05).ConclusionHOTAIR is highly expressed in cervical cancer tissue and plays important roles in the proliferation and migration of HeLa cell.
Cervical cancer;Long non-coding RNA;Proliferation;Migration;Small interfering RNA
R737.33
A
1003—6350(2017)14—2285—03
10.3969/j.issn.1003-6350.2017.14.015
2017-02-13)
叶岭。E-mail:yeling_jy@yeah.net

