发酵豆渣中低聚糖对益生菌增殖的研究
傅宇翔,范亚苇,*,陶 林,邓泽元,穆松牛,曾云霞(.南昌大学食品科学与技术国家重点实验室,江西南昌 330047; .南昌大学医学院实验动物科学中心,江西南昌 330006)
发酵豆渣中低聚糖对益生菌增殖的研究
傅宇翔1,范亚苇1,*,陶 林1,邓泽元1,穆松牛2,曾云霞1
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047; 2.南昌大学医学院实验动物科学中心,江西南昌 330006)
目的:研究粗壮脉纹孢菌发酵豆渣中低聚糖对植物乳杆菌NCU116和青春双歧杆菌CICC 6178增殖的影响。方法:将植物乳杆菌NCU116和青春双歧杆菌CICC 6178分别培养48 h,测定生长曲线、最大比生长速率、延迟期、发酵液pH曲线和基质消耗率。结果:2 g/L发酵豆渣低聚糖组的植物乳杆菌NCU116发酵液最大吸光度、pH减小值、基质消耗率(p<0.05)均小于2 g/L菊糖组(阳性对照组),2 g/L发酵豆渣低聚糖组的青春双歧杆菌CICC 6178最大吸光度、pH减小值、基质消耗率(p<0.05)均大于2 g/L菊糖组,所有发酵豆渣低聚糖组对两种益生菌的最大比生长速率均大于2 g/L菊糖组,2、6 g/L发酵豆渣低聚糖组的植物乳杆菌NCU116延迟期小于2 g/L菊糖组,各发酵豆渣低聚糖组的青春双歧杆菌CICC 6178延迟期大于2 g/L菊糖组。结论:粗壮脉纹孢菌发酵豆渣中低聚糖对植物乳杆菌NCU116的增殖作用不如菊糖,对青春双歧杆菌CICC 6178的增殖作用优于菊糖。
粗壮脉纹孢菌,发酵豆渣,低聚糖,植物乳杆菌,青春双歧杆菌
粗壮脉纹孢菌是一种有较强发酵能力且能产生纤维素酶的真菌,刘沛毅[1]优化粗壮脉纹孢菌固态发酵豆渣中纤维素酶的提取条件,得到最高总酶活为1.702×10-2IU/mL。粗壮脉纹孢菌发酵豆渣后产生低聚糖,叶俊[2]通过优化低聚糖提取工艺,得到发酵豆渣中低聚糖的最大得率为11.91%。低聚糖具有多种生理功能,其中,促进益生菌增殖和改善肠道菌群是重要的生理功能之一。张立峰等[3]用不同浓度的低聚糖给小鼠灌胃,发现中、高剂量组能显著增加小鼠肠道中乳酸杆菌的数量,且低、中、高三个剂量组能显著增加小鼠肠道中乳酸杆菌的数量;通过人体实验表明,大豆低聚糖能显著提高人体肠道中双歧杆菌和乳酸杆菌的数量。张延坤[4]研究表明,健康成人每日摄入10 g大豆低聚糖,可显著提高肠道内双歧杆菌的数量。文献表明,目前国内外没有关于粗壮脉纹孢菌发酵豆渣低聚糖的研究,只有本课题组发表的相关论文[2],本论文是该研究的延续。本研究通过植物乳杆菌NCU116和青春双歧杆菌CICC 6178两种益生菌的增殖效果,来评估粗壮脉纹孢菌发酵豆渣中低聚糖对益生菌的影响,为粗壮脉纹孢菌发酵豆渣中低聚糖的应用提供参考。
1 材料与方法
1.1 材料与仪器
植物乳杆菌NCU116 由南昌大学食品科学与技术国家重点实验室筛选并保藏;青春双歧杆菌CICC 6178 购于中国工业微生物菌种保藏管理中心;发酵豆渣低聚糖(含量为72.25%±2.07%) 从粗壮脉纹孢菌发酵豆渣中提取的混合物,低聚糖通过HPLC测定[2];实验所用试剂 均为分析纯;梭菌增菌培养基 广东环凯微生物科技有限公司;MRS培养基、BSM培养基 参照文献[5-6]进行配制。
DGG-9140A型电热恒温鼓风干燥箱 上海森信实验仪器有限公司;温控摇床 上海博迅实业有限公司医疗设备厂;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;HD-650桌上型超净工作台 苏州安泰空气技术有限公司;恒温水浴锅 巩义市英峪予华仪器厂;YQX-II厌氧培养箱 上海龙跃仪器设备有限公司;TDL-5-A飞鸽牌台式离心机 上海安亭科学仪器厂;精密pH计 上海仪电科学仪器股份有限公司;722E型可见分光光度计 上海光谱仪器有限公司;电子天平 奥豪斯仪器有限公司。
1.2 实验方法
1.2.1 发酵豆渣低聚糖的提取工艺流程 发酵豆渣→45 ℃烘干→粉碎机粉碎→90 ℃热水浸提→4200 r/min离心10 min→上清液→60 ℃浓缩→4倍乙醇醇沉过夜→4200 r/min离心10 min→上清液→60 ℃浓缩→冷冻干燥→粗发酵豆渣低聚糖。
粗发酵豆渣低聚糖用Sevag法脱蛋白和AB-8大孔树脂脱色[2]后,得到精制发酵豆渣低聚糖。
1.2.2 培养基的配制 参照文献[5-6]配制MRS培养基、BSM培养基。
1.2.3 菌种活化 将含20%(v/v)甘油的植物乳杆菌NCU116和青春双歧杆菌CICC 6178以1%的接种量分别接种于MRS液体培养基和BSM液体培养基中,pH调至7.2和6.25[7],分别置于振荡速度为120 r/min的恒温摇床和厌氧培养箱中(90% N2,5% CO2,5% H2),37 ℃培养过夜。
1.2.4 分组 共分为5组,分别为2、6、10 g/L发酵豆渣低聚糖组,2 g/L菊糖组(阳性对照组)以及空白对照组(CK),各添加量按发酵豆渣中低聚糖含量(72.25%)换算得出。
1.2.5 植物乳杆菌NCU116和青春双歧杆菌CICC 6178生长曲线的测定 将植物乳杆菌NCU116和青春双歧杆菌CICC 6178分别以3%[8]和10%[9]的接种量接种于不含碳源(未加入葡萄糖和牛肉膏)的MRS液体培养基和BSM液体培养基中,两种培养基中都以2、6、10 g/L的发酵豆渣低聚糖或2 g/L菊糖作为唯一碳源。空白对照组未添加任何碳源。将加入不同碳源的MRS液体培养基和BSM液体培养基的pH分别调至7.2和6.25,每管装液量为6 mL,分别置于振荡速度为120 r/min的恒温摇床和厌氧培养箱中,37 ℃培养48 h。0~48 h中,每2 h取发酵液,以各处理组未接种的培养基为空白,在600 nm下测定吸光度,绘制生长曲线。每个样品平行测定三次。
1.2.6 植物乳杆菌NCU116和青春双歧杆菌CICC 6178最大比生长速率和延迟期的测定 最大比生长速率(μmax)为每小时单位质量的菌体所增加的最大菌体量,延迟期(lag)为体外发酵生长的延迟时间。最大比生长速率和延迟期均由Microsoft Excel add-in DMfit v.2.1软件拟合的S形曲线模型中计算得到[10]。
1.2.7 植物乳杆菌NCU116和青春双歧杆菌CICC 6178发酵液pH曲线的测定 0~48 h内,每4 h取发酵液,用pH计测定pH,绘制pH变化曲线。每个样品平行测定三次。
1.2.8 植物乳杆菌NCU116和青春双歧杆菌CICC 6178发酵液中基质消耗率的测定 分别在6、12、24、48 h取发酵液,参照苯酚-硫酸比色法和间羟基联苯比色法[11-12]测定中性糖和糖醛酸,二者之和即为发酵液中糖的总质量。
其中:M0为0 h时发酵液中糖的总质量,Mt为培养t h时发酵液中糖的总质量。
1.3 统计学处理
实验中每个处理重复三次。应用SPSS 19.0软件进行显著性分析,Origin 8.0作图。
2 结果与分析
2.1 植物乳杆菌NCU116和青春双歧杆菌CICC 6178生长曲线
由图1可以看出,各组在0~4 h内处于延迟期,植物乳杆菌NCU116生长缓慢,各处理组在4~12 h内进入对数期,增殖迅速,之后进入稳定期,生长逐渐减缓,吸光度趋于稳定,后期吸光度略有下降,空白组在整个培养过程中吸光度变化很小。不同添加量的发酵豆渣低聚糖组对植物乳杆菌NCU116均有一定的增殖作用,在各时间段的吸光度都高于空白对照组,且发酵豆渣低聚糖组在相同时间的吸光度均随着添加量的增加而增加,10 g/L发酵豆渣低聚糖的吸光度最高,在20 h时达到最大值1.334。6、10 g/L发酵豆渣低聚糖组的最大吸光度大于2 g/L菊糖组,说明同等添加量的菊糖比发酵豆渣低聚糖对植物乳杆菌NCU116的增殖作用更强。
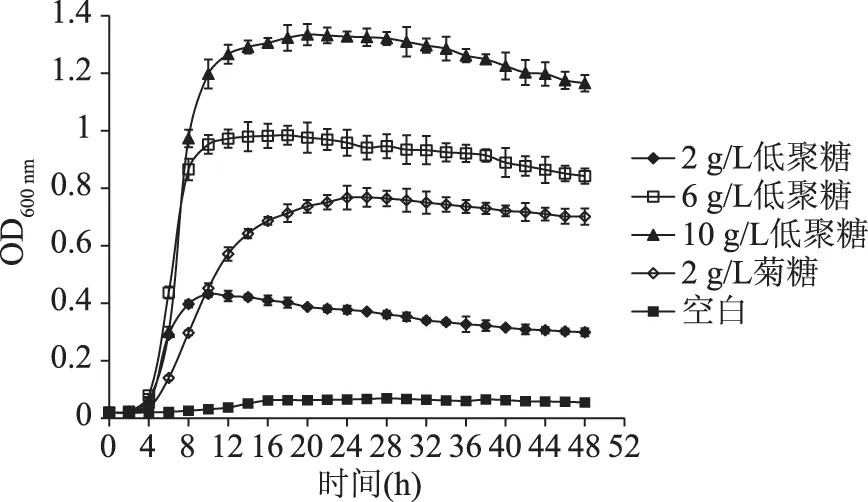
图1 植物乳杆菌NCU116生长曲线Fig.1 The growth curve of Lactobacillus plantarum NCU116
由图2可知,各组在0~6 h青春双歧杆菌CICC 6178生长迟缓,吸光度变化很小,之后生长速率逐渐加快,发酵豆渣低聚糖组生长曲线较为陡峭,各组在36 h内吸光度均达到最大值。不同添加量的发酵豆渣低聚糖均能一定程度上促进青春双歧杆菌CICC 6178的增殖,在所有时间段的吸光度都高于空白对照组。但2 g/L菊糖对青春双歧杆菌CICC 6178几乎没有促进生长的作用,与白文[13]研究结果相似。发酵豆渣低聚糖的吸光度均随着添加量增加而增高。10 g/L发酵豆渣低聚糖在所有组别中有最大吸光度,为0.478。添加量同为2 g/L时,发酵豆渣低聚糖和菊糖的最大吸光度分别为0.192、0.099,故相同添加量下,发酵豆渣低聚糖对促进青春双歧杆菌CICC 6178生长的作用优于菊糖。相较于植物乳杆菌NCU116,各处理组中青春双歧杆菌CICC 6178发酵液的吸光度明显减小,其原因可能是植物乳杆菌NCU116是兼性厌氧菌,而青春双歧杆菌CICC 6178是厌氧菌,生长条件更为苛刻,其主要生长于试管底部,中上层很少生长,故发酵液浓度较低,吸光度较小。
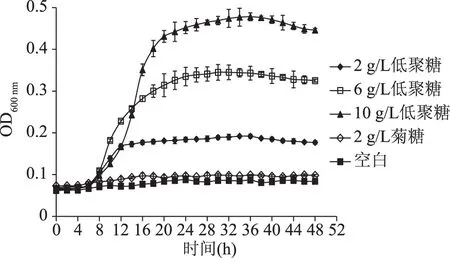
图2 青春双歧杆菌CICC 6178生长曲线Fig.2 The growth curve of Bifidobacterium adolescentis CICC 6178
2.2 植物乳杆菌NCU116和青春双歧杆菌CICC 6178最大比生长速率和延迟期的测定
由表1可知,不同添加量的发酵豆渣低聚糖的植物乳杆菌NCU116最大比生长速率均比空白对照组大,发酵豆渣低聚糖组的最大比生长速率随添加量的增加而增大。添加量为2 g/L时,发酵豆渣低聚糖的最大比生长速率比菊糖大,说明植物乳杆菌NCU116对发酵豆渣低聚糖的利用速率大于菊糖,可能和发酵豆渣低聚糖的聚合度比菊糖小有关。
不同添加量的发酵豆渣低聚糖组的植物乳杆菌NCU116延迟期都比空白对照组短。发酵豆渣低聚糖组的植物乳杆菌NCU116延迟期随添加量的增大呈现先减小后增大的趋势,说明10 g/L发酵豆渣低聚糖可能会短暂抑制植物乳杆菌NCU116的生长。2、6 g/L发酵豆渣低聚糖的延迟期小于菊糖,而10 g/L发酵豆渣低聚糖的延迟期大于菊糖。

表1 植物乳杆菌NCU116的最大比生长速率和延迟期Table 1 Maximum growth rates(μmax,h-1) and lag parameters(lag,h)of Lactobacillus plantarum NCU116
由表2可见,不同添加量的发酵豆渣低聚糖组的青春双歧杆菌CICC 6178最大比生长速率均比菊糖组和空白对照组大。添加量越大,发酵豆渣低聚糖组的最大比生长速率也越大。添加量同为2 g/L时,菊糖的最大比生长速率小于发酵豆渣低聚糖,故青春双歧杆菌CICC 6178对发酵豆渣低聚糖的利用速率大于菊糖。
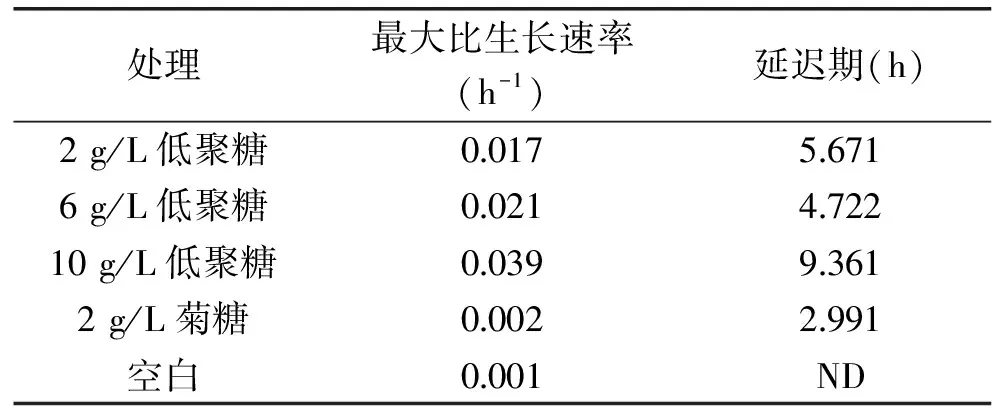
表2 青春双歧杆菌CICC 6178的最大比生长速率和延迟期Table 2 Maximum growth rates(μmax,h-1)and lag parameters(lag,h)of Bifidobacterium adolescentis CICC 6178
注:ND表示未得出结果。
随着添加量的增大,发酵豆渣低聚糖组的青春双歧杆菌CICC 6178延迟期表现出先减小后增大的趋势,说明10 g/L发酵豆渣低聚糖会延长青春双歧杆菌CICC 6178的延迟期。添加量相同时,菊糖的延迟期短于发酵豆渣低聚糖,其原因可能是菊糖组吸光度不大,生长曲线较平缓,软件拟合得出的延迟期较短。
2.3 植物乳杆菌NCU116和青春双歧杆菌CICC 6178发酵液pH曲线的测定
由图3可以看出,2、6、10 g/L发酵豆渣低聚糖组pH下降幅度均比空白对照组大,pH减小值随添加量的增加而加大。各组中10 g/L发酵豆渣低聚糖pH减小值最大,为1.74。6、10 g/L发酵豆渣低聚糖比2 g/L菊糖pH减小值大。2 g/L菊糖组pH减小值大于2 g/L发酵豆渣低聚糖组,故添加量相同时,菊糖对植物乳杆菌NCU116发酵液pH的影响大于发酵豆渣低聚糖。

图3 植物乳杆菌NCU116发酵液pH曲线Fig.3 The pH curve of fermentation broth of Lactobacillus NCU116
由图4可见,2、6、10 g/L发酵豆渣低聚糖组的pH减小值比2 g/L菊糖和空白对照组都更大,且发酵豆渣低聚糖组随添加量越多,pH减小值越大,所有组别中10 g/L发酵豆渣低聚糖pH减小值最大,为0.69。相同添加量时,发酵豆渣低聚糖对青春双歧杆菌CICC 6178发酵液pH影响比菊糖大。
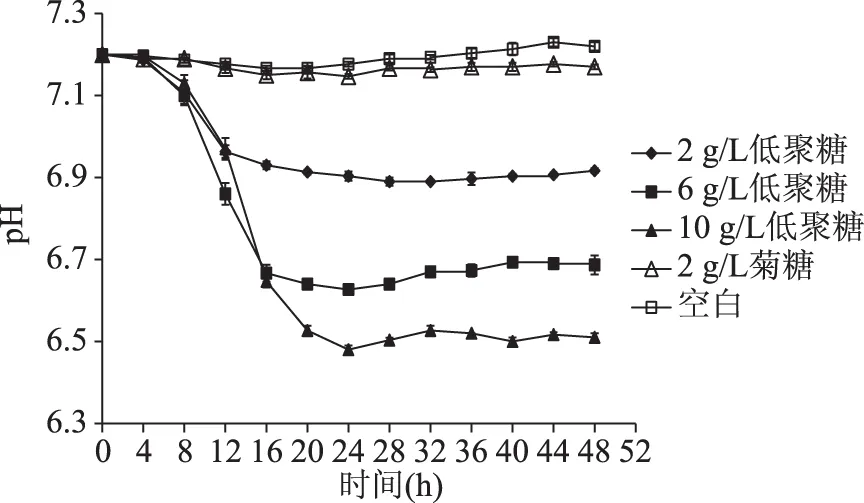
图4 青春双歧杆菌CICC 6178发酵液pH曲线Fig.4 The pH curve of fermentation broth of Bifidobacterium adolescentis CICC 6178
2.4 植物乳杆菌NCU116和青春双歧杆菌CICC 6178发酵液中基质消耗率的测定
由图5可见,2、6、10 g/L发酵豆渣低聚糖在各时段植物乳杆菌NCU116发酵液基质消耗率均随培养时间的延长呈增大趋势。发酵豆渣低聚糖组6 h时基质消耗率随添加量的增加而减小,且有显著差异(p<0.05),而其他时间段2 g/L发酵豆渣低聚糖比6、10 g/L发酵豆渣低聚糖基质消耗率大(p>0.05)。6 h时各添加量发酵豆渣低聚糖基质消耗率均显著大于2 g/L菊糖,而24、48 h时,发酵豆渣低聚糖各组的基质消耗率均小于2 g/L菊糖(p<0.05)。
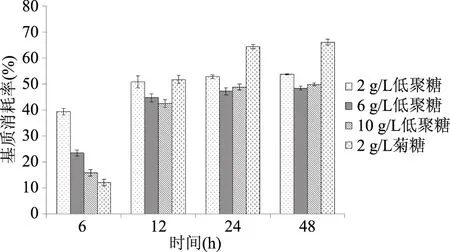
图5 植物乳杆菌NCU116发酵液基质消耗率Fig.5 Rate of substrate consumption in fermentation broth of Lactobacillus NCU116
由图6可以看出,各添加量的发酵豆渣低聚糖组在6、12、24、48 h时,青春双歧杆菌CICC 6178发酵液基质消耗率均随时间的增加而呈现增大趋势。6 h时,2、6 g/L发酵豆渣低聚糖组的基质消耗率无显著差异(p>0.05),但在其他时段,发酵豆渣低聚糖组随添加量的增加,基质消耗率显著减小(p<0.05)。所有时段各添加量发酵豆渣低聚糖组基质消耗率均显著大于(p<0.05)2 g/L菊糖的基质消耗率。

图6 青春双歧杆菌CICC 6178发酵液基质消耗率Fig.6 Rate of substrate consumption in fermentation broth of Bifidobacterium adolescentis CICC 6178
3 结论
本研究通过对植物乳杆菌NCU116和青春双歧杆菌CICC 6178的增殖实验得出,与对照组相比,各添加量发酵豆渣低聚糖组均能不同程度增加植物乳杆菌NCU116和青春双歧杆菌CICC 6178发酵液的吸光度,增大最大比生长速率,缩短延迟期,降低发酵液的pH。相同添加量下,菊糖对植物乳杆菌NCU116的增殖效果优于发酵豆渣低聚糖,而发酵豆渣低聚糖对青春双歧杆菌CICC 6178的增殖效果优于菊糖。
[1]刘沛毅. 不同碳源诱导粗壮脉纹胞菌CGMCC3088产纤维素酶酶学性质的研究[D]. 南昌:南昌大学,2014.
[2]叶俊. 粗壮脉纹孢菌发酵豆渣生产低聚糖的研究[D]. 南昌:南昌大学,2013.
[3]张立峰,刘庆富,宁海凤. 大豆低聚糖对肠道菌群的调节作用[J]. 食品工业科技,2013(4):357-359.
[4]张延坤. 大豆低聚糖的特性及其生理功能[J]. 解放军预防医学杂志,1996(1):75-78.
[5]凌代文.乳酸细菌分类鉴定及实验方法[M]. 北京:中国轻工业出版社,1999.
[6]霍冬雪,张家超,白娜,等. 适用于分离人肠道中双歧杆菌的选择性培养基[J]. 微生物学报,2014,54(4):433-441.
[7]冉域辰. 金银花水提物对双歧杆菌、乳酸杆菌的作用[D]. 重庆:重庆医科大学,2005.
[8]Xiong T,Huang X,Huang J,et al. High-density cultivation ofLactobacillusplantarumNCU116 in an ammonium and glucose fed-batch system[J]. African Journal of Biotechnology,2011,10(38):7518-7525.
[9]Cardelle-Cobas A,Corzo N,Olano A,et al. Galactooligosaccharides derived from lactose and lactulose:Influence of structure on Lactobacillus,Streptococcus,and Bifidobacterium,growth[J]. International Journal of Food Microbiology,2011,149(1):81-87.
[10]Baranyi J,Roberts T A. A dynamic approach to predicting bacterial growth in food[J]. International Journal of Food Microbiology,1994,23(3-4):277-294.
[11]Blumenkrantz N,Asboe-Hansen G. New method for quantitative determination of uronic acids[J]. Analytical Biochemistry,1973,54(2):484-489.
[12]Meseguer I,Aguilar V,González M J,et al. Extraction and Colorimetric Quantification of Uronic Acids of the Pectic Fraction in Fruit and Vegetables[J]. Journal of Food Composition & Analysis,1998,11(4):285-291.
[13]白文. 青春双歧杆菌高密度培养方法及冻干工艺的研究[D]. 长春:吉林农业大学,2006.
Study on proliferation of oligosaccharides in fermented soybean residue
FU Yu-xiang1,FAN Ya-wei1,*,TAO Lin1,DENG Ze-yuan1,MU Song-niu2,ZENG Yun-xia1
(1.State Key Laboratory of Food Science and Technology of Nanchang University,Nanchang 330047,China; 2.The Center of Laboratory Animal Sciences,Medical College of Nanchang University,Nanchang 330006,China)
Objective:To investigate the effects of oligosaccharides on the proliferation ofLactobacillusplantarumNCU116 andBifidobacteriumadolescentisCICC 6178 in soybean residue fermented byNeurosporacrassa. Methods:The growth curve,maximum growth rates,lag parameters,pH value of fermentation broth and substrate consumption rate were determined by incubatingLactobacillusplantarumNCU116 andBifidobacteriumadolescentisCICC 6178 for 48 h.Results:The maximal absorbance,pH reduction value and substrate consumption rate of the fermentation broth ofLactobacillusplantarumNCU116 of 2 g/L fermented soybean residue oligosaccharides group were lower than those of 2 g/L inulin group(positive control group). The maximal absorbance,pH reduction value and substrate consumption rate of the fermentation broth ofBifidobacteriumadolescentisCICC 6178 of 2 g/L fermented soybean residue oligosaccharides group were higher than those of 2 g/L inulin group. The maximum growth rates of all fermented soybean residue oligosaccharides groups to the two probiotics were greater than those of 2 g/L inulin group,the lag parameters ofLactobacillusplantarumNCU116 of 2,6 g/L fermented soybean residue oligosaccharides groups were less than those of 2 g/L inulin group. The lag parameters ofBifidobacteriumadolescentisCICC 6178 of all fermented soybean residue oligosaccharides groups were more than 2 g/L inulin group.Conclusion:The proliferation effect ofLactobacillusplantarumNCU116 of oligosaccharides in soybean residue fermented byNeurosporacrassawas worse than that of inulin,the proliferation effect ofBifidobacteriumadolescentisCICC 6178 of oligosaccharides in soybean residue fermented byNeurosporacrassawas better than that of inulin.
Neurosporacrassa;fermented soybean residue;oligosaccharide;Lactobacillusplantarum;Bifidobacteriumadolescentis
2016-12-12
傅宇翔(1992-),男,硕士研究生,研究方向:营养与食品卫生学,E-mail:marcofu2012@163.com。
*通讯作者:范亚苇(1969-),女,博士,副教授,主要从事食品营养与化学方面的研究,E-mail:fanyw6601@sina.com。
TS201.3
A
1002-0306(2017)14-0137-05
10.13386/j.issn1002-0306.2017.14.027

