中度嗜酸放线菌YY21液体发酵产纤溶酶条件的研究
邓永平,刘晓兰,*,韩 杨,艾瑞波(.齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔 6006; 2.黑龙江省普通高校齐齐哈尔农产品加工重点实验室,黑龙江齐齐哈尔 6006)
中度嗜酸放线菌YY21液体发酵产纤溶酶条件的研究
邓永平1,2,刘晓兰1,2,*,韩 杨1,艾瑞波1
(1.齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔 161006; 2.黑龙江省普通高校齐齐哈尔农产品加工重点实验室,黑龙江齐齐哈尔 161006)
为了提高中度嗜酸放线菌YY21产纤溶酶的产量,本文通过单因素实验对其液体发酵培养基和培养条件进行了研究。结果表明:发酵培养基组成为小米粉1.7%,葡萄糖2%,碳酸钙0.2%,氯化钠0.5%,蛋白胨0.6%;发酵条件为250 mL三角瓶装培养基50 mL,接种量5%,在22 ℃、转速160 r/min的条件下振荡培养4 d。在最适条件下,放线菌YY21液体发酵产物在血纤维蛋白平板上形成溶圈面积可达到164.38 mm2,较初始产酶活力(溶圈面积87.58 mm2)提高了88%,发酵时间缩短了3 d。通过对液体发酵培养基和培养条件的研究有效地提高了中度嗜酸放线菌YY21产纤溶酶的产量。
中度嗜酸放线菌YY21,纤溶酶,液体发酵,发酵条件
血栓栓塞性疾病严重危害人类健康,已知构成血栓的主要成分是纤维蛋白,其由纤维蛋白原通过凝血酶的作用形成,纤维蛋白沉积在血管中形成血栓,导致心肌梗塞和其他心血管疾病[1]。纤溶酶或纤溶酶原激活剂可以直接或间接溶解血纤维蛋白[2]。纤溶酶原激活剂如链激酶、尿激酶、组织纤溶酶原激活剂(t-PA)已被临床用于治疗血栓栓塞性疾病。然而,这些纤溶酶原激活剂类药物还存在诸多弊端,如引起出血并发症、半衰期短、过敏反应等,而且价格较高[3]。因此,需要积极地寻找相对更安全和较低价格的纤溶酶。
纤溶酶存在于多种动物、植物和微生物中[4-6]。微生物种类多样,生长周期短,并且发酵技术相对较成熟,可在较短的时间内获得大量的目的产物[7],因此,微生物发酵法成为开发新型纤溶酶的主要方法。已经从多种微生物代谢产物中分离到了纤溶酶。例如,已见报道的源自细菌的纳豆激酶(NK)[8]、枯草激酶(CK)[9]等,源自中华根霉[10]、镰刀霉[11]、枯青霉[12]、好食脉孢霉[13]等霉菌的纤溶酶,源自金针菇[14]、蛹虫草[15]等大型真菌的纤溶酶,以及源自链霉菌[16]的纤溶酶。
国内外对放线菌产纤溶酶的研究甚少,仅限于链霉菌。Bono等[17]从链霉菌(Streptomycessp.)发酵液中获得了纤溶酶。武临专等[18]对产纤溶酶的链霉菌C3662进行了鉴定。Chitte等[19-20]依次对嗜热链霉菌纤溶酶的发酵和纯化进行了研究,获得了高纯度的纤溶酶。Ju等[21]对链霉菌纤溶酶进行了分离纯化,并对酶学性质进行了表征。放线菌种类繁多,代谢类型多样,对其产纤溶酶的研究还远远不够,特别是对一些有特殊生活习性的放线菌的代谢产物的研究还有很大的空间[22]。
嗜酸放线菌(Acidophilicactinomycetes)广泛分布于酸性环境中,可以产生耐酸的胞外酶,如几丁质酶、蛋白酶、淀粉酶等,在酸性土壤有机物的降解循环中起着重要作用。此外,由于大多数真菌适宜于酸性环境中生存,所以嗜酸放线菌也是极具潜力的抗真菌活性物质的产生者[23]。从嗜酸放线菌的代谢产物中开发新的天然生物活性物质,对新型药物的开发具有重要意义。在前期研究中,笔者发现中度嗜酸放线菌YY21的代谢产物中存在较高活力的纤溶酶[24]。本文对中度嗜酸放线菌YY21液体发酵产纤溶酶的培养基和培养条件进行了研究,以期获得高产纤溶酶的发酵工艺,为该酶的进一步研究奠定基础,为纤溶酶提供新的来源。
1 材料和方法
1.1 材料与仪器
中度嗜酸放线菌菌株YY21(Actinomycetesp.) 保藏于中国普通微生物菌种保藏管理中心,保藏号CGMCC No.5816;牛血纤维蛋白原、牛凝血酶 为中国医学科学院天津血研所产品;其余试剂 均为国产分析纯;GYM固体培养基 葡萄糖0.4%,酵母膏0.4%,麦芽浸膏1%,碳酸钙0.1%~0.2%,琼脂1.8%,pH6.7;GYM液体培养基 葡萄糖0.4%,酵母膏0.4%,麦芽浸膏1%,碳酸钙0.1%~0.2%,pH6.7;小米粉培养基 小米粉2%,葡萄糖2%,碳酸钙0.2%,氯化钠0.5%,蛋白胨0.3%,pH7.2-7.4;高氏合成一号培养基 可溶性淀粉2%,KNO30.1%,MgSO4·7H2O 0.05%,NaCl 0.05%,K2HPO40.05%,Fe2(SO4)30.001%,pH7.4;黄豆粉培养基 蔗糖 2%,黄豆粉 2%,pH7.0;豆饼粉培养基 豆饼粉2%,葡萄糖2%,pH自然;玉米黄粉培养基 玉米黄粉2%,葡萄糖2%,pH自然;豆粕粉培养基 豆粕粉2%,葡萄糖2%,pH自然;PDA液体培养基 称取去皮马铃薯200 g,切成小块,加1000 mL水煮沸30 min,用双层纱布过滤成清液,加水至1000 mL,然后加入20 g葡萄糖完全溶解,pH自然。
PYX-DHS型隔水式电热恒温培养箱 上海跃进医疗器械厂;双层振荡培养箱DZP-2F 金坛市城西峥嵘仪器厂;pHS-25型酸度计 上海精密科学仪器有限公司;himac CF15RX冷冻离心机 天美科学仪器有限公司。
1.2 实验方法
1.2.1 放线菌YY21生长曲线的测定 采用GYM液体培养基作为种子培养基,250 mL三角瓶中加入GYM培养基50 mL,将在GYM斜面培养基活化后的菌株接入种子培养基,28 ℃、180 r/min振荡培养,分别在培养0、6、12、18、24、29、32、34、36、38、40、44、48、52、56、60 h取样,测定生物量。
1.2.2 液体发酵培养基的确定 采用八种液体培养基(具体名称见表1)培养放线菌YY21,250 mL三角瓶中加入液体培养基50 mL,接种量为培养基体积的5%,28 ℃、180 r/min振荡培养,分别于2、3、4、5、6、7 d取样,测培养液pH和纤溶酶的活性。
1.2.3 培养基碳源的确定 以小米粉培养基为初始发酵培养基,分别添加蔗糖、麦芽糖、乳糖、可溶性淀粉和葡萄糖,浓度均为2%,接种量为培养基体积的5%,28 ℃、180 r/min振荡培养4 d,测定培养液中纤溶酶的活性。
1.2.4 底物配比的确定 以小米粉为主要碳源,兼做辅助氮源,以蛋白胨为主要氮源,以2%的葡萄糖为速效碳源,小米粉与蛋白胨占培养基中总含量2.3%不变,研究二者添加比例对产酶活力的影响。
1.2.5 培养条件对菌株YY21产纤溶酶的影响 通过单因素实验对影响菌株YY21液体发酵产纤溶酶的培养条件进行研究,包括接种量(接种量分别为1%、3%、5%、7%、10%和15%,在28 ℃、180 r/min振荡培养4 d)、培养温度(培养温度分别为22、24、26、28、30、32、34、37 ℃,接种量5%,180 r/min振荡培养4 d)和摇床转速(转速分别为140、160、180、200、220 r/min,接种量5%,在28 ℃培养4 d),并且在后续的实验中使用最佳条件。
1.2.6 粗酶液的制备 发酵结束后,将发酵液在4 ℃、10000 r/min离心10 min,收集上清液即为粗酶液。
1.2.7 纤溶酶活力的测定 参照Liu的方法[15],采用血纤维蛋白平板法测定纤溶酶活力。取10 μL粗酶液点加于平板表面,37 ℃保温6 h后测溶圈面积。纤溶酶的活力与其在血纤维蛋白平板上形成的溶圈面积正相关,因此,以水解血纤维蛋白后在平板上形成的溶圈面积大小表示菌株产纤溶酶活力的高低。
1.2.8 生物量的测定 采用称干重法[25]。
1.2.9 数据统计 利用Excel 2003和SPSS 11.5分析软件对数据进行统计分析,并结合Duncan氏法做多重比较,实验均重复三次,结果用平均值±标准差表示(p<0.05)。
2 结果与讨论
2.1 放线菌YY21生长曲线的测定
放线菌YY21生长曲线如图1所示。在0~12 h内,菌体生长处于延迟期。在12 h后,菌体生长逐渐进入快速生长期,在24 h之后菌体干重增加速率加快,培养36 h时,菌体生物量达到最大,菌体浓度为0.029 g/mL。随后,菌体生长逐渐进入衰亡期。

图1 放线菌YY21生长曲线Fig. 1 The growth curve of the strain YY21
处于快速生长期的菌种酶系活跃,代谢旺盛,可以缩短发酵的延迟期,最适宜作为发酵的种子[25]。因此,分别将培养12~36 h的新鲜种子液进行发酵实验,培养基为GYM培养基。由图2可知,接入培养30 h的种子液时发酵产酶活力最高,所以,确定种子培养时间为30 h。

表1 发酵时间对放线菌发酵液pH的影响Table 1 Effect of fermentation time on the pH of the fermentation liquor of the strain YY21
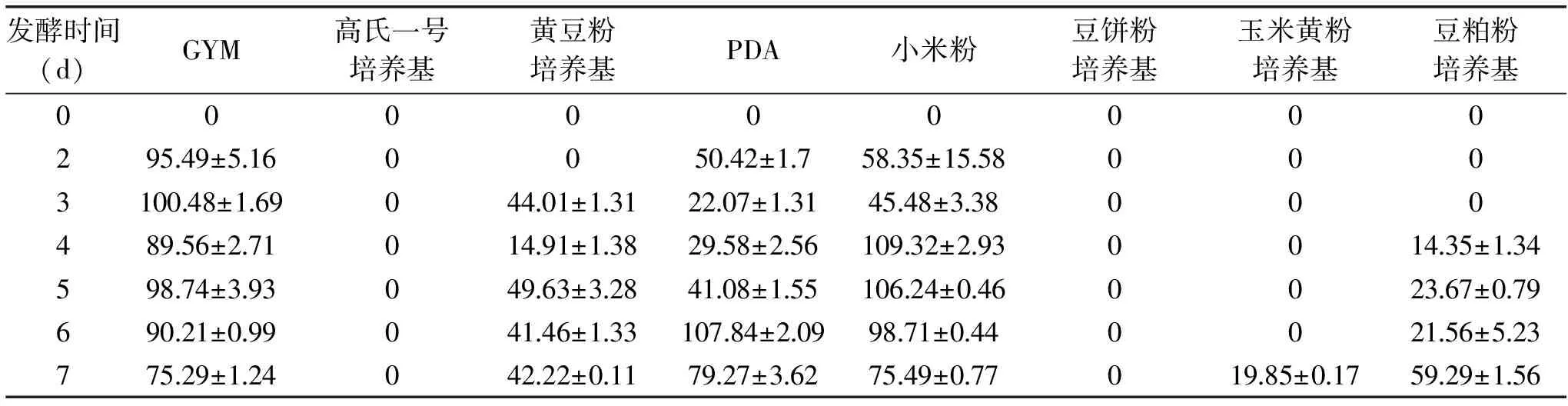
表2 发酵时间对纤溶酶活力影响(mm2)Table 2 Effect of fermentation time on the enzyme production of the fermentation liquor of the strain YY21(mm2)

图2 种龄对纤溶酶产量的影响Fig.2 Effect of the age of inoculum on the fibrinolytic enzyme production
2.2 培养基及发酵时间对产纤溶酶的影响
采用八种液体培养基培养放线菌YY21,发酵液pH随着培养时间的变化见表1,发酵液中纤溶酶活力见表2。
如表1和表2所示,高氏一号培养基为合成培养基,营养成分简单,含有速效碳源和氮源,有利于菌体生长,但是不利于积累代谢产物,而且可能缺乏产酶诱导物,导致其发酵产物中不含纤溶酶;豆饼粉培养基中也没有检测到酶活力;黄豆粉培养基、玉米黄粉培养基和豆粕培养基中富含蛋白质,需要经酶解为小分子物质才可以被菌体利用,导致产纤溶酶周期延长、酶活力低;同时,由表1可知,在培养菌株YY21过程中,高氏一号培养基、豆饼粉培养基、玉米黄粉培养基和豆粕粉培养基随培养时间的延长培养环境逐渐呈酸性,适合菌体生长,但是并不适合产纤溶酶,GYM、PDA和小米粉培养基的pH维持在中偏碱性,酶活力也较高,由此可以推测菌株YY21最适产酶pH可能是中偏碱性。GYM、PDA和小米粉培养基发酵液中纤溶酶活力较高,其中小米粉发酵液中酶活相对最高(109.32 mm2),在培养第2 d时暂时降低可能是培养基pH下降引起的,随后pH逐渐又上升至6.5左右,酶活力也随之升高,培养至第4 d酶活力最高,在血纤维蛋白平板上形成109.32 mm2的溶圈。
小米粉培养基为天然培养基,较GYM培养基营养丰富,小米含碳水化合物约74%~76%,蛋白质9.2%~14.7%,脂肪3.0%~4.6%,并富含维生素B1、B12[26],而且小米来源广泛,价格也较葡萄糖、麦芽浸膏(GYM培养基组分)低,从产酶活力以及经济的角度综合考虑,最终确定最适发酵培养基为小米粉培养基,最佳培养时间为4 d。
2.3 碳源对产纤溶酶的影响
碳源是微生物生长繁殖需求量最大的营养物质,可构成菌体及目的产物的碳骨架、为其生长繁殖提供发酵能。按干重计算,一个典型的细胞中碳元素约占50%,并且在生物大分子中,碳也是最主要的一种元素。碳源对产纤溶酶的影响见图3。

图3 培养基中碳源种类对纤溶酶产量的影响Fig.3 Effect of different carbon sources in culture medium on the fibrinolytic enzyme production
如图3所示,培养基中添加可溶性淀粉时,放线菌YY21产酶效果较差,结果与嗜热链霉菌S.megasporusSD5[19]、白色链霉菌StreptomycesalbusHS1类似[27];葡萄糖为单糖,可以作为速效碳源供菌体生长代谢之用,与迟效碳源小米粉协同使用,获得较好产酶效果,溶圈面积达到130.5 mm2。葡萄糖对链霉菌C-3662发酵产纤溶酶也有促进作用[18],但是,抑制某些真菌产酶[28]。对培养基中添加葡萄糖浓度进行研究。如图4所示,葡萄糖添加量为2%时酶的活力最高。

图4 培养基中葡萄糖浓度对纤溶酶产量的影响Fig.4 Effect of concentration of glucose in culture medium on the fibrinolytic enzyme production
2.4 底物配比的确定
培养基中碳源和氮源的比例(C/N)对微生物生长及产物的合成有很大影响。若培养基中氮源过多,会引起微生物生长过于旺盛,不利于产物的积累;氮源不足则菌体生长过慢。碳源供应不足时容易引起菌体衰老或自溶[25]。本实验对培养基中小米粉与蛋白胨的添加比例进行了研究,实验结果见表3。
如表3所示,与初始配比比较,C组配比最适宜发酵产酶,溶圈面积达到150.17 mm2。H组为没有添加蛋白胨的小米粉培养基,发酵液不产酶,而添加蛋白胨的其它组产酶量显著高于H组(p<0.05),说明蛋白胨或者其酶解产物对产纤溶酶可能有一定的诱导作用。F、G两组为没有添加小米粉的培养基,纤溶酶活力较添加小米粉的组低,说明,添加小米粉有利于YY21菌株产纤溶酶。由表3确定,培养基中小米粉添加量为1.7%,蛋白胨添加量为0.6%。

表3 小米粉/蛋白胨添加比例Table 3 Different ratio of millet to peptone
2.5 培养条件对产纤溶酶活力的影响
2.5.1 接种量对酶活力的影响 采用较大的接种量可缩短菌体生长达到稳定期的时间,使产物的合成提前。但是,接种量过大,可能使菌体生长过快,培养液粘稠度增加,溶氧不足,从而影响产物的合成;此外,接种量过大也会导致成本增加。接种量对产酶的影响见图5。

图5 接种量对产酶活力的影响Fig.5 Effect of inoculum size on the fibrinolytic enzyme production
如图5所示,接种量5%时中度嗜酸放线菌产纤溶酶活力最高,增大接种量不能进一步提高产酶活力,降低接种量纤溶酶的活力有所降低,因此,选择5%的接种量进行后续实验。
2.5.2 培养温度对酶活的影响 当微生物生长繁殖处于最适生长温度时,生长速度最快,代时也最短,但此时的产酶活力并不一定最高。在较高温度下,细胞分裂较快,但是持续时间短,易老化。而在较低温度时,细胞虽然生长缓慢,但是持续时间较长,所以产酶量反而较高。同样,发酵速度和温度之间也有类似关系[29]。因此,研究不同微生物在生长或积累代谢产物阶段时的不同最适温度,对提高发酵生产的效率具有十分重要的意义。温度对产酶的影响见图6。

图6 发酵温度对产酶活力的影响Fig.6 Effect of fermentation temperature on the fibrinolytic enzyme production
如图6所示,温度对菌体产酶活力具有较大影响,在22~28 ℃范围内,产纤溶酶活力较高,并且较稳定,温度达到30 ℃时产酶活力明显下降(p<0.05),且在30~37 ℃之间,产酶活力普遍较低,可见,温度升高抑制菌体产酶。通过对图6中酶活力的比较,确定最适产酶温度为22 ℃。嗜热链霉菌S.megasporusSD5的最适培养温度为55 ℃[19],白色链霉菌S.albusHS1的最适产酶温度为28 ℃[27],与之相比,放线菌YY21纤溶酶的生产能耗更低。
2.5.3 转速对纤溶酶的影响 放线菌属于好氧菌,适当的提高摇床转速有利于菌体生长。转速实验结果见图7。

图7 摇床转速对产酶活力的影响Fig.7 Effect of rotation speed of erlenmeyer flask on the fibrinolytic enzyme production
由图7可见,在其他培养条件不变的情况下,降低摇床转速时,酶活力下降,可能是因为溶氧量降低导致菌体代谢缓慢,产酶能力下降;提高摇床转速时,溶氧量虽然随之提高,但是剪切力继续增加,使成熟菌丝横隔间空泡的增大,导致部分菌丝体片断无法生长,影响了产酶[20]。由此可确定最佳转速为160 r/min。
2.6 放线菌YY21在GYM培养基和小米粉培养基中液体发酵产酶活力的比较
在前期研究中采用GYM培养基培养菌株YY21产纤溶酶,培养条件:GYM培养基,28 ℃,180 r/min,发酵7 d[24]。本文中使用小米粉培养基培养菌株YY21,培养条件:小米粉培养基(小米粉1.7%,葡萄糖2%,碳酸钙0.2%,氯化钠0.5%,蛋白胨0.6%),5%接种量,22 ℃、160 r/min发酵4 d。发酵结束后离心取上清,测定纤溶酶活力。结果表明,菌株YY21在小米粉培养基中产酶的活力明显高于GYM培养基[溶圈面积(87.58±0.72) mm2],溶圈面积达到(164.38±0.19) mm2,即酶活提高了88%,而且产酶周期缩短为4 d。
3 结论
本文以中度嗜酸放线菌YY21为菌种,通过单因素实验,对其液体发酵产纤溶酶的培养基组分和培养条件进行了研究。发酵培养基由1.7%小米粉、2%葡萄糖、0.2%碳酸钙、0.5%氯化钠和0.6%蛋白胨组成,液体种子种龄30 h,接种量5%,在22 ℃、160 r/min培养4 d,纤溶酶粗酶液在血纤维蛋白平板上形成溶圈面积可达到164.38 mm2,比前期使用GYM培养基产酶活力提高了88%,而且产酶周期缩短了3 d。
中度嗜酸放线菌YY21在pH4~5的环境中依然可以产纤溶酶,具有开发为口服的耐胃酸的纤溶酶制剂的潜力,而且产酶温度较目前已知的一些链霉菌产酶温度低,有利于节约液体发酵能耗,对于进一步研究工艺扩大有重要意义。
[1]Bode C,Runge M S,Smalling R W. The future of thrombolysis in the treatment of acute myocardial infarction[J]. European Heart Journal,1996,17 Suppl E:55-60.
[2]Liu X L,Kopparapu N K,Zheng H C,et al. Purification and characterization of a fibrinolytic enzyme from the food-grade fungus,Neurospora sitophila[J]. Journal of Molecular Catalysis B Enzymatic,2016,134:98-104.
[3]Park I S,Park J U,Min J S,et al. Purification and biochemical characterization of a 17 kDa fibrinolytic enzyme fromSchizophyllumcommune[J]. Journal of Microbiology,2010,48(6):836-841.
[4]汪光远,周艳芬,何叶喧,等. 中药蒲黄纤溶蛋白的分离纯化及部分性质[J]. 河北农业大学学报,2007,30(4):55-58.
[5]Torresurrutia C,Guzmán L,Schmedahirschmann G,et al. Antiplatelet,anticoagulant,and fibrinolytic activityinvitroof extracts from selected fruits and vegetables[J]. Blood Coagulation & Fibrinolysis:An International Journal in Haemostasis and Thrombosis,2011,22(3):197-205.
[6]Choi D B,Cha W S,Park N,et al. Purification and characterization of a novel fibrinolytic enzyme from fruiting bodies of Korean Cordyceps militaris[J]. Bioresource Technology,2011,102(3):3279-3285.
[7]艾瑞波,刘晓兰,邓永平,等. 微生物发酵法生产纤溶酶的研究进展[J]. 食品与机械,2013,29(2):227-230.
[8]Sumi H,Hamada H,Tsushima H,et al. A novel fibrinolytic enzyme(Nattokinase)in the vegetable cheese Natto,a typical and popular soybean food in the Japanese diet[J]. Experientia,1987,43:1110-1111.
[9]Kim W,Choi K,Kim Y,et al.Purification and characterization of a fibrinolytic enzyme produced flomBacillussp. strain CK11-4 scrcened from Chungkook-Jang[J]. Appl Environ Microbiol,1996,62(5):2482-2488.
[10]Liu X L,Du L X,Lu F P,et al. Purification and characterization of a novel fibrinolytic enzyme from Rhizopus chinensis 12#[J]. Applied Microbiology and Biotechnology,2005,67(2):209-214.
[11]Ueda M,Kubo T,Miyatake K,et al. Purification and characterization of fibrinolytic alkaline protease fromFusariumsp. BLB[J]. Applied Microbiology and Biotechnology,2007,74(2):331-338.
[12]闵伟红,李佳,王影,等. 高产纤溶酶霉菌固体发酵工艺条件的优化[J]. 食品科学,2008,29(1):207-211.
[13]Liu X L,Kopparapu N K,Zheng H C,et al. Purification and characterization of a fibrinolytic enzyme from the food-grade fungus,Neurospora sitophila[J]. Journal of Molecular Catalysis B Enzymatic,2016,134:98-104.
[14]Se-Eun Park. Purification and characterization of a fibrinolytic protease from a culture supernatant of Flammulina velutipes mycelia[J]. Biosci Biotechnol Biochem,2007,71(9):2214-2222.
[15]Liu X L,Kopparapu N,Shi X,et al. Purification and Biochemical Characterization of a Novel Fibrinolytic Enzyme from Culture Supernatant of Cordyceps militaris[J]. Journal of Agricultural and Food Chemistry,2015,63(8):2215-2224.
[16]Chitte R R,Deshmukh S V,Kanekar P P. Production,purification,and biochemical characterization of a fibrinolytic enzyme from thermophilicStreptomycessp. MCMB-379[J]. Applied Biochemistry and Biotechnology,2011,165(5):1406-1413.
[17]Bono F,Savi P,Tuong A,et al. Purification and characterization of a novel protease from culture filtrates of aStreptomycessp.[J]. Fems Microbiology Letters,1996,141(2-3):213-220.
[18]武临专,黄英. 一种产生纤溶酶的链霉菌C—3662的鉴定与发酵研究[J]. 微生物学报,2002,42(5):600-606.
[19]Chitte R R,Dey S. Production of a fibrinolytic enzyme by thermophilic Streptomyces species[J]. World Journal of Microbiology and Biotechnology,2002,18(4):289-294.
[20]Chitte R R,Deshmukh S V,Kanekar P P. Production,purification,and biochemical characterization of a fibrinolytic enzyme from thermophilicStreptomycessp. MCMB-379[J]. Applied Biochemistry and Biotechnology,2011,165(5):1406-1413.
[21]Ju X,Cao X,Sun Y,et al. Purification and characterization of a fibrinolytic enzyme fromStreptomycessp. XZNUM 00004[J]. World Journal of Microbiology and Biotechnology,2012,28(7):2479-2486.
[22]杜迎翔,贺丽英,程广艳,等. 链霉菌产生的抗血栓活性物质研究进展[J]. 西北药学杂志,2014(6):658-660.
[23]崔庆锋,王黎明,刘志恒. 酸性土壤中嗜酸稀有放线菌的多样性研究[J]. 微生物学报,2004,44(5):571-575.
[24]邓永平,刘晓兰,韩杨,等. 一株产纤溶酶放线菌YY21的生理生化特征和抑菌活性研究[J]. 食品工业科技,2015,36(4):163-166.
[25]岑沛霖,蔡谨. 工业微生物学[M]. 第二版. 北京:化学工业出版社,2012:139-140.
[26]张超,张晖,李冀新. 小米的营养以及应用研究进展[J]. 中国粮油学报,2007,22(1):51-55.
[27]汤祝华,朱春节,张宇,等. 白色链霉菌(Streptomycesalbus)HS1产豆豉纤溶酶发酵条件优化[J]. 海南师范大学学报:自然科学版,2010,23(3):308-313.

[29]储炬,李友荣. 现代工业发酵调控学[M]. 北京:化学工业出版社,2002:16-17.
Study on liquid fermentation conditions for fibrinolytic enzyme production by middle acidophilicActinomycetesp. YY21
DENG Yong-ping1,2,LIU Xiao-lan1,2,*,HAN Yang1,AI Rui-bo1
(1.College of Food and Biotechnology,Qiqihar University,Qiqihar 161006,China;2.Key Laboratory of Processing Agricultural Products of Heilongjiang Province,Qiqihar University,Qiqihar 161006,China)
In the current study,liquid fermentation medium and culture conditions were studied for fibrinolytic enzyme production from middle acidophilicActinomycetesp. YY21 by single factor experiment. The results showed that the fermentation medium consisted of 1.7% of millet,2% of glucose,0.2% of calcium carbonate,0.5% of sodium chloride and 0.6% of peptone. The optimized fermentation conditions were as follows:50 mL liquid medium in 250 mL flasks,inoculation volume 5%,rotate speed 160 r/min,culture time 4 d and culture temperature 22 ℃. Under the optimized conditions,the degradation zone area ofActinomycetesp. YY21 product by liquid fermentation reached 164.38 mm2in the fibrin plate,increasing by 88% than that of original conditions(87.58 mm2). Meanwhile,the fermentation time was decreased by 3 d. The production of fibrinolytic enzyme from middle acidophilicActinomycetesp. YY21 was enhanced effectively by study of liquid fermentation medium and culture conditions.
middle acidophilicActinomycetesp. YY21;fibrinolytic enzyme;liquid fermentation;fermentation conditions
2017-01-16
邓永平(1978-),女,硕士,副教授,研究方向:微生物学、酶学,E-mail:913913_monkey@163.com。
*通讯作者:刘晓兰(1962-),女,博士,教授,研究方向:发酵工程、应用酶学,E-mail:liuxiaolan001@126.com。
国家自然科学基金项目(31301414)。
TS201.1
A
1002-0306(2017)14-0131-06
10.13386/j.issn1002-0306.2017.14.026

