ChCl-urea-ZnO低共熔溶剂体系的电化学行为
雷震,徐存英,2,华一新,2,李坚,2,卢东辉,况文浩,张臻,高小兵
ChCl-urea-ZnO低共熔溶剂体系的电化学行为
雷震1,徐存英1,2,华一新1,2,李坚1,2,卢东辉1,况文浩1,张臻1,高小兵1
(1昆明理工大学冶金与能源工程学院,云南昆明 650093;2云南省复杂有色金属资源清洁利用国家重点实验室,云南昆明 650093)
研究了ChCl-urea-ZnO低共熔溶剂(DES)体系的电化学行为与ZnO浓度的相互关系。电导率测定结果表明,ChCl-urea-ZnO体系的电导率随ZnO浓度的增加而增大,但当ZnO浓度超过0.24 mol·L-1,体系电导率趋于稳定。随着温度的升高,ChCl-urea-ZnO的电导率增大,电导率与温度的关系符合Kohlraush经验公式。循环伏安测试结果表明,在ChCl-urea-ZnO低共熔体系中,Zn(Ⅱ)还原为金属锌是受扩散控制的准可逆过程,Zn(Ⅱ)的扩散系数约为1.2×10-7cm2·s-1。而且金属锌的析出电位随ZnO浓度的增加而正移,峰值电流明显增大,说明增大ZnO浓度有利于锌的沉积。此外,ZnO浓度对锌沉积层的形貌有明显影响,不同ZnO浓度下得到锌沉积物的形貌各不相同,有短棒状、方形等。
低共熔溶剂;氧化锌;电化学;还原;锌
引 言
锌作为防腐镀层和电池制造的重要有色金属原材料,广泛用于车辆、桥梁、舰船、建筑、能源等行业[1-2]。目前世界上80%以上锌都是采用硫酸锌电解工艺生产。该工艺主要是以硫化锌矿为原料,因为采用传统的浮选技术可以很容易地将硫化矿与脉石分离,实现浮选富集得到硫化锌精矿[3-4]。硫化锌精矿在热空气中焙烧形成氧化锌,然后用稀硫酸浸出,得到硫酸锌溶液;对此溶液进行净化,以除去溶液中的杂质,再从硫酸锌溶液中电解析出锌[5]。但是,硫酸锌电解工艺对杂质非常敏感。因此浸出液需要经过复杂烦琐的除杂工艺才能用于电解生产锌。
低共熔溶剂(deep eutectic solvent,DES)是新发展起来的一种合成简单、价格低廉的新型溶剂,具有蒸气压低、无毒性、可生物降解、溶解性能好、导电性优良、电化学稳定窗口宽等独特的物理化学性质,在电化学等领域中有着很好的应用前景[6-8]。在众多的低共熔溶剂中,氯化胆碱-尿素低共熔溶剂(ChCl-urea DES)由于导电性好、能够很好地溶解金属氧化物等,在金属氧化物提取、分离金属方面引起人们的极大关注[9-17]。Abbott等[18]的研究结果表明,ChCl-urea DES能够选择性溶解金属氧化物,对有价金属氧化物ZnO,Cu2O和PbO2具有良好的溶解性能,而对氧化铝、二氧化硅、氧化镁、氧化钙、氧化铁等常见的脉石成分则基本不溶解。因此,ChCl-urea DES是提取金属锌的理想电解液,避免了传统硫酸电解液需要严格除杂等问题,大大简化了锌的提取工艺。而且在60℃,ZnO在低共溶溶剂中的溶解度高达8.466 g·L-1[19],说明在该溶液中电沉积制备金属锌是可能。Yang等[20]研究了氧化锌在ChCl-urea DES中的溶解性能,并在溶有ZnO的低共溶溶剂中电沉积出金属锌。Xie等[21]在溶有氧化锌和氧化铜的ChCl-urea DES中电沉积出Zn-Cu合金。虽然人们已经可以从溶有氧化锌的ChCl-urea DES中电沉积锌,但是ChCl-urea-ZnO DES的综合电化学性能以及溶解的氧化锌浓度对锌电沉积性能的影响尚不清楚,而这些对于开发ChCl-urea DES电解生产锌的新工艺又至关重要。
因此,本文系统研究ChCl-urea-ZnO DES的电化学行为,分析ZnO浓度对体系电导率、锌离子还原电极过程、锌离子析出电位、沉积锌形貌的影响规律。
1 实 验
1.1 主要化学试剂及仪器
氯化胆碱(AR),国药集团化学试剂有限公司;氧化锌(AR),西陇化工股份有限公司;尿素(AR),天津福晨化学试剂厂;无水乙醇(AR),天津市风船化学试剂科技有限公司;α-氧化铝抛光粉(纯 度>99%),天津艾达恒晟科技发展有限公司;DDS-12DW型电导仪,上海般特仪器有限公司;RET型加热磁力搅拌器,广州仪科实验室技术有限公司;CHI760C型电化学工作站,上海辰华仪器公司;DPS-305DM型直流电源器,深圳市宏盛电子有限公司;DZF-6090型真空干燥箱,上海精宏实验设备有限公司;SK8210HP型超声波清洗器,上海科导超生仪器有限公司。
1.2 离子液体的制备
将氯化胆碱与尿素分别放进真空干燥箱内于80℃干燥12 h,干燥好之后,密封保存备用;将干燥好的氯化胆碱与尿素按1:2的摩尔比均匀混合,放入真空干燥箱内加热至80℃,熔融后直至形成无色透明液体。
将ZnO分别按照不同浓度加入ChCl-urea DES内,油浴加热至所需温度,磁力搅拌至完全溶解,进行电导率测试、电化学与电沉积的研究。在不同温度下,ZnO在ChCl-urea DES中的最大溶解度如表1所示。
1.3 电化学测试与电沉积
为了探索体系中Zn的电沉积过程,需要进行行循环伏安。电化学测试时,参比电极为银丝,对电极为铂电极(1 mm),工作电极为钨电极(2 mm),电极用α-氧化铝抛光粉在麂皮上研磨光亮并用去离子水清洗。电沉积实验中,电极间距为1 cm,阴极采用铜片(2 cm×2 cm),阳极采用石墨(3 cm×3 cm)。电极在进行实验前需要在3号砂纸和5号砂纸上进行磨光,然后将打磨好的电极片用无水乙醇浸泡超声去脂,最后用去离子水冲洗吹干备用。

表1 不同温度下ZnO在ChCl-ureaDES中的溶解度
2 结果与讨论
2.1 ChCl-urea-ZnO DES的电导率研究
在不同温度条件下,测定了ChCl-urea-ZnO DES电导率与组成的关系,其结果如图1所示。从图中可以看出,随着浓度的增加,溶液电导率逐渐增大,当浓度超过0.24 mol·L-1,溶液电导率趋于稳定,这表明ZnO浓度与电导率之间有密切的关系。溶液的电导率可以表示为[22]
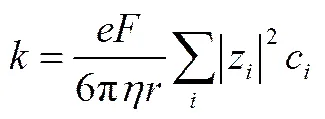
式中,为电导率,S·m-1;为电子电量, 1.6022×10-19C;为Faraday常数;|z|为带电体所带电荷数;c为带电体摩尔浓度,mol·m-3;为溶液黏度,Pa·s;为带电体半径,m;π为圆周率。由式(1)可知,电导率与体系的组成、带电体的数目、半径及介质黏度等均有关系。
由Abbott等[18]的研究可知,在ChCl-urea DES中存在[ChCl2]-和[(Ch)2Cl3]-,说明在未加ZnO时低共熔溶剂中存在由胆碱阳离子(Ch+)和Cl-交替排列形成的低聚体,如式(2)所示。
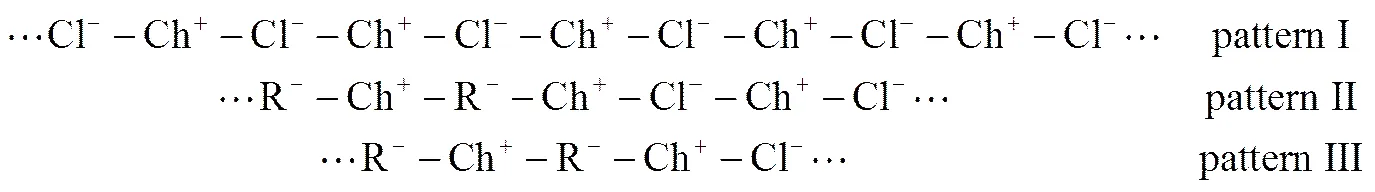
当ZnO加入到ChCl-urea DES中,ZnO便与溶液中存在的urea和Cl-配位生成了配阴离子{[ZnO·CO(NH2)2]·Cl-}-[18]。随着ZnO浓度的增加,{[ZnO·CO(NH2)2]·Cl-}-浓度不断增加,而体系中的Cl-和尿素的浓度却逐渐减小,如图2所示。由于配合物的体积远大于Cl-的体积,生成的低聚合度的多聚物使得溶液的黏度减小,电导率随带电体数目的增加而增大。但是,当ZnO>0.24 mol·L-1时,溶液电导率随ZnO含量的增加而趋于不变,这主要是因为配阴离子较大的离子半径导致体系的淌度减小,黏度增加[23-24]。当溶液淌度和粘度的变化对溶液的影响与带电体数目的变化对溶液的影响差不多时,溶液电导率的变化就很小。

图2 ChCl-urea DES中Ch+、Cl-、尿素和{[ZnO·CO(NH2)2]·Cl-}-的浓度和ZnO浓度的关系
由图1还可以看出,在ZnO浓度一定的条件下,ChCl-urea-ZnO DES的电导率随温度的升高而增大。这是由于低共熔溶剂体系由阴、阳离子组成,依靠离子迁移来导电,随着温度的升高,离子能量的增加,使得离子容易克服相互间的聚合效应和氢键作用,导致体系黏度降低,离子迁移的阻力减小,在电场作用下迁移速度加快,电导率增大[23]。
对图1中的实验数据进行回归分析发现,ChCl-urea-ZnO DES的电导率与温度的关系符合Kohlraush经验式[24]
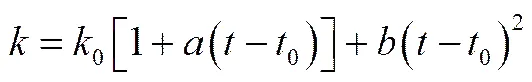
式中,0为当温度时体系的电导率,S·m-1;、为温度系数;为温度,℃;0为最低测试温度(50℃)。在一定的ZnO浓度条件下,ChCl-urea-ZnO DES的电导率与温度的关系如图3所示。由图3可以计算出式(3)中的0、和,其结果列于表2。
为了清楚地观察温度系数随温度的变化,将温度系数对ZnO作图,结果如图4所示。从图4可以看出,在ZnO<0.16 mol·L-1,随着ZnO浓度增大,温度系数明显随之增大;0.16 mol·L-1<ZnO<0.24 mol·L-1,随着ZnO浓度增大,明显随之下降;在ZnO>0.24 mol·L-1,随着ZnO浓度增大,的下降趋势趋于平缓,说明ZnO对的影响越来越小。从图4还可以看出,在ZnO<0.16 mol·L-1,随着ZnO浓度增大,温度系数明显下降;ZnO>0.16 mol·L-1,的下降趋势趋于平缓,说明ZnO对的影响越来越小。
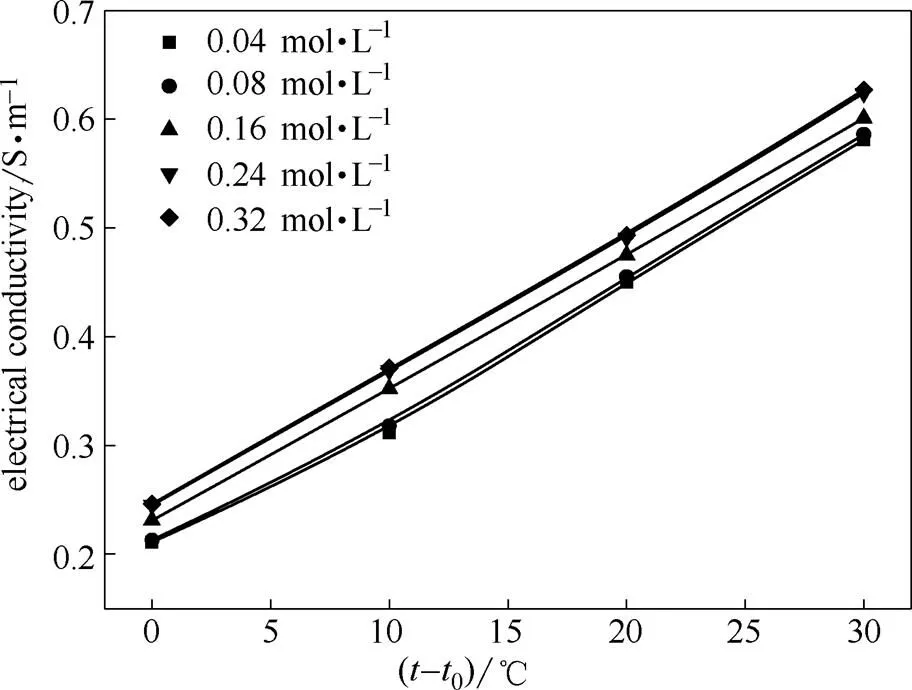
图3 不同CZnO下低共熔体系电导率与温度的关系
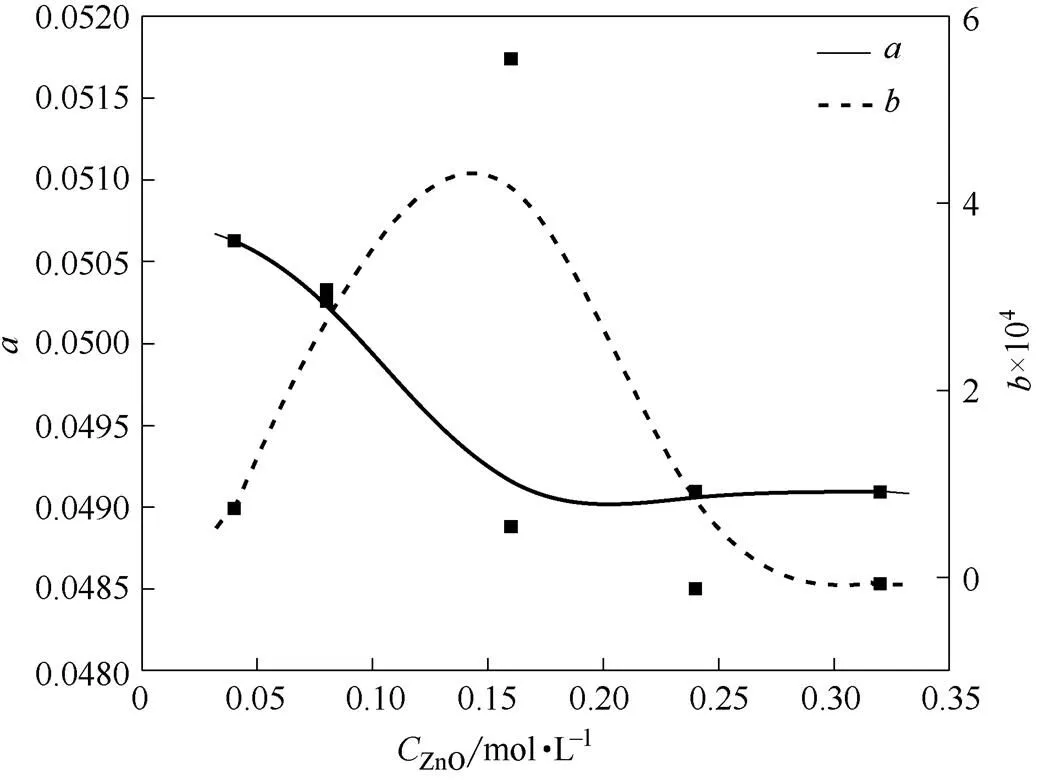
图4 温度系数a和b与CZnO的关系
2.2 ChCl-urea-ZnO DES的循环伏安(CV)研究
图5和图6分别为ChCl-urea DES 和ChCl-urea-ZnO DES的循环伏安曲线。从图5和图6中可以看出,锌的沉积和溶解发生在ChCl-urea DES的电化学窗口。在ChCl-urea-ZnO DES伏安图中出现了一对还原氧化峰,说明锌的还原为一步两电子转移过程。其还原氧化峰分别对应于锌的还原和 溶解。
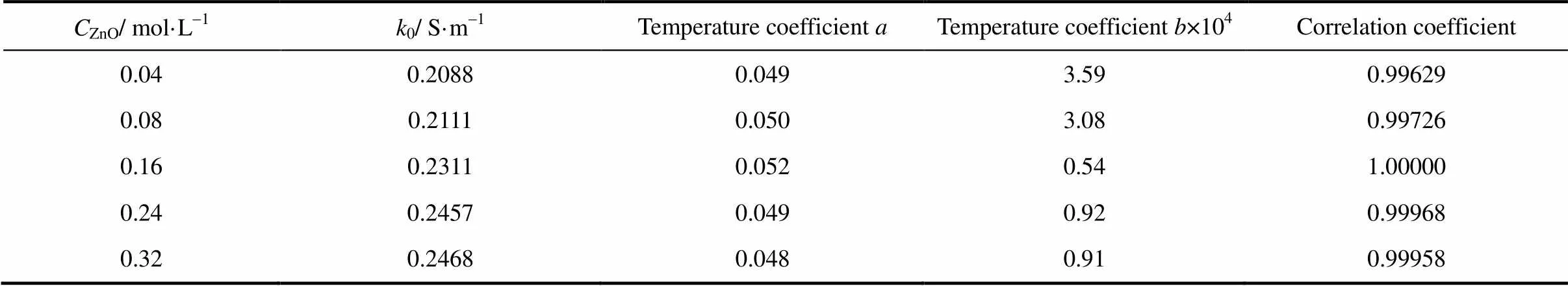
表2 ChCl-urea-ZnODES电导率与温度回归方程[式(3)]的相关系数
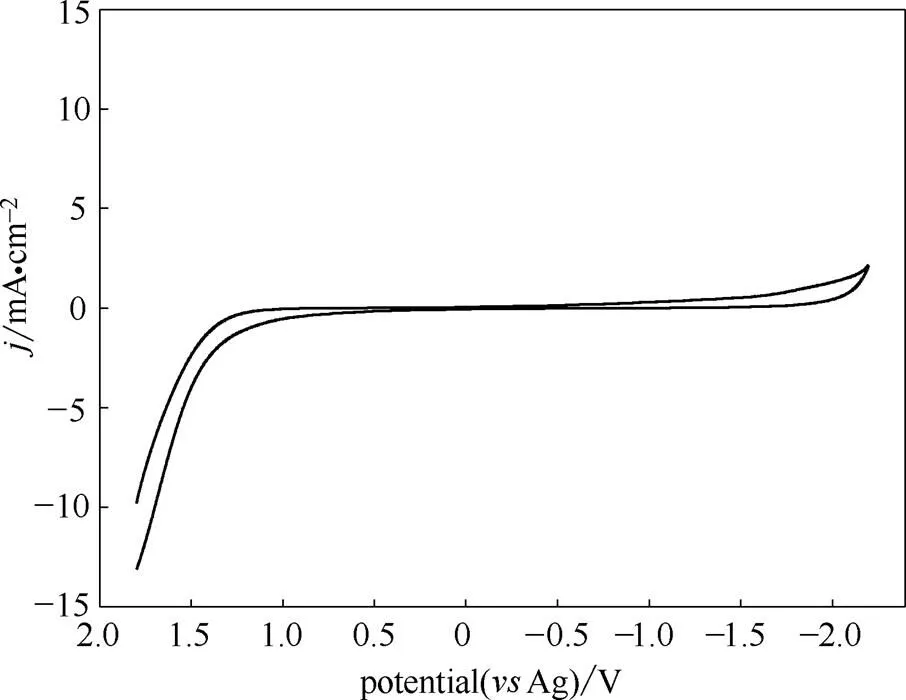
图5 ChCl-urea DES的循环伏安图
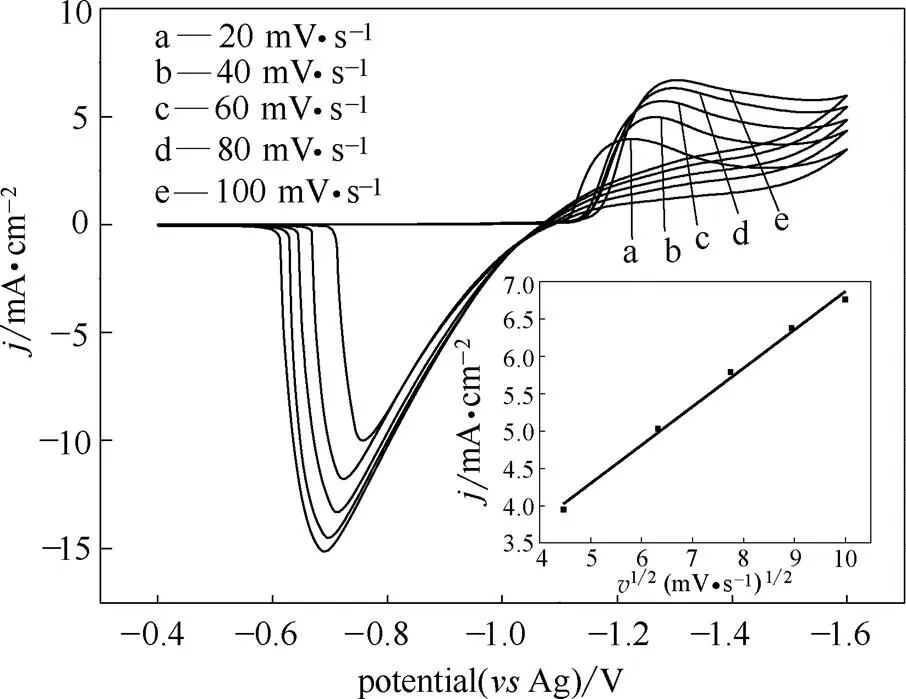
图6 ChCl-urea-ZnO DES在不同扫速下的CV曲线
此外,从图6中还可以观察到,随着扫速的增加,阴极峰值电流pc增加,同时阴极峰值电位pc负移。由于扫速越高,导致扩散通量越大,这使得还原电流不断增加。根据文献[26-27]报道,不可逆过程中阴极峰值电流与扫速的关系适用于准可逆过程中。在此前提下,峰值电流与扫速的关系可用Randles- Sevick方程[28]表示

式中,p为阴极峰值电流;为得失电子数;为Faraday常数;为电极面积;Zn(Ⅱ)为Zn(Ⅱ)浓度;Zn(Ⅱ)为Zn(Ⅱ)扩散系数;为扫速;为转移系数;n为速率限制步骤的电子转移数;为气体常数;为热力学温度。可以通过式(5)求得。
(5)
式中,p/2为半峰电位。
将图6中阴极峰值电流p对扫速的平方根1/2作图,结果如图6插图所示。p与1/2之间良好的线性关系表明Zn(Ⅱ)在ChCl-urea DES中的还原过程受扩散控制。由表3可知,阴极峰值电位与阳极峰值电位差的绝对值|pcpa|为41 mV,大于可逆过程的标准值(33 mV,343 K),且,这说明在ChCl-urea DES中金属锌的还原过程是一个准可逆过程[25]。结合上述分析可知金属锌的还原过程是受扩散控制的准可逆过程。分析还发现,根据式(4)可知插图中拟合得到的直线应当过原点,但本研究中的情况并非如此,这主要与体系中存在的未补偿电阻有关。

表3 ChCl-urea-ZnODES中ZnO浓度对钨电极上Zn(Ⅱ)还原时循环伏安曲线的影响
根据图6插图得到的斜率,通过式(4)和式(5)可以算出343 K下Zn(Ⅱ)在溶液中的扩散系数1.2×10-7cm2·s-1。
为了研究在ChCl-urea-ZnO DES中ZnO浓度对锌还原过程的影响,测定了不同ZnO浓度下的循环伏安曲线,如图7所示。循环伏安曲线的电位扫描起始于开路电位-0.5 V,ZnO浓度与阴极峰值电位pc、阴极峰值电流pc的关系如表3所示。可以看出,金属锌的起始析出电位(Zn(Ⅱ)/Zn)和阴极峰值电位(pc)均随ZnO浓度的增加而正移,这主要是因为ZnO浓度增加后使金属锌的还原电位发生了改变。
当Zn(Ⅱ)的扩散为还原反应的速率限制环节时,Zn(Ⅱ)/Zn在ChCl-urea-ZnO DES中的还原电位可以用式(6)表示[27,29]。

图7 不同ZnO浓度的ChCl-urea-ZnO DES的CV曲线
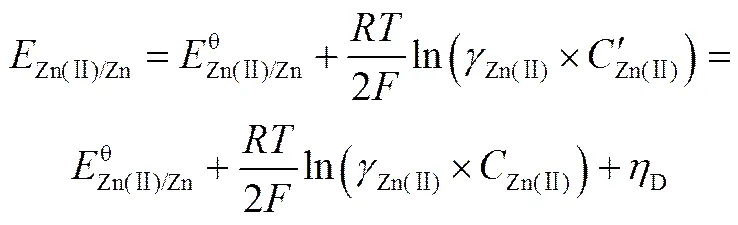
式中,Zn(Ⅱ)为Zn(Ⅱ)的本体浓度,mol·L-1;为Zn(Ⅱ)在电极表面的浓度,mol·L-1;Zn(Ⅱ)/Zn为Zn(Ⅱ)的起始还原电位,V;为Zn(Ⅱ)的标准还原电极电位,V;Zn(Ⅱ)为Zn(Ⅱ)的活度系数;D为浓差超电位,V;为Faraday常数;为气体常数;为反应温度,K。在反应的初始阶段,电极表面与本体溶液之间存在的Zn(Ⅱ)浓度差极小,即≈。因此,电极表面附近的电位可以表示为
(7)
式(7)表明当活度系数为常量时,Zn(Ⅱ)的起始还原电位Zn(Ⅱ)/Zn与Zn(Ⅱ)浓度的对数值lnZnO呈线性关系。从图8中可以看出,实验数据与式(7)吻合很好。Zn(Ⅱ)/Zn与lnZnO之间良好的线性关系表明,增加ChCl-urea DES中的ZnO含量能够使Zn(Ⅱ)的析出电位Zn(Ⅱ)/Zn正移,有利于金属锌的电沉积。此外,随着ZnO浓度的升高,阴极峰值电流不断增加,并且呈良好的线性关系(图7插图),这与文献[30]中报道的现象一致。研究还发现,随ZnO浓度的升高,阳极峰值电位正移,对应的峰值电流增加。综上所述,升高ZnO浓度有利于Zn(Ⅱ)在低共熔溶剂中沉积出来。
2.3 锌的电沉积研究
由上述的循环分析可知,在一定的阴极电位下,溶液中ZnO的浓度越高,则相应的阴极电流密度也将越大。根据文献[22]报道,电流密度对沉积物的形貌特征及颗粒尺寸具有显著影响,因此,以石墨为阳极,铜片为阴极,通过恒电位沉积实验来考察ZnO浓度改变对沉积锌形貌的影响。在槽电压为2.2 V,温度为343 K条件下,所得沉积层均为银灰色物质,并对其进行XRD 测试分析,结果如图9所示。由图9可见,银灰色的沉积物为金属锌。
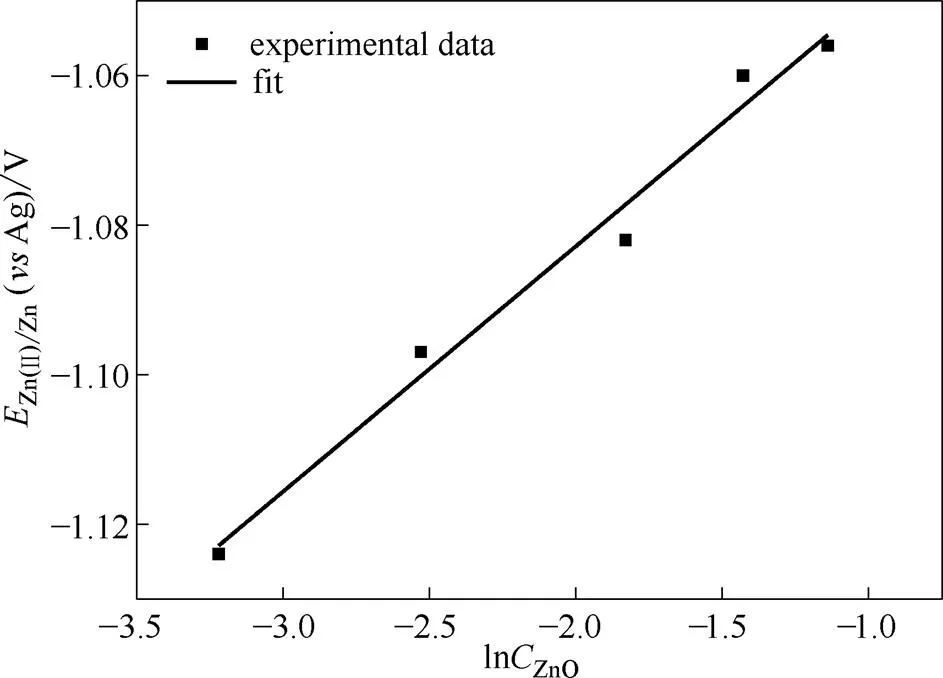
图8 Zn(Ⅱ)的析出电位EZn(Ⅱ)/Zn与ZnO浓度的对数lnCZnO的关系
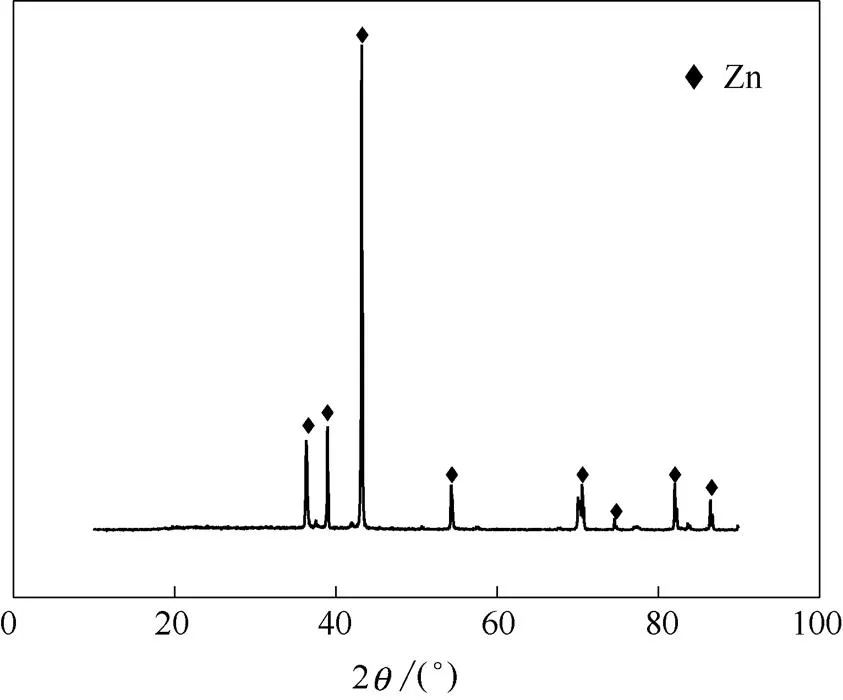
图9 沉积层的XRD图谱
根据文献[20]报道,沉积过程中阴、阳极发生的电极反应为:
阴极

阳极
(9)
图10是槽电压为2.2 V,温度为343 K时不同ZnO浓度下沉积得到的锌沉积层的扫描电镜图。从图中可以看出,不同浓度下沉积的锌沉积物的各不相同。当ZnO浓度为0.04 mol·L-1时,锌沉积层由短棒状颗粒组成,长度约为0.5 μm [图10(a)]。随着ZnO浓度升高0.16 mol·L-1时,锌沉积物的形貌并未有明显变化,短棒状颗粒尺寸变大[图10(b)~(c)]。当ZnO浓度继续增加到0.24 mol·L-1时,沉积物颗粒发生明显变化,颗粒形状由短棒状变成了方形,颗粒相互连接一起[图10(d)]。进一步增加ZnO浓度到0.32 mol·L-1,沉积物发展为更均一的整体,沉积颗粒之间空隙率明显降低[图10(e)]。不同形貌的产生主要与晶体生长速率及的各个结晶取向间的竞争作用有关。根据文献[31]报道,离子浓度、温度、过电位等不仅影响晶体的生长速率,还影响不同晶面的生长速率。

图10 不同ZnO浓度的ChCl-urea-ZnO DES电沉积所得锌沉积层的SEM图像
3 结 论
(1)在测定范围内ChCl-urea-ZnO DES的电导率随ZnO浓度的升高先增大后趋于不变,这主要与ZnO加入ChCl-urea DES后形成的配离子和低聚体有关;此外,电导率随温度升高而增大,其相互关系符合Kohlraush经验式。
(2)循环伏安测试表明,ChCl-urea-ZnO DES中Zn(Ⅱ)能够被还原为金属锌,其还原过反应是一个受扩散控制的准可逆过程。Zn(Ⅱ)在该溶液中的扩散系数约为1.2×10-7cm2·s-1。而且金属锌的析出电位和阴极峰值电位随ZnO浓度的增加而正移,峰值电流明显增大,有利于锌的沉积。
(3)在0.04~0.32 mol·L-1的ZnO浓度范围内,直流电沉积均可得到锌沉积层。锌沉积物的形貌特征与ZnO浓度密切相关。当ZnO浓度为0.32 mol·L-1,沉积层更平整致密。
References
[1] 张启富, 刘邦津, 仲海峰. 热镀锌技术的最新进展 [J]. 钢铁研究学报, 2002, 14 (4): 65-72. ZHANG Q F, LIU B J, ZHONG H F. Development trend of hot-dip galvanizing technology [J]. Journal of Iron and Steel Research, 2002, 14 (4): 65-72.
[2] 王金良. 锌锰电池主要原材料资源分析 [J]. 电池工业, 2006, 11 (4): 258-262. WANG J L. Analysis on the raw material resources of Zn-MnO2batteries [J]. Chinese Battery Industry, 2006, 11 (4): 258-262.
[3] 彭荣秋. 锌冶金 [M]. 长沙: 中南大学出版社, 2005: 103-118. PENG R Q. Zinc Metallurgy [M]. Changsha: Central South University Press, 2005: 103-118.
[4] 石绍渊, 方兆珩. 铁闪锌矿浮选精矿生物浸出 [J]. 化工学报, 2004, 55 (7): 1145-1149. SHI S Y, FANG Z H. Bioleaching of marmatite flotation concentrate [J]. Journal of Chemical Industry and Engineering (China), 2004, 55 (7): 1145-1149.
[5] 徐采栋. 锌冶金物理化学 [M]. 北京: 科学技术出版社, 1979: 236. XU C D. Physical Chemistry of Zinc Metallurgy [M]. Beijing: Technology and Science Press, 1979: 236.
[6] 李汝雄, 王建基. 绿色溶剂—离子液体的制备与应用 [J]. 化工进展, 2002, 21 (1): 43-47. LI R X, WANG J J. Research and application on green solvent—the ionic liquid [J]. Chemical Industry and Engineering Progress, 2002, 21 (1): 43-47.
[7] 韩金玉, 黄鑫, 王华, 等. 绿色溶剂离子液体的性质和应用研究进展 [J]. 化学工业与工程,2005,22 (1): 62-66. HAN J Y, HUANG X, WANG H,. Progress in characteristic and application of ionic liquid as green solvent [J]. Chemical Industry and Engineering, 2005, 22 (1): 62-66.
[8] 陈双平, 王寿武, 汪守建, 等. 离子液体的性质和制备方法 [J]. 精细化工中间体, 2004, 34 (5): 10-12. CHEN S P, WANG S W, WANG S J,. The character and the synthetic methods of ionic liquids [J]. Fine Chemical Intermediates, 2004, 34 (5): 10-12.
[9] TIAN G. Application of ionic liquids in extraction and separation of metals [J]. Green Solvents Ⅱ, 2012, 2012: 119-153.
[10] ABBOTT A P, CAPPER G, DAVIES D L,. Processing metal oxides using ionic liquids [J]. Mineral Processing &Extractive Metallurgy IMM Transactions, 2006, 115 (1): 15-18.
[11] ABBOTT A P, CAPPER G, MCKENZIE K J,. Electrodeposition of zinc-tin alloys from deep eutectic solvents based on choline chloride [J]. Journal of Electroanalytical Chemistry, 2007, 599 (2): 288-294.
[12] ABBOTT A P, CAPPER G, DAVIES D L,. Novel solvent properties of choline chloride/urea mixtures [J]. Chemical Communications, 2003, 1: 70-71.
[13] REDDY B R, PRIYA D N, RAO S V,. Solvent extraction and separation of Cd(Ⅱ), Ni(Ⅱ) and Co(Ⅱ) from chloride leach liquors of spent Ni-Cd batteries using commercial organo-phosphorus extractants [J]. Hydrometallurgy, 2005, 77 (3): 253-261.
[14] 张盈盈, 吉晓燕, 陆小华. 氯化胆碱/尿素和氯化胆碱/甘油的性质与应用 [J]. 中国科学:化学, 2014, 44 (6): 927-941. ZHANG Y Y, JI X Y, LU X H. Properties and applications of choline chloride/urea and choline chloride/glycerol [J]. Scientia Sinica Chimica, 2014, 44 (6): 927-941.
[15] ZHANG Q, DE O V K, ROYER S,. Deep eutectic solvents: syntheses, properties and applications [J]. Chemical Society Reviews, 2012, 41 (21): 7108-7146.
[16] CARRIAZO D, SERRANO M C, GUTIÉRREZ M C,. Deep-eutectic solvents playing multiple roles in the synthesis of polymers and related materials [J]. Chemical Society Reviews, 2012, 41 (14): 4996-5014.
[17] ABBOTT A P, BARRON J C, RYDER K S. Electrolytic deposition of Zn coatings from ionic liquids based on choline chloride [J]. Transactions of the Institute of Metal Finishing, 2009, 87 (4): 201-207.
[18] ABBOTT A P, CAPPER G, DAVIES D L. Solubility of metal oxides in deep eutectic solvents based on choline chloride [J]. Journal of Chemical & Engineering Data, 2006, 51 (4): 1280-1282.
[19] ABBOTT A P, CAPPER G, DAVIES D L,. Selective extraction of metals from mixed oxide matrixes using choline-based ionic liquids [J]. Inorganic Chemistry, 2005, 44 (19): 6497-6499.
[20] YANG H, REDDY R G. Electrochemical deposition of zinc from zinc oxide in 2:1 urea/choline chloride ionic liquid [J]. Electrochimica Acta, 2014, 147: 513-519.
[21] XIE X L, ZOU X L, LU X G,. Electrodeposition of Zn and Cu-Zn alloy from ZnO/CuO precursors in deep eutectic solvent [J]. Applied Surface Science, 2016, 385: 481-489.
[22] 高颖, 邬冰. 电化学基础 [M]. 北京: 化学工业出版社, 2004: 11-14. GAO Y, WU B. Foundations of Electrochemistry [M]. Beijing: Chemical Industry Press, 2004: 11-14.
[23] RU J J, HUA Y X, LI J,. Effects of existence form and concentration of PbO on the conductivity of choline chloride–urea deep eutectic solvent [J]. Journal of Molecular Liquids, 2014, 199 (199): 208-214.
[24] 王喜然, 华一新, 赵秋凝, 等. AlCl3-BMIC离子液体率 [J]. 中国有色金属学, 2006, 16 (12): 2138-2141. WANG X R, HUA Y X, ZHAO Q N,. Electrical conductivity of AlCl3-BMIC room temperature ionic liquids [J]. The Chinese Journal of Nonferrous Metals, 2006, 16 (12): 2138-2141.
[25] 贾铮, 戴长松, 陈玲. 电化学测量方法 [M]. 北京: 化学工业出版社, 2007: 137-139. JIA Z, DAI C S, CHEN L. The Methods of Measurement of Electrochemistry [M]. Beijing: Chemical Industry Press, 2007: 137-139.
[26] NAGAISHI R, ARISAKA M, KIMURA T,. Spectroscopic and electrochemical properties of europium (Ⅲ) ion in hydrophobic ionic liquids under controlled condition of water content [J]. Journal of Alloys & Compounds, 2007, 431 (1): 221-225.
[27] KUZNETSOV S A, GAUNE-ESCARD M. Kinetics of electrode processes and thermodynamic properties of europium chlorides dissolved in alkali chloride melts [J]. Journal of Electroanalytical Chemistry, 2006, 595 (1): 11-22.
[28] BARD A J, FAULKNER L R. Electrochemical Methods: Fundamental Sand Applications [M]. 2nd ed. New York: Wiley, 2001: 166.
[29] 华一新. 冶金过程动力学导论 [M]. 北京: 冶金工业出版社, 2004: 202-203. HUA Y X, Metallurgy Process Kinetics [M]. Beijing: Metallurgy Industry Press, 2004: 202-203.
[30] RU J J, HUA Y X, XU C Y,. Morphology-controlled preparation of lead powders by electrodeposition from different PbO-containing choline chloride-urea deep eutectic solvent [J]. Applied Surface Science, 2015, 335: 153-159.
[31] TREJO G, OB R, MV Y,. Nucleation and growth of zinc from chloride concentrated solutions [J]. Journal of the Electrochemical Society, 1998, 145 (12): 4090-4097.
Eelectrochemical behaviors of ZnO in choline chloride-urea deep eutectic solvents
LEI Zhen1, XU Cunying1,2, HUA Yixin1,2, LI Jian1,2, LU Donghui1, KUANG Wenhao1, ZHANG Zhen1, GAO Xiaobing1
(1Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, Yunnan, China;2State Key Laboratory of Complex Nonferrous Metal Resources Cleaning Utilization in Yunnan Province, Kunming 650093, Yunnan, China)
The effect of ZnO concentration on the electrochemical behaviors of ChCl-urea-ZnO deep eutectic solvents (DES) system were examined with electric conductivity tests and cyclic voltammetry. The results of electric conductivity tests indicate that the conductivity of ChCl-urea-ZnO DES increases with an increase in ZnO concentration as ZnO concentration is below 0.24 mol·L-1. When ZnO concentration exceeds 0.24 mol·L-1, the conductivity of ChCl-urea-ZnO DES tends to be roughly constant. The conductivity of ChCl-urea-ZnO DES increases with the increasing of temperature. The relation between conductivity and temperature is consistent with Kohlraush empirical formula. The results of voltammetry tests indicate that the reduction of Zn(Ⅱ) is a quasi-reversible process, which is controlled by diffusion step. The diffusion coefficient of zinc ion is about 1.2×10-7cm2·s-1. Furthermore, with an increase in ZnO concentration, deposition potential of Zn shifts positively and reduction peak current increases gradually, indicating that the higher concentration of ZnO is helpful to the electrodeposition of zinc. In addition, the electrodeposition of Zn-ChCl-urea DES containing different concentration of ZnO was performed at 2.2 V and 343 K. The surface morphology and phase structure of Zn deposits were characterized by X-ray diffraction (XRD) and scanning electron microscopic (SEM), respectively. ZnO concentration is found to play central role on the morphology of deposited Zn. Different shapes of Zn deposits including rod-like and square, can be electrodeposited from ChCl-urea DES by controlling the ZnO concentration.
deep eutectic solvents; zinc oxide; electrochemistry; reduction; znic
10.11949/j.issn.0438-1157.20170084
TQ 153;O 0645
A
0438—1157(2017)08—3301—09
徐存英。第一作者:雷震(1991—),男,硕士研究生。
国家自然科学基金项目(21263007);国家重点基础研究发展计划项目(2014CB643404)。
2017-01-18收到初稿,2017-05-18收到修改稿。
2017-01-18.
Prof. XU Cunying, 878472313@qq.com
supported by the National Natural Science Foundation of China (21263007) and the National Basic Research Program of China (2014CB643404).

