分段补料法生产猪多杀性巴氏杆菌病活疫苗(EO630株)的试验研究
肖华春,王成业,陆有飞, 张晓明,钟志敏,冯育宁,陈丽丽,李媛媚
(1.云南生物制药有限公司,昆明 650503;2.广西农业职业技术学院,南宁 530007;3.广西丽原生物股份有限公司,南宁530001;4.安徽东方帝维生物制品股份有限公司,安徽亳州236800)
分段补料法生产猪多杀性巴氏杆菌病活疫苗(EO630株)的试验研究
肖华春1,王成业1,陆有飞2, 张晓明3,钟志敏3,冯育宁4,陈丽丽4,李媛媚4
(1.云南生物制药有限公司,昆明 650503;2.广西农业职业技术学院,南宁 530007;3.广西丽原生物股份有限公司,南宁530001;4.安徽东方帝维生物制品股份有限公司,安徽亳州236800)
为改进猪多杀性巴氏杆菌病(亦称猪肺疫)活疫苗抗原制备工艺,提高生产效率和产品质量,采用分段补料发酵工艺制备猪多杀性巴氏杆菌病活疫苗(EO630株)抗原,培养12~13 h,EO630株的活菌数达到高峰期,最高活菌数可达1.31×1010CFU/mL。按分段补料法共生产抗原5批,培养12 h后收获抗原,平均活菌数为1.17×1010CFU/mL,进行配苗和冻干疫苗5批,冻干后的平均存活率为69%。安全和效力检验均合格,达到预期效果。与传统方法相比,该方法培养的活菌数有大幅度的增长,优势明显。
猪多杀性巴氏杆菌EO630株;传统发酵工艺;分段补料发酵工艺;活菌数;生长曲线;冻干存活率
猪多杀性巴氏杆菌病(猪肺疫)是由猪多杀性巴氏杆菌引起的一种常见的细菌性传染病。多年来,EO630株被广泛用作猪多杀性巴氏杆菌病活疫苗及其联苗的生产菌株,EO630株是用猪源B型多杀性巴氏杆菌强毒菌株经在含有海鸥牌洗衣粉的培养基中连续传代选育而得[1]。利用多杀性巴氏杆菌EO630株生产的弱毒活疫苗对猪肺疫有较好的预防效果。根据传统的发酵工艺,采用逐步增大通气量培养15 h,测定细菌生长曲线,发现EO630株在培养的第10~11小时时活菌数达到高峰期,活菌数大约在6.8×109CFU/mL。为了提高抗原活菌数,采用分段补料法进行EO630株抗原的生产试验,即在培养的第8小时和第10小时分别添加10%的新鲜培养基,培养15 h后收获,并测定细菌的生长曲线。从该生长曲线中能看出,在培养第12~13小时时,EO630株的活菌数达到高峰期,最高活菌数可达1.31×1010CFU/mL。按分段补料法共生产抗原5批,培养12 h后收获抗原,平均活菌数为1.17×1010CFU/mL,冻干后的平均存活率为69%。按《中华人民共和国兽药典2010版三部(简称《兽药典》)[2]进行安全和效力检验,检验结果均符合《药典》规定,达到预期效果。
1 材 料
1.1 菌种 猪多杀性巴氏杆菌EO630株,来自成都兽医药械厂。
1.2 培养基、试剂 马丁肉汤干粉培养基,青岛海博生物技术公司提供;马丁琼脂干粉培养基,北京中海生物科技有限公司提供。
1.3 仪器设备 200 L生物发酵罐,购自青岛强星设备科技有限公司;pH计,购自德国赛多利斯(Sartorius);移液器,购自德国艾本德(EPPENDORF)。
2 方 法
2.1 马丁肉汤干粉培养基制备 马丁肉汤干粉培养基按说明书的规定加注射用水进行配制,然后按116 ℃,30 min进行消毒灭菌后,冷却备用。
传统工艺发酵培养按12万毫升的培养基总量准备,分段补料法发酵培养按10万毫升的培养基总量准备,另用2万毫升规格的玻璃瓶按1万毫升、1.1万毫升的培养基量准备若干瓶,于培养过程中作补料用。
2.2 细菌种子制备 按《中华人民共和国兽用生物制品规程》二〇〇〇版(简称《规程》)[3]的方法,制备猪多杀性巴氏杆菌EO630株菌种液,经纯粹检验及有关检查合格者,置2~8 ℃,可保存3 d。
2.3 抗原制备
2.3.1 细菌接种 根据《规程》中的方法进行细菌接种,按培养基总量的2%接种细菌种子液。将保存备用的细菌种子液移入操作间,按发酵罐培养基总量加入0.1%裂解血球全血,连接接种各管道。通过空气过滤器洁净空气的压力将菌种压入发酵罐内。
2.3.2 传统工艺发酵培养 细菌发酵罐培养基量为12万毫升,接种细菌种子液2400 mL。接种完毕后,37 ℃静止培养1 h,然后通入洁净空气,以逐渐增大通气量的方法进行培养。通气量根据溶氧量来设置调整,2~3 h小气量通气培养,溶氧量设置在50%,在通气培养至4~6 h,逐步增大气量,溶氧量60%~100%(即培养至第4小时溶氧量设置为60%,培养至第5小时溶氧量调整到80%,通气培养至第6小时开始溶氧量调整到100%)。培养至6 h后,全部按气量通气培养,溶氧量100%设定进行通气培养至第15小时培养结束。从第4小时开始,每小时取样进行活菌计数,测定EO630株的生长曲线。
本次传统工艺发酵培养的试验共进行4次重复,根据各个时段的活菌计数结果取平均数,最终确定该传统工艺发酵培养的生长曲线。
2.3.3 分段补料法发酵培养 细菌发酵罐培养基量为10万毫升,接种细菌种子液2000 mL。接种完毕后,37 ℃静止培养1 h,然后通入洁净空气,以逐渐增大通气量的方法进行培养。通气量根据溶氧量来设置调整,2~3 h小气量通气培养,溶氧量设置在50%,在通气培养第4~6小时时,逐步增大气量,溶氧量设置为60%~100%(即培养第4小时溶氧量设置为60%,培养第5小时溶氧量调整到80%,培养第6小时溶氧量调整到100%)。培养至6 h后,全部按气量通气培养,溶氧量设定为100%来进行通气培养,待培养至第15小时时培养结束。在通气培养第8小时和第10小时,分别添加10%经灭菌的新鲜培养基(即分别添加1万毫升、1.1万毫升经灭菌的新鲜培养基)。从第4小时开始,每小时取样并进行活菌计数,测定EO630株的生长曲线。
本次分段补料法的试验共进行4次重复,根据各个时段的活菌计数结果取平均数,最终确定该分段补料法发酵培养的细菌生长曲线。
2.3.4 分段补料法制备抗原、疫苗 通过用分段补料法和传统工艺分别发酵培养4批进行比较,摸索分段补料的发酵工艺。按2.3.3项的方法测定的生长曲线可以看出,在培养至第12~13小时时,活菌数达到最高峰。
根据摸索的分段补料发酵培养工艺共制备了5批EO630株抗原,选择在培养第12小时时即结束培养时收获抗原,并取样分别进行纯粹检验和活菌计数,按《规程》中规定的方法进行配苗、冻干。
2.3.5 质量检验 对每批疫苗在冻干前后分别随机取样进行活菌计数,统计疫苗的冻干存活率,并按《药典》标准,对疫苗进行安全、效力等质量检验。
3 结果与分析
3.1 活菌计数结果 用传统发酵工艺和分段补料法分别培养EO630株,每个时段的活菌计数见表1。
3.2 生长曲线 两种方法培养EO630株所得生长曲线见图1所示。
3.3 分段补料发酵工艺制备抗原的结果 分段补料发酵工艺制备EO630株抗原见表2,培养至12 h收获平均菌数为117 亿/mL。分段补料发酵工艺制备EO630株疫苗生产情况见表3,5批疫苗冻干后的平均存活率为69%,安全检验、效力检验均合格。
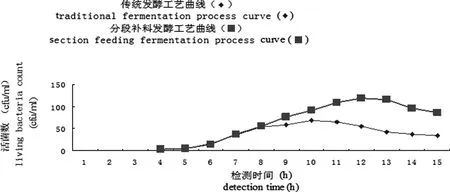
图1 生长曲线Fig 1 Growth curve
4 小结与讨论
4.1 由表1可以看出,根据传统的发酵工艺制备EO630株抗原,在培养6~10 h时活菌数增长很快,培养第10~11小时时活菌数达到最高峰,之后活菌数逐步下降,活菌数平均为6.8×109CFU/mL。根据分段补料工艺制备EO630株抗原,在培养6~12 h时,活菌数都一直保持较快的生长速度,在培养至12~13 h时,菌液的生长达到菌高峰,之后继续培养,活菌数呈现逐步下降的趋势,活菌数平均为1.19×1010CFU/mL,与传统发酵工艺相比,其活菌数有大幅度的增长,增菌效果明显。
4.2 由表2可以看出,采用分段补料工艺制备的5批EO630株抗原,在培养12 h时收获抗原,菌液活菌数稳定在1.08×1010~1.26×1010CFU/mL之间,菌液的平均活菌数为1.17×1010CFU/mL。该活菌数和测定生长曲线时长菌高峰期的菌数基本吻合,表明该工艺还是比较稳定的。
4.3 由表3可看出,采用分段补料法制备5批EO630株抗原用于生产疫苗,冻干后疫苗的细菌存活率稳定在67%~73%之间,冻干后的平均存活率为69%,疫苗的安全检验、效力检验均合格,表明该工艺生产的产品质量是稳定的,可以降低产品生产成本,有生产应用价值。
在效力检验中,由于试验动物个体差异,攻毒菌数会略有差异。在文中的5批疫苗的效力检验中,对照成立,而保护率有3批为10/10,2批为9/10,但都超过标准规定的80%。
4.4 马丁肉汤干粉培养基产品具有性质稳定、易于保存、使用方便等优点,对于保证猪多杀性巴氏杆菌(EO630株)抗原质量稳定有重要作用[4]。由于各个企业的设备条件和培养条件有所不同,本试验所述方法对其他企业不一定适合,仅作参考[5]。
4.5 细菌培养过程的中后期为营养消耗最快的时期,即细菌增值对数期中段添加新鲜培养基,既能补充细菌增值消耗的营养成分,又能稀释有害代谢产物,延长细菌对数生长期,可大幅度提高培养菌数。本试验对补充不同比例的培养基量以及补料时间段未作更多的试验,活菌数是否会随着培养基的补充量增加而提高,有待进一步的研究[6]。
[1] 陶柏辉. 猪肺疫EO630菌株变异情况的观察[J]. 中国兽药杂志, 2000, 34(1):24-25.
Tao B H. The Observation of variation for the EO630 Strain of Swine pneumonia[J]. Chinese Journal of Veterinary Drug, 2000, 34(1): 24-25.
[2] 中华人民共和国农业部. 中国兽药典(三部)2010年版[S].
Ministry of Agriculture of the People's Republic of China. Pharmacopoeia of People's Republic of China 2010 edition three[S].
[3] 中国兽药典委员会. 中华人民共和国兽用生物制品规程2000年版[S].
Commission of Chinese Veterinary Pharmacopoeia. The People's Republic of China veterinary biological products regulation 2000 version [S].
[4] 朱云,杨丽萍,曹阳春. 用不同培养基生产猪多杀性巴氏杆菌活疫苗的试验研究[J]. 畜牧兽医科技信息, 2008, (2):41-42.
Zhu Y, Yang L P, Cao Y C. Experimental Study on the Production of Vaccine againstPasteurellamultocidaby Different Culture Medium[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2008, (2): 41-42.
[5] 董海杰,张金平,孙继强,等. 用马丁干粉培养多杀性巴氏杆菌内蒙系679-230株增菌高峰期试验[J]. 黑龙江畜牧兽医, 2006, (6):88.
Dong H J, Zhang J P, Sun J Q,etal. Cultivation ofPasteurellamultocidain 679-230 Strain by Martingale Powder [J]. Heilong ̄jiang Animal Science and Veterinary Medicine, 2006, (6):88.
[6] 吴国胜,罗镇藩,李炽新,等. 猪A型多杀性巴氏杆菌培养基改良的初步探讨[J]. 广东畜牧兽医科技, 2012, 37(1):26-27.
Wu G S, Luo Z P, Li Z X,etal. Preliminary Study on the Improvement of Culture Medium for A typePasteurellaMultocidaof Swine [J]. Technology of Guangdong Animal and Veterinary Science, 2012, 37(1): 26-27.
(编辑:侯向辉)
Production of SwinePasteurellamultocidaVaccine(Live,Strain EO630) by Section Feeding Method
XIAO Hua-chun1, WANG Cheng-ye1, LU You-fei2, ZHANG Xiao-ming3, ZHONG Zhi-ming3, FENG Yu-ning4, CHEN Li-li4, LI Yuan-mei4
(1.YunnanBiologicalProductsCo.Ltd,Kunming650503,China; 2.GuangxiAgriculturalVocationalCollege,Nanning530007,China; 3.GuangxiLiyuanBiotechCompanyLimited,Nanning530001,China; 4.AnhuiDivinityBiologicalProductsCo.Ltd,Bozhou,Anhui236800,China)
In order to improve the swinePasteurellamultocida(also called pig lung disease) vaccine(live, strain EO630) antigen preparation technology, and improve production efficiency and product quality, production efficiency and product quality,this experiment used segmented fed batch fermentation technology to produce to improve the swinePasteurellamultocidaliving vaccine (strain EO630) antigen, the living bacteria count reaches peak time at the 12~13 hours after incubation, and the highest living bacteria count is 1.31×1010CFU/mL. producing 5 batches of antigen by segmented fed-batch fermentation, obtain antigen after 12 hours incubation. The average living bacteria count is 1.17×1010CFU/ml. Formulate the vaccine and freeze-dry 5 batch of vaccine. The average survival rate is 69% after freeze-dry. Safety test and potency test were qualified to achieve the desired results. All the results are qualified with anticipated effect. Compared with the traditional method, the living bacteria count by this method substantially increased with obvious advantages.
PasteurellamultocidaEO630 strain;traditional fermentation process;sub-fed fermentation process;living bacteria count;growth curve;survival rate after freeze-dry
肖华春,学士,工程师,从事兽用疫苗生产、研制、质量管理工作。E-mail:xhc896@163.com
10.11751/ISSN.1002-1280.2017.7.03
2017-04-01
A
1002-1280 (2017) 07-0010-05
S859.797

