表面等离激元结构光照明显微成像技术研究进展∗
张崇磊 辛自强 闵长俊袁小聪
(深圳大学,纳米光子学研究中心,深圳 518060)
表面等离激元结构光照明显微成像技术研究进展∗
张崇磊 辛自强 闵长俊1)†袁小聪‡
(深圳大学,纳米光子学研究中心,深圳 518060)
(2017年3月29日收到;2017年4月27日收到修改稿)
结构光照明显微成像技术(SIM)因其高分辨、宽场、快速成像的优势,在生物医学成像领域发挥了不可估量的作用.结构光照明显微成像技术与动态可控的亚波长表面等离激元条纹相结合,可以在不借助非线性效应的情况下,将传统SIM的分辨率从2倍于衍射极限频率提升到3—4倍,此外还有抑制背景噪声、提升信噪比的能力,在近表面的生物医学成像应用中有重要价值.本文介绍了表面等离激元结构光照明显微成像技术的原理,并总结了近几年国内外的相关研究进展.
结构光照明,超分辨成像,表面等离激元
1 引 言
光学显微成像技术的应用与发展极大地推动了人们对生命现象的研究与认知.然而,由于光学衍射极限的存在,传统光学显微成像技术的空间分辨率最高只能达到200—300 nm[1-3],无法满足观测生物细胞微结构等重大应用需求,也对能够突破衍射极限的超分辨光学显微成像技术提出了新的挑战.为此,近些年大批新颖的超分辨光学显微成像技术被陆续提出并快速发展,获得了科学界的广泛关注.2014年诺贝尔化学奖就颁给了“超分辨荧光显微成像技术”,以表彰该领域科学家的突出贡献.
提高光学成像分辨率的关键问题是如何获取样品的光学高频信息,但是光学高频信息主要局域在光学近场范围,即样品表面一到几个波长范围内,无法传播到远场自由空间被探测到.为了解决这个问题,人们发展出许多近场光学成像技术来提取光学高频信息.例如:扫描近场光学显微镜(scanning near- field optical microscope,SNOM),该技术通过亚波长探针将只在物体表面传播的倏逝波(evanescent wave)即高频信息转换成可以在远场探测的传播场,由此大幅提高了成像分辨率,分辨率可达20—50 nm[4-6];另外超透镜(superlens)是基于纳米金属薄膜结构的一种新颖成像技术[7],可以通过特殊结构设计将倏逝波传递并放大到远场,使人们可以观测到物体表面的精细信息,从而突破了衍射极限[8-12].
因为近场光学显微成像技术只能获取样品表面局部的近场信息,所以只适合于物体表面信息的探测.相比于近场光学成像方法,远场光学成像方法则更加灵活,能在提高x-y平面横向空间分辨率的同时,也具有z方向的纵向分辨率,从而得到样品的三维光学信息.近些年,不少远场超分辨光学成像方法得到了很大发展[13-23].为了克服光学衍射极限,这些远场成像方法从另一个角度出发考虑:光学衍射极限理论是建立在线性光学的基础上,线性的超分辨技术不可能真正突破它,但可以利用非线性效应来打破光学衍射极限.例如,受激发射损耗(STED)[13]显微镜利用荧光分子的非线性效应,用一束光作为激发光激发荧光,再用另一束长波长同轴的中空环形光束损耗掉部分第一束光激发的荧光,只剩下中间极小的荧光点,从而得到更锐利的点扩散函数.此技术成像分辨率可达30—80 nm范围,并可实现三维光学成像,但也因为其逐点扫描的成像方式,往往需要消耗大量的时间成本.此外,还有随机光学重建技术(STORM)[14]和光激活定位显微技术(PALM)[15]都是单分子定位显微技术,通过荧光分子的非线性效应(例如光活化、光开关等)控制小部分荧光分子进入激发态,然后成像在远场电荷耦合器(CCD)中,最后通过高斯拟合得到这些发光分子的精确位置.这种方法可以让相互影响的衍射光斑在不同时刻分别记录,从而消除衍射影响.在每张原始图片上虽然只有少数荧光斑点,但上千张图片集合起来就组成了所有荧光分子的强度分布图,犹如点彩(pointillism)图画一样.其成像分辨率可达30 nm级别,但是这种方法局限在小范围成像,且需要大量图片集合,成像和处理过程复杂,时间分辨率低.同时STED和PALM/STORM通常所需要的辐射强度在103—108W/cm2,在这种情况下,荧光蛋白/分子很容易被漂白,产生大量的自由基,损伤活细胞样品.
结构光照明显微成像技术(structure illumination microscopy,SIM)是一种远场超分辨光学显微成像技术,其原理是在宽场荧光显微镜的基础上,利用特殊调制的结构光场来照明样品,并运用特定算法从调制图像数据中提取焦平面的信息,从而突破衍射极限的限制,重建出超分辨切层的图像信息.这种超分辨成像技术不需要逐点扫描样品,可大范围成像,具有快速、超分辨、宽场显微成像的显著优点.2000年,美国霍华休斯医学研究院的Gustafsson等[16]首次在实验上证实了SIM的可行性,使用SIM成像方法对Hela细胞的肌动蛋白细胞骨架进行了宽场超分辨成像研究,实现了170 nm左右的成像分辨率.2005年Gustafsson等[17]进一步利用非线性效应的饱和荧光成像技术对荧光颗粒实现了50 nm左右分辨率的超分辨成像.随后Gustafsson等[18,19]又研究了对生物样品的三维成像技术,实现了SIM宽场超分辨成像技术在生物医学中的应用,成像分辨率在100 nm左右. 2008年,Schermelleh等[20]将SIM技术应用到哺乳动物亚细胞核结构的成像中,对多重染色下的染色质、核纤层和核孔进行了高分辨率的精确成像,开启了细胞核物质运输交换研究的大门 (图1(a)).2007年起,Chung等[21],Folka等[22]和Gliko等[23]先后使用全内反射显微镜实现了表面倏逝场的SIM成像,由于表面倏逝场的穿透深度在100 nm左右,这些超分辨成像研究对于了解生物样品膜表面特性具有重要的意义.2011年,Betzig课题组[24]报道了基于贝塞尔光束的结构光照明显微成像,实现了细胞内囊泡、线粒体、有丝分裂的染色体等多种组分的动态3D成像(图1(b)).2015年,Betzig课题组[25]报道了利用一种新型反复光激活荧光蛋白Skylan-NS和结构光激活的非线性SIM技术,获得了细胞运动和改变形状过程中骨架蛋白的解体和自身再组装过程,以及在细胞膜表面的caveolae的微小内吞体动态过程的影像(图1(c)).
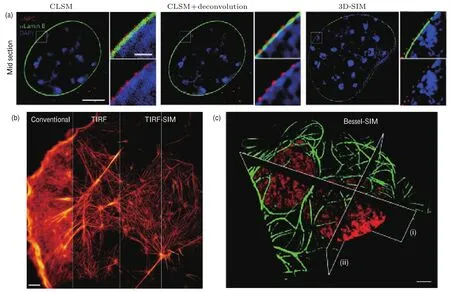
图1 不同SIM显微成像技术效果图[20,24,25]Fig.1.The imaging e ff ect of di ff erent SIM microscopy technologies[20,24,25].
表面等离激元结构光照明显微成像(plasmonic structure illumination microscopy,PSIM)将SIM超分辨显微成像技术与可动态调控的表面等离激元(surface plasmons,SPs)干涉条纹相结合,可以在不借助非线性效应的情况下,将传统SIM的分辨率从2倍于衍射极限频率提升到3—4倍.SPs干涉条纹是由两个相向传播的SPs波干涉产生的稳定驻波场,条纹周期大小依赖于SPs波长.由于SPs波长可远小于自由空间光波长,所以SPs干涉条纹的周期也远小于衍射极限,从而可作为一种突破衍射极限的结构光场应用于SIM成像系统.所以PSIM作为一种新型的超分辨宽场显微成像技术,结合了SIM显微技术和SPs特性的优势,进一步提高了成像分辨率[26-32].2010年,美国加州大学圣地亚哥分校刘照伟教授等[26]首次明确提出类PSIM的概念,通过设计不同SPs激发结构,采用调整激发角的方式得到PSIM成像,其所在课题组随后又开展了基于不同结构的PSIM成像验证实验[27-29].同年,袁小聪教授课题组[30]利用全光紧聚焦激发金属膜SPs,并动态调控入射光学旋涡的拓扑荷实现多步相移,达到了接近理论值的PSIM成像分辨率,其课题组后期又在振幅调控、分数阶拓扑荷等方面进行了改进[31,32].目前PSIM成像技术作为一种仍在发展中的超分辨成像技术,在成像分辨率、削弱背景噪声等方面有明显优势,但其成像范围局限于金属表面,只能实现二维平面成像结果.目前已有利用PSIM成像技术实现超分辨增强拉曼光谱信号的研究报道[33],相信随着PSIM成像技术的不断研究发展,此技术的性能参数会得到进一步提升,并在生物医学领域实现更多重要应用.
2 基本理论
在介绍PSIM技术原理之前,有必要先了解SPs的基本特性、激发方式以及传统SIM的成像原理,以便对PSIM技术进行更深层次的研究.
2.1 表面等离激元的色散关系
表面等离激元是局域于金属表面的一种电磁振荡波,有的文献中也称为表面等离子体[34]. 20世纪初,Wood[35]检测了具有连续光谱的偏振光经过光栅后的变化情况,发现偏振光的频谱在某一区域内出现损失的现象,称为“Wood异常”,这是对于SPs现象的最早记载.1941年,Fano[36]发现“Wood异常”现象是由于一种表面波引起的,并提出了体积等离激元的概念,初步解释了SPs产生的原理.1957年,Ritchie[37]发现当电子穿过金属膜之后存在能量消失峰的现象,他定义这种消失峰为“能量降低的”等离激元模式,并对这种模式与薄膜边界之间的关系进行了分析,首次提出了“金属等离激元”的概念,用于描述金属内部电子密度的纵向波动情况.在1958年,Stem和Farrel[38]研究了此种模式产生的条件并首次提出了“表面等离激元共振(surface plasmon resonance,SPR)”的概念.随后在1960年,Powell和Swan[39]通过实验证实了Ritchie的理论.1998年,Ebbesen等[40]在《Nature》报道了SPs在亚波长金属孔阵列结构中的异常透射增强现象之后,SPs因其具有亚波长尺度光信号传递与增强特性再次引起了广大研究人员的兴趣,有关SPs的新现象、新机理和新应用的研究不断发展.2003年,Barnes等[34]在《Nature》上发表了题为“表面等离激元亚波长光学(surface plasmon subwavelength optics)”的综述文章,标志着SPs光学的兴起并逐渐形成一门独立的学科.近年来随着纳米尺寸加工技术的进步,基于SPs的各种新奇应用不断涌现,如突破衍射极限的成像[26]、亚波长波导[41]、等离激元刻蚀[42]、负折射率材料等[43].

(1)式为从麦克斯韦方程组推导出的金属/介质分界面的表面等离激元色散公式[44].图2所示为光在自由空间(A)、高折射率介质(B),以及表面等离激元(C)的色散关系曲线.由于金属介电常数的实部为负值,根据(1)式SPs的波矢要大于自由空间入射光波矢.从图2中可以看出SPs的色散曲线始终位于自由空间光波矢k0的右边,并随着频率增加ksp与k0距离越来越远,即SPs的波矢越来越大,波长越来越小,因此入射光波无法直接在金属膜表面耦合激发SPs.为了有效激发SPs,必须对激发光的波矢进行补偿,满足激发所需的波矢匹配条件,才能激发SPs.下面简要介绍SPs激发的几种常用方法.
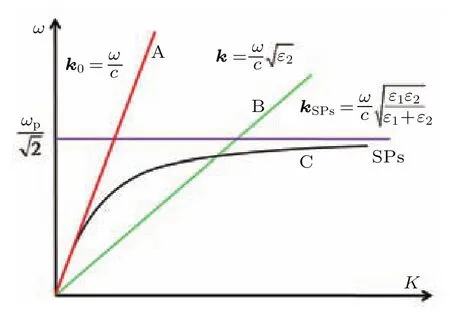
图2 光在自由空间、电介质以及表面等离激元的色散关系曲线Fig.2.The dispersion relation curves of light in free space,dielectric and SPs.
2.2 表面等离激元的激发方法
2.2.1 棱镜耦合法
这种方法是现在应用最多的一种表面等离激元激发方法.1968年,Otto[45]首次基于棱镜的全内反射实现了表面等离激元的光学激发,如图3(a)所示.接着Kretschmann和Raether[46]也报道了一种更加实用的棱镜结构激发表面等离激元,如图3(b)所示.入射光以不小于全反射角的角度入射,利用高折射率棱镜(折射率np>1)进行波矢补偿.通过调节入射角度θsp,改变入射光波矢k0在x轴上的分量kx=k0npsinθ,使kx与SPs波矢ksp相等即可激发SPs,即满足如下波矢匹配方程:
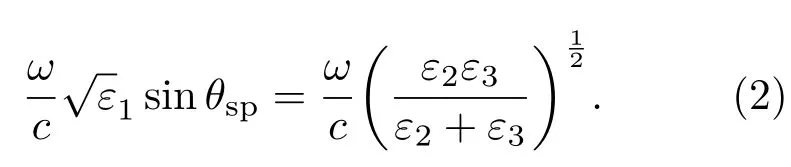
所以当沿金属与空气界面方向的光波矢分量在特定入射角度和波长条件下满足波矢匹配方程(2)时,即可有效地激发SPs.
值得提出的是在金属薄膜的上下两个表面均可激发SPs.对于较厚的金属膜,光子隧道效应很弱,这种情况Otto[45]的结构比较适合.在该结构中,全反射棱镜和金属膜有很小的空气间隙(近场区域),依旧可在金属和空气间隙的界面上激发SPs.当金属膜厚度减少到上下表面电磁模的相互作用(SPR的相互耦合)不能忽略时,SPs的色散关系会发生很大改变,此时表面等离激元共振频率将产生分裂,分别对应对称模式(低频模式)、非对称模式(高频模式).对于较大的SPs波矢,分裂后的频率可用(3)式描述:

其中d是金属膜的厚度.同时,经过研究表明,因为对称模式的波矢虚部随厚度的减少而减少,其传播距离也随之增加,所以它也被称为长程表面等离激元(long range surface plasmons,LRSPs)[47].

图3 利用棱镜耦合法激发SPsFig.3.Using prism coupling method to excite SPs.
2.2.2 近场散射激发方法
波矢匹配条件限制了远场光波对近场SPs的耦合,而近场光波可以不受任何限制地耦合到SPs.采用尺寸远小于波长的探针在近场范围内扫描金属表面,由于探针对光的散射作用,在探针附近存在近场倏逝波,其波矢范围包含了SPs的波矢量,这样其中一部分倏逝波就能够实现波矢匹配从而激发SPs.同理,利用金属表面的亚波长尺寸散射体(如凸起、凹槽等缺陷)也能激发SPs.图4(a)为近场探针激发SPs的结构示意图[48],图4(b)为亚波长尺寸散射体激发SPs的结构示意图[49].近场散射激发方法的优点是结构简单、激发容易,缺点是只有很小一部分散射光能满足SPs波矢匹配条件,所以激发SPs的效率比较低.
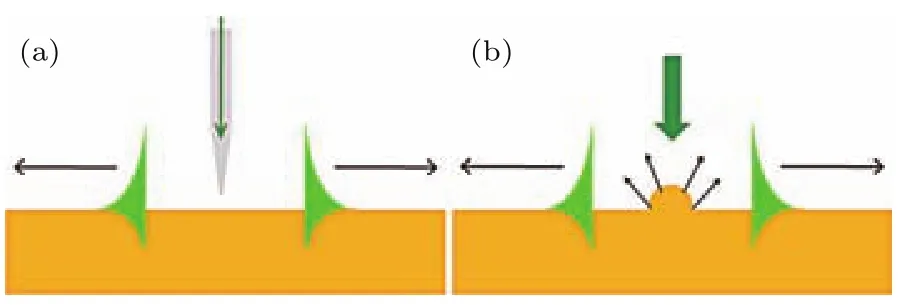
图4 近场激发SPs示意图[48,49]Fig.4.Schematic of exciting SPs by scattering wave[48,49].
2.2.3 光栅激发方法
最早关于SPs的报道就是采用光栅耦合激发的方法实现.光栅耦合是利用光栅对入射光波矢引入一个额外的波矢增量来实现SPs的波矢匹配.常用的光栅有一维光栅,二维光栅以及孔阵列结构和颗粒阵列结构[50].图5显示的是一维光栅结构激发SPs的示意图,其波矢匹配方程为(4)式,其中θ为入射角,G=2π/Λ是光栅常数,Λ是光栅周期长度,m(=1,2,3,…)是光栅的级次.由于光栅的材料、几何结构参数等都可以自由选定,可供研究的内容很丰富.这种方法激发SPs的效率较高,缺点是光栅结构制备成本较高,缺乏动态调控性.


图5 光栅耦合激发SPs示意图Fig.5.Schematic of exciting the SPs by grating coupling.
2.2.4 紧聚焦激发方法
近年来,使用高数值孔径物镜紧聚焦激发SPs的方法备受关注[51],其原理与棱镜耦合法中Kretschmann[46]的结构相似,如图6所示.将高数值孔径的显微物镜通过油浸层靠近一个镀有金属薄膜的介质衬底,入射光波通过该物镜聚焦到介质衬底/金属界面.由于高数值孔径物镜能够提供足够大的入射角范围,涵盖了SPs激发所需要的共振角,从而能在SPs共振角位置满足波矢匹配条件,激发SPs.此方法的优点是激发容易,只要物镜提供的入射角范围包含SPs共振角就自然能激发SPs,缺点是只有SPs共振角附近很小一部分入射光可以激发,绝大部分其他角度的入射光都被金属膜反射了,所以激发SPs的效率比较低.这种激发方法能够与传统光学显微系统相结合,因此被广泛应用于生物显微成像、传感等领域.
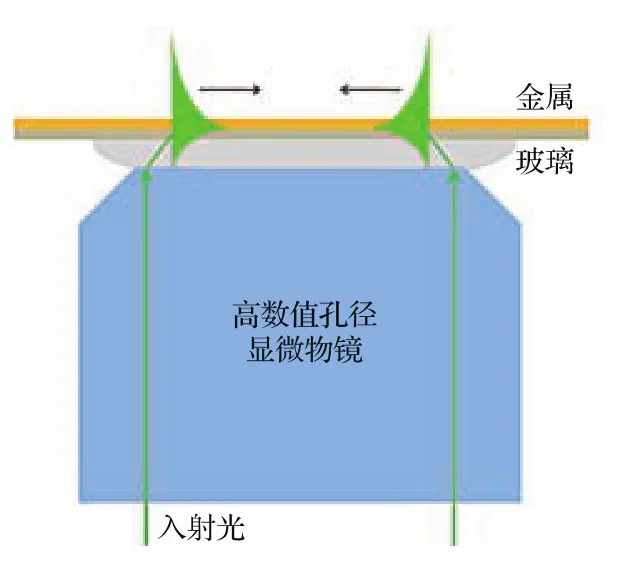
图6 利用高数值孔径物镜紧聚焦激发SPsFig.6.SPs excieted by highly focused laser beam.
2.3 结构光照明显微术基本理论
结构光照明显微成像技术属于一种宽场成像技术,在提高成像速度方面比点扫描成像具有明显优势.初期的结构光照明显微术主要用来提高光学显微镜的层析能力,并且由于只需对传统显微镜稍加改造就可以实现结构光照明,因此它更为经济,目前已经有商业公司提供结构光照明模块,如Olympus的OptiGrid[52]和Zeiss的Apotome[53].结构光照明显微术最早是通过在照明光路中加入一个正弦光栅来实现[15],利用压电陶瓷控制器整体移动光栅来实现结构光的相移,但是这种机械移动装置降低了系统的稳定性;后期利用可动态控制的空间光调制器[30-32]、数字微镜器件(digital micromirror device)[54]来代替光栅,实现结构光照明.结构光照明不仅可以获得层析成像能力,更重要的是利用结构光频率和样品频率分量形成的莫尔条纹可以提高横向分辨率.通过空间调制后的结构光照明样品,将物场空间高频率信息编码,再通过计算提取高频率信息,可将横向分辨率提高到2倍于衍射极限频率.需要说明的是横向成像分辨率取值与结构光波矢正相关,因此提高结构光的波矢就提高了系统接收高频信息的能力,也就提升了成像的空间分辨率.
2.3.1 结构光照明横向分辨率原理
横向的结构光照明为正弦分布:
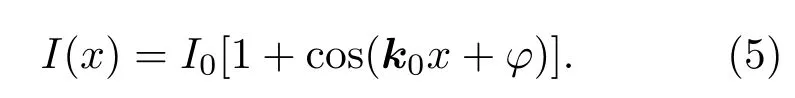
(5)式经过傅里叶变换,可以在频谱面上看到三个脉冲(δ)频率分量:

在频域内,定义源图像的频域为B(k),其反映的是荧光分子等样品的浓度分布信息.必须指出的是,无论是结构光照明图案的频率I(k),还是源图像的空间频率B(k),都受到系统的衍射极限频率限制OTF(k).故系统在频域的输出为O(k),其表示为
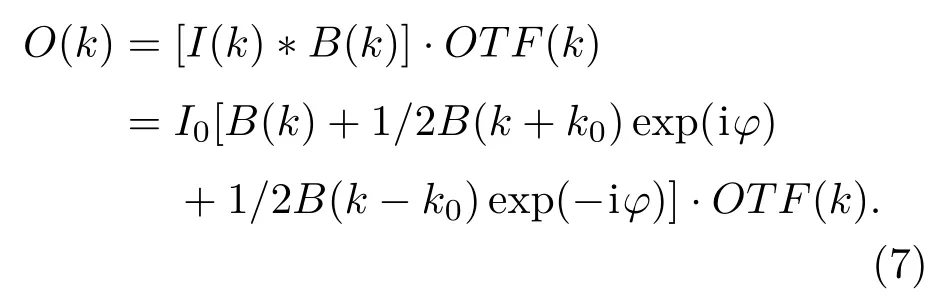
SIM系统所获得的图像空间频谱实为宽场频谱和衍射极限频率外高频信息所叠加产生的混合频谱.为了复原超分辨频谱的真实分布,首先需要将各频谱分量B(k),B(k+k0)和B(k-k0)准确分离;再将已分离的高频信息搬回原有的位置;最后,结合去卷积运算[55],获得最优化的超分辨图像显示效果.基于以上分析可知,由于(6)式中共包含三个未知频谱分量B(k),B(k+k0)和B(k-k0),至少需要构建三个独立方程式以获得未知数的精确解.显然,在结构光调控过程中,相位是最合适的调制参数.选择三个不同初相位{0,φ1,φ2}的结构光激发样品,得到三项频域内的输出{O(k),O1(k),O2(k)},从而求得

经过算法重构,结构光系统最大的空间频率可以达到系统衍射极限频率的2倍,故可以将特定方向的空间分辨率提高一倍.同时改变相移方向,将所有方向获得的高频分量整合,可以将整个二维平面的分辨率都提高一倍.结构光照明在k矢量空间的表示如图7所示.

图7 结构光照明在k矢量空间的表示[56](矩形代表样品k矢量空间的表示,为了简单说明分成三个方向,纵向条纹为样品的直接成像宽场信息,斜条纹代表样品的高频信息) (a)小圆圈表示系统点扩散函数的傅里叶变换,由于正弦照明,记录强度是三个不同方向分量的总和的傅里叶变换,包含有纵向条纹物品信息与其他两个斜条纹信息; (b)如果在图像中记录的三个信息分量被适当分开,它们可以用来提升分辨率Fig.7.E ff ect of the structured illumination in k-vector space[56](the rectangle represents the sample kvectors,the sample separation in three areasis simply illustrative):(a)The small circles are the Fourier transform of the point spread function,because of the sinusoidal illumination,the Fourier transform of the recorded intensity is the sum of three di ff erent components,include with the wide- field information(vertical stripes),information from two more areas of the sample(diagonal stripes),is mixed in the recorded image; (b)if the three information components recorded in the image are properly separated,they can be used to increase the resolution.
2.3.2 表面等离激元结构光显微成像基本原理

对于传统SIM成像技术,其分辨率R可以写成[26]:对于荧光光谱来说,λeimission≈ λexciatation,因此SIM成像分辨率接近λeimission/(4NA),即传统衍射极限频率的2倍.而PSIM技术将SIM与可调控的SPs干涉驻波条纹相结合,对于PSIM成像, λexciatation=λsp,根据图2可知SPs波矢总大于激发光波矢,使得SPs驻波比激发光波长更短、频率更高,因此将高频的SPs条纹作为结构光可以显著提升成像系统分辨高频信息的能力.SPs条纹可以通过相向传播的SPs波干涉形成驻波来产生,并可以通过调节SPs波的初始相位实现驻波的相移.图8给出了PSIM成像波矢空间的示意图.
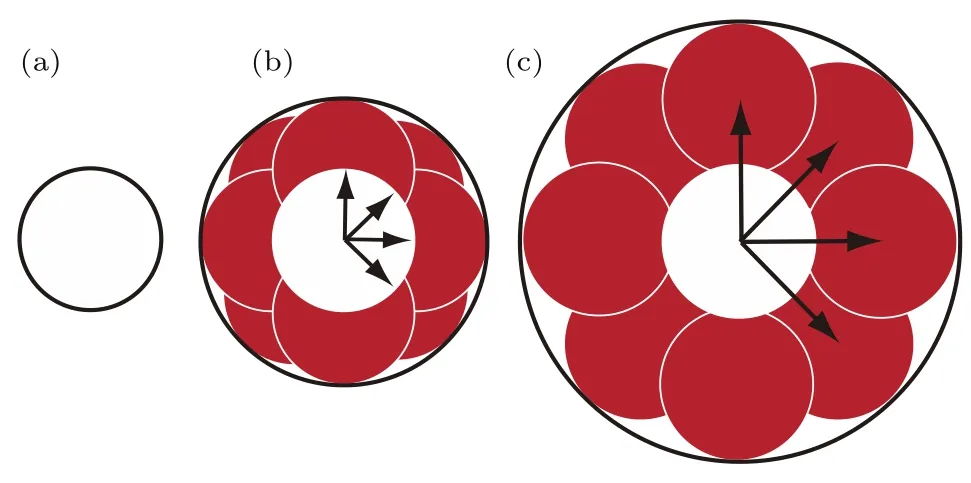
图8 PSIM波矢空间示意图[56](黑色圆圈是波矢空间中的点扩散函数,圆越大表明分辨率越高) (a)初始点扩散函数;(b)通过四个方向(箭头表示)SIM成像重建的点扩散函数,共有十二幅图像获取(每个方向的三幅图像),得到更高的分辨率;(c)通过PSIM技术重建的点扩散函数,条纹由相向传播的SPs波干涉生成,这些条纹超越光学分辨,对于一个连续点扩散函数,PSIM可实现衍射极限频率三倍以上的成像分辨率Fig.8. Thek-vectorspacerepresentationsof PSIM[56](the black circles are the point spread functions in k space,the larger the circle the better the resolution):(a)Original point spread function of the lens;(b)reconstructed point spread function via optical SIM for four directions(the arrows),twelve images are acquired(three for each direction)to reproduce a high resolution one;(c)reconstructed point spread function via PSIM,the illumination fringes are created from counter propagating SPs,these fringes beyond optically resolved,for a continuous point spread function,PSIM achieves triple better imaging resolution as the di ff raction limit.
3 表面等离激元结构光照明显微术的研究进展
国际上对PSIM技术的研究,根据SPs条纹的产生与调控方法可分为两类:一类是基于微纳米金属结构的PSIM,还有一类是基于全光激发与调控的PSIM.结构型的PSIM技术具有高效耦合、局域场增强的优势,但同时透过结构的光对于成像会造成影响,并且因为结构固定,限制了结构光场的任意可调.全光型的PSIM技术具有高动态性、光场任意可调的优点,但其耦合效率较低.得益于纳米加工技术的发展,基于纳米尺度结构的PSIM相比较全光的PSIM可以实现更高的条纹空间频率,理论上可以得到更高分辨率的PSIM成像,但也存在加工难度高等问题.
3.1 基于结构调制的PSIM介绍
2010年,美国加州大学圣地亚哥分校刘照伟教授在国际上首次提出PSIM的概念[26],并通过模拟分析了两种结构的PSIM成像分辨率.两种结构分别基于不同厚度的两种金属/介质膜,以银膜作为金属膜,水作为周围介质.其中一种结构如图9所示,银膜厚度为100 nm(灰色区域),采用Kretschmann[46]结构激发方法,563 nm激发光以不同入射角激发产生SPs干涉图样并发生横向位移.当入射激发角度分别为0°,4.6°和8°时,三种SPs干涉驻波场沿横向呈现120°的相位差.该方法可用于暗场荧光成像,文中分析可实现3倍的成像分辨率提高.

图9[26](a)—(c)SPs驻波干涉条纹的时间平均电能量密度分布,分别以0°,4.6°和8°作为激发角,三种干涉SPs驻波模式沿横向方向呈现120°的相位差Fig.9.[26](a)–(c)The time-averaged electrical energy density distribution of the SP interference pattern with incident angle equal to 0°,4.6°,and 8.0°,respectively.The three interference patterns show 120°mutual phase di ff erence along the lateral direction.
第2种结构采用17 nm厚度的银膜和光栅激发方法,通过优化的周期性Cr金属纳米孔结构去激发SPs[26],如图10所示.纳米孔结构可以产生类似光学Bloch波的SPs-Bloch模式,当m阶SPs-Bloch波相向传输形成驻波条纹,条纹周期决定于纳米孔的周期,其在矢量空间满足kf=2(kS±mkg),这里kg为纳米孔周期的倒数.因此可以通过缩小纳米孔的周期长度来形成更为精细的SPs干涉驻波条纹,文中分析可实现4倍的成像分辨率提高.
2012年,袁小聪教授课题组[57,58]利用四方向金属光栅结构实现了PSIM,具体结构如图11(a)所示,其中光栅围绕的中心区域面积是12µm×12µm.采用633 nm波长的线偏振的光学旋涡(optical vortex,OV)作为激发光弱聚焦于金属光栅结构上,在中心区域内激发产生SPs驻波场,再通过调控入射光的相位(即OV光束的拓扑荷),实现SPs驻波条纹相移,致使荧光成像.这种实验装置简单、重复性高,但由于成像视场范围受限于SPs的传播距离,中心成像区域面积较小,不利于大尺寸样品的放置、对准测量.通过调整激发光的偏振方向,可以实现双方向的PSIM成像,最终实现的成像分辨率达到172 nm,接近激发波长的1/4.

图10[26](a)结构示意图与SP干涉图案(取电场能量密度分布的时间平均值);(b)干涉图案的傅里叶变换;(c)对应的波矢空间表示;不同的颜色代表不同阶照明图案的波矢信息Fig.10.[26](a)Structure and SP interference pattern(time-averaged electric energy density distribution); (b)Fourier transform of interference pattern;(c)corresponding k space representations;di ff erent colors represent the information obtained from di ff erent orders of the illumination patterns.
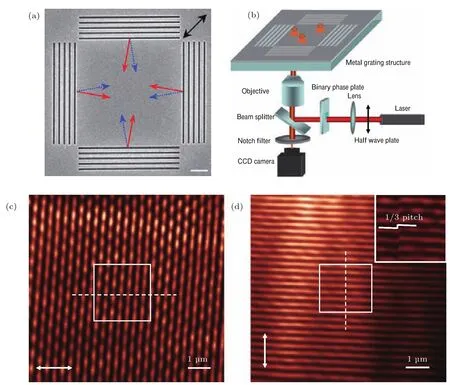
图11[58](a)四方向金属光栅扫描电镜图像,可用于产生SPs莫尔条纹;(b)SPs驻波荧光显微镜原理图; (c),(d)利用近场光学显微镜得到狭缝阵列结构中心区域的SPs驻波场的强度分布,其入射光偏振方向分别为x(c)和y(d)方向,(d)的插图是采用二进制相位板插入光路光学显微镜中实现的SP驻波相移的条纹图像Fig.11.[58](a)SEM image of four metallic gratings to generate plasmonic Moiré fringes;(b)a schematic diagram of the SP-SWF microscope;(c),(d)NSOM images of SP standing wave fi led intensity distributions in the central area of slit array structures with polarization of illumination light along x(c)and y(d) direction,respectively.Insertion in(d)is the NSOM image of phase-shifted SP standing wave fringe by using binary phase plate inserted into optical path.
2014年,刘照伟课题组在《Nano Letters》期刊上发表的文章展示了其PSIM技术的最近实验研究成果[27].如图12和图13所示,他们在金属膜上刻蚀了正交的细缝,形成了正方形狭缝阵列.每次入射光照明,正方形对边将会激发产生相向传播的SPs,叠加后形成SPs驻波的结构光用于荧光成像.他们又通过精确控制照明光的入射角度实现了驻波条纹的移动.而SIM二维超分辨成像的实现,则是由调节照明光的偏振实现,正交的偏振方向分别开关了正方形两组对边狭缝SPs的产生.这一技术使得成像分辨率提升了2.6倍,达到123 nm.
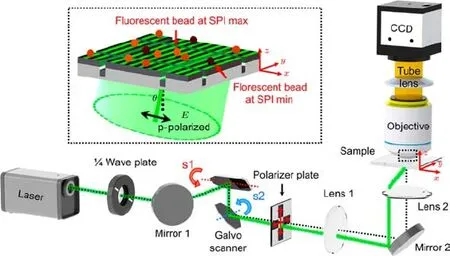
图12[27]PSIM系统原理图 在x-z与y-z平面的入射角度通过分别控制扫描电镜S2和S1的旋转实现,扫描电镜S2放在透镜1的焦平面上,样品放置在透镜2的焦平面上,插图为样品区域的放大图Fig.12.[27]Schematics of the PSIM system.The illumination angle tuning in x-z and y-z planes are controlled by the rotation of the s2 and s1 mirror of the Galvo scanner,respectively,with the s2 mirror placed at the focal plane of lens 1 and the sample placed at the focal plane of lens 2.Inset:a magni fi ed view of the sample region.
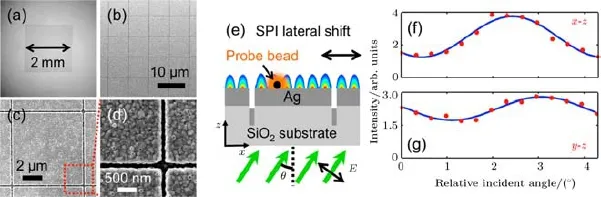
图13[27]样品制备与表征 (a)PSIM基板的光学图像,PSIM基板面积为2 mm×2 mm;(b)—(d)PSIM基板扫描电子显微镜图像,狭缝阵列的图像(b),(b)结构单元的扫描电子图像(c),狭缝的进一步放大图像(d);(e)SPs干涉结构示意图,随着入射角θ的变化,SPI干涉结构发生变化(由水平横向黑色箭头指示的方向);(f),(g)荧光强度与分别在x-z平面(f)和y-z平面(g)相对入射角的关系Fig.13.[27]Sample fabrication and characterization:(a)Optical image of a large PSIM substrate,the total PSIM substrate area is 2 mm×2 mm;(b)–(d)scanning electron microscope(SEM)images of a PSIM substrate,showing an array of the patterned slits(b),one unit cell(c)and a further magni fi ed view of the slits(d);(e)schematic illustration of the SPI tuning scheme,as the incident angle θ changes,the SPI pattern shifts laterally(direction indicated by the horizontal black arrow);(f),(g) fl uorescence intensity vs the relative incident angle in x-z(f)and y-z(g)plane,respectively.
此外,基于纳米光学天线结构,刘照伟课题组又开发出一种局域表面等离激元结构光照明显微成像技术(LPSIM)[29].不同于前面基于周期性狭缝结构的PSIM技术,利用纳米天线激发的局域表面等离激元,其空间频率可以任意获取,理论上并没有分辨率的极限.图14为光学天线的结构示意图[28],纳米天线的直径在60 nm,天线间距为150 nm,制作成六角形排布.图中红线表示照明激发光的p-偏振方向,通过改变激发光的入射角,即能实现SPs条纹的相移.结果显示,LPSIM技术将图像分辨力提高3倍,点扩散函数半高宽从153 nm降到52 nm.
2016年鱼卫星课题组[59,60]理论研究了梯度介电常数人工结构在SIM成像中的应用.此人工结构由金属与介质交替叠加组成,其多步相移通过调制入射角度得到,如图15所示.采用532 nm激发光入射,可以得到SPs干涉驻波条纹周期达到84 nm,理想情况下可以实现亚45 nm的PSIM成像分辨率.这意味着相比较常规的荧光成像,可以实现5倍的成像分辨率提升.此类设计与之前刘照伟课题组[25]报道的结构类似,但创新性地采用了金属与介质交替叠加的结构,进一步增加了等效折射率,降低了驻波条纹周期,提升了空间频率.
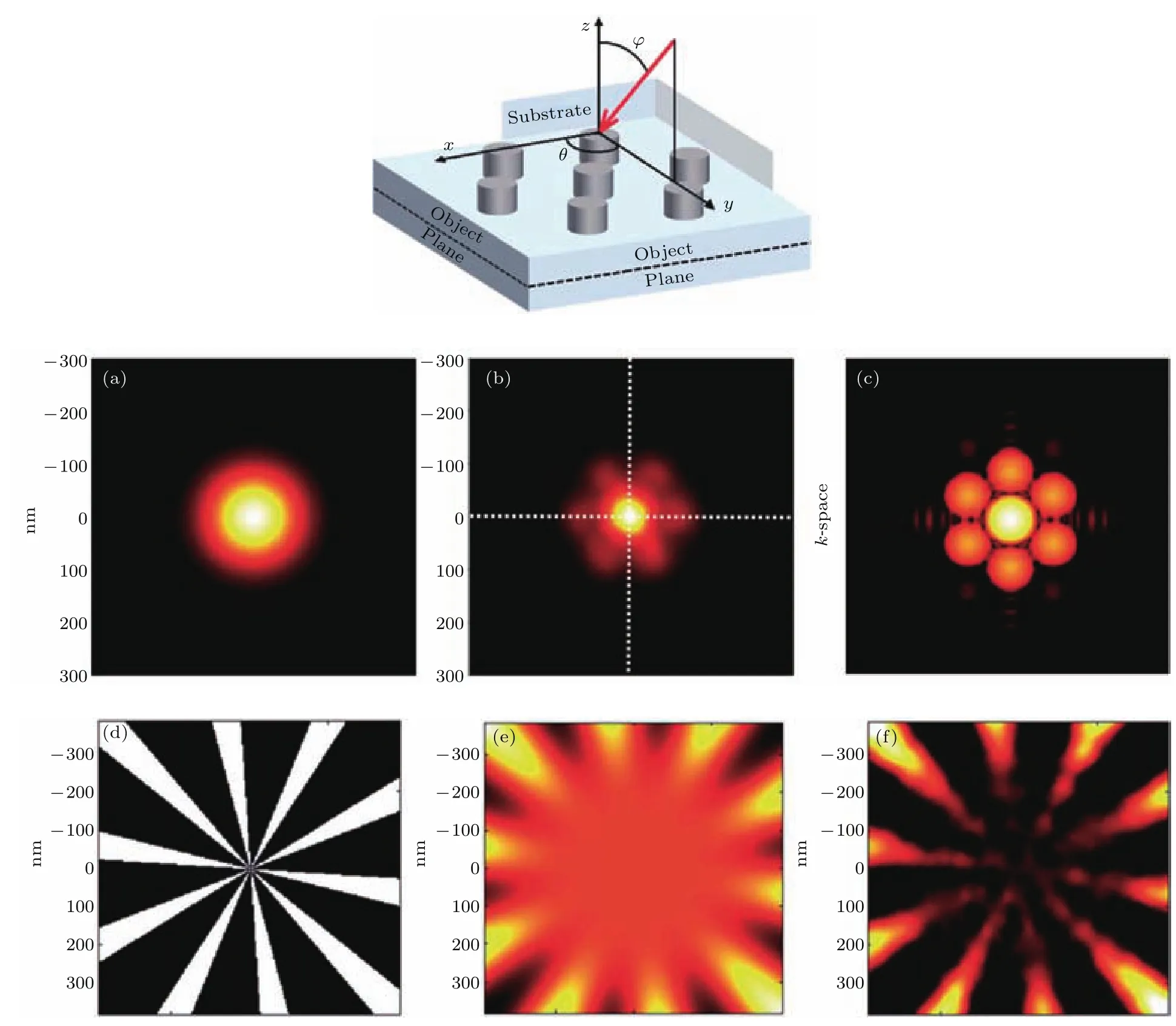
图14[29]LPSIM原理示意图(红色箭头代表p偏振激光,以不同角度激发等离子基板,在天线后产生短程的近场激发模式)分辨率表征 PSFs(a)衍射受限系统和(b)LPSIM技术;(c)经过LPSIM重构之后的光学传递函数;(d)实心条纹物体;(e)衍射受限图像;(f)LPSIM图像Fig.14.[29]The Schematics of the LPSIM.The red arrow represents p-polarized laser light,directed towards the plasmonic substrate at varying angles to create near- field excitation patterns a short distance behind the antennas.Resolution characterization:PSFs of(a)a di ff raction-limited system,and(b)the LPSIM technique;(c)expanded OTF after LPSIM-reconstruction;(d)a solid striped object;(e)di ff raction-limited image;(f)LPSIM image.

图15[59]在SIM使用的GPMS的示意图和它的成像性能仿真结果 (a)由GPMS产生SPS的光学示意图,两列相向传输的表面等离激元形成驻波干涉条纹,用来激发在水膜中的量子点(或荧光珠);点扩散函数(b)的二(a)衍射受限系统,(c)x方向的重建图像,(d)传统的荧光显微镜图像(蓝色曲线)和利用GPMS实现的超分辨率图像(红色线)之间的半高宽比较;(e)x和y方向的重建图像Fig.15.[59]The schematic diagram of the GPMS used in SIM and the simulation results of its imaging performance:(a)Optical con fi guration of SPs generated by GPMS,the standing interference pattern,which is generated by two adjacent counter propagating SPs,is used to excite the quantum dots(or fl uorescent beads)in the water fi lm;point spread function(b)a di ff raction-limited system,(c)x-direction reconstructed image,(d)FWHM comparison between conventional epi- fl uorescence microscope image(blue curve)and the super-resolution image using the GPMS(red line);(e)both x and y direction reconstructed image.
3.2 基于全光调制的PSIM技术
全光调控型PSIM技术利用入射光束整形产生特殊相位、偏振分布的新颖光束作为激发光源,选择性地在均匀金属/介质界面激发可重构的SPs驻波条纹,并进一步通过变化入射光束的相位、振幅、偏振来动态调控所激发的SPs条纹.此方法无须制备复杂的微纳米金属结构,简单经济,而且易与传统的光学显微系统相整合.此技术类似于已经报道的TIRF-SIM成像[25]手段,只是样品的底层介质不同,相比较而言PSIM由于SPs波长短而具有更高的成像分辨率.
2009年,麻省理工大学的Chung等[61]发表了一项研究工作:将SPs应用于宽场荧光超分辨成像中,称为驻波-表面等离激元荧光成像技术(SWSPRF).图16为光学系统示意图,使用激光波长为532 nm,在准直系统中置入偏振片,以此选择激发光为p偏振或者s偏振.实验中金膜蒸镀在盖玻片上,然后在金膜上又镀了一层5 nm厚的二氧化硅.激发所使用的紧聚焦物镜是45倍,数值孔径为1.45,此时两束激发光入射角度为44.7°,每束光都会激发SPs,两束相向的SPs干涉产生驻波结构光照明体系,文中分析了此时对应的对比度为0.8.SIM技术中重要的环节之一就是控制结构光产生稳定相移,从而覆盖整个成像区域,如图所示, Chung等在一束激发光中加入了反馈调节装置,稳定快速地完成了SPs条纹的相移过程.图16(a1)为原始荧光像,(b1)为(a1)去卷积后得到的效果图,(c1)和(d1)分别为三步相移的算法合成图像以及合成后算法优化处理后的图像,(d2)表征了最后得到的荧光点扩散函数(PSF)的截面数据,可以看出最终的成像分辨率达到124 nm.另外,此方法提高了信噪比,降低了荧光猝灭的可能性,可满足生物医学成像中的迫切需求.
2010年,袁小聪课题组[30]提出了基于表面等离激元旋涡的PSIM显微成像技术.如图17(a)所示,他们用高数值孔径物镜将OV聚焦在银膜上,在银膜上表面激发产生SPs旋涡驻波条纹,致使荧光成像.再利用OV光束的拓扑荷变化,实现了SPs驻波场的相移,如图17(b)所示,拓扑荷从1—4变化,所对应的相移为0,2π/5,4π/5和 6π/5.这种装置较Chung等实验装置更加简单,重复性高.从图17(c)荧光点扩散函数的截面数据可以知道,实验最终实现的图像分辨率为150 nm,与152 nm的理论分辨率符合得很好.

图16[61]SW-SPRF实验系统结构图 SW-SPRF显微在垂直方向的分辨率:(a1)初始荧光图像,(b1)去卷积的SPRF图像,(c1)基于三幅去卷积后的SPRF图像实现SW-TIRF算法得到SW-SPRF图像,(d1)线性去卷积降低SW-SPRF图像的旁瓣;(a2)—(d2)比较了不同方法得到的选定区域PSF函数分布.比例尺,2µm;插图直径1.3µmFig.16.[61]Experimental setup of SW-SPRF microscopy.Extended-resolution imaging with SW-SPRF microscopy in vertical direction:(a1)Original SPRF image,(b1)deconvolved SPRF image,(c1)SW-SPRF image after applying the SW-TIRF algorithm on three deconvolved SPRF images,(d1)SW-SPRF image with linear deconvolution to reduce side lobes;(a2)–(d2)comparison of PSF pro fi les of various imaging methods at a selected region of interest (ROI).Scale bar,2µm;inset size 1.3µm across.
2015年,袁小聪课题组[31]进一步改进了PSIM系统,利用携有分数拓扑荷的OV光束激发特定相移的SPs驻波场,同时对激发光束进行强度调制,激发出利于算法处理的一维驻波条纹.如图18(a)所示,强度调制器为一蝴蝶形的光阑,如此一来,OV光分为对称的两束光,同时携带了相移的拓扑信息.如图18(c)所示,拓扑荷分别为1, 1.66,2.34的OV光束进入激发系统后产生的驻波相移分别是-2π/3,0,2π/3.实验处理后得到的点扩散函数截面半高宽(FWHM)为95 nm,国际上首次将全光调制型PSIM成像分辨率提高到100 nm以下.此项技术实现了近似平行的均匀SPs驻波条纹,解决了之前旋涡光束激发产生SPs条纹为圆形且不均匀的问题,为后期图像处理带来了较大的方便.
由于全光调制型PSIM大都高数值孔径物镜聚焦的SPs激发方法,其中只有SPs共振角附近很小一部分入射光可以用来激发,绝大部分其他角度入射光都被金属膜反射了,所以激发SPs的效率比较低.2016年,袁小聪课题组[31]将新颖的完美涡旋光束(POV)引入PSIM系统,利用完美涡旋光束的环形边带非常窄的特点,将窄带环形光束精确对应到SPs共振角度,从而让更多的入射光能量被用于激发SPs驻波场.该项PSIM技术的优势在于SPs激发效率比普通OV光束高很多,目前已实现了6.2倍的成像激发效率提升.此外,由于完美涡旋光束是窄带环形光束,中心没有激发光透过金属膜,能较好地抑制背景噪声,提高成像的信噪比.

图17[30](a)光学旋涡聚焦银薄膜所产生的表面等离激元激元的实验系统示意图;(b)具有不同拓扑荷l=1,2,3,4的线偏振光学旋涡光束x方向激发的表面等离激元驻波分布;(c)(a1)原始图像,(b1)利用SPCE点扩散函数去卷积的SPRF图像,(c1)应用sw-tirf算法和线性Richardson-Lucy去卷积后sw-sprf图像;(a2)—(c2)为(a1)—(c1)选定区域的点扩散函数包络Fig.17.[30](a)Aschematic diagram of experimental setup of SPPs generated by OV which focuses on the Ag thin fi lm; (b)excitation SPs standing wave pro fi le generated by a linearly polarized OV beam in x direction which carries the topological charge of l=1,l=2,(cl)=3,and dl=4.(c)(a1)original SPRF image,(b1)deconvolved SPRF image with SPCE PSF kernel,(c1)SW-SPRF image after applying SW-TIRF algorithm and linear Richardson-Lucy linear deconvolution; (a2)–(c2)comparison of PSF pro fi les at a selected ROI in(a1)–(c1).
该技术通过调节POV光束的分数阶拓扑荷,实现SPs条纹相移的过程,如图19所示,拓扑荷分别为1.33,2,2.66的POV光束实现0,2π/3,4π/3的相移过程,得到的成像分辨率为132 nm.
4 总结及展望
由于传统显微成像技术存在的衍射极限极大地制约了其应用范围,如今有越来越多的新型成像技术被提出以突破这一限制.其中结构光照明显微成像技术因其超分辨、宽场、快速成像的优势,在生物医学上的应用价值不可忽视.近些年来SIM技术结合表面等离激元的研究进展,发展出了PSIM技术.该技术将成像分辨率提高了衍射极限频率的3到4倍,且其成像区域受限于金属表面,背景噪声弱,有较好的成像对比度.本文介绍的不同PSIM成像技术的综合参数对比见表1.此外,PSIM技术还可以与其他显微技术相结合产生更多应用,例如:由于SPs具有局域电磁场增强的特性,有报道将PSIM技术与Raman成像技术相结合实现表面增强拉曼的宽场成像[33,62];在理论上PSIM可以实现多种波长多色成像,可以使用感兴趣的不同荧光分子来成像;同时PSIM技术可以通过增加激发功率,增强荧光分子的非线性效应,进一步提高成像分辨率,实现基于SPs的饱和吸收SIM成像.

图18[31](a)利用振幅滤波器实现激发光变成为一对较小的半弧如绿色半弧所示;(b)在银膜中心相向传播SPS波形成一个标准的SP驻波模式;(c)利用分数阶拓扑荷的光学旋涡实现精确的相移{-2π/3,0,2π/3}Fig.18.[31](a)The excitation position was cut to a smaller pair of arcs showed as green solid arcs by amplitude fi lter; (b)a standard SP-standing-wave pattern with uniform periodicity could be generated by two counter-propagate SPs waves toward the silver fi lm center;(c)precise phase shifts of{-2π/3,0,2π/3}achieved by OVs with fractional topological charges.

图19[32](a),(b)PSIM系统的示意图;(c)具有分数阶拓扑荷的完美光学旋涡;(d)原始的荧光图像;(e)经过三步相移算法重构得到的超分辨荧光图像;(f)对应于(e)红色线表示的强度分布,表明具有132 nm的成像分辨率Fig.19.[32](a),(b)Experimental setup for PSIM system;(c)perfect optics vortex with fractional topological charges; (d)origianl fl uorescence images;(e)super-resolved fl uorescence image by applied reconstructed algorithm to three inter media images;(f)the corresponding fl uorescence intensity cross-section in(e)shows the optical resolution(132 nm).

表1 不同PSIM成像技术的综合参数对比Table 1.Comparison of di ff erent PSIM imaging techniques.
需要指出的是,虽然PSIM技术拥有诸多优势,但其局限性也十分明显:由于SPs是一种表面倏逝,所以其成像区域限定为距离金属表面200 nm左右范围内,只能实现近金属表面样品的二维平面成像;结构型PSIM成像可以实现更高的成像分辨率,但受限于结构固定,不易动态调控,且信噪比、成像维度也受到影响;全光型PSIM成像均采用高数值孔径聚焦,成像区域受到SPs干涉区域大小的限制.并且现在已有的PSIM成像报道,主要是通过荧光小球进行分辨率的标定,尚缺乏对于实际生物样品的检测.同时现有PSIM成像研究都是基于一些基本的假设:如荧光强度与SPs条纹的相对线性相关;形成的SPs条纹周期不会因为表面荧光分子的分布产生变化;不考虑金属表面对于荧光淬灭的影响等.所以现有的PSIM成像技术还远不够完善,仍有待于进一步深入研究和发展.相信随着该技术的不断研发和改进,这些难题终将被解决,最终形成可实用化的新型超分辨光学显微成像仪器,为生物医学成像领域做出突出贡献.
[1]Born M,Wolf E 2009 Principles of Optics(Amsterdam:Elsevier)
[2]White J G,Amos W B 1987 Nature 328 183
[3]Sheppard C J R,Wilson T 1981 J.Microsc.124 107
[4]Bek A,Vogelgesang R,Kern K 2006 Rev.Sci.Instrum. 77 043703
[5]Betzig E,Trautman J K 1991 Science 251 1468
[6]Reddick R C,Warmack R J,Ferrell T L 1989 Phys.Rev. B 39 767
[7]Fang N,Lee H,Sun C,Zhang X 2005 Science 308 534
[8]Durant S,Liu Z,Steele J M,Zhang X 2006 JOSA B 23 2383
[9]Liu Z,Durant S,Lee H,Pikus Y,Fang N,Xiong Y,Sun C,Zhang X 2007 Nano Lett.7 403
[10]Xiong Y,Liu Z,Sun C,Zhang X 2007 Nano Lett.7 3360
[11]Lee H,Liu Z,Xiong Y,Sun C,Zhang X 2007 Opt.Express 15 15886
[12]Liu Z,Lee H,Xiong Y,Sun C,Zhang X 2007 Science 315 1686
[13]Klar T A,Hell S W 1999 Opt.Lett.24 954
[14]Rust M J,Bates M,Zhuang X 2006 Nature Methods 3 793
[15]Betzig E,Patterson G H,Sougrat R,Lindwasser O W, Olenych S,Bonifacino J S,Davidson M W,Hess H F 2006 Science 313 1642
[16]Gustafsson M G L 2000 J.Microsc.198 82
[17]Gustafsson M G L 2005 PNAS 102 13081
[18]Kner P,Chhun B B,Griffis E R,Winoto L,Gustafsson M G 2009 Nature Methods 6 339
[19]Shao L,Kner P,Rego E H,Gustafsson M G 2011 Nature Methods 8 1044
[20]Schermelleh L,Carlton P M,Haase S,Shao L,Winoto L,Kner P,Burke B,Cardoso M C,Agand D A,Gustafsson M G,Leonhardt H,Sedat J W 2008 Science320 1332
[21]Chung E,Kim D,Cui Y,Kim Y H,So P T 2007 Biophys. J.93 1747
[22]Fiolka R,Beck M,Stemmer A 2008 Opt.Lett.33 1629
[23]Gliko O,Brownell W E,Saggau P 2009 Opt.Lett.34 836
[24]Planchon T A,Gao L,Milkie D E,Davidson M W,Galbraith J A,Galbraith C G,Betzig E 2011 Nature Methods 8 417
[25]Li D,Shao L,Chen B C,Zhang X,Zhang M,Moses B, Milkie D E,Beach J R,Hammer J A,Pasham M,Kirchhausen T,Baird M A,Davidson M W,Xu P,Betzig E Science 349 aab3500
[26]Wei F,Liu Z 2010 Nano Lett.10 2531
[27]Wei F,Lu D,Shen H,Wan W,Ponsetto J L,Huang E, Liu Z 2014 Nano Lett.14 4634
[28]Fernández-Domínguez A I,Liu Z,Pendry J B 2015 ACS Photon.2 341
[29]Ponsetto J L,Wei F,Liu Z 2014 Nanoscale 6 5807
[30]Tan P S,Yuan X C,Yuan G H,Wang Q 2010 Appl. Phys.Lett.97 241109
[31]Wei S,Lei T,Du L,Zhang C,Chen H,Yang Y,Zhu S W,Yuan X C 2015 Opt.Express 23 30143
[32]Zhang C,Min C,Du L,Yuan X C 2016 Appl.Phys.Lett. 108 201601
[33]Ertsgaard C T,McKoskey R M,Rich I S,Lindquist N C 2014 ACS Nano 8 10941
[34]Barnes W L,Dereux A,Ebbesen T W 2003 Nature 424 824
[35]Wood R W 1902 Proc.Phys.Soc.London 18 269
[36]Fano U 1941 JOSA 31 213
[37]Ritchie R H 1957 Phys.Rev.106 874
[38]Ferrell R A 1958 Phys.Rev.111 1214
[39]Powell C J,Swan J B 1960 Phys.Rev.118 640
[40]Ebbesen T W,Lezec H J,Ghaemi H F,Thio T,Wol ffP A 1998 Nature 91 667
[41]Bozhevolnyi S I,Volkov V S,Devaux E,Laluet J Y, Ebbesen T W 2006 Nature 440 508
[42]Liu Z W,Wei Q H,Zhang X 2005 Nano Lett.5 957
[43]Yao J,Liu Z,Liu Y,Wang Y,Sun C,Bartal G,Stacy A M,Zhang X 2008 Science 321 930
[44]Raether H 1988 Surface Plasmons(Berlin:Springer)
[45]Otto A 1968 Zeitschriftfür Physik 216 398
[46]Kretschmann E,Raether H 1968 Znaturforsch 23 2135
[47]Sarid D 1981 Phys.Rev.Lett.47 1927
[48]Hecht B,Bielefeldt H,Novotny L,Inouye Y,Pohl D W 1996 Phys.Rev.Lett.77 1889
[49]Hornauer D,Kapitza H,Raether H 1974 J.Physics D: Appl.Phys.7 L100
[50]Nash D J,Cotter N P K,Wood E L,Bradberry G W, Sambles J R 1995 J.Modern Opt.42 243
[51]Kano H,Mizuguchi S,Kawata S 1998 JOSA B 15 1381
[52]http://wwwbiomartcn/infosupply/6945559.html[2017-03-01]
[53]https://wwwzeisscom/microscopy/int/products/imagingsystems/apotome-2-for-biology.html[2017-03-01]
[54]Dan D,Lei M,Yao B,Wang W,Winterhalder M,Zumbusch A,Qi Y,Xia L,Yan S,Yang Y,Gao P,Zhao W 2013 Sci.Reports 3 1116
[55]Chakrova N,Rieger B 2016 JOSA A 33 B12
[56]Gjonaj B 2012 Digital Plasmonics:from Concept to Microscopy(Amsterdam:University of Amsterdam)
[57]Wang Q,Bu J,Tan P S,Yuan G H,Teng J H,Wang H, Yuan X C 2012 Plasmonics 7 427
[58]Yuan G,Wang Q,Yuan X 2012 Opt.Lett.37 2715
[59]Cao S,Wang T,Xu W,Liu H,Zhang H,Hu B,Yu W 2016 Sci.Reports 6 23460
[60]Cao S,Wang T,Sun Q,Hu B,Yu W 2017 Opt.Express 25 3863
[61]Zhang J,See C W,Somekh M G,Pitter M C,Liu S G 2004 Appl.Phys.Lett.85 5451
[62]Chen H,Du L,Wu X,Zhu S,Yang Y,Fang H,Yuan X 2016 Appl.Phys.Lett.109 261904
PACS:87.64.M—,65.40.gp,73.30.+y DOI:10.7498/aps.66.148701
Research progress of plasmonic structure illumination microscopy∗
Zhang Chong-LeiXin Zi-Qiang Min Chang-Jun†Yuan Xiao-Cong‡
(Nanophotonics Research Center,Shenzhen University,Shenzhen 518060,China)
29 March 2017;revised manuscript
27 April 2017)
Structure illumination microscopy(SIM)is a novel imaging technique with advantages of high spatial resolution, wide imaging field and fast imaging speed.By illuminating the sample with patterned light and analyzing the information about Moiré fringes outside the normal range of observation,SIM can achieve about 2-fold higher in resolution than the di ff raction limit,thus it has played an important role in the field of biomedical imaging.In recent years,to further improve the resolution of SIM,people have proposed a new technique called plasmonic SIM(PSIM),in which the dynamically tunable sub-wavelength surface plasmon fringes are used as the structured illuminating light and thus the resolution reaches to 3–4 times higher than the di ff raction limit.The PSIM technique can also suppress the background noise and improve the signal-to-noise ratio,showing great potential applications in near-surface biomedical imaging.In this review paper,we introduce the principle and research progress of PSIM.In Section 1,we fi rst review the development of optical microscope,including several important near- field and far- field microscopy techniques,and then introduce the history and recent development of SIM and PSIM techniques.In Section 2,we present the basic theory of PSIM,including the dispersion relation and excitation methods of surface plasmon,the principle and imaging process of SIM,and the principle of increasing resolution by PSIM.In Section 3,we review the recent research progress of two types of PSIMs in detail.The fi rst type is the nanostructure-assisted PSIM,in which the periodic metallic nanostructures such as grating or antenna array are used to excite the surface plasmon fringes,and then the shift of fringes is modulated by changing the angle of incident light.The resolution of such a type of PSIM is mainly dependent on the period of nanostructure, thus can be improved to a few tens of nanometers with deep-subwavelength structure period.The other type is the alloptically controlled PSIM,in which the structured light with designed distribution of phase or polarization(e.g.optical vortex)is used as the incident light to excite the surface plasmon fringes on a fl at metal fi lm,and then the fringes are dynamically controlled by modulating the phase or polarization of incident light.Without the help of nanostructure, such a type of PSIM usually has a resolution of about 100 nm,but bene fi ts from the structureless excitation of plasmonic fringes in an all-optical con fi guration,thereby showing more dynamic regulation and reducing the need to fabricate nanometer-sized complex structures.In the fi nal Section,we summarize the features of PSIM and discuss the outlook for this technique.Further studies are needed to improve the performance of PSIM and to expand the scope of practical applications in biomedical imaging.
structure illumination microscopy,super-resolution imaging,surface plasmon
:87.64.M—,65.40.gp,73.30.+y
10.7498/aps.66.148701
∗国家自然科学基金(批准号:61427819,61422506,61605118)、国家重点基础研究发展计划(批准号:2015CB352004)和国家重点研发计划(批准号:2016YFC0102401)资助的课题.
†通信作者.E-mail:cjmin@szu.edu.cn
‡通信作者.E-mail:xcyuan@szu.edu.cn
©2017中国物理学会Chinese Physical Society
http://wulixb.iphy.ac.cn
*Project supported by the National Natural Science Foundation of China(Grant Nos.61427819,61422506,61605118),the National Basic Research Program of China(Grant No.2015CB352004),and the National Key Research and Development Program of China(Grant No.2016YFC0102401).
†Corresponding author.E-mail:cjmin@szu.edu.cn
‡Corresponding author.E-mail:xcyuan@szu.edu.cn

