健脾补肾方增加β-catenin、Runx2表达而促进骨质疏松性骨折愈合的疗效观察
笪巍伟 赵永见 兰儒贤 王腾腾 唐德志* 舒冰 马俊明 施杞 王拥军
1. 上海中医药大学附属龙华医院,上海 200032 2. 扬州市中医院骨伤科,江苏 扬州 225000 3. 上海中医药大学脊柱病研究所,上海 200032
骨质疏松性骨折(osteoporotic fracture),是骨质疏松症的严重并发症,常在轻微外力作用下即可造成全身各部位骨折,多发于脊柱、髋部和桡尺骨远端,其他部位也易发生骨折,常可引起骨折部位疼痛、畸形、功能障碍,脊柱骨折还可引起身高变矮、驼背等[1]。
骨质疏松性骨折的发生率不断上升,以绝经后妇女及中老年患者居多[2],而骨折后的长期卧床及制动,将引起骨量的快速丢失,进一步加重骨质疏松症,导致骨折愈合过程缓慢,恢复时间长,易发生骨折延迟愈合甚至不愈合,其他部位发生再骨折等并发症的风险明显增加,给此类患者带来沉重的经济负担、躯体痛苦[3]。中医药内治法具有局部治疗、整体调节的效果。上海中医药大学施杞教授传承、创新了石氏伤科的学术思想和理论特色,将“以气为主、以血为先”、“肝脾肾同治”充分运用于骨科疾患的诊治中,健脾补肾方是其数十年来用于治疗骨质疏松性骨折的临床经验基础方,具有较好临床疗效。本实验旨在探讨该方治疗骨质疏松性骨折的疗效机制,为指导临床运用提供科学依据。
1 材料和方法
1.1 实验动物
由上海中医药大学动物房订购2月龄C57BL/6雌鼠46只,SPF级饲养至3月龄。所有动物在整个实验过程中均自由饮水和进食。许可证号:SCXK(京)2012-0001。
1.2 实验试剂和仪器
水合氯醛(批号:20081027,国药集团化学试剂有限公司);Ultra-Sensitive Estradiol RIA超敏雌二醇试剂盒(Beckman Coulter, DSL-4800,Immunotechs.r.o.,USA);10%中性缓冲福尔马林固定液(批号15090101,广州维格斯生物科技有限公司);uCT80 Micro-CT(SCANCOMedical,CHE);5417R小型台式冷冻型离心机(Eppendorf,DEU);MDF-U53V -80℃超低温冰箱(SANYO,JPN);SN-697γ计数器(机号789655,上海核所日环光电仪器有限公司);RNase-freeEP管(MCT-150-C,Axygen,USA)。
1.3 实验方法
1.3.1 建立骨质疏松模型:在雌鼠3月龄时,10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,剔除小鼠背部正中平两侧髂嵴水平处鼠毛,碘伏消毒,无菌条件下,俯卧位经腰背侧正中切开皮肤约2~3 cm切口进入,移至一侧肋弓下第3-4腰椎处,钝性分开腰部筋膜、肌肉,切开腹膜,分离暴露卵巢,结扎输卵管和周围血管后,摘除卵巢。然后按相同的方法摘除对侧卵巢。在确保摘除双侧卵巢后,逐层缝合腹膜至皮肤,金霉素眼膏涂抹伤口。随机选取5只小鼠作为假手术组,不摘除卵巢,仅摘除双侧卵巢旁边少许脂肪组织;其余41只小鼠均按上述方法行双侧卵巢摘除手术,3个月后从中随机选取5只摘除双侧卵巢小鼠作为去卵巢组,与假手术组同时处死,进行观察比较,以证实摘除双侧卵巢后小鼠骨质疏松模型建立成功。并对剩余36只摘除卵巢(骨质疏松)小鼠再进行胫骨骨折造模。
1.3.2 随机法分组:去卵巢后3月,对36只小鼠进行编号,称量、记录体重,平均体重为(35.4±3.6)g,运用SPASS 18软件进行随机法分组,分为两个组:生理盐水组、健脾补肾组,每组3个时间点7、14、28 d,每组每个时间点各6只小鼠。
1.3.3 药物配制、煎煮:①健脾补肾方药物配伍:党参12 g,刺五加12 g,骨碎补9 g,仙灵脾9 g,独活9 g,丹参12 g,药材均购于上海熔仁堂中药房。②小鼠与人用药剂量换算公式:小鼠药量=1/70×10×体重×数量×次数。小鼠每只每天0.2 mL灌胃。生理盐水组给予等体积的生理盐水灌胃。
1.3.4 建立骨质疏松性骨折模型:骨质疏松造模3月后,10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,取仰卧位,左侧胫骨,剔净鼠毛,碘伏消毒,无菌操作经胫骨前缘切开皮肤1.5 cm,钝性分开胫骨中、上1/3处(胫骨脊上方)内外侧部分筋膜、肌肉,预先髓内针头由胫骨平台处插入胫骨上1/3处(断端上部),手术剪在1/3处避开胫骨内侧深部肌肉,完全横断胫骨,针头插入断端下部骨腔中,插入约3/4长度剪断,再抵入胫骨平台下方,逐层缝合筋膜、肌肉、皮肤。术后第2天进行灌胃治疗。分别于术后7、14和28d处死小鼠,取材,进行相应指标检测。
1.3.5 血清雌二醇(E2)检测:通过摘眼球取血,分离血清,委托上海中医药大学核医学放射免疫实验室采用放射免疫法完成血清E2检测。
1.3.6 X-ray线检测:剔除胫骨周围多余软组织,使用uCT80 Micro-CT,以55 kVp,71 μA条件对左侧胫骨进行X-ray扫描。
1.3.7 Micro-CT检测:使用uCT80 Micro-CT统一定位左侧胫骨骨折部位,分辨率为18 μm 逐层扫描成像及三维重建,形态计量学分析包括骨体积分数(BV/TV)、骨小梁数目(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp)、连接密度(connectivity density,Conn.D.)、骨密度(BMD of TV、BMD of BV)。
1.3.8 组织病理学染色:①HE染色:石蜡切片60℃烤箱5 min,常规脱蜡至水→苏木素染液2 min→蒸馏水冲洗1 min→盐酸乙醇分化5 sec→氨水蓝化15 sec→蒸馏水冲洗→伊红染液 2 min→蒸馏水清洗→梯度乙醇分化→二甲苯透明→中性树胶封片。Olympus VS120-SL 20倍目镜下观察。②ABH/OG染色:石蜡切片60℃烤箱5 min,常规脱蜡至水→盐酸乙醇分化30sec→不冲洗→ABH 30 min→蒸馏水冲洗→盐酸乙醇分化2 sec→蒸馏水冲洗→氨水蓝化15sec→蒸馏水冲洗→95%乙醇1 min→Orange G/Eosin Y/Phloxin B溶液 90sec→95%乙醇(I、II、III)10 sec、10 sec、3 min→无水乙醇1 min→二甲苯透明→中性树胶封片。Olympus VS120-SL 20倍目镜下观察。③β-catenin、Runx2染色:石蜡切片60℃烤箱5 min,常规脱蜡至水→蒸馏水冲洗1 min→甲醇∶H2O2(1∶9)15 min→蒸馏水冲洗→抗原修复液:蒸馏水(1∶50),高温高压至(105℃,0.025 kPa)→自然冷却至室温→PBS 洗片 2 min×3次→5%BSA 封闭 20 min,37℃→不洗片,滴加一抗(β-catenin:1%BSA 1∶200、Runx2∶1%BSA 1∶200),4℃过夜→PBS洗片 2 min×3次→滴加羊抗兔IgG-Biotin,37℃孵育 15 min→PBS洗片 2 min×3次→滴加SABC,室温15 min→PBS洗片 2 min×3次→DAB显色液(蒸馏水1 mL+D1 50 μL+D2 100 μL+D3 50 μL),室温孵育3~10 min→梯度乙醇分化→二甲苯透明→中性树胶封片。Olympus VS120-SL 20倍目镜下观察。
1.4 统计学处理
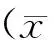
2 结果
2.1 骨质疏松小鼠模型建立
(1) 去卵巢组与假手术组血清雌二醇(E2)含量比较,见表1。去卵巢后3月,小鼠血清雌二醇含量明显低于假手术组(P<0.05),说明去卵巢后小鼠可模拟绝经后妇女雌激素水平降低。
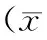
表1 去卵巢模型组与假手术组E2含量±s)Table 1 The E2 level in the ovariectomized ±s)
注:去卵巢组与假手术组比较,*P<0.05(下同)
(2)Micro-CT定量分析结果显示,去卵巢后3月,可导致小鼠胫骨BV/TV、Tb.Th、Tb.N、Tb.Sp、BMD of TV均明显降低(P<0.05)。根据胫骨Micro-CT以及血清雌二醇结果,说明骨质疏松性骨折小鼠模型建立成功,见表2。
2.2 两组小鼠不同时间点骨折断端影像学观察
骨折断端X-ray线可见7 d各组胫骨骨折线均较为清晰,两组间差异不明显;14 d生理盐水组骨折线较明显,断端无明显骨痂影连接,健脾补肾组骨折线模糊,均可见骨折断端大量骨痂影形成,跨过骨折线;28 d生理盐水组仍可见模糊的骨折线,健脾补肾组骨折线均消失,断端皮质连续性完整,见图1。骨痂三维重建图可直观看出,与生理盐水组相比,健脾补肾组7、14、28 d时均可促进骨痂的生成和发展,见图2。
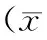
表2 去卵巢模型组与假手术组胫骨Micro-CT定量分析结果±s)Table 2 The results of quantitative micro-CT analysis in the tibia of the ovariectomized group and sham group(±s)
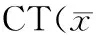
表3 药物干预7d胫骨骨痂Micro-±s)Table 3 Micro-CT result of the tibia callus in 7 days of the drug intervention(±s)
注:与生理盐水组相比,**P<0.01,*P<0.05(下同)
表4 药物干预14 d胫骨骨痂Micro-±s)Table 4 Micro-CT result of the tibia callus in 14 days of the drug intervention(±s)
表5 药物干预28 d胫骨骨痂Micro-±s)Table 5 Micro-CT result of the tibia callus in 28 days of the drug intervention(±s)
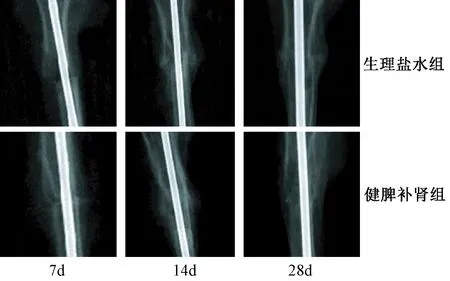
图1 骨折断端X-ray线Fig.1 X-ray image of the fracture point

图2 骨痂三维重建Fig.2 The 3D reconstruction of the callus
2.3 两组小鼠不同时间点胫骨骨痂Micro-CT定量分析
两组均在灌胃干预后7、14和28d期间,不同时间点各死亡2只小鼠。与生理盐水组相比,健脾补肾组干预7、14d时,可促进骨痂中骨小梁体积比(P<0.05),提高骨痂骨密度(P<0.01)。28d时,两组无明显差异(P>0.05),说明健脾补肾中药早中期可促进骨质疏松性骨折骨痂的形成和发展,见表3,表4,表5。
2.4 两组小鼠28 d时骨折部位生物力学强度分析
生物力学分析时,生理盐水组一组数据无法通过有限元软件正确读取分析,因此,该组仅有3组数据。通过有限元分析软件,对药物干预28d后小鼠胫骨骨折部位生物力学进行计量分析,数据显示在刚度方面,健脾补肾组与生理盐水组有明显差异(P<0.05);在弹性模量方面,两组有显著性差异(P<0.01),见表6。图3为三维重建受力分析图,红色代表最大受力强度,绿色代表最小受力强度,从而说明健脾补肾组能够提高骨折愈合部位生物力学强度,不仅可以加速骨质疏松性骨折的愈合,还可提高预后质量,预防二次骨折的发生。
表6 药物干预28d胫骨骨折部位生物力学±s)Table 6 Biomechanical result of the tibia fracture site in 28 days of the drug intervention(±s)
2.5 病理组织学观察
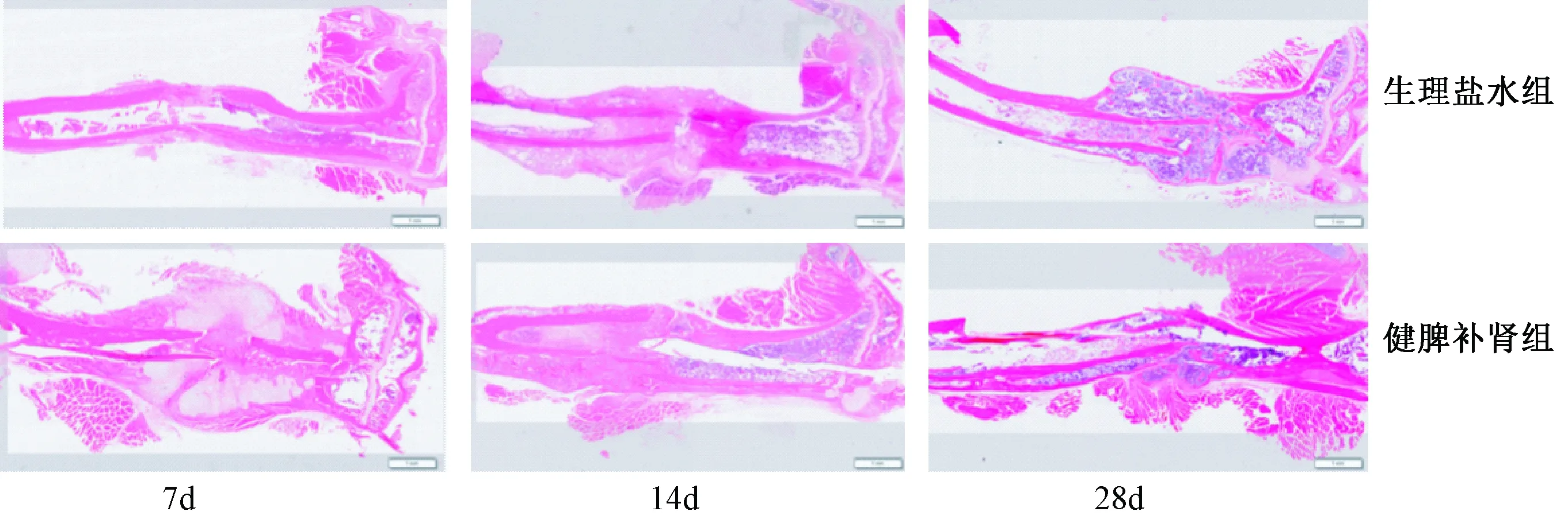
图4 两组干预7、14、28 d胫骨骨折部位HE染色Fig.4 HE staining of the tibia fracture site at 7, 14, and 28 days of the drug intervention in two groups
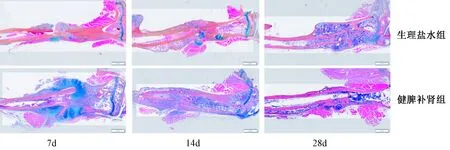
图5 两组干预7、14、28 d胫骨骨折部位ABH/OG染色Fig.5 ABH/OG staining of the tibia fracture site at 7, 14, and 28 days of the drug intervention in two groups
2.5.1 HE染色:两组干预7、14、28 d后,小鼠胫骨骨折部位HE染色,可见健脾补肾组7 d时促进骨折断端软骨痂的形成,而生理盐水组无明显骨痂的形成;14 d天时,健脾补肾组骨折断端骨痂开始重塑,成骨细胞增加,多余骨痂组织被破骨细胞大量吸收,而生理盐水组此时软骨痂刚开始形成;28 d时,健脾补肾组骨折断端已基本愈合,骨皮质连续,骨髓腔已通,而生理盐水组断端仍有较多硬骨痂存在,表明健脾补肾方可明显加速骨质疏松性骨折愈合,见图4。
2.5.2 ABH/OG染色:两组干预7、14、28 d后,小鼠胫骨骨折部位ABH/OG染色,可见健脾补肾组在7 d时促进断端软骨细胞(软骨痂)的形成,而生理盐水组断端无明显软骨细胞的形成;14 d时,健脾补肾组小鼠骨折断端骨痂开始重塑,软骨细胞大量凋亡,成骨细胞增加,多余骨痂组织被破骨细胞大量吸收,而生理盐水组此时软骨痂开始大量形成;28 d时,健脾补肾组骨折断端已基本愈合,无明显软骨细胞的存在,见图5。与HE染色,共同说明健脾补肾方可以促进骨折部位早、中期膜内成骨和软骨内成骨,加速骨折愈合。
2.5.3 β-catenin免疫组化染色:两组干预7、14、28 d后,小鼠胫骨骨折部位β-catenin染色,可见健脾补肾组7 d时能够明显促进骨痂内软骨细胞胞质和核内β-catenin的阳性表达量,多于生理盐水组;14 d时,健脾补肾组促进软骨、成骨细胞胞质和核内β-catenin的阳性表达量,多于生理盐水组;28 d时,两组成骨细胞胞质内仍有部分阳性表达,见图6。说明健脾补肾中药能增加β-catenin的表达,调节软骨、成骨细胞增殖及分化活性,促进骨折愈合。
2.5.4 Runx2免疫组化染色:两组药物干预7、14、28 d后,小鼠胫骨骨折断端Runx2染色,可见健脾补肾组7、14 d时,能够促进骨痂内软骨、成骨细胞胞质和核内Runx2的阳性表达量,明显多于生理盐水组;干预28 d时,健脾补肾组成骨细胞胞质内仍有部分阳性表达,多于生理盐水组,见图7。说明健脾补肾中药能增加Runx2的表达,调控软骨、成骨细胞活性,从而促进骨折愈合。
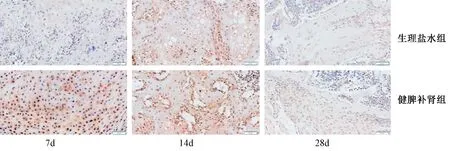
图6 两组干预7、14、28 d胫骨骨折部位β-catenin染色Fig.6 β-catenin staining of the tibia fracture site at 7, 14, and 28 days of the drug intervention in two groups
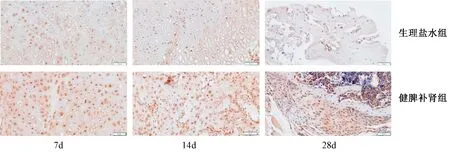
图7 两组干预7、14、28 d胫骨骨折部位Runx2染色Fig.7 Runx2 staining of the tibia fracture site at 7, 14, and 28 days of the drug intervention in two groups
3 讨论
在中医古代文献中,对于骨质疏松性骨折的认识及论治尚无明确的记载,因其是骨质疏松最严重的并发症,多归属于《黄帝内经》中 “骨痹”、“骨痿”等范畴。中老年人由于机体的自然退变及基础疾病等因素影响,单纯依靠补钙或抗骨质疏松等靶点干预骨质疏松性骨折,显得较为单薄,而中医药理论及治疗方法在该病的预防、围手术期治疗中,凸显特色优势。
中医学及现代医学均认识到肌肉与骨骼在生理、病理上的相关性。《难经·二十四难》记载:“少阴者,冬脉也,伏行而温于骨髓。故骨髓不温,即肉不着骨,骨肉不相亲,即肉濡而却…发无润泽;无润泽者,骨先死。”肌肉作为人体最主要的动力组织器官,其应力刺激[4]和微循环营养供应[5],均可影响骨代谢水平及骨质量;同时,骨骼肌的力量与骨折风险有着密切联系[6],是评估和防治老年人因跌倒而骨折可能的一个重要因素[7,8]。由此可见,肌肉与骨的密切关系在骨质疏松症和骨质疏松性骨折防治中具有重要的作用。
《傅青主女科》曰:“脾为后天,肾为先天,脾非先天之气不能化,肾非后天之气不能生。”脾肾之间为后天补养先天、先天温养后天的辨证关系[9],同时,“脾主肌肉”、“肾主骨”、“先、后天之本”等中医理论说明通过调补脾肾可促进肌肉、骨骼间的相互作用,从而达到防治疾病的功效。
骨质疏松性骨折的病机类似于骨质疏松症,脾肾亏虚是主要病机、气血瘀滞是促进因素[10],因此,本研究的治法以健脾补肾为主,辅以活血化瘀。方中党参补中益气、健脾益肺,骨碎补补肾强骨、续伤止痛,两者共为君药;辅以臣药刺五加益气健脾、补肾安神,仙灵脾补肾阳、强筋骨,两者共为臣药;佐药丹参活血祛瘀,通经止痛;使药独活,入肾经,祛风除湿,通痹止痛。
3.1 健脾
金元四大家之一李东垣提出:“内伤脾胃,百病由生”、“善治病者,惟治在脾,治脾胃以安五脏”,说明了脾胃在疾病诊治中的重要性。骨伤科的骨损筋伤等疾患,多从肝脾肾论治,肝主筋、肾主骨、脾主肌肉,然肝血、肾精,无不源于脾之运化[11,12]。同时,骨折患者的治疗多重用破血逐瘀、滋腻补益药物,易致胃失纳呆、脾失健运。《慎斋遗书》云:“脾胃一伤,四脏皆无生气”、“错病不愈,必伤及脾胃之中”。故顾护脾胃,则精血充盈;再者,脾土健运,可充分吸收、摄取药物的有效成分,发挥药物的治疗作用,濡养肌肉、骨骼,促进骨折愈合[13]。
3.2 补肾
《素问·六节藏象论篇》所云:“肾主骨,生髓。”《医经精义》记载:“肾藏精,精生髓,髓生骨,故骨者肾之合也。”对于“肾主骨”理论的研究理解,分为狭义“肾主骨”,主要强调肾脏中1α羟化酶的活性及对钙磷代谢的调控,其重要作用在于对维生素D的羟化作用,促进钙的吸收[14];广义“肾主骨”,从“肾藏精,主生长、发育与生殖,肾主骨生髓”等方面阐述,肾藏生殖之精是髓和骨骼生成的原始物质,髓藏骨中以养骨,肾藏精促进骨骼的发育等[15]。肾精亏虚则是导致机体退变的重要因素,可引起发育障碍、骨骼脆弱等表现[16]。
现代研究探析肾-骨-骨髓之间的生理关系,发现补肾中药可促进骨髓间充干细胞(marrow stromal cells,MSCs)的成骨细胞分化,调控骨的生长发育修复[17]。补肾中药对骨质疏松性骨折具有较好的临床疗效[18-20],可有效缓解疼痛、降低骨转换率、预防骨折后骨量的丢失、提高骨密度、缩短住院时间及改善便秘等临床症状。其可能机制[21,22]是通过调控β-catenin或Runx-2等信号通路,促进成骨细胞分化及矿化、钙磷代谢、钙盐沉积和骨形成,同时可抑制骨量丢失,从而明显增加骨密度,改善骨显微结构,提高骨的生物力学强度,包括最大载荷、弹性模量和屈服强度,降低骨折发生率。
3.3 活血
瘀血是骨折发生时的必然病理产物,同时也是骨折愈合过程启动的初始因子。清·陈士铎在《洞天奥旨》中提出骨折愈合是瘀去、新生、骨合的过程,“瘀不祛,则新不生”。活血化瘀中药能够改善损伤部位微循环,从而消除瘀血对于骨折愈合的不利影响。一方面可抑制较大血肿生成,而缩小软骨内成骨的范围,另一方面通过加速血液循环,改变血管壁的通透性,利于钙离子的交换和沉积[23],同时,还可增加骨折断端组织毛细血管开放量,改善循环,促进瘀血消散,代谢产物清除也随之加快[24],消除肿胀、疼痛等症状,同时提供更多的氧和营养,以加速损伤部位的修复[25]。
本研究发现健脾补肾方可促进骨质疏松性骨折早中期骨痂的形成和发展,可能通过上调β-catenin和Runx2表达而促进软骨、成骨细胞活性;并通过健运脾胃,提高机体对中药有效成分的充分吸收,从而促进骨质疏松性骨折愈合,具有较好的临床推广价值。

