基于蒽酮硫酸比色法建立一种快速测定果糖含量的方法
任 婧,李景富,张 佳,刘俊芳,许向阳,姜景彬
(东北农业大学 园艺园林学院,哈尔滨 150036)
基于蒽酮硫酸比色法建立一种快速测定果糖含量的方法
任 婧,李景富,张 佳,刘俊芳,许向阳,姜景彬
(东北农业大学 园艺园林学院,哈尔滨 150036)
利用蒽酮比色法对番茄果实果糖含量进行测定,初步建立了微型化蒽酮比色法测定果糖含量的实验方法和蒽酮比色法测定番茄果糖含量的最佳条件,对影响测定结果的因素:测定波长、显色剂用量、显色时间、稳定时间,进行了单因素试验。结果表明,620 nm波长、85%硫酸含量、400 μL显色剂、50℃水浴3 min为最佳测定条件。该最佳测定条件下,果糖含量在2~16 μg与吸光值呈良好的线性关系。利用得到优化方法对4个番茄品种的果糖含量进行了测定,回收率在102.32%~107.38%。本研究得到番茄果实果糖含量测定的优化方法,是一种稳定、高效可行的测定方法。
番茄;蒽酮比色法;微型化;果糖
番茄(Solanumlycopersicum),茄科番茄属,起源于北美洲的安第斯山地带。不同品种的番茄成熟时积累不同比例的糖分,栽培品种一般主要积累葡萄糖和果糖,蔗糖含量极低[1]。积累果糖与葡萄糖的比例也不相同,果糖与葡萄糖的含量比值受一对显性基因(Fgr)控制,Fgr调控果糖和葡萄糖在己糖中的比例而不影响总糖含量[2]。番茄果实不同部位积累的糖分也不相同:果实维管束中果糖和葡萄糖含量较高,果肉、果胶质和胎座及心室隔壁中果糖和葡萄糖含量相差不大[3]。也有一些品种除了绿熟期外,果皮中果糖量比果心的含量高[4]。
番茄果糖量是可溶性总糖的重要组成成分[5]。测定果糖含量的方法有多种,如高效液相色谱法[6]、蒽酮比色法[7]、半胱氨酸盐酸盐法[8]、盐酸法[9]等,大多是利用紫外可见光吸收法,但这些方法存在一些明显的缺点,如价格昂贵、操作复杂、测定时间长,不能进行批量测定。本实验对蒽酮硫酸比色法测定番茄果糖含量的反应条件进行了优化,寻找最佳实验条件,以保证试验的精确度,获得可靠的实验数据为番茄育种提供参考。
本实验建立了微型化测定果糖含量的实验方法,用酶标仪测定其吸光值,对样品的吸光值可以进行批量测定,同时操作方便,减少了传统紫外分光光度计比色皿清洗不彻底从而影响测定值的问题。酶标法的线性范围良好,稳定性、可重复性和精密度较高,测定时需要的样品量少[10]。
1 仪器与试药
酶标仪(伯腾Epoch);水浴锅;天平;磁力搅拌器;容量瓶;离心管;蒽酮;98%浓硫酸;果糖;葡萄糖;蒸馏水。
2 方法
2.1 溶液的制备
2.1.1 显色剂的配制
取质量分数为75%、80%、85%、90%及98%的硫酸100 mL,加入0.2 mg蒽酮试剂,磁力搅拌器搅拌1 h,静置30 min待使用。
2.1.2 标准液的配制
精密称定果糖0.2 g,加水溶解并定容至 1 000 mL 的容量瓶,即得浓度为0.2 mg/mL果糖标准溶液,精密称定葡萄糖0.2 g,加水溶解并定容至 1 000 mL 的容量瓶,即得浓度为0.2 mg/mL葡萄糖标准溶液。
2.1.3 待测糖溶液的制备
将-80℃冷冻的番茄“16588”、“16698”、“16541”、“16513”去皮、籽,取3 g,加入80%乙醇20 mL,充分研磨成匀浆,沸水浴40 min ,过滤,加蒸馏水定容至25 mL。
2.2 优化实验
为建立一种快速、准确测定果糖的含量的方法,对蒽酮硫酸比色法的测定波长、水浴温度、显色剂用量、显色时间、稳定时间进行单因素试验。
2.2.1 实验流程
取果糖标准液0 μL、10 μL、20 μL、30 μL、40 μL、60 μL、80 μL到0~6号离心管中,加蒸馏水至100 μL,离心管置于冰水中,加显色剂,震荡混合、50℃水浴,立即冰水冷却10 min,摇匀后以各自对照溶液调零,测定吸光值。
2.2.2 硫酸浓度选择
果糖标准液0 μL、80 μL到离心管,加蒸馏水至100 μL,将各浓度蒽酮硫酸0.6 mL,震荡混合、50℃水浴3 min,在500~800 nm波长下测定吸光值。结果显示各显色剂在630 nm波长附近均有最大吸收峰,且硫酸含量为85%的显色剂吸光值最大。故选择85%的硫酸反应试剂。

图1 不同硫酸浓度Fig.1 Different sulfuric acid concentration
2.2.3 加样方案选择
取果糖标准液、葡萄糖标准液各0 μL、80 μL到离心管,加显色剂0.6 mL,震荡混合、50℃水浴3 min,在500~800 nm波长下测定吸光值。另一组果糖、葡萄糖标准液,离心管放入冰水中,再加显色剂。结果(图2)显示:冰水中的葡萄糖较在室温中的吸光值低,对果糖、葡萄糖混合液测定果糖含量影响可忽略不计,认为该温度条件下硫酸不与葡萄糖反应,常温中可能是由于硫酸溶于水瞬间放热使得硫酸与部分葡萄糖发生反应,从而使得吸光值升高。选择冰水加样为实验方案。
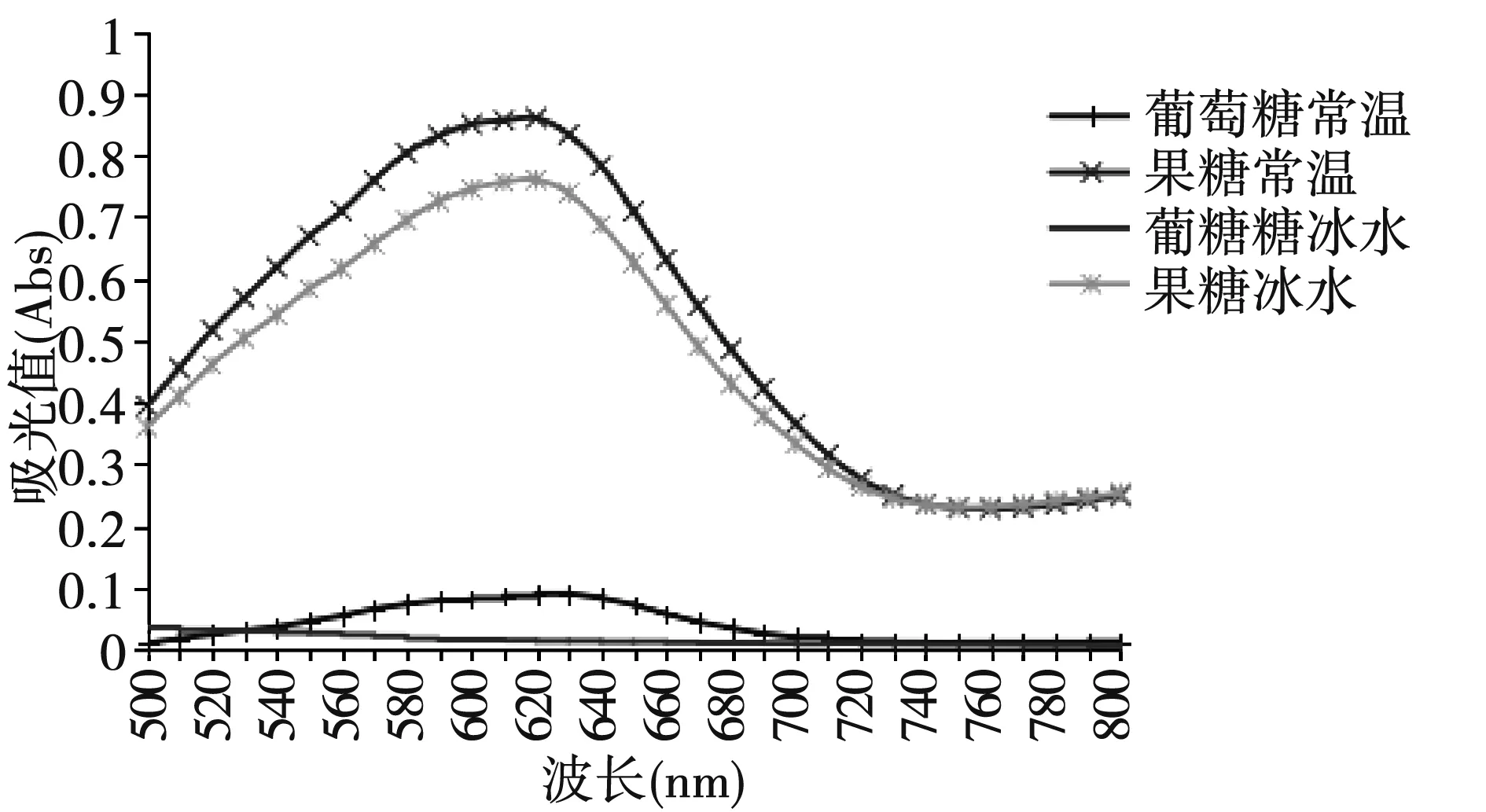
图2 不同温度Fig.2 Different temperature
2.2.4 最佳波长
取果糖标准液操作同2.2.1实验条件同上,在500~800 nm波长下测定吸光值。由图3可知:不同含量的葡萄糖溶液均在620 nm波长处有最大吸收峰,故选择620 nm为测定波长。
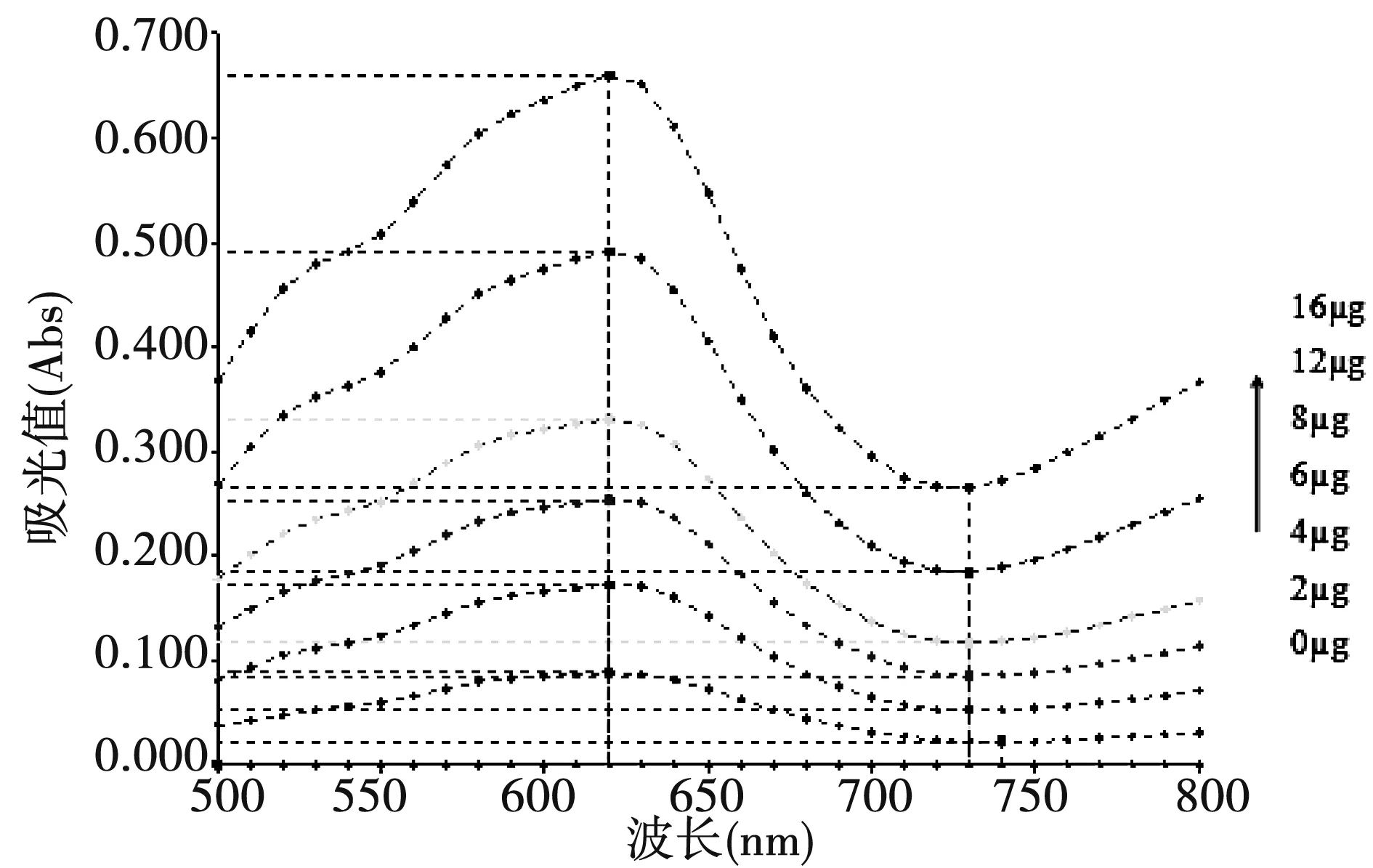
图3 不同波长Fig.3 Different wavelength
2.2.5 显色时间
取果糖标准液、葡萄糖标准液各80 μL到离心管,加蒸馏水至100 μL,50℃水浴0.5 min、1 min、1.5 min、2 min、2.5 min、3 min、3.5 min、4 min、4.5 min、5 min、7 min、10 min,操作同2.2.1以已得到的最佳条件进行。由图4可知:水浴3 min吸光值达到稳定状态,故选择3 min为最佳显色时间。
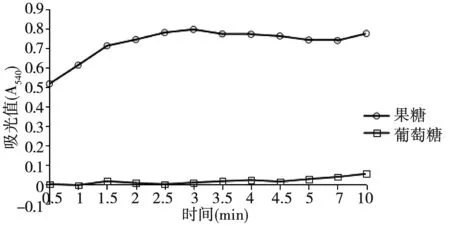
图4 不同水浴时间Fig.4 Different water bath time
2.2.6 显色剂用量
果糖标准液操作同2.2.1已得到的最佳条件进行。图5可知:显色剂在400 μL时,标准曲线R2达到最佳值,故选择400 μL为最佳显色剂用量。

图5 不同显色剂含量Fig.5 Different dosage of chromogenic agent
2.2.7 稳定曲线
取果糖标准液按最佳实验条件进行,取出立即冰水冷却10 min,摇匀后以对照溶液调零在620 nm波长下测定吸光值。图6可知:最佳条件下得到的标准曲线线性良好(a),可用于果糖含量的测定;在1 h内测定果糖吸光值(b)较为稳定,可用于批量测定。
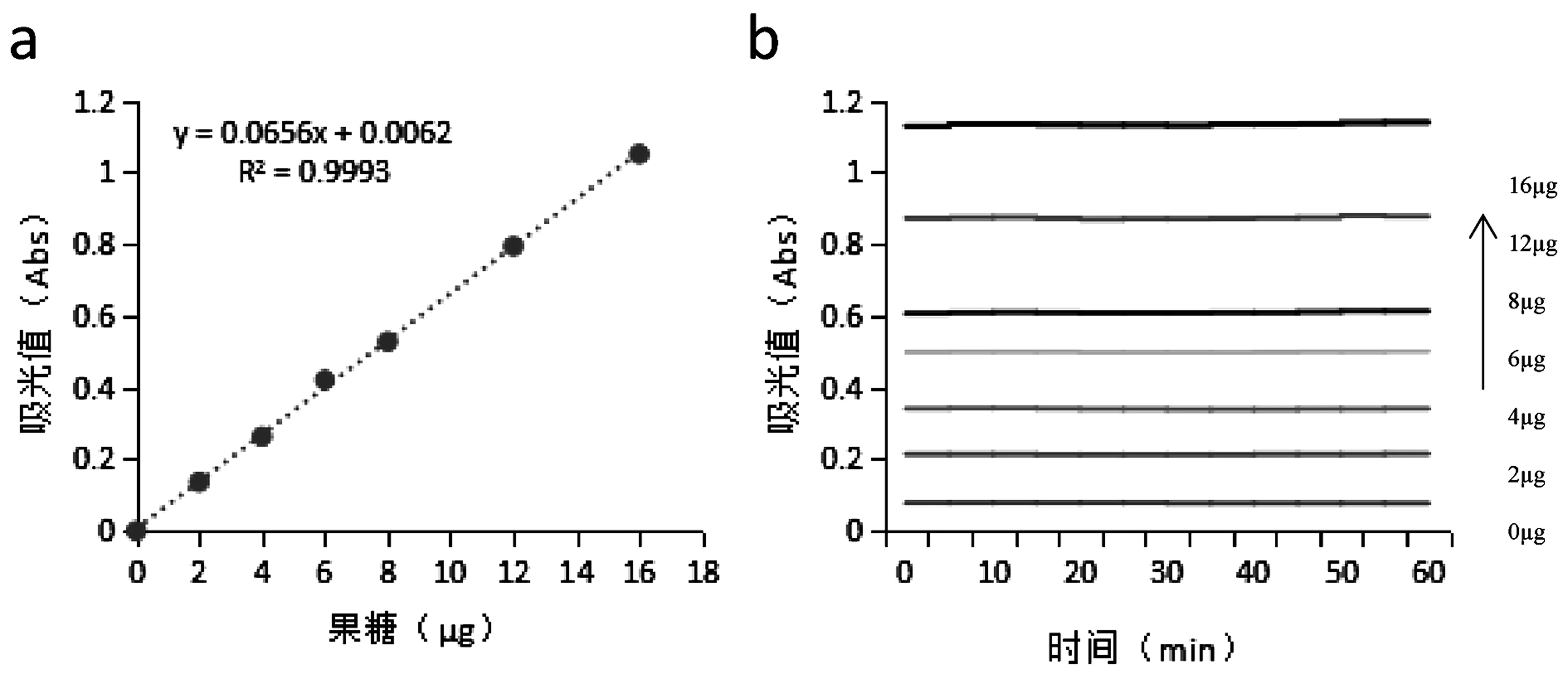
图6 标准曲线(a)及稳定曲线(b)Fig.6 The standard curve and the stability curve
2.2.8 标准曲线绘制
取果糖标准液按最佳实验条件进行。重复步骤3 次,计算回归方程及相关系数。三次测定相关系数R2分别为0.997 9、0.999 3、0.998 9,相对标准偏差RSD为0.072%,表明优选出的测定条件在所选的水平范围内为最佳条件,且方法稳定,重复性好。
3 精密度试验
将不同浓度的果糖标准液(20 μL、40 μL、80 μL),按2.2.8方法显色,加到同一个酶标板上测定吸光值,随后分别加到3个不同的酶标板上测量吸光值。同样处理进行2个批次,在620 nm处的吸光值相对标准偏差在0.2%~2.3%(表1),表明仪器的精密性良好,可用于测定吸光值。

表1 精度测定值
4 番茄果糖含量的测定
4.1 番茄果实果糖含量测定
将所得糖液按照最佳实验条件进行测定,同时进行标准曲线的测定。按照公式
(C-在标准曲线上查出的果糖含量,μg;Vs-提取液总体积,mL;Vt-测定时取用体积,mL;D稀释倍数;W-样品质量,g)
得到“16698”果糖含量17.52mg/g,“16588”果糖含量16.01mg/g,“16541”果糖含量23.1mg/g,“16513”果糖含量22.41mg/g。
4.2 回收率试验
精密称取已知含量的糖溶液各 5 份,分别精密加入果糖对照品2μg,按照2.2.8项方法分别测定其吸光值,代入标准曲线方程,计算回收率。结果(表2)表明测定结果可靠性良好,该方法可用于测定番茄总糖含量。

表2 回收率测定
5 讨论
蒽酮硫酸比色法测定果糖的原理是利用糖类在较高温度下可被浓硫酸脱水生成糠醛或羟甲基糖醛后,与蒽酮(C14H10O)脱水缩合,形成糠醛的衍生物,呈蓝绿色,其颜色的深浅在一定范围内与可溶性糖含量成线性关系。实验得到了蒽酮法测定果糖的硫酸浓度为85%、测定波长620 nm、加样方案为冰水加样、显色时间3 min、显色剂用量400 μL、显色 1 h内吸光值较稳定。
通过吸光值的大小及硫酸用量选择了85%的硫酸,使得果糖充分脱水。根据报道葡萄糖与果糖共存时,水浴温度在50℃时[11],果糖与蒽酮显色而葡萄糖不显色,经过试验发现:室温时加入浓硫酸也会使得葡萄糖发生显色反应,而在冰水条件下加入浓硫酸葡萄糖显色可以忽略不计,这种加样方案可以更准确的反应混合物中果糖的含量,此操作方法与刘前[7]、张友杰[12]的不同。本实验选择的测定波长为620 nm,此波长测定吸光值较好,也有研究者[7、12]选择640 nm。显色时间为3 min时,果糖与显色剂充分反应而葡萄糖不与之反应,使测定混合物中果糖含量更为准确。
[1] 谭其猛. 蔬菜育种[M].北京:农业出版社,1980.
[2] Levin I,Gilboa N,Yeselson E,et al. Fgr, a major locus that modulates the fructose to glucose ratio in mature tomato fruits.[J].Theoretical and Applied Genetics,2000,100(2):256-262.
[3] 齐红岩,李天来,张洁,等.番茄果实发育过程中糖的变化与相关酶活性的关系[J].园艺学报,2006,33(2):294-299.
[4] 陈素艳.不同番茄品种糖酸代谢及‘浙粉702’种子纯度的SSR鉴定[D].杭州:浙江农林大学,2014.
[5] 田春雨,刘野.番茄风味品质性状遗传研究进展[J].农业科技与装备,2009,(03):4-5.
[6] 于淼,阮成江,李贺,等. HPLC法测定10个引自北美蓝莓品种果实中的糖酸组分及含量[J]. 食品工业科技,2016,37(10):77-81.
[7] 刘前.果葡糖浆中果糖葡萄糖的测定[J].淀粉与淀粉糖,1993,(02):31-35.
[8] 傅维,孙勇民,侯玮.用分光光度计测定不同果汁中果糖含量的研究[J].农产品加工·学刊,2009,(01):86-88.
[9] 占达东.紫外分光光度法测定水果汁中果糖的含量[J].琼州学院学报,2003,10(2):23-24.
[10] 石耀强,张晗依,刘双月.酶标仪检测技术应用的研究进展[J].科技展望,2016,26(24):73,107.
[11] Halhoul M N,Kleinberg I. Differential determination of glucose and fructose, and glucose- and fructose-yielding substances with anthrone[J]. Analytical Biochemistry,1972,50(2):337-343.
[12] 张友杰.以蒽酮分光光度法测定果蔬中的葡萄糖、果糖、蔗糖和淀粉[J].分析化学,1977,(03):5-9.
Establishment of a method for rapid determination of fructose content based on anthraquinone sulfate colorimetric method
REN Jing, LI Jing-fu, ZHANG Jia, LIU Jun-fang, XU Xiang-yang, JIANG Jing-bin
(Northeast Agricultural University, College of Horticulture and Landscape, Harbin 150036, China)
In this experiment, the content of fructose in tomato fruit was determined by anthrone colorimetry, and it was initially established that a miniaturization anthrone colorimetry used to determine the content of fructose and the optimum conditions for the determination of tomato fructose content via anthrone colorimetry. We did single factor experiments to four factors affecting the determination of the results: wavelength, dosage of chromogenic agent, chromogenic time and stable time. The results showed that the optimum conditions were as follows: 620nm wavelength, 85% sulfuric acid content, 400 μL chromogenic agent and 50℃ water bath for 3 min. Under the optimum conditions, the fructose content had a good linear relationship with the absorbance in the range of 2~16 μg. The fructose content of four tomato cultivars was determined by using the optimized method. The recoveries were between 102.32% and 107.38%. In this study, we obtained the optimal method for determination of tomato fruit fructose content which was a stable, highly effective and feasible method.
Tomato; Anthrone colorimetry; Miniaturization; Fructose
2017-04-02
番茄杂种优势利用技术与强优势杂交种创制(2016YFD0101703)
任婧(1992-),女,硕士研究生。
李景富(1943-),男,教授,博士研究生导师,e-mail:Lijf_2005@126.com。
R927.2
A
1674-8646(2017)10-0082-04

