耐热木聚糖酶基因的克隆表达及其在酶解玉米芯木聚糖中的应用
李琦,陈明真,赵林果
(南京林业大学化学工程学院;江苏省生物质绿色燃料与化学品重点实验室,南京210037)
耐热木聚糖酶基因的克隆表达及其在酶解玉米芯木聚糖中的应用
李琦,陈明真,赵林果*
(南京林业大学化学工程学院;江苏省生物质绿色燃料与化学品重点实验室,南京210037)
为寻求具有耐热性能的木聚糖酶,笔者以嗜热网球菌(Dictyoglomusthermophilum)DSM3960的基因组为模板,克隆得到木聚糖酶基因xynB-DT,该基因全长1 083 bp,共编码361个氨基酸,蛋白的理论分子量约为40 ku。通过NCBI数据库比对发现该基因编码的蛋白质属于糖苷水解酶G11家族。实现大肠杆菌异源表达重组木聚糖酶XynB-DT,通过IPTG诱导,酶活达到30.6 U/mL。该重组木聚糖酶的最适温度为85℃,在60~80℃范围内均有较好温度稳定性,在60℃条件下保温2 h,酶活维持在90%以上,在90℃下保温2 h,酶活尚残余约50%;最适pH为6.5,在pH为5.0~7.5范围内保温24 h仍可保留约90%剩余酶活力。该酶以Beechwood木聚糖为底物,米氏常数(Km)和最大反应速率(Vmax)值分别为5.63 mg/mL和1.572 mmol/(L·min-1)。以玉米芯木聚糖为底物,研究XynB-DT水解玉米芯木聚糖的条件及产物,结果显示在温度70℃、pH 6.0条件下酶解12 h,加酶量为400 U/g,最终酶解得率为44.3%,玉米芯木聚糖的水解产物主要以木二糖和木三糖为主,表明该木聚糖酶在低聚木糖制备方面具有较大应用潜能。
嗜热网球菌;木聚糖酶;克隆;水解
木聚糖酶是一类可将木聚糖降解为低聚木糖和木糖的酶的总称,主要分为内切β-1,4-木聚糖酶、外切β-1,4-木聚糖酶以及β-D-木糖苷酶[1-3]。内切β-1,4-木聚糖酶,以内切方式水解木聚糖主链中的β-1,4-糖苷键,生成木二糖和木三糖等寡糖,是降解木聚糖最主要的酶,在造纸、纸浆工业、食品和饲料工业中有广泛应用前景[4-6]。我国作为农业大国,全国年粮食总产量达到6亿t,但大量秸秆、玉米芯等农副产物却只能被焚烧,既造成环境污染又浪费生物资源。玉米芯内木聚糖含量高达35%,木聚糖经木聚糖酶水解后可获得具有应用价值的低聚木糖。低聚木糖作为一种新型功能性食品添加剂,在提高食物质量方面具有较大潜能[7]。然而,在食品加工工业中,需要利用较高温度以提升底物的溶解性并防止杂菌污染。耐高温木聚糖酶具有较大应用价值及广阔市场前景。
目前,木聚糖酶已经从细菌、真菌、植物和各种无脊椎动物中分离,其中,微生物来源的木聚糖酶最为广泛[8],通常细菌来源的木聚糖酶比真菌来源的木聚糖酶耐热。根据酶蛋白催化区的氨基酸同源性以及疏水簇分析,大多数木聚糖酶属于糖苷水解酶家族F/10和G/11族。一般情况下,F/10族木聚糖酶分子量大,热稳定性好,大部分含有多个结构域,作用底物广泛,且水解产物中单糖成分含量较多。与F/10族木聚糖酶相比,G/11族木聚糖酶同源性在40%~90%范围内,且分子量低,催化效率高,最适pH为2.0~9.0,最适温度为35~80℃,热稳定性低以及单一催化结构域等特点,对木聚糖有较高的特异性[9-11]。嗜热网球菌(Dictyoglomusthermophilum)作为一种极耐热菌,其分泌的木聚糖酶归属于G/11家族,通过研究其酶学特性,能够使其较好应用于半纤维素资源生产食品、药品、保健品等。笔者通过基因克隆方法,从D.thermophilum中获得耐高温的木聚糖酶XynB-DT,再利用该酶酶解玉米芯木聚糖,最终利用离子色谱法分析水解后的低聚木糖产物。对该类具有应用价值的低聚木糖进行开发和研究,不仅可充分利用资源,也能够创造较高经济价值。
1 材料与方法
1.1 菌株质粒和培养基
表达载体pET-20b购于TaKaRa公司;目的基因来源菌株D.thermophilumDSM3960购于DSM(www.dsmz.de);宿主菌大肠杆菌(Escherichiacoli)Top 10F’和BL21由南京林业大学化学工程学院微生物技术研究室保藏。
LB培养基:胰蛋白胨1 g,酵母提取物0.5 g,NaCl 1 g(pH控制在中性),加入100 mL蒸馏水,121℃灭菌20 min,培养基温度降至60℃时加入相应抗生素。
1.2 主要试剂
dNTP、Ex Taq DNA聚合酶、T4 DNA连接酶、DL5000 DNA Marker、限制性内切酶EcoRI、NotI等购于TaKaRa公司;胰蛋白胨、酵母提取物购于Oxoid公司;榉木木聚糖(Beechwood)标准品购于Sigma公司;凝胶回收试剂盒、质粒小提试剂盒、氨苄青霉素、核酸染料等购自于南京天为公司;引物合成及测序由南京思普金公司完成。
1.3 主要仪器
上海智城ZHWY-2102C摇床,日本TOMY SX-500自动蒸气灭菌锅,德国Eppendorf公司台式高速冷冻离心机5415R,德国Eppendorf公司梯度PCR仪,美国Bio-rad公司凝胶成像系统,美国Molecular Devices公司全波长酶标仪SpectraMax190。
1.4 试验方法
1.4.1 引物设计
根据NCBI上公布的D.thermophilumDSM3960的xynB-DT基因序列设计引物如下:xynB-DT-f1(CCGGAATTCATGTTTCTTAAAAAACTTA)和xynB-DT-r1(TTGCGGCCGCTTACTGTATCAAC)。下划线部分分别为EcoRI和NotI酶切位点。
1.4.2 木聚糖酶基因的克隆
将合成的引物用TE buffer稀释成10 μmol/L工作液,以D.thermophilumDSM3960基因组DNA为模板,用引物对xynB-DT进行PCR扩增。PCR体系为:D.thermophilumDSM3960基因组DNA 1.0 μL,上下游引物(10 μmol/L)各2.0 μL,dNTP Mixture 4.0 μL,10×Ex Taq buffer(Mg2+free)5.0 μL,MgCl24.0 μL,Ex Taq酶(5 U/μL)0.5 μL,ddH2O 31.5 μL。
1.4.3 pET-20b-xynB-DT表达载体的构建及表达
割胶回收基因片段xynB-DT,用限制性内切酶EcoRI和NotI分别对目的基因片段和大肠杆菌表达载体pET-20b进行双酶切后连接,构建表达载体pET-20b-xynB-DT。将表达载体转化到大肠杆菌E.coliTop 10F’和E.coliBL21感受态细胞中,将重组菌接入到含有氨苄青霉素的LB培养平板中37℃过夜培养,筛选出阳性重组菌。挑选阳性单菌落至5 mL含有氨苄青霉素的LB培养基中,在37℃,180 r/min条件下恒温过夜培养,至OD600达到0.6~0.8时,加入终浓度为0.1 mmol/L的异丙基-β-D-硫代吡喃半乳糖苷(IPTG),28℃诱导培养4 h后,离心收集菌体,用50 mmol/L pH为7.0的柠檬酸-磷酸氢二钠缓冲液重悬后,超声破碎至菌液澄清,在4℃条件下10 000 r/min离心5 min,收集上清液即为胞内酶液。
1.4.4 重组木聚糖酶的表达条件优化
挑取单菌至5 mL LB培养基中,在37℃,180 r/min条件下恒温培养12 h。转接于50 mL LB培养基中37℃培养至OD600为0.8,加入终浓度分别为0.005,0.01,0.02,0.05和0.1 mmol/L的IPTG,28℃下诱导4 h,以不添加IPTG为对照;选定IPTG浓度为0.01 mmol/L,在28℃条件下分别诱导2,4,6和8 h,以0 h为对照;选定IPTG浓度为0.01 mmol/L,诱导时间为4 h,改变诱导温度20,24,28,32和37℃。
1.4.5 重组木聚糖酶的纯化、酶活测定及SDS-PAGE分析
重组蛋白用镍亲和试剂盒纯化。Ni柱平衡后,将粗酶液以1 mL/min速率上样,然后使用平衡缓冲液以同样速率洗去未吸附的蛋白质和杂质,使用200 mmol/L咪唑缓冲液进行洗脱,并收集蛋白。将收集的酶液透析除盐后进行酶活测定和SDS-PAGE分析。
以Beechwood木聚糖为底物,采用3,5-二硝基水杨酸(DNS)法[12]测定纯化后的木聚糖酶XynB-DT的活性。反应体系为:100 μL柠檬酸-柠檬酸三钠缓冲液(pH 6.5, 50 mmol/L),50 μL 1%底物在85℃下预热5 min,加入50 μL酶液,85℃下反应30 min后加入300 μL DNS混匀,煮沸计时5 min后混匀,于540 nm波长处测定其吸光度。以有底无酶作为对照。
SDS-PAGE试验方法参照分子生物学实验指南进行[13]。取500 μL酶液,加入500 μL的2×蛋白电泳缓冲液,煮沸计时5 min后离心。取15 μL上清液进行SDS-PAGE电泳。
1.4.6 重组木聚糖酶酶学性质分析
最适反应温度及温度稳定性测定:在60,65,70,75,80,85和90℃温度下,分别测定木聚糖酶酶活,以测定的酶活最高为100%计算相对酶活;在最适pH条件下,于60,70,80和90℃条件下分别保温20,40,60,80,100和120 min,以未育温的木聚糖酶活力为相对100%。
最适反应pH及pH稳定性测定:在最适温度条件下,分别测定pH 5.0~7.5条件下的酶活力,以测定的最高酶活力为相对100%,根据各pH条件下酶活力大小确定重组木聚糖酶的最适反应pH;在不含底物条件下,将重组木聚糖酶置于不同pH(5.0~7.5)的柠檬酸-柠檬酸三钠缓冲液中,于4℃保存24 h,在最适温度及pH条件下测定其残余酶活力,以未经过pH处理酶的酶活力为相对100%。
1.4.7 重组木聚糖酶水解玉米芯木聚糖条件优化
玉米芯木聚糖提取方法[14]:风干玉米芯粉碎至40~60目(420~250 μm),加入10%的NaOH溶液至固液比为1∶10,在121℃条件下抽提1 h后抽滤,用适量水洗涤抽滤渣1~2遍。合并所有液体,使用盐酸中和至pH为7.0,离心后沉淀物用蒸馏水洗至乳白色,烘干粉碎后即为玉米芯木聚糖。样品用4%硫酸水解,混匀后在121℃下水解1 h,调节pH至中性,离心取上清液测定总还原糖,将所测还原糖质量浓度乘以木聚糖聚合系数0.88,即得到木聚糖质量。
重组木聚糖酶酶解玉米芯木聚糖条件优化:玉米芯木聚糖底物质量浓度为1.25 mg/mL,以纯化后的XynB-DT为酶解用酶,以还原糖质量浓度为评价指标,研究温度(30,40,50,60,70和80℃)、pH(5.0,5.5,6.0,6.5,7.0和7.5)、加酶量(50,100,200,400,800和1 000 U/g)和时间(2,4,6,8,10,12,14和16 h)对酶解的影响,优化酶解条件,所有条件均设置3组平行试验。酶解率和低聚木糖得率根据以下公式计算:
酶解率=(还原糖×0.88)/玉米芯木聚糖质量浓度×100%
低聚木糖得率=(x2+x3+x4+x5+x6)/玉米芯木聚糖质量浓度×100%
式中,x2、x3、x4、x5和x6分别为木二糖、木三糖、木四糖、木五糖和木六糖的质量浓度,mg/mL。
2 结果与分析
2.1 木聚糖酶基因的克隆及表达载体构建
根据NCBI网站公布的来源于D.thermophilumDSM3960的xynB-DT基因序列设计特异性引物(Genbank:CP001146.1),扩增出xynB-DT基因片段,全长1 083 bp,该基因编码361个氨基酸。该基因与来源于Caldicellulosiruptorsp.F32和Paenibacilluscurdlanolyticus的木聚糖酶基因分别具有80%和56%的同源性。将xynB-DT基因片段连接到大肠杆菌表达质粒pET-20b中,构建重组质粒pET-20b-xynB-DT(图1),载体转化大肠杆菌E.coliTop 10F’中,筛选阳性克隆。
对重组质粒进行EcoRI和NotI双酶切验证(图1),一条在3 000 bp左右,为切去xynB-DT基因的pET-20b片段;另一条在1 000 bp左右的条带为xynB-DT基因的片段,说明此细菌木聚糖酶的基因已插入到pET-20b载体上。
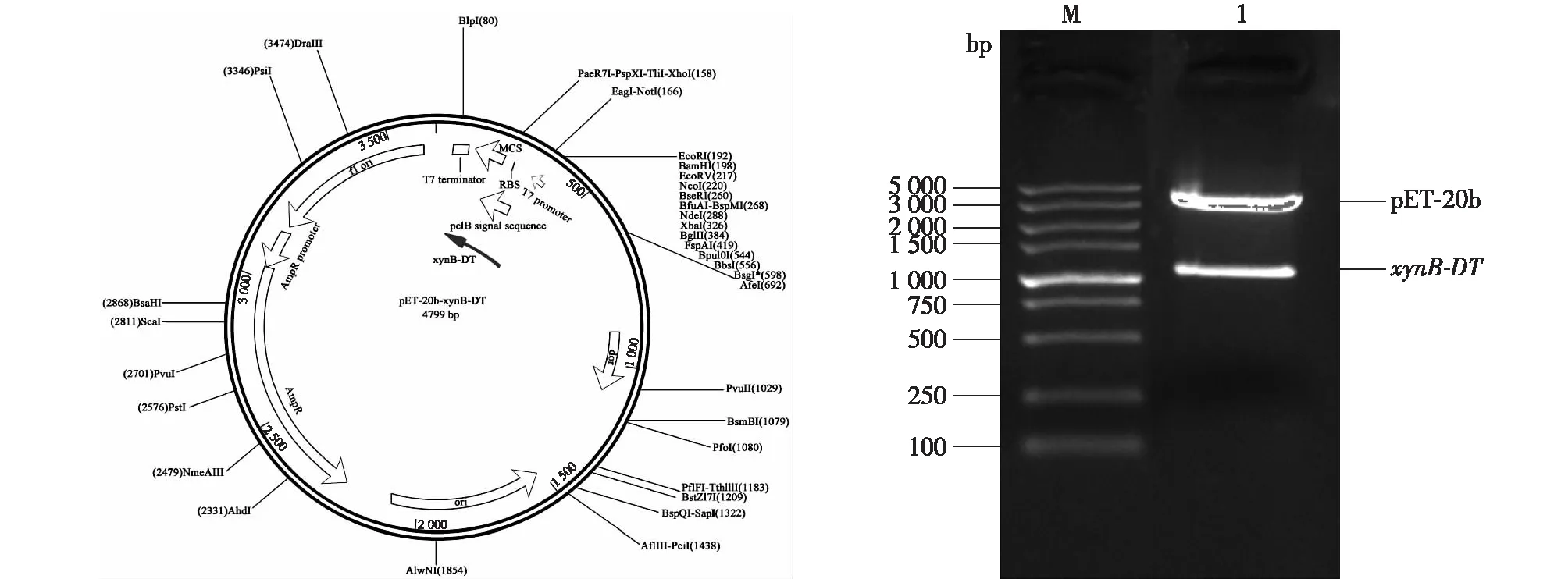
Lane1:DL5000 Marker;Lane2:重组质粒双酶切产物图1 表达载体pET-20b-xynB-DT的构建及双酶切验证图Fig. 1 Construction and double enzyme digestion of expression vector pET-20b-xynB-DT
2.2 重组木聚糖酶表达条件优化
在不同的诱导剂IPTG浓度、诱导时间和诱导温度条件下,测定重组木聚糖酶酶活力,以最高酶活力为100%,结果如图2所示。重组木聚糖酶诱导表达的最佳条件分别为:在32℃条件下,添加0.02 mmol/L的IPTG,诱导6 h后所测木聚糖酶酶活最高,达到30.6 U/mL,表达量在木聚糖酶大肠杆菌表达水平下位居前列[15-16]。

图2 重组木聚糖酶表达条件优化Fig. 2 Condition optimization of expression of recombinant xylanase
2.3 目的蛋白纯化及重组木聚糖酶的酶学性质
诱导6 h后的菌液离心收集,并超声破碎后,经过镍亲和柱纯化得到电泳纯的木聚糖酶XynB-DT(表1)。结果显示,经镍亲和柱纯化后,最终的酶得率为73%。透析除盐后进行SDS-PAGE分析(图3)和木聚糖酶酶学性质测定。SDS-PAGE分析的结果表明,诱导的重组菌具有明显蛋白条带,经85℃热处理后,已有较大部分杂蛋白被去除,说明该细菌木聚糖酶蛋白纯化手段简单。经镍柱纯化后得到一条清晰单一的XynB-DT蛋白条带,且目的蛋白条带在40~55 ku范围内,与理论蛋白分子量接近,由此可知,重组木聚糖酶基因已在大肠杆菌中成功表达。

表1 重组木聚糖酶XynB-DT的纯化
利用纯化后的重组木聚糖酶进行酶学性质分析,结果如图4。以1% Beechwood xylan为底物,在pH 5.0条件下,测定温度60~90℃下的酶活性。由图4a可知,重组木聚糖酶的最适反应温度为85℃,在70~90℃内均能保持80%以上相对酶活力;而由图4b可见,该重组木聚糖酶在60~80℃下 具有较好稳定性,保温120 min后酶活基本未变化。

M:蛋白上样Marker;1:带有空载质粒pET-20b的大肠杆菌;2:细胞破碎后粗酶液;3:85℃热变性60 min蛋白;4:镍柱纯化后蛋白图3 重组木聚糖酶的SDS-PAGE图Fig. 3 The SDS-PAGE of recombinant xylanase
在90℃下保温60 min仍能保持50%以上相对酶活力。在温度85℃下,测定pH 5.0~7.5条件下的酶活性。由图4c可知,该木聚糖酶在pH 5.5~7.0范围内均能维持80%以上活性,当pH高于7.0后,活性下降趋势明显。该重组木聚糖酶在pH 5.0~7.5缓冲液中4℃下放置24 h后,仍能保持90%以上活性(图4c)。
以不同浓度的木聚糖为底物测定重组酶的酶活,采用双倒数法计算该酶的米氏常数Km。1/s为横坐标(底物浓度的倒数),1/v为纵坐标(酶促反应速度的倒数),该直线在x轴上的截距为1/Km值,y轴上的截距为1/Vmax值,结果如图4d所示。重组木聚糖酶的Km和Vmax分别为5.63 mg/mL和1.572 mmol/(L·min-1)。
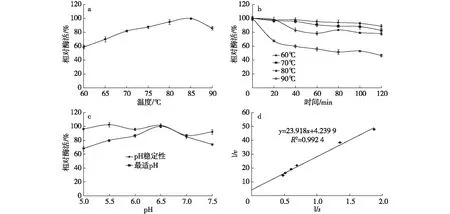
a)最适温度;b)温度稳定性;c)最适pH和pH稳定性;d)反应动力学方程图4 重组木聚糖酶的酶学性质Fig. 4 Enzyme characterization of recombinant xylanase
2.4 玉米芯木聚糖的制备及酶解条件研究
玉米芯中除含有高达35%的木聚糖外,还含有大量纤维素、木质素、脂肪、蛋白质等物质,它们通过共价键、氢键等作用力紧密结合,需通过物理、化学等手段进行预处理,手段一般包括高温蒸煮浸提、酸法提取、碱法提取等[17]。本试验通过碱法提取玉米芯木聚糖,从50 g玉米芯中得到木聚糖提取物10 g。
温度和pH对酶的酶解有较大影响。一定温度范围内,随温度升高,酶-底物中间体分解转化为产物的速度加快。当温度过高则会降低酶的稳定性,使其失活,从而影响酶的反应速率。参考本文木聚糖酶的酶学性质,选取30,40,50,60,70和80℃测定其酶解的最适温度(底物质量浓度为1.25 mg/mL,酶用量为200 U/g,pH为6.5,酶解12 h),结果如图5a所示。温度对酶解率影响较大,最适酶解温度为70℃,当温度过低时不利于酶解反应发生,高于70℃后,酶解率开始下降。最适酶解温度条件下,选取pH为5.0,5.5,6.0,6.5,7.0和7.5测定其酶解的最适pH(底物质量浓度为1.25 mg/mL,酶用量为200 U/g,酶解12 h)。由图5b可知,在pH为5.0~6.5范围内,其酶解率维持在35%以上,而当pH逐渐升高为弱碱性时,其酶解率下降,当pH为6.0时,酶解效率最高。
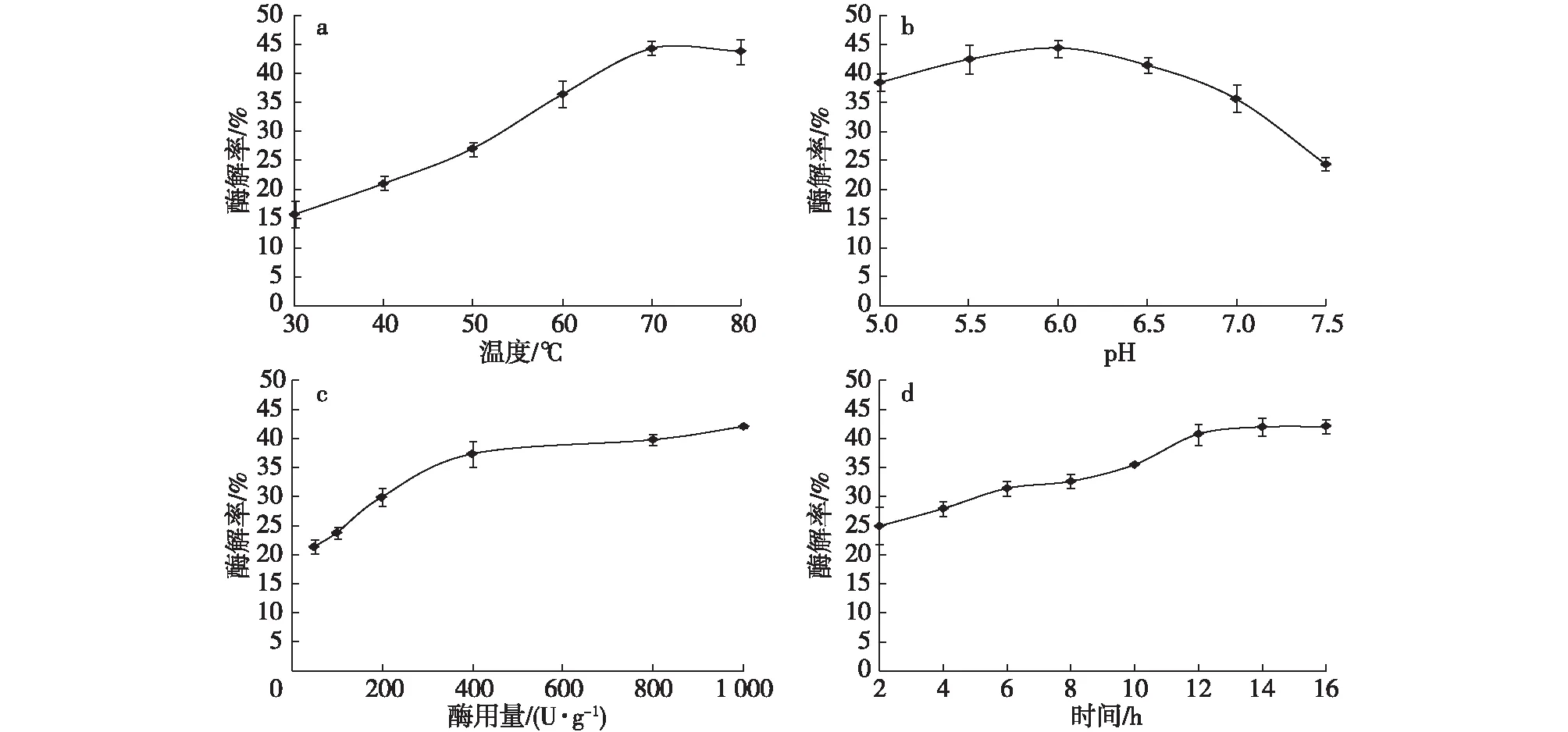
a)最适温度;b)最适pH;c)最适酶用量;d)最适酶解时间图5 重组木聚糖酶酶解玉米芯木聚糖的条件优化Fig. 5 Condition optimization of degradation of corncob xylan by recombinant xylanase
加酶量对酶解率也有显著影响,当加酶量不足时,底物酶解不充分,而加酶量过大则导致生产成本增加,因此应选择合适的加酶量。选取酶用量为50,100,200,400,800和1 000 U/g(底物质量浓度为1.25 mg/mL,温度为70℃,pH为6.0,酶解12 h),结果如图5c所示。随酶用量增加,酶解率逐渐升高,但当酶用量高于400 U/g时,酶解率增加趋势平缓。这可能是因为半纤维素分子与木聚糖酶的结合位点数量有限,当结合位点全部被占据后,过多用量反而增加了酶与底物的无效吸附,从而降低了酶解率。因此,从降低生产成本方面考虑,酶用量选择400 U/g较为合适。
酶解反应时间对酶解效果具有一定影响,酶解时间过短,则底物酶解不充分,但受酶稳定性的限制,在70℃条件下经过一定反应周期后酶逐渐失活,不利于低聚木糖产生,因此应选择合适的酶解时间。当底物质量浓度1.25 mg/mL、温度70℃、pH 6.0和加酶量400 U/g的条件下酶解2,4,6,8,10,12,14 和16 h后分别取样,结果如图5d所示,酶解率随酶解时间的延长而升高,超过12 h后,酶解率变化不大。因此,最佳的反应时间为12 h。
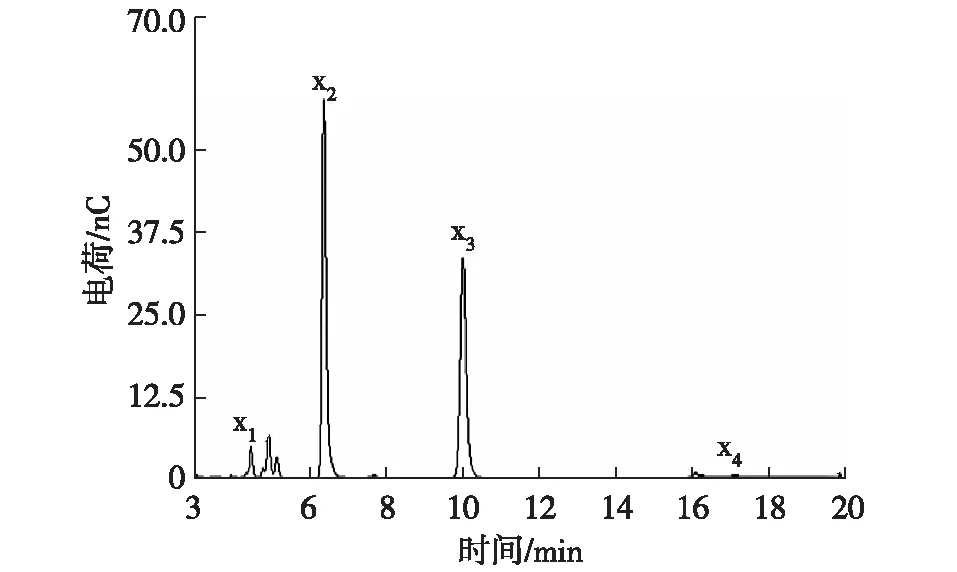
x1:木糖;x2:木二糖;x3:木三糖;x4:木四糖图6 重组木聚糖酶水解玉米芯木聚糖产物的离子色谱分析图Fig. 6 Ion chromatography analysis diagram ofdegradation products of corncob xylan
目前,聚合度在2~4范围内的功能性低聚木糖在食品中应用较为广泛,它们能够促进肠道内有益菌增殖,改善肠道功能,因此作为新一代生物制品具有较大应用潜力[18]。在最适条件下,重组木聚糖酶对玉米芯木聚糖的水解产物用离子色谱进行分析,结果如图6所示。酶解12 h后,酶解产物以低聚木糖为主,其中木二糖和木三糖质量浓度分别达到279.381 5和275.228 4 mg/L,占总糖的90%以上,且只有少量木糖被检出,而在G10族木聚糖酶的酶解产物中木糖含量则偏高[19]。最终的酶解得率为44.3%,与文献报道结果相近[20-21]。本研究中得到的重组木聚糖酶具有较好的热稳定性和pH稳定性,且酶解产物中木糖含量少,说明其在生物转化木质纤维原料生产低聚木糖方面具有较大应用前景。
3 结 论
本研究以来源于D.thermophilumDSM3960的基因组为模板,对木聚糖酶XynB-DT进行克隆、表达研究,结论如下:
1)D.thermophilum来源的木聚糖酶基因全长1 083 bp,共编码361个氨基酸,该基因编码蛋白质属糖苷水解酶G11家族。成功构建大肠杆菌表达质粒pET-20b-xynB-DT,优化其表达条件:32℃条件下,添加0.02 mmol/L的IPTG诱导6 h后产酶量达到30.6 U/mL。
2)经镍亲和柱纯化后得到电泳纯的重组木聚糖酶,该酶的最适反应温度为85℃,最适反应pH为6.5,在pH为5.0~7.5范围内具有较好稳定性,在90℃条件下保温120 min,剩余酶活达50%以上,该酶的Km和Vmax分别为5.63 mg/mL和1.572 mmol/(L·min-1)。
3)利用重组木聚糖酶对玉米芯木聚糖进行酶解,获得最佳酶解条件为:温度70℃,pH 6.0,加酶量400 U/g,酶解12 h。利用HPLC对酶解产物进行分析,产物中含有较多木二糖和木三糖,分别占水解产物总量的49.4%和48.7%。因此,该重组木聚糖酶不但具有优良的酶学性质,且在水解玉米芯木聚糖的产物中以低聚木糖为主,木糖含量少,较利于低聚木糖的纯化,显示了其在制备低聚木糖方面具有较大应用潜力。
本研究可为XynB-DT木聚糖酶工业化生产低聚木糖提供一定的理论基础,促进其工业化应用。
[ 1 ]万红贵, 王涛, 蔡恒, 等. 木聚糖酶的特性及应用研究[J]. 食品与发酵工业, 2008, 34(3):92-95. WAN H G, WANG T, CAI H, et al. Research advances on characteristics and application of xylanases[J]. Food and Fermentation Industries, 2008, 34(3):92-95.[ 2 ]KHANDEPARKER R, NUMAN M T. Bifunctional xylanases and their potential use in biotechnology[J]. Journal of Industrial Microbiology & Biotechnology, 2008, 35(7):635-644.
[ 3 ]JOSELELU J P, COMTAT J, RUEL K. Chemical structure of xylans and their interaction in the plant cell wall[J]. Progress in Biotechnology, 1991, 179(3):356-364.
[ 4 ]孙振涛, 赵祥颖, 刘建军, 等. 微生物木聚糖酶及其应用[J]. 生物技术, 2007, 17(2):93-97. SUN Z T, ZHAO X Y, LIU J J, et al. Microbial xylanases and their industrial applicafions[J]. Biotechnology, 2007, 17(2):93-97.
[ 5 ]陆健, 曹钰, 陈坚, 等. 木聚糖酶的产生、性质和应用[J]. 酿酒, 2001, 28(6):30-34. LU J, CAO Y, CHEN J, et al. Production, properties and applications of xylanase[J]. Liquor Making, 2001, 28(6):30-34.
[ 6 ]KIM J C, SIMMINS P H, MULLAN B P, et al. The digestible energy value of wheat forpigs, with special reference to the post-weaned anaimal[J]. Animal Feed Science and Technology, 2005, 122:257-287.
[ 7 ]BRIENZO M, CARVALHO W, MILAGRES A M. Xylooligosaccharides production from alkali-pretreated sugarcane bagasse using xylanases fromThermoascusaurantiacus[J]. Applied Biochemistry and Biotechnology, 2010, 162(4):1195-1205.
[ 8 ]BEG Q K, KAPOOR M, MAHAJAN L, et al. Microbial xylanases and their industrial applications:a review[J]. Applied Microbiology and Biotechnology, 2001, 56(3-4):326-338.
[ 9 ]COLLINS T, GERDAY C, FELLER G. Xylanases, xylanase families and extremophilic xylanases[J]. FEMS Microbiology Reviews, 2005, 29(1):3-23.
[10]刘亮伟, 秦天苍, 翟继, 等. F10/G11木聚糖酶家族密码子偏好型分析[J]. 河南农业大学学报, 2008, 42(2):223-227. LIU L W, QIN T C, ZHAI J, et al. Analysis on codon bias in F/10 and G/11 xylanase[J]. Journal of Henan Agricultural University, 2008, 42(2):223-227.
[11]SUBRAMANIYAN S, PREMA P. Biotechnology of microbial xylanases:enzymology, molecular biology, and application[J]. Critical Reviews in Biotechnology, 2002, 22(1):33-64.
[12]MILLER G L. USE of dinitrosalicylic acid reagent for of reducing sugar[J]. Analytical Chemistry, 1959, 31(3):426-428.
[13]AUSUBEL F M, KINGSTON R E, SEIDMAN J G, 等. 精编分子生物学实验指南(第四版)[M]. 北京:科学出版社, 2005, 22-24, 26, 55-58. AUSUBEL FM, KINGSTON R E, SEIDMAN J G, et al. Short protocols in molecular biology (4th edition) [M]. Beijing:Science Press, 2005, 22-24, 26, 55-58.
[14]李秀婷, 孙宝国, 宋焕禄, 等. 玉米芯水不溶性木聚糖的碱法提取及酶解分析[J]. 中国食品学报, 2010, 10(5):171-176. LI X T, SUN B G, SONG H L, et al. Studies on alkali extraction of water insoluble xylan from corncobs and enzymolysis analysis[J]. Journal of Chinese Institute of Food Science and Technology, 2010, 10(5):171-176.
[15]向亚萍, 罗楚平, 周华飞, 等. 枯草芽孢杆菌分泌表达极耐热木聚糖酶及其酶学性质[J]. 江苏农业学报, 2016, 32(5):1037-1042. XIANG Y P, LUO C P, ZHOU H F, et al. Expression of xylanse B gene ofThermotogamaritimainBacillussubtilisand the properties of recombinase[J]. Jiangsu Journal of Agricultural Sciences, 2016, 32(5):1037-1042.
[16]陈鲜, 郭颖, 胡胜伟, 等. 嗜热木聚糖酶基因在毕赤酵母中的表达及其酶学性质[J]. 基因组学与应用生物学, 2016, 35(11):3060-3068. CHEN X, GUO Y, HU S W, et al. Expression of a thermophilic xylanase gene inPichiapastorisand its enzymatic properties[J]. Genomics and Applied Biology, 2016, 35(11):3060-3068.
[17]杨瑞金, 许时婴, 王璋. 凝胶过滤色谱法研究酶法生产低聚木糖过程中木聚糖分子结构的变化[J]. 中国粮油学报, 2002, 17(4):48-51. YANG R J, XU S Y, WANG Z. The changes in the structure of xylan during the enzymatic production of xylooligosaccharides with gel filtration chromatography[J]. Journal of the Chinese Cereals and Oils Association, 2002, 17(4):48-51.
[18]OTIENO D O, AHRING B K. The potential for oligosaccharide production from the hemicellulose fraction of biomasses through pretreatment processes:xylooligosaccharides (XOS), arabinooligosaccharides (AOS), and mannooligosaccharides (MOS)[J]. Carbohydrate Research, 2012, 360(1):84-92.
[19]BERRIN J G, JUGE N. Factors affecting xylanase functionality in the degradation of arabinoxylans[J]. Biotechnology Letters, 2008, 30(7):1139-1150.
[20]欧阳嘉, 刘明, 李鑫, 等. 重组木聚糖酶生产低聚木糖的实验研究[J]. 林产化学与工业, 2011, 31(2):37-42. OUYANG J, LIU M, LI X, et al. Experimental investigation of xylooligosaccharides production by recombinant xylanase[J]. Chemistry and Industry of Forest Products, 2011, 31(2):37-42.
[21]杨然, 朱培华, 姚君, 等. 重组木聚糖酶酶解玉米芯制备低聚木糖[J]. 食品与发酵工业, 2015, 41(4):115-120. YANG R, ZHU P H, YAO J, et al. Experimental investigation of xylooligosaccharides production from corn cob by recombinant xylanase[J]. Food and Fermentation Industries, 2015, 41(4):115-120.
Cloning and expression of a thermophile GH11 xylanase gene andits application in xylooligosaccharide production
LI Qi, CHEN Mingzhen, ZHAO Linguo*
(CollegeofChemicalEngineering,NanjingForestryUniversity;JiangsuKeyLaboratoryofBiomassBasedGreenFuelsandChemicals,Nanjing210037,China)
The GH11 endo-1, 4-xylanase gene,xynB-DTfromDictyoglomusthermophilumDSM3960 was cloned and expressed inEscherichiacoli. The full-length gene contained 1 083 bp, which encoded 361 amino acids. The recombinant plasmid pET-20b-xynB-DTwas reconstructed and expressed in theE.coliBL21 successfully. In addition, the pure protein was obtained by Ni-NTA affinity column, and the molecular weight of protein was approximately 40 ku. The activity of recombinant xylanase was 30.6 U/mL in LB medium by IPTG induction. The properties of XynB-DT were analyzed and the results showed that the optimum temperature of this recombinant enzyme was 85℃, and the relative enzyme activity was higher than 90% under 60℃ in 120 min and more than 50% under 90℃ in 120 min. Correspondingly, the optimum pH was 6.5, and it preserved enzyme activity lower than 90% in the range of 5.0-7.5 for pH. TheKmandVmaxfor beechwood xylan was 5.63 mg/mL and 1.572 mmol/(L·min-1), respectively. Then, taking the corncobs xylan as the substrate, this study was focused on the hydrolyzing conditions and the hydrolysis products identified by ion chromatography, and the results showed that after 12 h, under 70℃, pH 6.0 with the enzyme dosage of 400 U/g, the final hydrolysis yield was 44.3%. As the major hydrolytic products, xylobiose and xylotriose were excised from corncob xylan by XynB-DT and only a little of amount of xylose was detected during the hydrolysis. All the results made XynB-DT be attractive for potential application in xylooligosaccharides production.
D.thermophilum; xylanase; gene cloning; hydrolysis
2016-10-28
2017-02-09
江苏省高校自然科学研究重大项目(13KJA220004);江苏省“333高层次人才培养工程”专项资助项目 (BRA2015317);江苏省“六大人才高峰”资助项目(2014-JY-011);江苏省优势学科建设工程资助项目(PAPD)。
李琦,女,实验师,研究方向为微生物发酵及酶工程。通信作者:赵林果,男,教授。E-mail:lgzhao@njfu.edu.cn
Q819
A
2096-1359(2017)04-0063-07

