甲状旁腺激素(1-34)对骨质疏松性腰椎退变性疾病TLIF术后的影响
付宏伟 陈晓华 马海召 尚春香
1.青海省第五人民医院骨科,青海 西宁,810007 2.青海省第五人民医院肿瘤内科,青海 西宁,810007
骨质疏松性腰椎退变性疾病是脊柱外科的常见病、多发病,是由于腰椎间盘和关节突关节的关节软骨及其周围韧带退行性改变导致腰腿痛等临床表现的一系列疾病的总称,可导致腰椎不稳定、腰骶部疼痛向下肢放射、马尾神经损伤、跛行等,严重影响患者的生活质量[1]。此类疾患通常首选保守治疗,但对于保守治疗失败及部分重症病例,手术治疗是缓解症状的必要手段[2]。经椎间孔椎管减压椎间植骨融合术(transforaminal lumbar interbody fusion,TLIF)治疗退变性腰椎疾病应用越来越普遍,其早期的临床疗效满意率得到国内外学者的认可[3, 4]。由于骨质疏松基础疾病的影响不仅增加了手术难度,也会影响手术疗效,如何加强固定强度,加速骨组织融合速度对手术结果及后期的功能有着重大作用。甲状旁腺激素(1-34)可以促进骨形成、提高骨密度、降低骨折风险,对促进骨质疏松性骨折的愈合有着独特的作用和优势[5, 6],但其能否提高骨质疏松腰椎退变性疾病患者椎间融合率,研究较少。本研究旨在前瞻性比较TLIF术后使用和未使用PTH的疗效差异,以明确PTH对伴骨质疏松腰椎退变性疾病患者行TLIF 的影响。报告如下。
1 资料和方法
1.1 患者选择标准及分组
2013年1月-2015年10月,共49例患者符合选择标准纳入研究。根据术后是否使用PTH分为试验组(24例)和对照组(25例)。纳入标准:①腰椎管狭窄症、腰椎滑脱症或巨大腰椎间盘突出症患者;②经正规保守治疗 3~6 个月,症状缓解不明显,影响正常生活;③接受TLIF;④年龄>60岁,经双能X线骨扫描检查符合原发性骨质疏松诊断;⑤术前未正规使用抗骨质疏松药物治疗,且术后未使用促进骨折愈合药物者。排除标准:①伴糖尿病、营养不良者;②继发性骨质疏松患者;③合并其他腰椎疾患,如椎间盘炎、肿瘤等;④行双节段及以上固定融合手术患者。所有患者均签治疗同意书。
1.2 一般资料
试验组:男9例,女15例;年龄 60~80岁,平均 67.5岁。巨大腰椎间盘突出症10例,腰椎管狭窄症8例,腰椎滑脱症(均为Meyerding Ⅱ度及以下滑脱)6例。 病程 10~22个月,平均 13个月。病变节段:L344例,L460例,L5S115例。有吸烟史6例;合并高血压8例。对照组:男8例,女17例;年龄 61~82岁,平均69.1岁。巨大腰椎间盘突出症 11例,腰椎管狭窄症9例,腰椎滑脱症(均为 Meyerding Ⅱ度及以下滑脱)5例。病程9~20个月,平均14个月。病变节段:L348例,L4L512例,L5S112例。有吸烟史7例;合并高血压 9 例。两组患者临床表现均为单侧或双侧下肢麻木、疼痛或间歇性跛行。术前患者均行腰椎 X 线片、CT 及MRI 检查,结果均符合腰椎退变性疾病改变。两组患者性别、年龄、病变类型、病变节段、病程比较,差异均无统计学意义(P>0.05),具有可比性。
1.3 手术方法
手术均由同一组医生完成。全麻成功后,取俯卧位,取后正中纵直切口,C 臂机透视以确定病变节段,向两侧分离椎旁肌暴露至关节突外缘,定位并置入椎弓根螺钉,再次透视确定螺钉位置满意,切断病变间隙的棘上韧带和棘间韧带,咬除上位椎体的双侧椎板。根据病变范围咬除增厚的黄韧带及增生的关节突内侧缘,扩大患侧侧隐窝,行神经根管减压,松解神经根,保护好硬膜囊、神经根,切开后方纤维环,去除椎间盘组织,将椎间前方 1/3 终板去皮质,后方 2/3 骨性终板保留以提供足够支撑力。冲洗椎间隙,安装连接棒并适度纵向撑开,填入预留的椎板碎骨,将大小合适并填充好碎骨的 Cage 置入椎间隙,适度纵向加压,使 Cage 与上下椎体终板紧密接触,再次透视检查内固定物位置及腰椎生理弧度满意后,安放横向连接棒。冲洗伤口,放置负压引流管 1 根,缝合切口。
1.4 术后处理
两组术后常规预防性应用抗生素1~3 d。所有患者术后均口服补充元素钙500 mg/天和维生素D 200U/天(凯思立D,上海安盛药业公司);术后第 24~48 h 拔除引流管,术后1周佩戴腰围下床活动,腰围保护时间为3个月。术后 6 个月内避免过度弯腰负重。试验组术后开始每天皮下注射PTH 1-34 20 μg(特立帕肽,美国礼来公司),注射部位在左下腹、右下腹或者大腿外侧;连续使用6个月。
1.5 观察指标
1.5.1疗效比较:分别在药物治疗前后6个月对两组患者进行视觉模拟疼痛评分(VAS)及 Oswestry 功能障碍指数评分(ODI)评定。VAS 评分标准:0~10 分代表不同程度的疼痛,其中0分为无痛,1~2 分为疼痛轻微,3~4分为疼痛尚能忍受,5~9分为疼痛难忍受,10分为剧烈疼痛。ODI评分标准[7]:分别评价腰痛、生活自理能力、提物、行走、坐、站立、睡眠、性生活、社会活动、旅行等10项功能,每项0~5分,0分为无障碍,5分为完全障碍。最终记分=实际得分/50 ×100。
1.5.2骨密度:美国生产 LUNAR双能 X 线吸收骨密度仪测量治疗前及治疗后6个月各组患者腰椎1-4 (L1-4)、股骨颈、股骨大转子及全髋BMD。
1.5.3骨代谢指标:在药物治疗前后6个月检测两组患者骨代谢指标骨转换指标骨碱性磷酸酶骨人交联碱性磷酸酶(BALP),I型胶原N末端肽/肌酐(I型胶原N-端肽,肌酸酐,NTX / Cr);BALP测定采用酶免疫法(ELX800,Immunodiagnostic Systems Ltd); NTX / Cr测定采用酶联免疫吸附法(ELX800,Wampolelaboraties)。
1.5.4融合情况:术后6月复查腰椎正侧位及动力位X光片,必要时行腰椎CT观察椎体间植骨融合情况。根据改良 Brantigan 评分标准[8]评价椎间融合情况。
1.6 统计学方法
采用SPSS 19.0 统计软件进行数据分析,计量资料以均数±标准差(χ±s)表示,采用方差和t检验;计数资料用%表示,采用χ2检验;P<0.05 为差异有统计学意义。
2 结果
2.1 疗效评分
两组患者治疗前VAS及ODI 评分比较,差异无统计学意义(P>0.05)。TLIF手术结合药物治疗6个月,两组患者 VAS及ODI评分均较治疗前有所改善(P<0.05),且实验组评分均低于对照组同期(P<0.05),这表明TLIF手术结合PTH可以明显改善腰椎退变性疾病伴骨质疏松症腰部VAS及ODI评分,见表1。


组别人数腰部 VAS 评分ODI评分术前术后6个月术前术后6个月实验组245.3 ±2.32.6±1.1∗#23.9±10.77.8±5.5∗#对照组255.2 ±2.13.3±1.4∗24.1±10.99.6±5.6∗
注:与本组治疗前后比较,*P<0.05;与对照组同期比较,#P<0.05。
Note: Within group comparison before and after treatment,*P<0.05; compared with the control group at the same time point,#P<0.05.
2.2 骨密度改变
两组患者治疗前骨密度比较,差异无统计学意义(P>0.05)。TLIF手术结合药物治疗6个月,实验组患者骨密度较治疗前明显提高P<0.05),且明显高于同期对照组(P<0.05)。而对照组与治疗前比较无明显变化(P>0.05)。见表2。

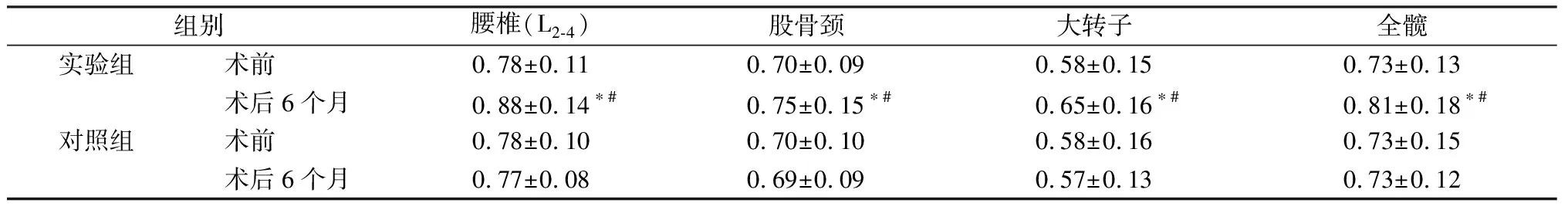
组别腰椎(L2-4)股骨颈大转子全髋实验组术前0.78±0.110.70±0.090.58±0.150.73±0.13术后6个月0.88±0.14∗#0.75±0.15∗#0.65±0.16∗#0.81±0.18∗#对照组术前0.78±0.100.70±0.100.58±0.160.73±0.15术后6个月0.77±0.080.69±0.090.57±0.130.73±0.12
注:与本组治疗前后比较,*P<0.05;与对照组同期比较,#P<0.05。
Note: Within group comparison before and after treatment,*P<0.05; compared with the control group at the same time point,#P<0.05.
2.3 代谢指标改变
两组患者治疗前血清BALP和NTX水平比较,差异无统计学意义(P>0.05),药物治疗6个月,观察组血清 BALP和NTX水平较术前明显上升(P<0.05),且明显高于同期对照组(P<0.05)。而对照组与术前比较无明显变化(P>0.05)。见表3。
2.4 融合情况
根据改良Brantigan 评分标准,术后6个月试验组椎间融合率为79.16%(19/24),对照组为 44.00%(11/25),两组融合率比较差异有统计学意义(χ2=4.93,P=0.003)。


组别例数治疗前治疗后ρ(BALP)/(μg/ L)NTX/Cr(nmol/LBEC)ρ(BALP)/(μg/ L)NTX/Cr(nmol/LBEC)实验组2418.78±10.5467.43±51.2230.89±16.99∗#98.33±61.22∗#对照组2517.89±10.8768.14±49.9917.87±10.9865.33±41.12
注:与本组治疗前后比较,*P<0.05;与对照组同期比较,#P<0.05。
Note: Within group comparison before and after treatment,*P<0.05; compared with the control group at the same time point,#P<0.05.
3 讨论
本研究选取49例老年骨质疏松性腰椎退变性疾病患者作为研究对象,所有患者都予以TLIF治疗;对照组术后补充钙片及维生素D,治疗组在对照组的基础上加用PTH,通过6个疗程的治疗,观察两组患者VAS评分、ODI评分、骨密度、骨代谢指标BALP和NTX的改变以及椎间融合情况。结果表明PTH对老年腰椎退变性疾病合并骨质疏松症患者安全有效,可以明显降低术后患者VAS和ODI评分,增加腰部及髋部骨密度,促进成骨活性,增加椎间融合率。这些结果表明老年骨质疏松性腰椎退变性疾病患者TLIF术后使用PTH治疗安全有效,是一种合适的提高术后椎间融合率,改善患者预后的方法。
脊柱融合术可以增加腰椎的稳定性,避免医源性不稳的发生。手术方法也可归纳为彻底减压、滑脱椎体复位和椎体植骨融合,均能够延展脊柱前柱,增大前凸,复位滑脱,矫正脊柱轴向和冠状面畸形,解除临床症状[9]。目前普遍接受的观点是对于腰椎退变性疾病使用内固定器械以提高融合率,但是任何内固定物都是暂时的,植骨融合才是长久解决的途径。椎间融合是一个复杂、连续的骨愈合过程,涉及多种细胞和活性因子。影响椎间融合的因素包括局部力学稳定性、骨质量、营养状况和全身性疾病等[10, 11]。骨质疏松可导致椎体对螺钉的把持力下降,从而出现内固定物松动和移位,局部力学稳定性降低;骨质疏松患者融合骨质量也会降低[12]。充分的术前准备,术中彻底减压、复位及术后加速植骨融合对患者预后有着重大意义。
近年来, 间歇应用甲状旁腺素对骨骼的合成作用引起关注, 且其与其他抗骨质疏松药物的联合治疗可达到较好效果。PTH作为治疗骨质疏松症的合成药物,对骨代谢具有正向调节作用,能刺激成骨细胞骨形成,促进骨骼的矿化。在降低骨折风险,提高骨密度和骨质量方面有肯定疗效。国内目前治疗骨质疏松症的药物主要有双膦酸盐、降钙素、雌激素、雌激素受体调节剂、骨化三醇等, 虽有一定疗效, 但由于治疗方法注重于抑制骨吸收, 对改善骨质量的疗效较差。动物和临床试验结果[13-15]证明, 小剂量间歇注射PTH可刺激成骨细胞形成新骨, 促进皮质骨形成, 且可改善骨的微结构, 增加骨力学强度, 从而降低骨折风险。研究表明PTH不仅介导成骨细胞合成代谢,而且还可以刺激成骨细胞分泌白介素-1(IL-1)和白介素-6(IL-6)等因子,活化破骨细胞,从而沟通成骨-破骨细胞之间联系。PTH不同于以往的骨吸收抑制剂,是基于骨重建和骨塑建的骨形成,增加骨量,改善骨结构。PTH不仅可以增加骨小梁和骨皮质的厚度及骨的机械强度,还能增加绝经后骨质疏松症妇女腰椎面积骨密度,升高骨转换指标。
本研究中使用PTH联合TLIF治疗老年骨质疏松性腰椎退变性疾病患者,效果明显优于单纯TLIF手术治疗的对照组患者。我们发现实验组患者的VAS评分、ODI评分在同一时期明显优于对照组,可能原因有几点:①PTH联合电磁场可以加速骨组织的愈合,因此椎间融合率较高;同时增加局部的骨量,使患者疼痛明显减轻,因此VAS评分、ODI评分中疼痛项得到改善;②疼痛得到改善后,患者活动增加,进一步影响ODI评分,同时活动会改善患者骨质疏松情况,也会影响到VAS评分;③PTH对骨质疏松本身的治疗,也会影响到VAS评分、ODI评分。因此,实验组各项指标明显优于对照组,同时,骨密度增加对预防再次骨折有积极的作用。
当然,本研究也有其不足之处,首先,患者数量较少,其随访时间较短,适当的增加样本量及延长随访时间很有必要;其次,我们这项研究只在一家医院实行,研究的内容较局限;最后,药物及患者医嘱执行情况有着重要的影响,具体结果的可行性需要进一步证实。但是总的来说PTH对老年骨质疏松性腰椎退变性疾病TLIF术后是一种切实可行的方法,提高融合率安全有效,值得临床推广。

