原发性骨质疏松症患者与对照人群血清骨钙素水平比较的Meta分析
刘仲宇 叶瑜 戎利民*
1.中山大学附属第三医院脊柱外科, 广东 广州 510630 2.中山大学孙逸仙纪念医院院长办公室,广东 广州 510120
骨质疏松症(osteoporosis, OP),是一种以骨量低下,骨微结构破坏,导致骨脆性增加,易发生骨折为特征的全身性骨病[1]。绝经后女性和中老年男性原发性OP的发病机制不同。绝经后OP(postmenopausal osteoporosis,PMO)为高骨转换状态[2,3],即骨吸收和骨形成均明显增强,且骨吸收要强于骨形成[4]。而中老年男性原发性OP的发病机制以及骨转换状态尚无明确报道。骨钙素(osteocalcin, OC)是骨基质中含量最为丰富的非胶原蛋白分子,主要由成熟成骨细胞分泌[5]。血清骨钙素(serum osteocalcin, sOC)是一种常用的骨转换标记物(bone turnover markers,BTMs),多用来反映成骨细胞活性和骨形成能力[6-9]。作为一种骨质疏松症的辅助诊断指标,sOC已被列入骨质疏松症的诊断指南[10,11]。虽然sOC被广泛用于OP的辅助诊断,但是对于原发性骨质疏松症患者sOC水平的变化情况,既往的临床观察结论不一致。仅有一篇相关的Meta分析报道,但研究同时纳入了继发性OP病例,且未将不同性别的人群分开比较[12]。因此,国内外尚缺乏对原发性OP患者sOC水平的高质量系统评价。本研究通过Meta分析的方法比较不同性别原发性OP患者与对照人群之间sOC水平的差异,从而评价sOC对于原发性OP的辅助诊断价值,为其临床应用提供高质量的证据支持。
1 材料和方法
1.1 检索策略
检索Cochrane临床对照试验中心数据库(CENTRAL)、PubMed和CNKI,从建库之日起至2016年12月31日,不限语种。手工检索筛选文献的参考文献,尽量向相关作者索取原始数据。英文检索词为:“biomarkers,turnover,osteocalcin,osteoporosis”。中文检索词为:“骨转换,骨钙素,骨质疏松”。
1.2 纳入与排除标准
1.2.1纳入标准:1、病例组由经双能X线吸收法(Dual-energy X-ray absorptiometry, DXA)参照1994年世界卫生组织推荐的诊断标准[13]确诊的原发性OP患者组成(注:有些文献中OP诊断标准为T≤-2S,可以考虑纳入,如果放宽OP诊断标准sOC有显著差异,说明严格OP诊断标准后sOC亦有显著差异);2、对照组由与病例组同龄(绝经状态相同)同性别的正常人组成;3、不同性别分开比较;4、以sOC为测量评价指标。
1.2.2排除标准:1、继发性OP患者;2、男性年龄<40岁(排除特发性骨质疏松症病例),或非绝经后女性;3、合并有其他代谢疾病或服用药物可影响sOC水平者。
两位文献研究评估员独立搜索和审阅文献,严格按照本次系统评价的纳入和排除标准筛选文献。对于有分歧的数据通过讨论或由第三位研究者判断和仲裁。
1.3 纳入研究的偏倚风险评价
病例对照研究的偏倚风险评价参考纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)[14]。
1.4 数据提取
提取内容包括:作者、研究地区、发表时间,OC试剂盒生产商及目标片段,抽血状态,研究对象性别、年龄,sOC水平以及文献质量评分。
1.5 统计分析
使用RevMan 5.0.24软件进行Meta分析。首先利用卡方(χ2)检验评估各项纳入研究结果间的异质性,如果异质性检验结果为P>0.10(或I2≤50%),认为纳入研究有同质性,使用固定效应模型进行Meta分析。当异质性检验结果为P≤0.10(或I2>50%)时,则认为纳入研究间存在异质性,使用随机效应模型进行Meta分析。P<0.05时认为组间差异有统计学意义。Meta分析结果用95%置信区间(confidence interval,CI)和P值[95%CI,P]表示。
OC完整分子(intact molecule)在血液内不稳定,易分解为N端中段大分子(N-terminal midfragment,N-MID)等不同片段[15],不同试剂盒所检测的目标OC分子片段可能不同。因此,研究针对不同OC分子片段进行了亚组分析。
2 研究结果
2.1 文献检索结果
通过数据库检索和人工搜索,共检索到有关文献3188篇。按照事先制定的纳入和排除标准进行筛选(图1),最终共纳入32篇文献,其中绝经后女性22项研究包括2906人,成年男性13项研究包括1338人(32篇文献中有3篇文献同时涉及女性研究及男性研究)。
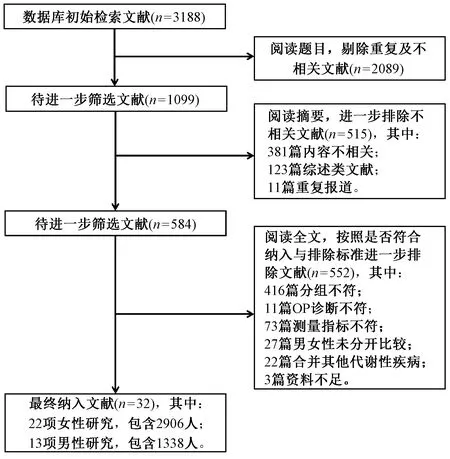
图1 文献筛选流程及结果Fig.1 Flowchart of study selection
2.2 纳入研究的数据提取及质量评价
纳入研究的基本特征见表1。纳入研究包括中文和英文研究,涉及世界各地多个国家和人种,其中女性研究较多。试剂盒测量的sOC成分主要包括OC完整分子和N-MID片段,多数研究明确报道了抽血情况为清晨空腹抽血。全部纳入研究中的病例组与对照组年龄均无显著性差异。对纳入研究进行质量评分,女性全部22项研究最高分9分(满分),最低分5分,平均分7.6分;男性全部13项研究,最高分9分,最低分5分,平均分7.0分。
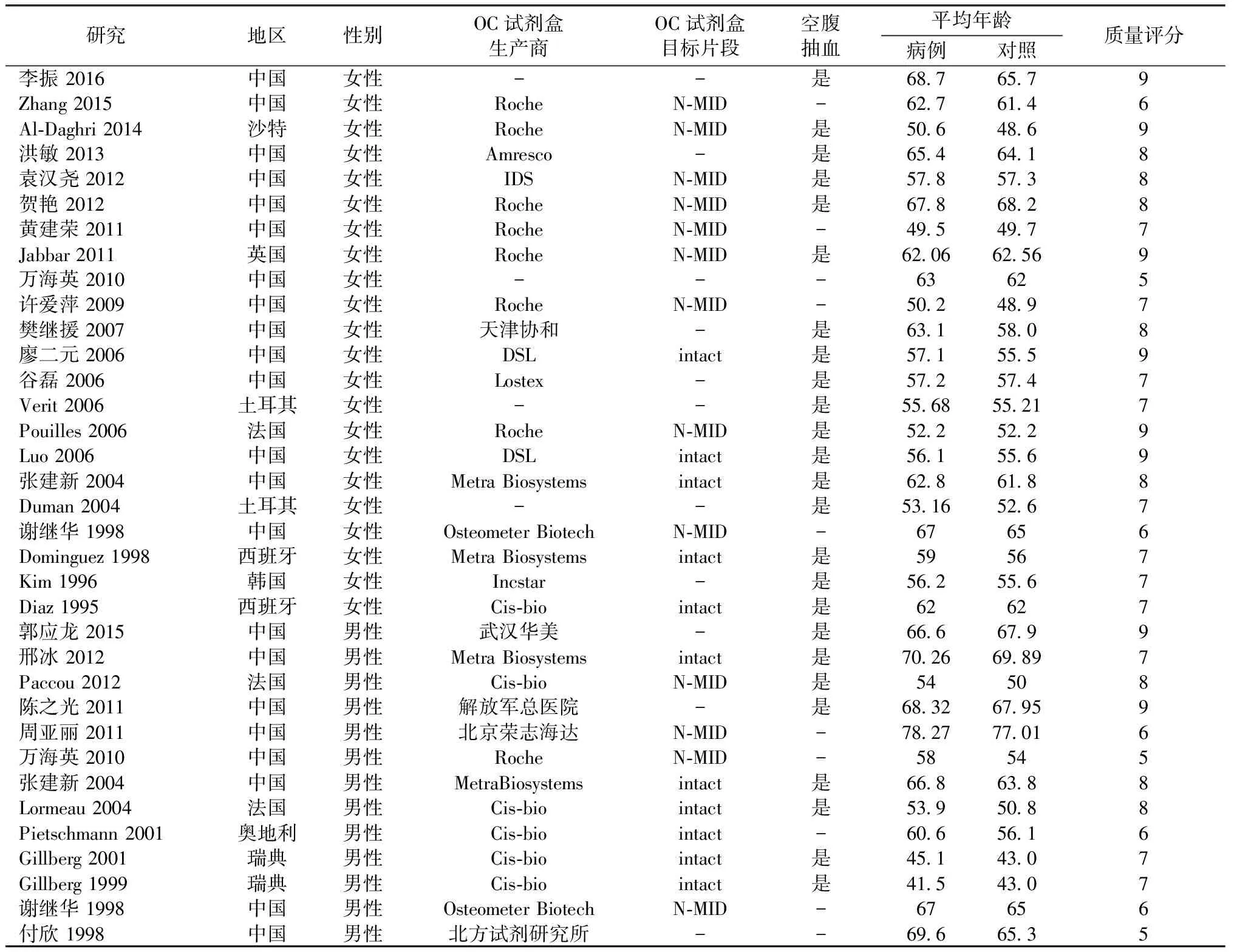
表1 纳入研究的基本特征Table 1 Basic information of the included studies
注:“OC”表示骨钙素,“N-MID”表示骨钙素N端中段大分子;“intact”表示骨钙素完整分子;“-”表示未报告。
2.3 统计分析结果
分别分析女性22项和男性13项研究,异质性检验提示各研究结局指标之间均存在异质性,故均采用随机效应模型进行分析。
女性研究Meta分析:PMO组总sOC水平显著高于对照组[95%CI(1.59,5.84),P=0.0006](图2)。亚组分析提示PMO组sOC完整分子水平显著高于对照组[95%CI(0.58,4.17),P=0.010],N-MID分子较对照组亦有升高趋势[95%CI(-0.22,13.54),P=0.06](图3)。综上,PMO患者sOC水平高于同龄正常的绝经后女性。

图2 绝经后骨质疏松症病例与对照人群血清骨钙素水平对比的森林图Fig.2 Forest plot for sOC level comparison between PMO patients and controls

图3 根据不同血清骨钙素分子成分的亚组分析(女性)Fig.3 Subgroup analysis according to different sOC fragments in females

图4 男性原发性骨质疏松症病例与对照人群血清骨钙素水平对比的森林图Fig.4 Forest plot for sOC level comparison between males with primary OP and controls
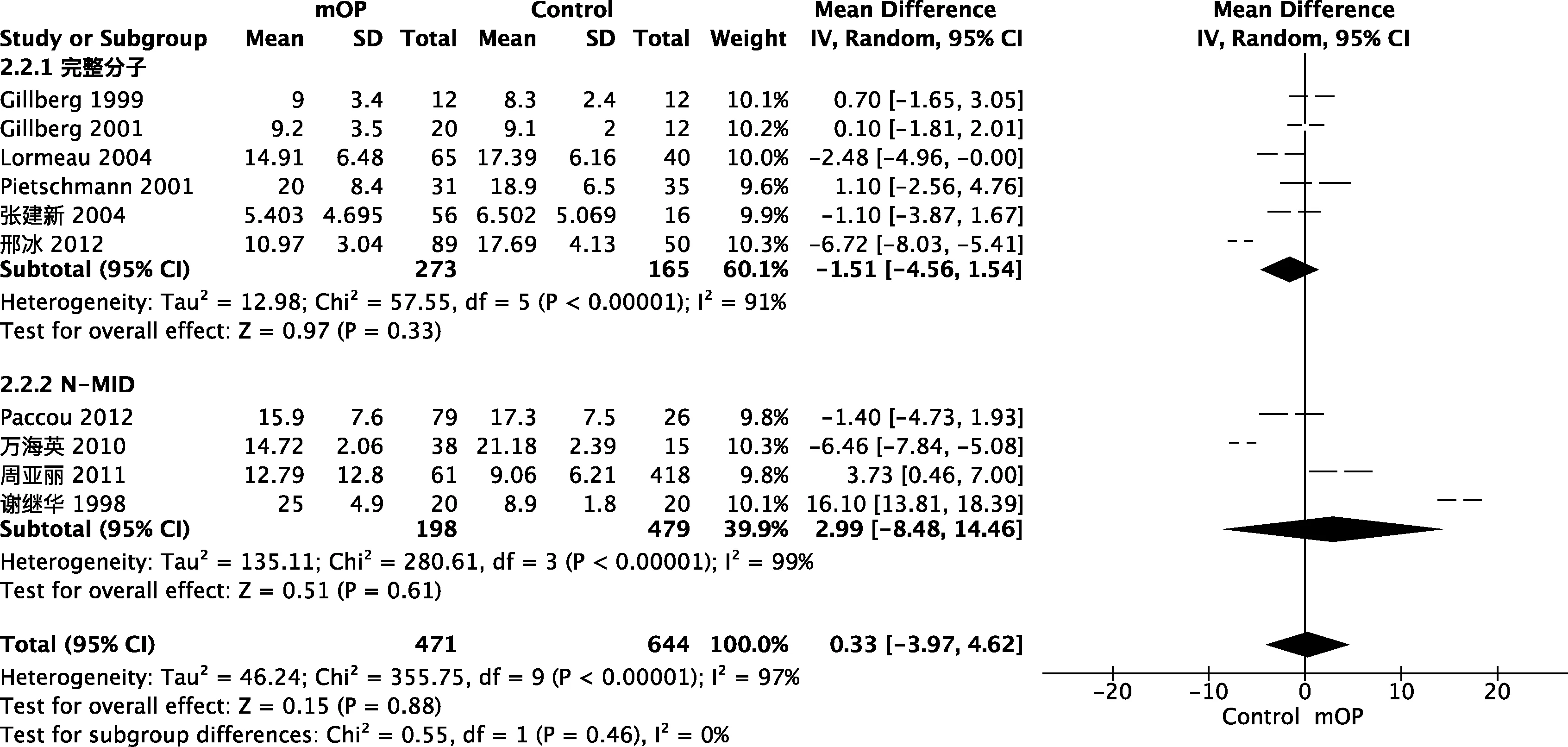
图5 根据不同血清骨钙素分子成分的亚组分析(男性)Fig.5 Subgroup analysis according to different sOC fragments in males
男性研究Meta分析:男性OP组与对照组总sOC水平无显著性差异[95%CI(-2.31,3.98),P=0.60](图4)。亚组分析提示男性OP组与对照组sOC完整分子[95%CI(-4.56,1.54),P=0.33]及N-MID分子[95%CI(-8.48,14.46),P=0.61]水平均无显著性差异(图5)。所以,综合分析男性原发性OP患者sOC水平与同龄正常男性无显著差异。
2.4 敏感性分析
通过剔除可疑研究或改变分析模型的方法对本研究进行敏感性分析,对结果均未产生影响,提示研究的敏感性低,结果较为稳健和可靠。
3 讨论
目前,在骨代谢状态的检测方面,相比于DXA等传统方法,BTMs因为取样检测方便、对患者创伤小、无辐射、灵敏度高及实时性好等诸多优点越来越受到临床及科研工作者的重视与青睐[16]。作为OP重要的辅助诊断指标之一,sOC用于检测骨代谢的敏感性和特异性均较其他BTMs有特殊优势[17],其在OP患者体内的变化趋势对于临床实践和科学研究均具有重要的参考价值。Meta分析是循证医学重要的研究方法和最佳证据的重要来源。高质量Meta分析是目前级别最高的临床证据之一,被各类临床诊疗指南广泛应用[18]。本研究首次报道利用Meta分析的方法明确sOC在不同性别原发性OP患者与正常对照之间的关系。纳入标准严格,纳入文献质量较高,结果较为可信。
PMO骨代谢类型为高转换型,骨形成功能和骨吸收功能均较同龄正常绝经后女性更为活跃。本研究发现PMO患者sOC水平较对照人群升高,与PMO骨转换率升高相符[19],亚组分析提示,分析结果基本不受sOC分子类型的影响,说明sOC用来指示PMO骨代谢状态较为可靠。然而,对于sOC水平在男性OP中的变化情况,不同研究之间结果分歧明显。本文纳入的13项男性研究结果异质性较大,有4项研究指出sOC水平在男性OP中较对照组降低,另有4项研究发现sOC水平在男性OP中升高,其余5项研究指出sOC水平在两组间无显著差异。综合分析与亚组分析结果均提示OP组与对照组sOC水平无显著差异,说明不同研究结果之间的异质性并非来源于不同的sOC分子片段。研究结果之间分歧明显的一个重要原因可能是男性原发性OP骨形成与骨吸收状态本身存在较大的异质性,即男性原发性OP的病理生理机制并不均一[20]。目前男性OP研究较少,其病理生理机制尚不明确[21],据本研究结论推断,男性原发性OP可能存在不同亚型,呈现不同的骨转换状态。因此,sOC在男性OP患者中的测量结果可能差别很大,使用时需要慎重解释,必要时需与其他诊断方法联合使用。
目前对于sOC的检测仍缺乏统一标准,这也是纳入研究之间异质性的另一重要来源,给本研究结果带来了不利影响。同时,受研究类型、样本量等因素的影响,本研究的证据质量仍不及高质量随机对照试验(randomized controlled trial,RCT)的Meta分析,研究结论仍需要更多高质量的临床试验加以补充和进一步验证。

