进行性核上性眼肌麻痹(附1例报道)
郭树晨 李承晏
进行性核上性眼肌麻痹(附1例报道)
郭树晨 李承晏
目的 报道1例少见的进行性核上性眼肌麻痹(progressive supranuclear palsy, PSP)治疗可能有效的患者。方法 回顾性分析1例临床拟诊为PSP患者的诊断及治疗,并复习文献。结果 患者临床表现为认知功能障碍、运动障碍、垂直性眼肌麻痹、饮水呛咳;颅脑MRI示额颞叶皮质明显萎缩、轴位显示中脑“牵牛花征”、矢状位显示中脑被盖部“蜂鸟征”。给予大剂量美多芭、珂丹、辅酶Q10等治疗后患者症状明显好转。结论 大剂量的美多芭(0.75 g/d)、珂丹(0.3 g/d)可能改善PSP患者的临床症状,但应结合患者的实际情况,注意其相关的不良反应,本例患者对大剂量的美多芭、珂丹耐受性较好,未出现不良反应。
核上性眼肌麻痹 进行性 临床表现 诊断 治疗
进行性核上性眼肌麻痹(progressive supranuclear palsy PSP)是一种由Tau蛋白病变引起的散发性神经退行性疾病,其患病率约5~6.5/10万[1],从出现症状到死亡的平均时间为7年[1]。典型的临床表现为垂直性凝视麻痹、姿势不稳定、容易向后摔倒、皮层下痴呆、构音障碍及吞咽困难、帕金森样症状。本研究结合文献对1例PSP患者的临床资料进行分析总结,现报道如下。
1 临床资料
患者,男,65岁, 2012年12月无明显诱因出现记忆力下降,主要表现为记不住刚放的东西在什么地方、言语减少、经常一个人发呆,遂至医院就诊,诊断为“老年痴呆”给予安理申(具体用量不详)口服治疗,症状未见明显缓解。2013年下半年开始出现抬头困难、走路前倾、坐下后不能站立、经常向后摔倒,但生活尚能自理。2014年5月患者认知障碍加重,完全不能言语,走路向后摔倒的次数增多,同时左下肢开始抖动,2014年8月再到某医院就诊,诊断为“老年痴呆”给予森福罗、尼麦角林、欧来宁胶囊治疗,症状未见好转。11月再次至某医院就诊,诊断为“老年痴呆、帕金森氏综合征”,停用森福罗,给予美多芭0.125 g Tid治疗,患者症状无明显改善,但也未加重。2015年2月出现饮水呛咳, 3月完全不能行走,一直在医院行康复治疗,为求进一步治疗,门诊以“认知障碍原因待查”收入本科。既往有胃溃疡、高脂血症及肾结石病史,2015年2月因吸入性肺炎住院治疗,2015年因摔倒形成硬膜下血肿,未给予特殊治疗。家族中无类似疾病。查体:神志清楚、不语,查体欠合作,认知力、计算力、记忆力明显下降,无法用MMSE或MOCA量表测量。双侧瞳孔等大等圆,直径约3 mm,光反射灵敏,眼球上视不能,辐辏反射消失,未见明显眼震,双侧鼻唇沟等称,伸舌不配合,咽反射消失,双上肢肌力为4级,双下肢肌力为4级,躯干及左下肢肌张力增高,左下肢不自主抖动,无肌肉萎缩,左侧腱反射活跃,双侧Babinskin征阳性,脑膜刺激征阴性。深浅复合感觉不配合,心肺腹未见明显异常。辅助检查:血常规、贫血五项、甲状腺功能、凝血功能未见明显异常,生化及电解质示尿酸663 umol/L(149~407),甘油三酯3.55 mmol/L(0.56~1.7),葡萄糖6.56 mmol/L(3.5~6.1),糖化血红蛋白7.1%(3.5~6.5),餐后2 h血糖13.96 mmol/L。四肢肌电图示双下肢周围神经损害(感觉受累为主)。颅脑MRI示双侧额颞叶皮质明显萎缩,轴位中脑萎缩呈“牵牛花征”,第三、四脑室和中脑环池扩大,壳核和基底节T2加权像高信号;正中矢状位中脑被盖部萎缩呈“蜂鸟征”(图1~4);颅脑SWAN示双侧黑质信号强度、大小等称。入院后给予大剂量的美多芭(0.75 g/d)、珂丹(0.3 g/d)、辅酶Q10等治疗后患者行走状态较前明显好转,精神状态也明显好转,说话较前明显增多。
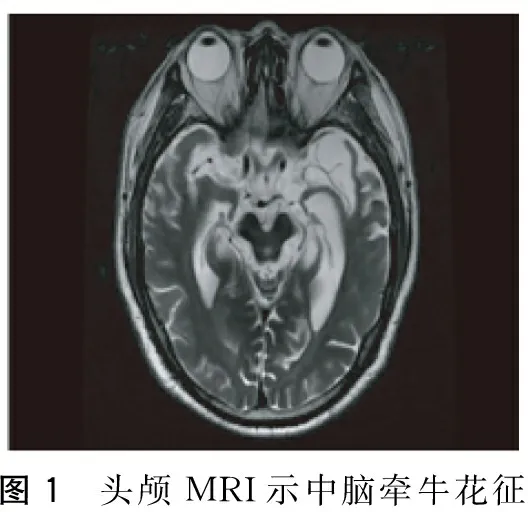
图1 头颅MRI示中脑牵牛花征

图2 头颅MRI示蜂鸟征
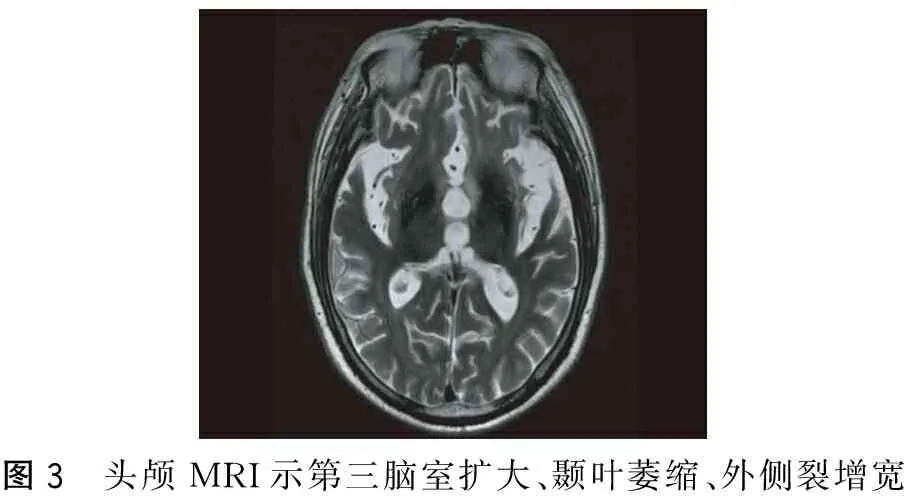
图3 头颅MRI示第三脑室扩大、颞叶萎缩、外侧裂增宽
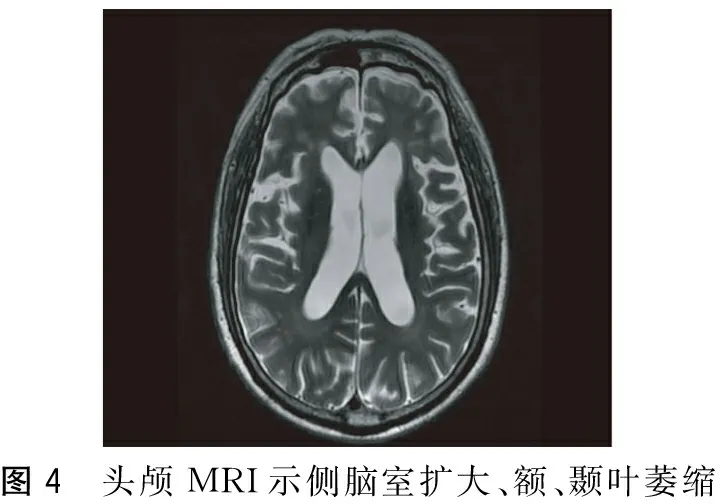
图4 头颅MRI示侧脑室扩大、额、颞叶萎缩
2 讨 论
PSP是一种散发的、成年起病的以Tau蛋白病变为病理特征的运动障碍性疾病,起病隐袭,呈进行性加重。此患者发病年龄为65岁、病情逐渐进展、有垂直性眼肌麻痹同时在疾病的第1年出现姿势不稳定经常摔倒,符合1996年美国国立神经系统疾病与脑卒中研究所(NINDS)与进行性核上性麻痹学会(SPSP)联合推荐并于2003年予以修订的PSP诊断标准[2-3]中拟诊PSP的入选标准,即40或40岁以后发病、病情逐渐进展、垂直性向上或向下核上性凝视麻痹。本例患者疾病的首发症状为认知障碍,表现为淡漠、言语减少,在疾病的第2年出现构音障碍,在病程的第3年出现饮水呛咳,符合NINDS-PSP诊断标准中拟诊PSP的支持标准中的早期出现吞咽困难和构音障碍、早期出现认知障碍如淡漠、抽象思维能力减弱、言语不流畅。本例患者从未有脑炎病史、无异己肢体综合征的表现、在疾病的过程中未出现过明显的小脑症状、无自主神经功能失调(明显低血压和排尿障碍)、无基底核和脑干梗死等脑部结构损害的神经放射学依据,符合NINDS-PSP诊断标准中拟诊PSP的排除标准。颅脑MRI中轴位T2加权像上中脑萎缩呈“牵牛花征”、矢状位T1加权像上呈“蜂鸟征”对预测PSP患者的病理有高度的特异性[4]。本例患者MRI有明显的“牵牛花征”、“蜂鸟征”及三、四脑室和中脑环池扩大征。患者多次血糖监测及糖化血红蛋白检查提示糖尿病,可解释其肌电图表现,PSP可伴有锥体束征,可解释患者双侧Babinskin征阳性体征。因此,结合其诊断的必备条件、支持条件及排除标准、特征性的影像学表现,本例患者拟诊为PSP。
PSP的临床症状多变,基于Tau蛋白病理学上分布的不同主要有以下几种表型[5],即(1)PSP的Richard综合征(PSP-RS) 临床特征:垂直性核上性眼肌麻痹、严重的姿势不稳定早期易摔倒、假性球麻痹、轴性肌强直、对称性的、左旋多巴抵抗性运动不能及认知障碍,也可出现复视、畏光及眼睑运动不能等其他的非典型的眼睛体征。PSP-RS早期最常出现的是姿势不稳定伴摔倒,大部分患者在疾病的第1年出现。假性球麻痹特征包括吞咽困难和构音障碍,是PSP的支持性诊断。PSP-RS有一系列典型的认知障碍,额叶功能障碍尤其是行为和性格的改变,在PSP-RS中始终可见,并且可能在疾病的早期出现。淡漠比去抑制更常见,执行功能障碍、语言流利性减低在PSP-RS额叶障碍的患者中也很常见;(2)以帕金森氏综合征为主要表现的PSP(PSP-P):主要表现为运动迟缓及非对称性锥体外系强直及疾病早期阶段应用左旋多巴有效,震颤、摔倒及眼睛运动障碍经常出现在疾病的晚期甚至从不出现。疾病的早期很少出现认知障碍,一些患者早期可出现吞咽困难和构音障碍。其他还包括单纯性运动不能伴步态冻结(PSP-PAGF)、皮质基底节综合征型PSP(PSP-CBS)、主要表现为说话或/和语言功能障碍的PSP(PSP-AOS和PSP-PNFA)、以小脑性共济失调为主要表现的PSP(PSP-C)、以原发性脊髓侧索硬化为主要表现的PSP(PSP-PLS)等7种类型。根据以上分型,此患者较符合“PSP-RS”。由于PSP的临床表现各异,同时缺乏特异性检查手段,临床需与额颞叶痴呆、帕金森病、多系统萎缩等相鉴别。本例患者最初误诊为“老年痴呆”后被误诊为“帕金森病”。
PSP目前无特效治疗。多巴胺替代治疗只能暂时轻度缓解一些症状,有时会获得一些益处[6],值得进行尝试性治疗。本例患者在给予大剂量的美多芭、珂丹治疗后患者症状明显缓解。本例大剂量美多芭、珂丹治疗有效的可能原因如下:帕金森病患者运用多巴胺药物有效是通过增加基底神经节的神经输出,减弱来自丘脑-苍白球的GABA抑制,而PSP患者基底神经节黑质、苍白球、尾状核、壳核、丘脑底核严重广泛受损,因此对于常规剂量外源性的多巴胺药物作用有限,但大剂量的美多芭、珂丹可能能够进一步增加基底神经节的输出,从而改善患者的临床症状。因此,PSP在目前无特效治疗的情况下可以根据患者的耐受情况,联合应用大剂量的美多芭、珂丹,但是要注意其大剂量联合应用的不良反应,主要包括异常的不随意运动、意识模糊、失眠及罕见的恶心、呕吐或心律失常、体位性低血压。
[1] Koros C,Stamelou M. Interventions in progressive supranuclear palsy[J]. Parkinsonism Relate Disord,2016,22(Suppl 1):S93-S95.
[2] Litvan I,Agid Y,Calne D,et al.Clinical research criteria for the diagnosis of progressive supranuclear palsy (Steele-Richardson-Olszewski syndrome): report of the NINDS-SPSP international workshop[J].Neurology,1996,47(1):1-9.
[3] LitwanI,Hauw JJ,BartkoJJ,et al.Validity and reliability of the neuropathologic preliminary criteria for progressive supranuclear palsy and related disorders[J].Neuropathol Exp Neurol,1996,55(1):97-105.
[4] Massey LA,Micallef C,Paviour DC,et al.Conventional magnetic resonance imaging in confirmed progressive supranuclear palsy and multiple system atrophy[J].Mov Disord,2012,27(14):1754-1762.
[5] Respondek G,H glinger GU. The phenotypic spectrum of progressive supranuclear palsy[J].Parkinsonism Relat Disord, 2016, 22(Suppl 1):S34-S36.
[6] Rehman HU.Progressive supranuclear palsy[J].Postgrad Med J,2000,76(8):333-336.
(2016-07-19收稿)
430060 武汉大学人民医院神经内科[郭树晨 李承晏(通讯作者)]
R742
A
1007-0478(2017)03-0246-03
10.3969/j.issn.1007-0478.2017.03.020

