血清CEA、NSE、CYFRA21-1在肺癌脑转移患者中的变化及其临床意义
赵雪莲 赵宏刚
血清CEA、NSE、CYFRA21-1在肺癌脑转移患者中的变化及其临床意义
赵雪莲 赵宏刚
目的 探讨血清癌胚抗原(cancer embryo antigen, CEA)、神经元烯醇化酶(neuron specific enolase, NSE)和细胞角蛋白19片段(cytokeratin-19-fragment, CYFRA21-1)水平在肺癌脑转移患者中的变化及其临床意义。方法 随机选取2016年1月~2016年7月在本院进行肺癌脑转移手术治疗的患者112例为试验组,健康患者120例为对照组,全部肺癌脑转移患者于手术前、手术后第7 d分别于空腹状态采静脉血1次,对照组也采静脉血,测定血清CEA、NSE、CYFRA21-1水平。结果 (1)年龄、性别、身体质量指数(Body Mass Index, BMI)、美国麻醉医师学会(American Society of Anesthesioloists, ASA)分级和淋巴结转移(tumor lymph nodes metastasis, TNM)在试验组与对照组之间无明显差异(P>0.05),符合试验要求;(2)试验组血清的CEA、NSE和CYFRA21-1水平高于对照组(P<0.05);(3)手术后血清的CEA、NSE和CYFRA21-1水平均低于手术前(P<0.05)。结论 肺癌脑转移患者手术后血清的CEA、NSE和CYFRA21-1水平显著降低,CEA、NSE和CYFRA21-1水平的变化可能对肺癌脑转移患者的治疗、预后判断具有一定的价值。
癌胚抗原 神经元烯醇化酶 细胞角蛋白19片段 肺癌脑转移
肺癌脑转移是严重威胁人们生命健康的恶性肿瘤之一,肺癌脑转移血清学肿瘤标志物的研究对肺癌脑转移的早期发现以及合理选择治疗方案方面有着重要作用[1-3]。目前,应用单克隆抗体寻找和发现肺癌脑转移新的标志物是肺癌脑转移研究的重要课题之一,也是非侵入性诊断肺癌脑转移的重要途径。有研究发现,癌胚抗原(CEA)、神经元烯醇化酶(NSE)和细胞角蛋白19片段(CYFRA21-1)是肺癌脑转移的可靠标志物,血清CEA、NSE和CYFRA21-1水平高低反映疾病所处的临床阶段[4-6]。本研究对血清CEA、NSE、CYFRA21-1水平在肺癌脑转移患者中的变化及其临床意义进行探讨。
1 资料与方法
1.1 一般资料
随机选取2016年1月~2016年7月在本院进行肺癌脑转移手术治疗的患者112例为试验组,男女比例为74/38,平均年龄(46.7±3.4)岁,身体质量指数(Body Mass Index, BMI)(20.05±1.24)kg/m2,ASA[5]分级Ⅰ或Ⅱ级,TNM[6]分期Ⅰ或Ⅱ期非小细胞型肺癌脑转移(non-small cell lung cancer, NSCLC)。另选取在本院进行健康体检的健康患者120例为对照组,男女比例64/56,平均年龄(47.1±4.7)岁,身体质量指数(Body Mass Index, BMI)(20.01±1.13)kg/m2。
1.1.1 纳入标准
试验组患者经诊断确定为肺癌脑转移患者,对照组患者排除肿瘤,无支气管哮喘、急慢性肺炎等其他肺部疾病。
1.1.2 排除标准
经确诊为肺癌脑转移,并伴有其他心脑血管等疾病的患者。
1.2 检测指标
全部肺癌脑转移患者于手术前、手术后第7 d分别于空腹状态采静脉血1次,对照组也采静脉血,用仪器COBAS6000对分离血清测定CEA、NSE和CYFRA21-1水平,所有指标检测均重复3次,取平均值。试剂和校准品等均购置于罗氏诊断产品(上海)有限公司。
1.3 统计学处理
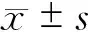
2 结 果
2.1 患者基本资料比较
2组患者基本资料比较显示,年龄、性别、BMI、ASA分级和TNM分期在试验组与对照组之间无明显差异(P>0.05),符合试验要求(表1)。

表1 2组患者基本资料比较)
2.2 2组血清CEA、NSE和CYFRA21-1水平比较
2组血清CEA、NSE和CYFRA21-1水平比较显示,试验组血清的CEA、NSE和CYFRA21-1水平高于对照组(P<0.05)(表2)。

表2 2组血清中CEA、NSE和CYFRA21-1水平比较,ng/mL)
注:与对照组比较,*P<0.05
2.3 试验组手术前、后血清CEA、NSE和CYFRA21-1水平比较
试验组手术前、后血清CEA、NSE和CYFRA21-1水平比较显示,手术后血清的CEA、NSE和CYFRA21-1水平均低于手术前(P<0.05)(表3)。

表3 手术前、后血清CEA、NSE和CYFRA21-1水平比较,ng/mL)
注:与对照组比较,*P<0.05
3 讨 论
大多数的肺癌脑转移都是在支气管上皮粘膜细胞中产生,所以在分化组织分型中多少能够根据原有的组织学形态进行判断[7]。在基底细胞进行修复工作的时候存在分化的潜力,通常分化时含有神经分泌颗粒,常见的形状为鳞状化,能够释放很多种激素导致神经内分泌癌的发生,像是小细胞癌、不典型类癌以及类癌[8-10]。因为在一开始的时候肺癌脑转移在临床上没有什么症状,往往在发现的时候80%以上已经是晚期肺癌脑转移,无法做到根本的治疗,这也是肺癌脑转移病死率较高的主要原因[11]。如果能在早期的时候发现肺癌脑转移,那么生存的时间有60%超过5年,早期发现肺癌脑转移能够延长患者的生命时间[12]。导致肺癌脑转移无法在早期被发现主要是因为没有有效的方法能够对高危人群进行早期的诊断。当下有自动荧光支气管镜、血清肿瘤标志物、影像学诊断等的早期诊断,较为理想的肿瘤标志物要具备高特异性、对肿瘤的高敏感性和准确率,并且在治疗的过程中能够起到监测治疗效果以及转移复发等情况[13]。
CEA属于可溶性的结构较为复杂的糖蛋白,胚胎期有明显升高,分子质量大约为180000,常见的良性疾病CEA水平少于10 ng/mL[14]。最早大家都以为胃肠癌是CEA主要升高的原因,但是在之后的研究中肺癌脑转移、乳腺癌和胰腺癌等患者中的水平也明显增高,CEA水平在肺癌脑转移中升高的变化可能跟细胞癌变的时候某些染色体发生了阻抑之后再次在癌组织中被激活之后跟癌基因形成CEA,导致血液中的水平增加[15]。以前的研究报道指出肺癌脑转移的类型和CEA的表达监测有一定的关系,其中在腺癌中的阳性率比较高,但是CEA小细胞癌以及鳞癌中也有高表达[16]。起初利用CEA作为临床诊断依据的时候是肺癌脑转移,尤其是非小细胞肺癌脑转移,能够通过CEA的水平判断肿瘤的大小以及是否发生转移以及转移部位和恢复的情况,临床上根据CEA的水平对肺癌脑转移的不同阶段进行判断,并且在程黎明研究中也发现,肺腺癌的诊断过程中CEA的辅助判断作用较大,不仅跟分期进展的程度有关,还跟肿瘤以及淋巴转移部位有关系。本研究中试验组血清的CEA水平高于对照组(P<0.05)。证实血清CEA水平测定对于肺癌脑转移的辅助诊断、病理分型、预后估计都具有重要价值。
NSE是在甘油分解过程中起到催化作用的酶,组成它有αα、ββ、γγ、αγ、βγ5种同工酶,α、β、γ三种亚基是其原料,神经元、上皮细胞、神经内分泌组织肿瘤的同工酶为γ亚基形成,在细胞系的分型中NSE属于脱梭基化,SCLC在生物学上与APUD相似,具有相似的同工酶,能够产生多种激素、活性肽等,所以NSE也能够由SCLC产生[17]。NSE是一种起到辅助酵解作用的烯醇化酶的异构体,与其同工酶是存在神经内分泌组织和神经元中,在发生神经性分泌细胞肿瘤的时候能够分泌出比正常情况下多3~34倍的NSE,神经性内分泌肿瘤小细胞肺癌脑转移在支气管肺癌脑转移中的占比为22%~31%,NSE的高表达使得其被作为重要的肿瘤标志物,在其他的很多研究报道中均有显示[18]。本研究结果显示,试验组血清的NSE水平高于对照组(P<0.05),提示NSE是观察疗效、预测复发和判断病情的有用血清学指标。
CYFRA21-1属于相对分子质量为40~68×103的蛋白,存在于恶性肿瘤上皮细胞蛋白的中间丝,因为细胞溶解或者癌细胞凋亡会释放其到血液中去,所以它也是一种肿瘤标志物,鳞癌属于上皮细胞肿瘤,具有较快的生长速度,会产生大量坏死的癌细胞,所以被释放的CYFRA21-1就会进入血液中然后被监测到[19-21]。CYFRA21-1属于酸性多肽,存在于细胞角蛋白19片段,简称为CK19,它主要存在于单层的上皮细胞,通常情况下是一种寡聚物形式,相对分子质量为40×103,只有在细胞发生癌变的时候才会掉落到血液中,临床上研究CK19对于在肿瘤发展过程中起到的作用已有十多年,是具有灵敏性及特异性比较高的鳞癌标志物[22]。本研究结果显示,试验组血清的CYFRA21-1水平高于对照组(P<0.05)。对非小细胞肺癌脑转移特别是肺鳞癌的诊断、鉴别诊断、病情监测和疗效判断都有很大的临床应用价值。血清的肿瘤标志物能够判断不同类型的肺癌脑转移以及监测发展过程。本研究结果显示,手术后血清的CEA、NSE和CYFRA21-1水平均低于手术前(P<0.05)。这表明这些指标能够被联合起来进行检测并动态观察对于治疗的帮助作用较大。
4 结 论
肺癌脑转移患者手术后血清的CEA、NSE和CYFRA21-1水平显著降低,CEA、NSE和CYFRA21-1水平的变化可能对肺癌脑转移患者的治疗、预后判断具有一定的价值。
[1] Hallamaa M,Huhtinen K,Suvitie P,et al.Serum concentrations of HE4 change little during in vitro fertilization[J].Acta Obstet Gynecol Scand,2014,93(7):640-646.
[2] Sawosz E,Jaworski S,Kutwin M,et al.Toxicity of pristine graphene in experiments in a chicken embryo model[J].Int J Nanomedicine,2014,9(1):3913-3922.
[3] Kolitz-Domb M,Corem-Salkmon E,Grinberg I,et al.Synthesis and characterization of bioactive conjugated near-infrared fluorescent proteinoid-poly(L-lactic acid) hollow nanoparticles for optical detection of colon cancer[J].Int J Nanomedicine,2014,9(3):5041-5053.
[4] Arnaboldi F,Menon A,Menegola E,et al.Sperm protein 17 is an oncofetal antigen: a lesson from a murine model[J].Int Rev Immunol,2014,33(5):367-374.
[5] Li PT,Liao CJ,Yu LC,et al.Localization of B4GALNT2 and its role in mouse embryo attachment[J].Fertil Steril,2012,97(5):1206-12.e1.
[6] Gerhart J,Hayes C,Scheinfeld V,et al.Myo/Nog cells in normal, wounded and tumor-bearing skin[J].Exp Dermatol,2012,21(6):466-468.
[7] Lee JH,Chang JH.Diagnostic utility of serum and pleural fluid carcinoembryonic antigen, neuron-specific enolase, and cytokeratin 19 fragments in patients with effusions from primary lung cancer[J].Chest,2005,128(4):2298-2303.
[8] Wiener CD,Molina ML,Passos M,et al.Neuron-specific enolase levels in drug-na ve young adults with major depressive disorder[J].Neurosci Lett,2016,620(1):93-96.
[9] Anderson BJ,Reilly JP,Shashaty MG,et al.Admission plasma levels of the neuronal injury marker neuron-specific enolase are associated with mortality and delirium in sepsis[J].J Crit Care,2016,36(1):18-23.
[10]Raco A,Cervoni L,Salvati M.Two distinct intracranial tumors of different cell types in a single patient. Case report and review of the literature[J].Neurosurg Rev,1994,17(4):305-308.
[11]Sachsenheimer W,Piotrowski W,Bimmler T.Quality of Life in patients with intracranial tumors on the basis of Karnofsky's performance status[J].J Neurooncol,1992,13(2):177-181.
[12]Kageji T,Nakagawa Y,Kitamura K,et al.Pharmacokinetics and Boron uptake of BSH (Na2B12H11SH) in patients with intracranial tumors[J].J Neurooncol,1997,33(1/2):117-130.
[13]Counsell CE,Grant R.Incidence studies of primary and secondary intracranial tumors: a systematic review of their methodology and results[J].J Neurooncol,1998,37(3):241-250.
[14]Rotteveel JJ,Colon EJ,Hombergen G,et al.The application of evoked potentials in the diagnosis and follow-up of children with intracranial tumors[J].Childs Nerv Syst,1985,1(3):172-178.
[15]Cassart M,Bosson N,Garel C,et al.Fetal intracranial tumors: a review of 27 cases[J].Eur Radiol,2008,18(10):2060-2066.
[16]Guzel A,Er U,Tatli M,et al.Serum neuron-specific enolase as a predictor of short-term outcome and its correlation with Glasgow Coma Scale in traumatic brain injury[J].Neurosurg Rev,2008,31(4):439-444; discussion 444-5.
[17]Proshchina AE,Savelyev SV,Barabanov VM,et al.Immunoreactivity of Neuron-Specific enolase (NSE) in human pancreas in health and type 1[J].Bull Exp Biol Med,2010,149(6):763-767.
[18]Maroulio T,Zoma M,Devetzi M,et al.Kallikrein-related peptidas 6(KLK6)gene expression in intracranial tumors[J].Tumor Biology,2012,19(1):335-342.
[19]Alturki A,Gagnon B,Petrecca K,et al.Patterns of care at end of Life for People with primary intracranial tumors: lessons learned[J].J Neurooncol,2014,117(1):103-115.
[20]Dorta-Contreras AJ,Tab o-Vald s E,Tab o-Vald s A,et al.Non increased neuron-specific enolase concentration in cerebrospinal fluid during first febrile seizures and a year follow-up in pediatric patients[J].Arq Neuropsiquiatr,1998,56(3B):540-544.
[21]Hang ZQ,Zheng MF,Huang JH. Detection and diagnostic value of serum carcinoembryonic antigen and cytokeratin 19 fragment in lung cancer patients [J].zhonghua zhongliu zazhi,2012,15(1):3311-3322.
[22]Zhang D,Wang L,Yang Z.Recurrent syncope associated with lung cancer[J].Case Rep Med,2015(3):309784.
(2016-09-15收稿)
721001 陕西省宝鸡市中医院检验科
R734.2
A
1007-0478(2017)03-0243-04
10.3969/j.issn.1007-0478.2017.03.019

