DB11/T828.3-2011中12号染色体标记筛选及适用性评价研究
魏 杰,王 洪,于鹏丽,岳秉飞
(中国食品药品检定研究院,北京 100050)
DB11/T828.3-2011中12号染色体标记筛选及适用性评价研究
魏 杰,王 洪,于鹏丽,岳秉飞*
(中国食品药品检定研究院,北京 100050)
目的 对北京小型猪遗传质量控制地方标准DB11/T828.3-2011中空缺的12号染色体标记进行筛选,并通过比较不同标记对同种群的遗传评价对地标的适用性进行分析。方法 结合文献报道,选取12号染色体上的4对微卫星标记,利用2个中国农大小型猪群体进行筛选;选取高度多态的12号染色体标记合并标准方法的18对染色体标记,形成全染色体法,通过不同方法对同批次群体的遗传质量评价进行比较分析。所得结果均使用Popgen32软件处理分析。结果 筛选到的4对12号染色体标记PIC值均大于0.5,为高度多态;现行标准在染色体覆盖率、扩增稳定性、结果评价三项指标结果分别为94.7%、96.0%、农大I系不合格而农大III系合格,增加12号染色体后评价的三项指标的结果分别为100%、96.6%和两群体均合格。结论 本研究筛选的4对12号染色体标记具有高度多态性,为完善DB11/T828.3-2011提供数据支撑。
DB11/T828.3-2011;12号染色体;多态性;适用性;遗传质量
实验用小型猪由于体型小、易饲育、生理解剖与人高度相似等特性,其研发与应用已受到广泛关注[1-3]。特别是随着器官移植与人源化研究的不断深入,小型猪资源更成为了人类健康的希望之光[4,5]。
我国小型猪资源丰富。长期以来,人们对不同品种品系小型猪在种资资源、遗传结构、生物学特性及应用进行了相关研究,但对资源的标准化尤其是遗传质量标准化研究尚在起步[6]。实验动物的遗传质量对医学生物学研究的准确性、重复性及科学性有着至关重要的影响,而遗传质量监测又是评价和保证动物资源质量的必要措施。基于此,北京地区在2011年出台了实验用小型猪遗传质量控制地方标准(北京市地方标准公告2011年标字第7号,总第109号),并在2012年正式实施[7]。
在标准的研究过程中,研究样本来自广西巴马小型猪、贵州小型猪、藏香猪和长春“军牧1号”;而作为北京地标,对于北京地区的小型猪遗传质量监测是否适用尚有待研究[6,8]。2013年,中国食品药品检定研究院应用DB11/T828.3-2011号标准对房山小型猪群体进行检测时,发现了该地标中存在着12号染色体标记缺失等问题,而因此导致的对遗传概貌反映不够全面,是否影响遗传质量评价也未可知[8]。为此,本研究利用北京地区两个农大小型猪群体进行12号染色体微卫星标记筛选,并通过筛选到的高度多态位点与原标准中的25对微卫星标记形成全染色体标记法,比较其与标准方法在质量评价中的应用,为地标的不断完善和小型猪的标准化进程提供技术资料。
1 材料和方法
1.1 样本
按照DB11/T828.3-2011的要求,取封闭繁育4代以上、不同窝别的农大I系和农大III系小型猪样本,每品系15头,雌7头雄8头。样品由北京市琉璃河科兴实验动物养殖中心提供【SCXK(京)2012-0005】。
1.2 样本DNA的制备[8]
用改良酚-氯仿抽提法从血样中提取基因组DNA,1%琼脂糖凝胶电泳鉴定,并用紫外分光光度计测定DNA的浓度及纯度,-20℃冻存备用。
1.3 引物[7]
本研究所用25对引物均按照北京市地方标准对封闭群实验用小型猪的规定,序列详见DB11/T828.3-2011附录B。12号染色体的4对引物标记S1060、SW168、SW467、SW2494,序列详见美国农业部官网数据库(http://www.marc.usda.gov/genome)。所有引物均由北京擎科新业生物技术有限公司合成。
1.4 主要试剂仪器、PCR扩增程序及结果处理均同已发文献[9]
1.5 结果评价
12号染色体标记筛选中,当标记的平均多态信息含量(polymorphism information content,PIC)大于0.25,即中度多态,可作为备选标记与原标准方法形成新的全染色体标记检测法。否则需要重新筛选,直到筛选到中度多态以上的标记。
DB11/T828.3-2011中的25对微卫星标记为标准方法。利用标准方法和全染色体标记法共同评价相同群体,通过两者在遗传质量评价中的差异比较分析标准方法的适用性。其中,对群体遗传质量的评价,仍参照平均杂合度及卡方检验指标[7]。即当平均杂合度在0.5 ~ 0.7,且期望杂合度与观测杂合度经卡方检验无明显差异,可判定为为合格的封闭群实验用小型猪群体,否则判为不合格。
2 结果
2.1 12号染色体微卫星标记的筛选
利用农大I系、农大III系小型猪群体的DNA进行标记筛选,通过等位基因频率计算PIC数据。结果显示,4对标记均有PIC>0.25。结果详见表1。
2.2 全染色体标记法的建立及对两群体小型猪的遗传质量评价
新筛选到的4对12号染色体标记均为高度多态位点,合并地标中其余18对染色体的25对标记,共29对微卫星标记形成覆盖19对染色体的全染色体法。利用新建方法对农大I系、农大III系小型猪群体进行测定,两群体的平均杂合度分别为0.6062和0.6821,卡方检验P值分别为0.1390和0.7339(均大于0.05)。即通过全染色体标记法检测,两群体均为合格的封闭群小型猪群体。具体遗传参数详见表2、表3。

表1 12号染色体微卫星位点PIC数据表Tab.1 Polymorphism information content (PIC) of microsatellite loci in chromosome 12
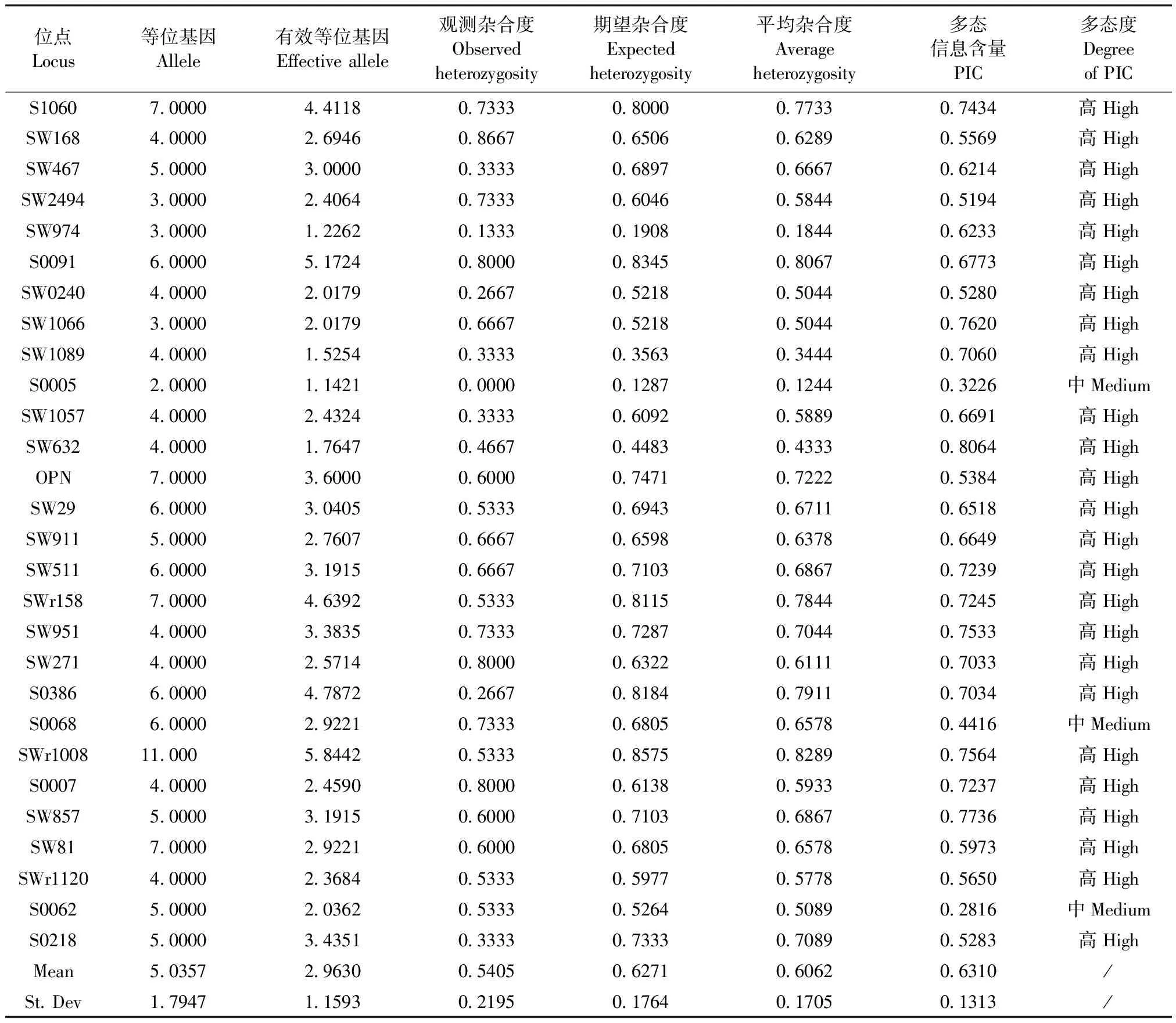
表2 农大I系小型猪群体遗传参数表(全染色体法)Tab.2 Genetic parameters of China Agricultural University miniature pig I (whole chromosome method)
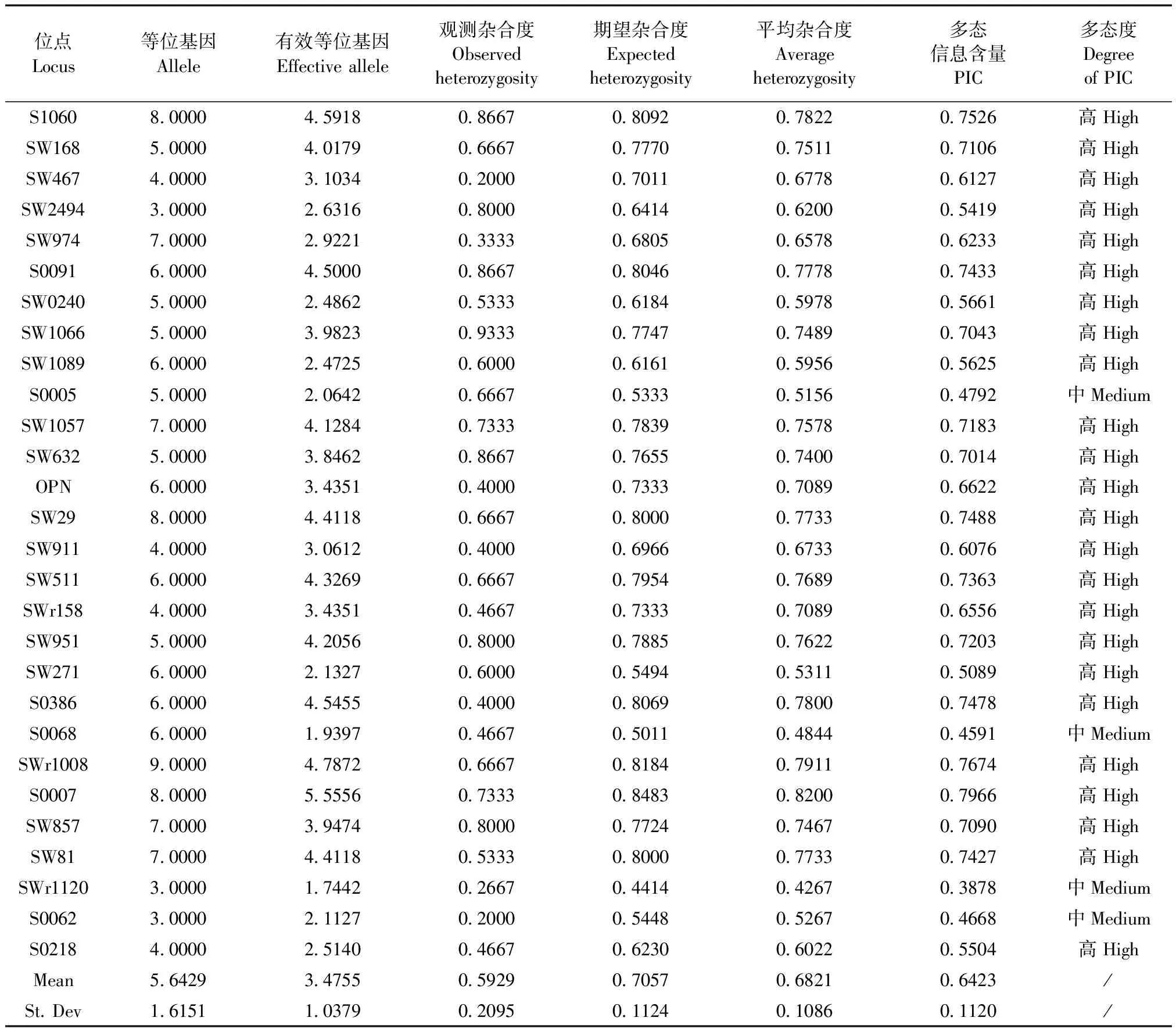
表3 农大III系小型猪群体遗传参数表(全染色体法)Tab.3 Genetic parameters of the China Agricultural University miniature pig III (whole chromosome method)

表4 标准方法与全染色体法的比较Tab.4 Comparison of the standard method with whole chromosome method
2.3 标准方法对相同两群体的遗传质量评价及与全染色体法的比较[9]
利用标准方法的25对标记对农大I系、农大III系相同群体样本进行测定结果已另文发表。测定结果为:两群体的平均杂合度分别为0.6759和0.6779,卡方检验P值分别为0.0022和0.7054。农大I系小型猪群体的观测杂合度与期望杂合度存在差异(P< 0.05)即通过标准法检测,农大III系小型猪群体可判定为合格的封闭群小型猪群体,农大I系不能判定为合格的封闭群小型猪群体。对两种方法进行比较分析,发现两者在染色体覆盖率、扩增稳定性及结果评价上均存在差异,结果详见表4。
3 讨论与建议
3.1 筛选标记的多态性
多态信息含量(PIC)是用以反应基因座位多态性的指标[10],用来评价标记位点是否可提供足够的遗传信息。当PIC>0.25时,为中度多态,可提供较为合理的遗传信息;PIC>0.5时,可提供高度丰富的遗传信息;而PIC<0.25时,则提供的遗传信息较差。因此在标记的筛选中,需要通过PIC值选择中高度多态性标记,从而提供足够的遗传信息。
本研究中,从数据库中选择的4对位点标记在国外猪种的研究中表现为中高度多态,而对于北京地区的小型猪是否适用需要通过研究验证。为降低标记在地区间存在差异的影响与可能,初步选择4对标记进行研究。结果4对标记在农大小型猪两个群体中均表现为高度多态,可以用于遗传质量评价。
3.2 对DB11/T828.3-2011技术方法的适用性评价与建议
DB11/T828.3-2011是国内第一部有具体技术方法的小型猪遗传质量控制地方标准;同时作为北京地区第一批实验动物标准,弥补了因无国家标准而无法在北京地区开展实验用小型猪行政许可管理的空白。
地标中的25对微卫星标记分布于19对染色体中的18对上(缺少12号染色体标记),基础的染色体覆盖率为94.74%(18/19),反映的遗传概貌不够全面。因此在质量评价中就可能存在不够全面客观的情况。通过研究也发现,标准方法和全染色体法在质量评价上出现了差异,标准修订时应考虑增加12号染色体标记。在扩增稳定性上,两种方法均存在15号染色体标记未能稳定扩增,应当通过进一步研究确定是否为品系特征,加强位点标记方法的研究,进一步完善标准的技术方法,使其反映的结果更为科学,从而实现标准对资源应用的保障作用。
[1] 袁进, 顾为望. 小型猪作为人类疾病动物模型在生物医学研究中的应用[J]. 动物医学进展, 2011, 32(2): 108-111.
[2] 冯书堂, 李奎, 刘岚, 等. 小型猪近交系新品种的培育与开发利用[J]. 农业生物技术学报, 2015, 23(2): 274-280.
[3] Ross JW, Fernandez de Castro JP, Zhao J, et al. Generation of an inbred miniature pig model of retinitis pigmentosa [J]. Invest Ophthalmol Vis Sci, 2012, 53(1): 501-507.
[4] 刘广波. 异种移植相关的猪内源性逆转录病毒的调查和实验研究[D]. 广州: 南方医科大学, 2012.
[5] 潘登科, 冯冲, 王宁, 等. GalKO/hCD46的人源化五指山小型猪[Z]. 2012中国器官移植大会, 中国福建厦门, 2012.
[6] 吴艳花, 徐玲玲, 杜小燕, 等. 封闭群实验用小型猪遗传标准的建立[J]. 实验动物科学, 2010, 27(6): 33-38.
[7] DB11/T828.3-2011. 实验用小型猪 第3部分: 遗传质量控制[S].
[8] 魏杰, 王洪, 李芳芳, 等. 房山封闭群小型猪微卫星位点的测定[J]. 中国比较医学杂志, 2013, 23(11): 7-12.
[9] 魏杰, 巩薇, 王洪, 等. 北京中国农大小型猪三个亚系群体的遗传状况分析[J]. 中国比较医学杂志, 2016, 26(10): 50-55.
[10] Kunieda T, Kobayashi E, Tachibana M, et al. Polymorphic microsatellite loci of the rat (Rattusnorvegicus) [J]. Mamm Genome, 1992, 3(10): 564-567.
Screening of the makers of chromosome 12 and evaluate the applicability ofBeijing local standard DB11/T828.3-2011
WEI Jie, WANG Hong, YU Peng-li, YUE Bing-fei*
(National Institutes for Food And Drug Control, Beijing 100050, China)
Objective To screen the markers of chromosome 12, which is vacant in the Beijing local standard DB11/T828.3-2011 for genetic quality control of miniature pigs in Beijing, and to study the applicability of the local standard by comparison of two different methods for evaluation of the genetic quality of the same population. Methods According to the literature, we selected four pairs of microsatellite markers of chromosome 12 and studied the polymorphism through monitoring the genetic quality of two populations of China Agricultural University miniature pigs. We screened the highly polymorphic markers of chromosome 12, combined them with the microsatellite primers of the standard 18 pairs of chromosomes to establish the whole chromosome method. We compared and analyzed the applicability of the local standard DB11/T828.3-2011 through monitoring the genetic quality of the same population of miniature pigs with different method. The data were processed and analyzed using software Popgen32. Results All the screened four pairs of microsatellite markers of chromosome 12 were highly polymorphic (PIC>0.5). The local standard showed a chromosome coverage of 94.7%, stability of amplification of 96.0%, and certified that the China Agricultural University miniature pig III was qualified, while the China Agricultural University miniature pig I was not qualified. When the markers of chromosome 12 were added, the whole chromosome method showed result of 100% chromosome coverage and 96.6% amplification stability, both of the two populations of pigs were certified as qualified. Conclusions The four screened markers of chromosome 12 are all highly polymorphic, and provide a support for supplement of the local standard DB11/T828.3-2011.
Local standard DB11/T828.3-2011; Chromosome 12; Polymorphism; Applicability; Genetic quality
中国食品药品检定研究院中青年基金(2014C4)。
魏杰(1982-),女,助理研究员,硕士。研究方向:免疫遗传检测。Email: jane3040320@163.com
岳秉飞(1960-),男,研究员,博士。研究方向:动物遗传学。Email: y6784@126.com
研究报告
R-33
A
1671-7856(2017) 07-0059-05
10.3969.j.issn.1671-7856. 2017.07.011
2016-12-30

